阿魏酸及其结肠代谢物的抗肿瘤活性
郑必胜 杨文涵 徐秋雄 刘瑞海
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.康奈尔大学食品科学系,美国 纽约伊萨卡 14853-7201)
阿魏酸(Ferulic Acid,FA)化学名为3-甲氧基-4-羟基肉桂酸,是一种广泛存在于植物组织中的酚酸。许多谷物和中草药都是阿魏酸的天然来源,例如青稞、玉米、当归、川芎等[1]。现有研究表明,FA具有抗氧化[2]、抗炎[3]、抗血栓[4]、降血糖[5]、抗心血管疾病[6]等健康活性。然而,和大多数膳食多酚一样,FA的生物活性很大程度上取决于它在体内的消化和吸收[7]。FA无法在胃和小肠中被吸收,但在结肠中,FA能够在肠道菌群酯酶的作用下从食物基质中释放,转化成更易吸收的简单化合物,大部分代谢物通过被动扩散被肠道吸收[8]。
大量酚酸代谢研究表明[8-11],FA在结肠内能够转化为一系列羟基苯丙酸化合物。Anson等[12]使用体外胃肠道模型模拟了FA的消化和代谢,研究表明FA在结肠主要被代谢为3,4-二羟基苯丙酸(3,4diOHPPA)、3-(3-羟基苯基)丙酸(3OHPPA)和3-苯丙酸(3PPA),其中3PPA是结肠末端代谢终产物。在整个代谢过程中,尽管有其他代谢物(如苯乙酸和苯甲酸)生成,但它们的含量极低,FA的主要结肠代谢产物仍是3,4diOHPPA、3OHPPA和3PPA[12]。图1展示了FA及其3种代谢物的化学结构,在结肠中,FA首先被还原和去甲基化生成3,4diOHPPA,由于C4较C3更易去羟基化,其后3,4diOHPPA更 多 地 被 转 化 为3OHPPA而 不 是4OHPPA,最后代谢为3PPA[11]。研究表明,FA的肠道代谢物具有体外抗氧化和抗炎活性,两种活性均随着消化的进行呈现先升高再下降的趋势[12-14]。Zheng等[15]的 研 究 表 明,3PPA对TNF-α诱 导 的Caco-2细胞炎症反应具有保护作用。近年来,酚酸肠道代谢物的健康活性引起了极大的关注,然而关于FA肠道代谢物的抗增殖活性鲜有报道。文中采用过氧自由基清除能力(Peroxyl Radical Scavenging Capacity,PSC)和细胞抗氧化活性(Cellular Antioxidant Activity,CAA)方法评价了FA及其3种代谢物(3,4diOHPPA、3OHPPA和3PPA)的抗氧化活性,探究了它们对人肝癌细胞HepG2的抗增殖作用,并通过流式细胞仪测定细胞周期和凋亡情况,最后选取抗增殖活性最好的FA和3,4diOHPPA,通过RTqPCR进一步探究其发挥抗增殖作用的机制。
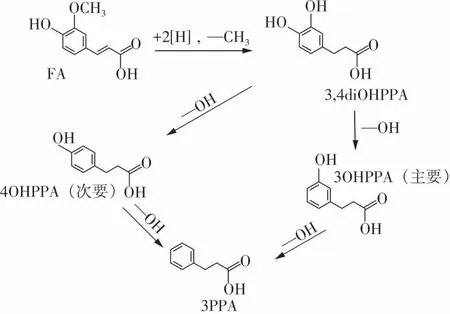
图1 阿魏酸及其结肠代谢物的化学结构Fig.1 Chemical structures of FA and its colonic metabolites
1 实验
1.1 材料与试剂
阿魏酸(纯度≥98%)、3,4-二羟基苯丙酸(纯度≥98%)、3-(3-羟基苯基)丙酸(纯度≥98%)和3-苯丙酸(纯度≥98%)购自上海阿拉丁科技股份有限公司;2,2′-偶氮二异丁基脒二盐酸盐(ABAP)和2′,7′-二氯荧光素二乙酸酯(DCFH-DA)购自Sigma-Aldrich公司;HepG2细胞购自美国ATCC公司;Williams’Medium E(WME)培养基、双抗、胰酶均购自美国Gibco公司;胎牛血清(FBS)购自浙江天杭生物科技有限公司;Annexin V-FITC/PT双染细胞凋亡试剂盒和细胞周期检测试剂盒购自南京建成生物工程研究所;通用RNA提取试剂盒购自广州东盛生物科技有限公司;Evo M-MLV反转录试剂盒和SYBR Green Premixpro TaqHS qPCR试剂盒购自湖南艾科瑞生物工程有限公司。其余试剂均为分析纯。
1.2 仪器与设备
Filter Max F5型多功能酶标仪,美国Molecular Devices公司生产;细胞CO2培养箱,美国Thermo Fisher公司生产;Gallios型流式细胞仪,美国Beckman Coulter公司生产;PCR仪,美国BIO-RAD公司生产。
1.3 实验方法
1.3.1 阿魏酸及其代谢物抗氧化活性的测定
1.3.1.1 PSC法测定体外过氧自由基清除能力
使用PSC法测定阿魏酸及其3种代谢物的体外过氧自由基清除能力[16],具体步骤如下:使用12.5%(体积比)的丙酮/水混合液配制不同含量(1.0、2.4、3.2、4.8、6.3μg/mL)的抗坏血酸标准品,使用75 mmol/L、pH7.4的磷酸缓冲盐溶液(PBS)配制样品。将100μL标准品或样品溶液加入96孔黑板中,之后在每孔中加入100μL DCFH-DA工作液和50μL 200 mmol/L的ABAP溶液。随后立刻将96孔黑板放入酶标仪中读取荧光值,读取条件为:37℃,激发波长λex=485 nm,发射波长λem=535 nm,每2 min读取一次荧光值,测定总时长为40 min。绘制荧光强度随时间的变化曲线,使用SigmaPlot软件分析曲线下面积,根据曲线下积分面积计算半最大效应浓度(即EC50),PSC的计算公式为
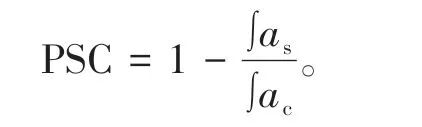
式中,∫as为样品/标准品的积分面积,∫ac为对照组的积分面积,PSC单位以抗坏血酸(Vit.C)当量表示。
1.3.1.2 CAA法测定细胞水平的抗氧化活性
细胞抗氧化活性的测定参考Wolfe等[17]的方法并稍作改动。
(1)细胞培养
HepG2细胞培养于完全培养基中,于37℃、5%(体积分数)CO2条件下培养。完全培养基通过在WME培养基中添加以下成分配制而成:5%(质量分数)FBS、5μg/mL胰岛素、2 mmol/L谷氨酰胺、10mmol/L Hepes、1%(质量分数)双抗和0.05μg/mL氢化可的松。
(2)细胞毒性测定
使用改良后的亚甲基蓝染色法测定样品对细胞的毒性[18]。当细胞长至对数生长期时,以2.5×104个/孔的密度接种于96孔板中,培养24 h后,弃去孔板中的旧培养基,用PBS清洗细胞,之后每孔加入100μL不同含量的样品,样品使用CM培养基稀释。继续培养24 h后,弃去孔内液体,PBS清洗,之后每孔加入50μL亚甲基蓝染液对活细胞进行染色。于37℃下孵育1 h后,用清水轻柔清洗96孔板,使用吸水纸去除96孔板中残留的水分,随后每孔加入100μL EB洗脱缓冲液,震荡15 min使之与活细胞结合的亚甲基蓝充分溶解,检测595nm下的吸光度。根据吸光度计算细胞存活率,细胞半数死亡对应的浓度记为CC50。细胞存活率计算公式如下:

式中,S为细胞存活率,A给药、A空白、A对照分别为给药组、空白组、对照组的吸光度。
若细胞存活率≤80%,则认为样品对细胞产生毒性。
(3)CAA实验
细胞以6×104个/孔的密度接种于96孔黑板中,培养24h后,弃去旧培养基,用PBS清洗。加入配制好的不同含量的样品或槲皮素标准品,对照组和空白组加入等体积的培养基。随后,向每孔中加入50μL浓度为50μmol/L的DCFH-DA的抗氧化培养基,放入培养箱孵育1h。待孵育结束后,弃去孔板内液体,分别进行以下两种操作。①无PBS清洗:弃去孔板内液体后,除空白组外直接加入100μL ABAP工作液(600μmol/L),空白组加入等量氧化培养基;②PBS清洗:弃去孔板内液体后,用PBS清洗,之后加入ABAP工作液或氧化培养基。随后使用多功能酶标仪检测荧光信号变化,检测条件为:37℃,激发波长λex=485nm,发射波长λem=535nm,每5min读取一次荧光值,测定总时长为60min。以时间为横坐标、荧光强度为纵坐标绘制荧光强度曲线,计算EC50,进而计算CAA,CAA的计算公式如下:
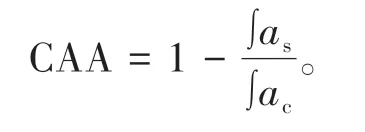
式中,CAA单位以槲皮素(QE)当量表示。
1.3.2 细胞毒性实验
细胞培养和毒性实验操作同1.3.1.2节(1)和(2)所述。
1.3.3 抗增殖活性测定
取生长良好的HepG2细胞,消化、离心、计数后,将细胞均匀铺在96孔板中(密度为1.5×105个/mL),放入培养箱中培养4 h,待细胞贴壁后,弃去旧培养基,用PBS清洗,之后加入100μL不同含量的样品,对照组以等量培养基代替。放入培养箱中继续培养72h,随后使用亚甲基蓝染色法判断细胞存活率,具体操作步骤同1.3.1.2节(2)所述。
1.3.4 细胞周期分析
细胞周期实验按照南京建成生物工程研究所的细胞周期检测试剂盒操作规程进行,利用细胞内DNA可以和PI染料结合的特性,检测细胞生长周期中各个时期的状况。细胞以2.5×104个/孔的密度接种于6孔板中,培养12 h,弃去旧培养基,用PBS清洗,加入不同浓度样品,浓度依据上述抗增殖实验结果选取,对照组以等量培养基代替(其中FA浓度为0.8、1.8、4.0 mmol/L,3,4diOHPPA浓度为0.4、0.8、1.8mmol/L,3OHPPA和3PPA浓度为1、2、4mmol/L),继续培养24h。之后,使用无EDTA和酚红的胰酶消化收集细胞,用冰PBS清洗两遍,加入75%(体积分数)乙醇,放入-20℃冰箱中过夜,固定细胞。次日,以1 000 r/min的速度离心5 min,弃去上清液,用PBS清洗细胞,室温下静置15 min后离心。弃去上清液,每管加入100μL RNase,37℃水浴加热30min,随后每管加入400μL PI染液,吹打混匀后在4℃下避光孵育30 min。孵育结束后,使用流式细胞仪进行检测,实验数据采用ModFit LT 5.0软件进行分析。
1.3.5 细胞凋亡分析
细胞凋亡分析按照南京建成生物工程研究所的Annexin V-FITC/PT双染细胞凋亡试剂盒操作规程进行,利用Annexin V和磷脂酰丝氨酸特异性结合、PI染色坏死或晚期凋亡细胞的特性,对细胞簇中的正常、坏死、早凋和晚凋细胞进行划分。将细胞接种至6孔板中(2.5×104个/孔),于培养箱中培养12 h后,弃去旧培养基,PBS清洗,加入不同浓度的样品,浓度设置同1.3.4节所述。之后继续培养24h,首先收集孔板中的旧培养基,之后加入无EDTA和酚红的胰酶消化收集细胞。将旧培养基与收集下来的细胞悬液混合,以1000r/min的速度离心5min,弃去上清液,用PBS清洗。加入500μL结合液重悬细胞,吹打均匀后,按照试剂盒要求加入染液,于室温下避光孵育10min,之后于流式细胞仪中进行检测。
1.3.6 细胞抗增殖相关基因表达分析
根据上述实验结果,选取抗增殖效果更好的FA和3,4diOHPPA进一步探究相关机制。按照1.3.5节的方法培养细胞,FA和3,4diOHPPA浓度设置同1.3.4节所述,之后参照Bi等[19]的方法,用细胞刮刀收集细胞至离心管中,在4℃、1000r/min的条件下离心5min,收集细胞沉淀。
1.3.6.1 细胞总RNA的提取
细胞总RNA的提取按照通用RNA试剂盒的说明书进行。提取后得到的白色沉淀即为RNA,加入适量DEPC水复溶,吹打均匀后测定RNA浓度,分装并于-80℃下保存。
1.3.6.2 cDNA的获取
使用Evo M-MLV反转录试剂盒获取cDNA,该环节所有操作均在冰上进行,反应条件为:42℃,2 min;4℃,15 min;37℃,15 min;85℃,5 s;4℃,2min。
1.3.6.3 Real-Time PCR分析
Real-Time PCR分析按照SYBR Green PremixPro TaqHS qPCR试剂盒说明书进行,引物序列见表1。以β-actin作为内参基因,基因相对表达量使用2-ΔΔCt方法分析。
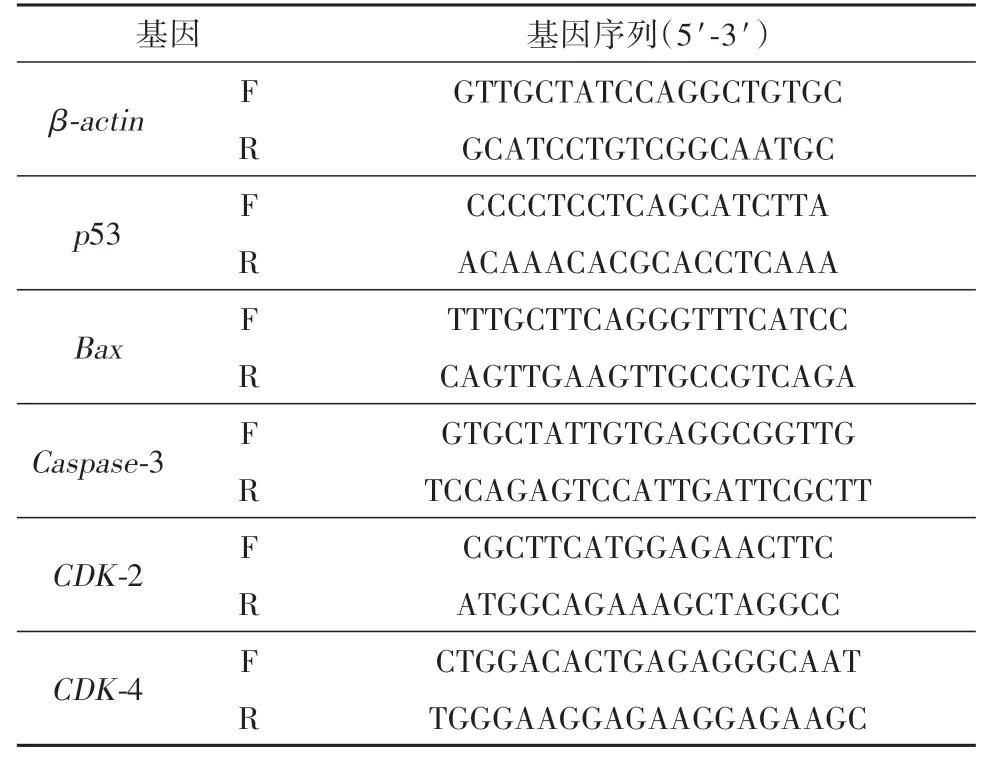
表1 基因引物序列表Table 1 Table of gene primer sequence
2 结果与分析
2.1 抗氧化活性分析
采用PSC和CAA方法分析FA及其3种结肠代谢物的抗氧化活性。两个方法都是以ABAP作为自由基来源,模拟接近正常生理条件下自由基的生成。使用DCFH-DA作为荧光染料,检测样品清除自由基的情况。
表2给出了4种样品的EC50和PSC,样品的EC50表示清除一半自由基对应的浓度,EC50越小,PSC越高。FA的PSC与先前报道的结果类似[16],为(0.58±0.09)μmol Vit.C equiv./μmol。3种代谢物的PSC分别为:(0.94±0.07)μmol Vit.C equiv./μmol(3,4diOHPPA)、(0.65±0.01)μmolVit.Cequiv./mmol(3OHPPA)、(1.55±0.20)μmol Vit.C equiv./mmol(3PPA)。相比3OHPPA和3PPA,FA和3,4diOHPPA表现出了更好的过氧自由基清除能力。
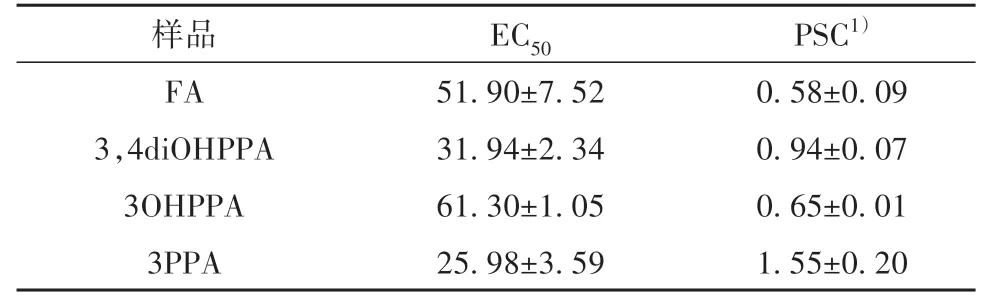
表2 阿魏酸及其3种结肠代谢物的PSC活性分析结果Table 2 PSC analysis results of FA and its three colonic metabolites
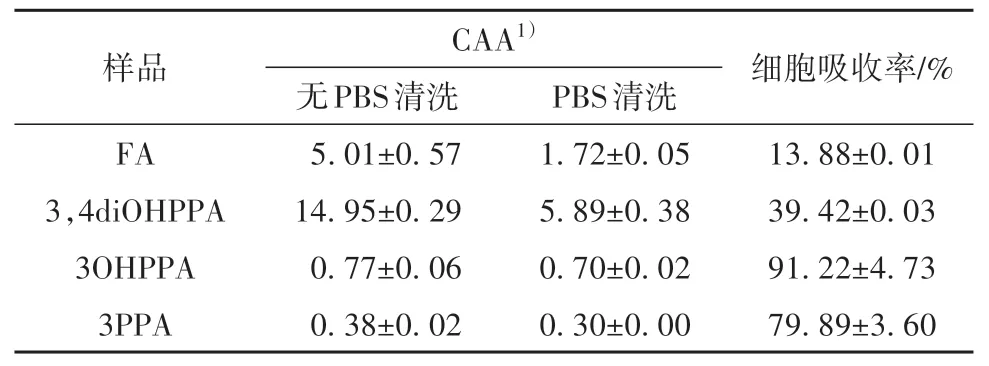
表3 阿魏酸及其3种结肠代谢物的CAA及细胞吸收率Table 3 CAA and cellular absorption rate of FA and its three colonic metabolites
CAA法用于评价阿魏酸及其代谢物的体内抗氧化能力,在用此方法评价抗氧化活性时,不仅涉及到样品清除自由基的能力,也通过PBS清洗和无PBS清洗两种方式体现了细胞对样品的吸收率。如表3所示,4种样品的CAA活性大小顺序为:3,4diOHPPA>FA>3OHPPA>3PPA。在体外抗氧化活性分析中,3PPA的PSC高于3OHPPA,但其CAA小于3OHPPA,这可能与3OHPPA的细胞吸收率更高有关。有研究[20]报道了富含阿魏酸的米糠经肠道消化后的抗氧化活性呈现先上升再下降的趋势,这与笔者测得的阿魏酸及其3种肠道代谢物的抗氧化活性大小结果相符。FA及其3种代谢物的抗氧化活性大小的不同或许与它们的结构有关。相比于FA,3,4diOHPPA的苯环上连接了两个相邻的羟基,这能够增加苯环的活性。Kikuzaki等[21]认为,羟基肉桂酸对DPPH自由基的清除能力取决于苯环上羟基的数量和电子供体甲氧基的邻位取代。FA的苯环上虽然只连接了一个羟基,但苯环上的3-甲氧基与该羟基能够共振形成稳定的苯氧基中间体[22],相比于3OHPPA和3PPA,FA对自由基有更好的清除活性。
2.2 抗增殖活性结果
利用人肝癌细胞HepG2评价阿魏酸及其3种结肠代谢物的抗肿瘤细胞增殖活性,毒性和抗增殖结果如图2和表4所示。在抗增殖实验中,FA、3,4diOHPPA、3OHPPA和3PPA的EC50分 别 为(1.82±0.07)、(0.74±0.06)、(7.77±0.05)和(4.52±0.05)mmol/L。在毒性实验中,4种样品的CC50分别为(4.50±0.02)、(3.32±0.01)、(20.60±0.46)和(14.08±0.26)mmol/L,它们的毒性和抗增殖实验结果均呈现出了剂量依赖。选择指数SI(CC50和EC50之比)用于判断样品对细胞的毒性和抗增殖之间的联系,从以上结果可以看出,4种样品的SI均大于2,说明它们所发挥的抑制HepG2细胞增殖的作用并不是由其细胞毒性引起的。从结果来看,3,4diOHPPA对HepG2细胞的抗增殖效果更好,FA次之,接着是3PPA和3OHPPA,这与前述测得的抗氧化活性大小大致相符,体现了抗氧化和抑制HepG2细胞增殖活性之间的紧密联系。
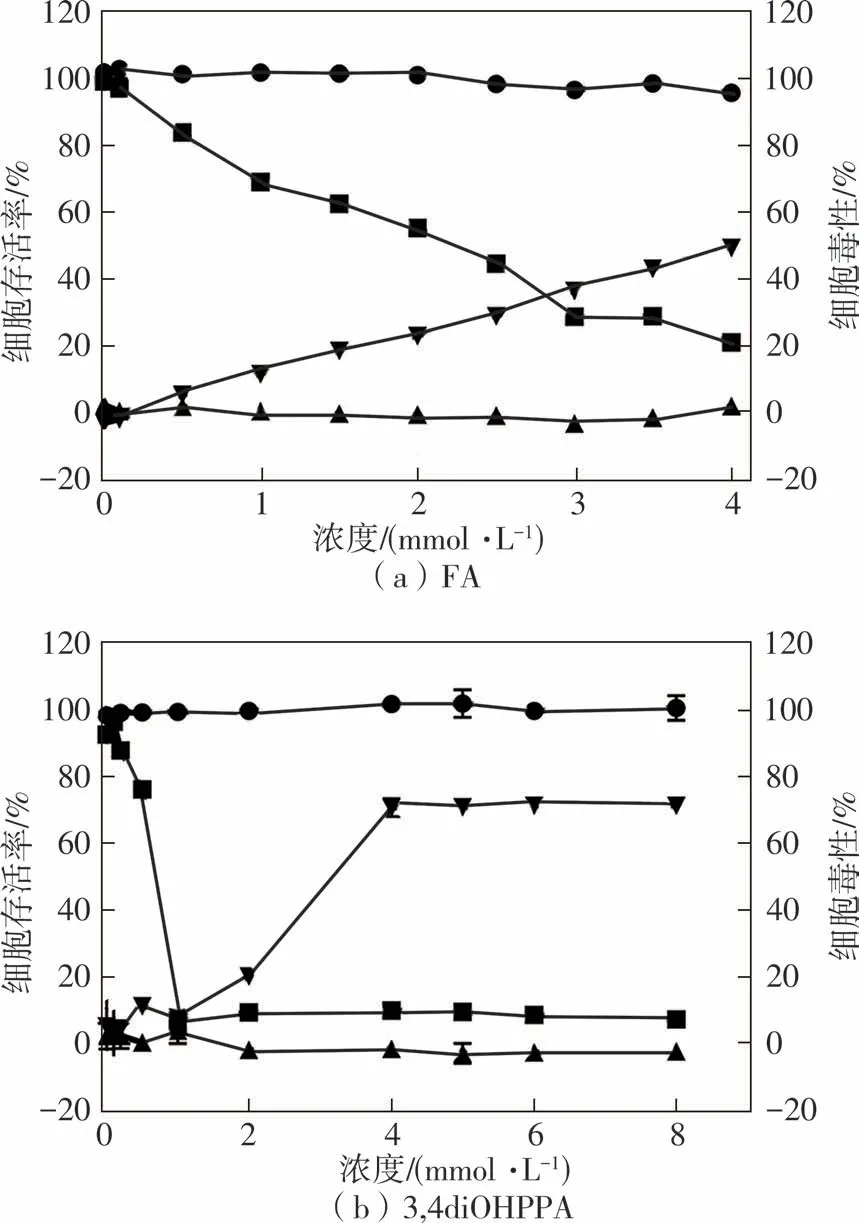
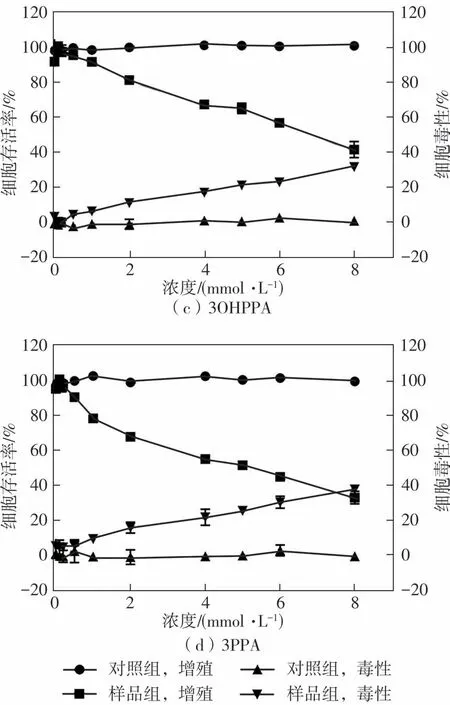
图2 阿魏酸及其代谢物对HepG2细胞的抗增殖效果Fig.2 Effects of FA and its metabolites on anti-proliferative effects of HepG2
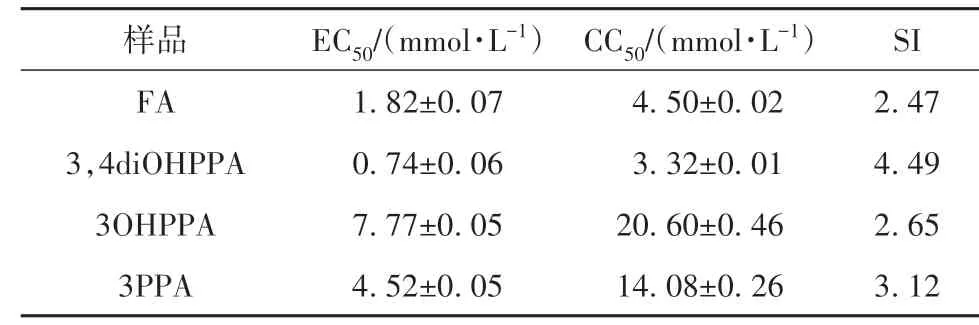
表4 阿魏酸及其代谢物对HepG2细胞的EC50、CC50和SITable 4 EC50,CC50 and SI values of FA and its metabolites against HepG2 cell
2.3 HepG2细胞周期分析
细胞周期分为间期和有丝分裂期(M期),其中,间期又被分为DNA合成前期(G0/G1期)、DNA合成期(S期)和DNA合成后期(G2期)。利用细胞内DNA和特异性荧光染料结合的特性,检测染料的荧光强度,就可以获得胞内DNA在细胞周期中所处的位置。通过干预手段使癌细胞生长阻滞于某一个特定的时期,可以达到抑制癌症的效果。例如临床上所使用的他汀类药物,通过抑制甲羟戊酸途径从而阻碍细胞周期相关功能蛋白的生成,进而将肿瘤细胞(如胆管癌、乳腺癌等)阻滞于G1和S期,诱导肿瘤细胞的凋亡[23]。
如图3-5所示,在经过48 h的培养后,对照组有55.26%的细胞处于G1期,28.94%的细胞处于S期,15.84%的细胞处于G2期。经过12h的药物处理后,FA、3OHPPA和3PPA均将细胞阻滞于G2期,也就是DNA合成后期,3,4diOHPPA则将HepG2细胞阻滞于DNA合成期,即S期。从最高浓度组来看,FA、3OHPPA和3PPA分别将G2期细胞比例显著提升至24.16%、22.56%和18.37%,3,4diOHPPA的最高浓度组则将S期细胞比例显著提升至42.84%。此外,相比于3OHPPA和3PPA,FA和3,4diOHPPA展现出了更好的对HepG2细胞周期的阻滞效果。
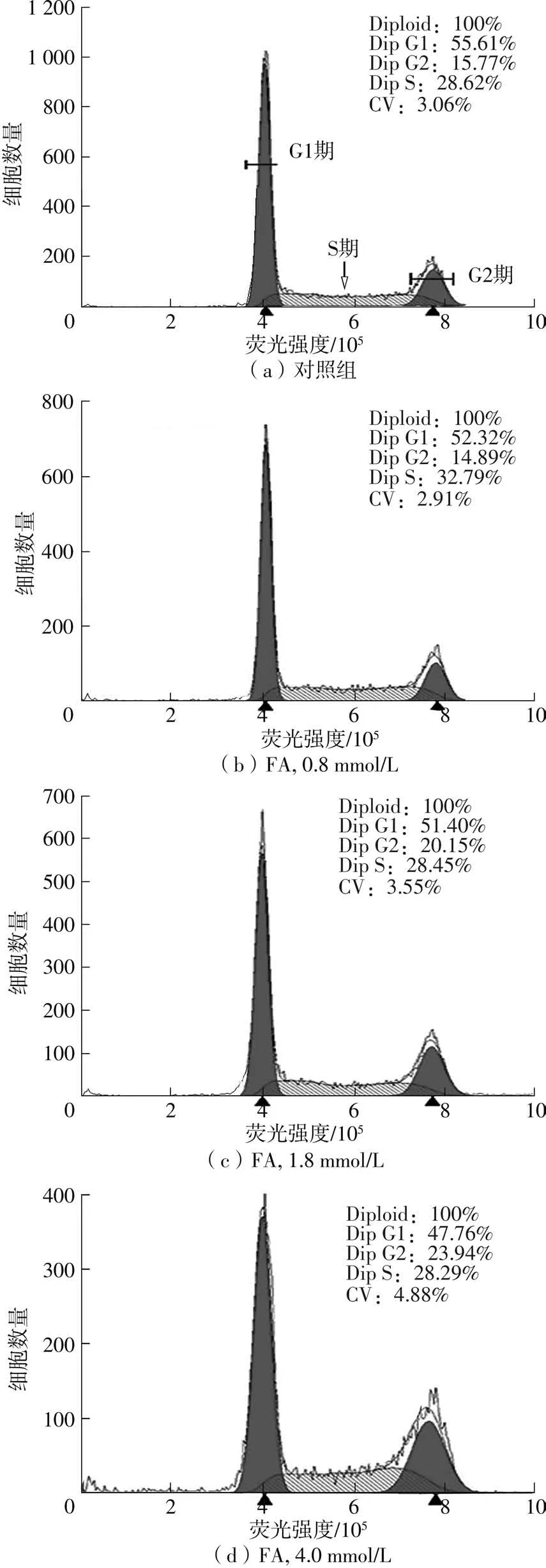
图3 阿魏酸处理后的细胞周期直方图Fig.3 Cell cycle histograms after intervention with FA
2.4 HepG2细胞凋亡分析
细胞死亡的方式包括凋亡、坏死和自噬,其中细胞凋亡是一种主动的、程序化的进程,需要通过特定的程序进行控制[24]。在早期凋亡阶段,细胞发生萎缩,体积减小,细胞染色质固缩,随后细胞核破裂,细胞碎片分离并形成凋亡小体,这些小体随后会被周围的细胞(如巨噬细胞)吞噬,并在溶酶体中降解[25]。在细胞凋亡过程中,细胞膜仍保持良好完整性,细胞内容物不会外溢,然而,细胞坏死会导致细胞膜破损,细胞内容物释放,影响周边组织并产生炎症反应[25],根据这一差异,可以使用流式细胞术区分凋亡和坏死的细胞。文中采用Annexin V-FITC方法测定HepG2细胞的凋亡情况。如图6-8所示,对照组总凋亡率为4.23%,经过药物处理后,细胞总凋亡率均呈现出剂量依赖性的提高,表明4种样品对HepG2细胞凋亡均具备有效诱导效果。FA、3,4diOHPPA、3OHPPA和3PPA的最大浓度组分别将细胞总凋亡率提升到了15.47%、71.84%、7.62%、12.01%,4种样品对HepG2细胞凋亡的作用效果展现了与抗增殖效果相同的趋势,说明4种样品发挥的诱导细胞凋亡作用对它们的抗HepG2增殖活性具有重大贡献,同时也说明4种样品对人肝癌细胞凋亡的调控是有序的。此外,FA、3OHPPA和3PPA能同时诱导HepG2细胞的早期和晚期凋亡,3,4diOHPPA则主要诱导HepG2细胞的晚期凋亡,其低、中、高浓度组分别将晚期凋亡率从2.21%提高至2.56%、11.64%、67.84%,其对HepG2细胞早期凋亡的影响较小,高浓度组将早期凋亡率从1.79%提高至4.00%。

图4 阿魏酸代谢物处理后的细胞周期直方图Fig.4 Cell cycle histograms after intervention with FA’s metabolites
2.5 抗增殖相关基因表达结果
细胞周期和凋亡的实验结果表明,阿魏酸及其3种代谢物对HepG2细胞的调控是有序的,4种样品对HepG2细胞的影响效果也各有不同。因此,根据上述实验结果,文中选取了对HepG2细胞增殖抑制效果更好的FA和3,4diOHPPA进行相关机制的探究,使用RT-qPCR方法测定细胞增殖相关基因的相对表达量。
Bax是定位于线粒体外膜的促凋亡因子,在正常状态下以非单体活性形式存在[26]。在内源性凋亡途径中,Bax在凋亡信号刺激下发生寡聚化,接着发生线粒体外膜通透化(MOMP),形成MPT小孔,导致促凋亡蛋白细胞色素c的释放,细胞色素c招募细胞凋亡激活因子1(Apaf-1)形成凋亡复合体,引发caspase级联反应[24]。此外,还存在caspase非依赖性的细胞凋亡方式:MOMP出现后,线粒体发生损伤,活性氧大量生成,激活PARP-1,诱导线粒体释放AIF,形成DNA损伤,以caspase非依赖性的方式直接诱导细胞凋亡[27]。p53是一种典型的抑癌因子,可以促进凋亡蛋白bax、bak的表达,抑制bcl-2的活性;也可以促进p21-Cip1的表达,抑制下游周期蛋白CDKs的活性,使细胞周期阻滞,从而抑制细胞增殖[28]。
先前研究[29]报道,阿魏酸钠预处理能够抑制β淀粉样蛋白诱导的caspase-9、caspase-7和caspase-3的活化。由图9可知,在低、中、高剂量的FA处理下,Bax表达量被显著提升至原来的2.77、7.43、9.13倍,然而caspase-3的表达量无显著变化。在低、中、高浓度的3,4diOHPPA处理下,Bax和caspase-3表达量分别被提升至原来的1.94、2.91、6.13倍和5.13、4.72、16.68倍。虽然3,4diOHPPA诱导Bax表达的能力不如FA,但它激活了caspase-3,FA则以caspase-3非依赖性途径诱导细胞凋亡,笔者推测这是3,4diOHPPA的细胞凋亡诱导效果远优于FA的原因。此外,FA预处理显著提高了p53的表达量,抑制了CDK-2和CDK-4的表达,表明FA可能是通过p53信号通路抑制下游靶基因CDK2/4的表达,进而发挥周期阻滞效果。3,4diOHPPA能够下调CDK-2和CDK-4,但它没有激活p53,说明3,4diOHPPA可能是以独立于p53的信号转导方式来调控HepG2细胞周期。
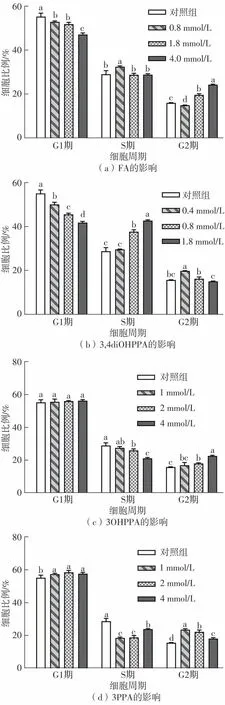
图5 阿魏酸及其代谢物对HepG2细胞周期的影响Fig.5 Effects of FA and its metabolites on cell cycle of HepG2

图6 阿魏酸处理后的细胞凋亡散点图截屏Fig.6 Screen capture of cell apoptosis scatter plots after intervention with FA
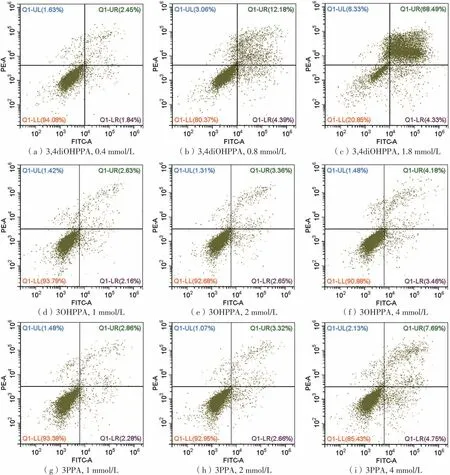
图7 阿魏酸代谢物处理后的细胞凋亡散点图截屏Fig.7 Screen capture of cell apoptosis scatter plots after intervention with FA’s metabolites
3 结论
文中选取FA及其3种结肠代谢物(3,4di-OHPPA、3OHPPA和3PPA)为研究对象,采用PSC和CAA两种方法评价它们的体外和体内抗氧化能力,并以HepG2为模型,探究4种样品的抗增殖活性,使用流式细胞仪和RT-qPCR进一步探究抗增殖相关机制。结果表明,3,4diOHPPA具有最高的抗氧化水平,FA次之。4种样品的抗增殖活性大小为:3,4diOHPPA>FA>3PPA>3OHPPA。FA、3,4diOHPPA、3OHPPA和3PPA的最大浓度组分别将细胞总凋亡率提高至15.47%、71.84%、7.62%和12.01%(对照组为4.23%)。细胞周期实验表明FA及其3种代谢物能够有序调控细胞周期进程,其中,FA、3OHPPA和3PPA将HePG2细胞周期显著阻滞于G2期,3,4diOHPPA将HePG2细胞周期显著阻滞于S期。FA通过上调Bax、p53基因和下调CDK-2、CDK-4基因发挥抗HepG2增殖效果;3,4diOHPPA则通过上调Bax、caspase-3基因和下调CDK-2、CDK-4基因抑制HepG2增殖。研究表明,FA的部分结肠代谢物的抗氧化活性和抗肿瘤细胞增殖活性优于FA,文中结果为FA的肠道代谢物发挥健康活性提供了理论依据。
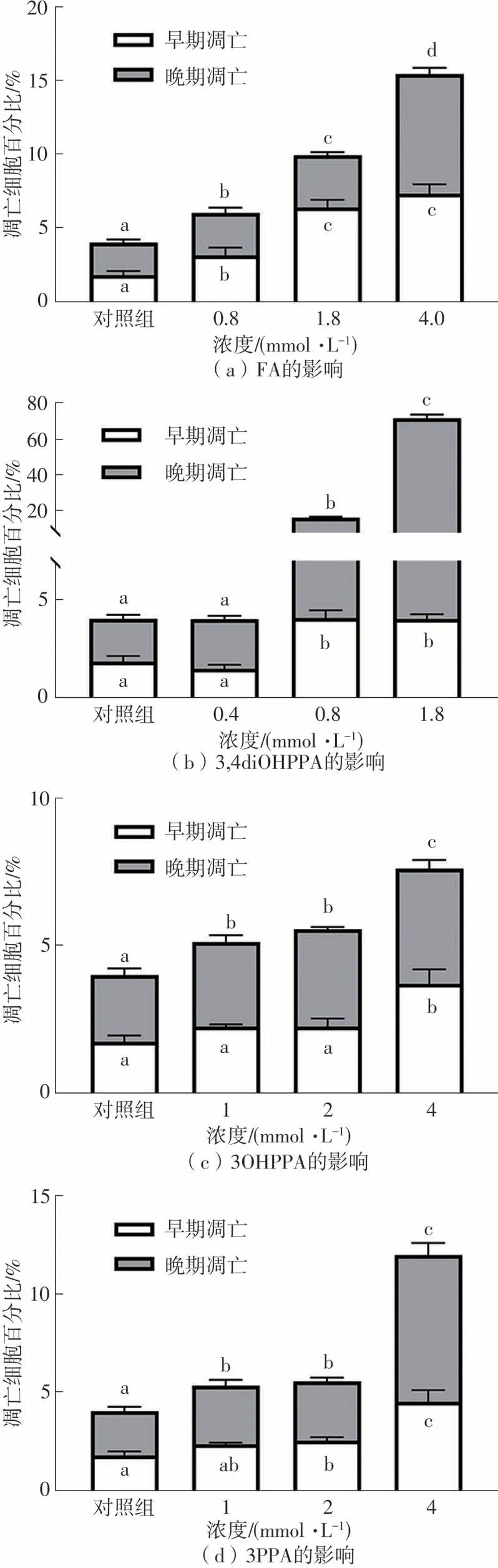
图8 阿魏酸及其代谢物对HepG2细胞凋亡的影响Fig.8 Effects of FA and its metabolites on cell apoptosis of HepG2
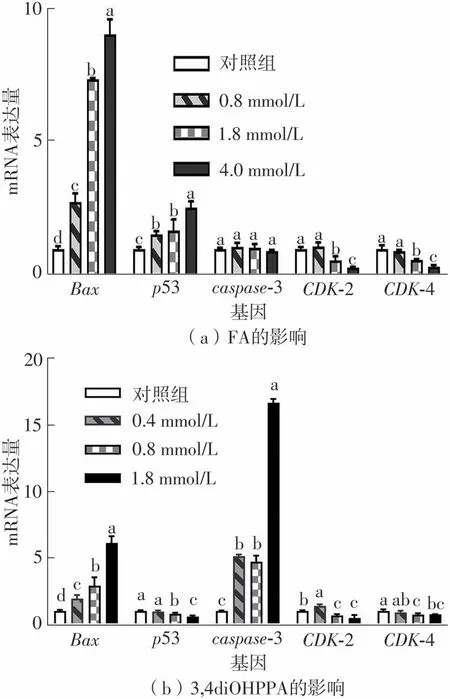
图9 FA和3,4diOHPPA对抗增殖相关基因表达的影响Fig.9 Effects of FA and 3,4diOHPPA on expression levels of anti-proliferation related genes

