高寒地区栽培牧草化感效应缓解初探
全小龙, 陈梦词, 段中华, 梁 军, 乔有明
(青海大学省部共建三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016)
世界上众多草原类型的生态学过程均被证明受到化感效应的调控。化感效应会对草地群落的结构和功能,如群落的物种组成和群落的演替过程产生影响[1-2]。国内外对此开展了大量的研究,如张宝琛等[3]开展了化感效应对高寒草甸群落演替过程的影响研究,结果表明垂穗披碱草的化感效应抑制了自身的种子萌发,却促进了细叶亚菊(Ajaniatenuifolia)的种子萌发,而细叶亚菊的化感效应则抑制了垂穗披碱草的种子萌发,这种化感效应的不同使细叶亚菊在退化高寒草甸占据了群落的优势地位。Greer等[4]的温室实验结果表明入侵植物白羊草(Bothriochloaischaemum)通过抑制本土植物的种子萌发和幼苗生长而在北美中南部草原成功占据生态位。罗马尼亚低地草原的研究结果也表明美丽针茅(Stipapulcherrima)占据群落优势地位的原因之一在于其释放的化感物质强烈地抑制了群落中其他物种的幼苗更新[5]。假高粱(Sorghumhalepense)通过分泌化感物质抑制北美高草草原群落优势种北美小须芒草(Schizachyriumscuparium)的生长和繁殖过程,促使其成功入侵北美高草草原并占据群落优势地位[6]。
化感效应不仅存在于植物之间,也涉及植物与微生物间的相互作用。土壤微生物参与养分循环及植物竞争,影响物质分解,是植物化感效应重要的决定因子[7-8]。当毒杂草入侵健康草地时,向土壤中释放化感物质,破坏土壤稳定性,降低土壤活力,加速有害物质的积累,抑制土壤酶及微生物活性,造成病原体及害虫等有害生物大量发生,导致土壤的微生物区系发生变化,土壤微生物与土壤因子的自然平衡遭到损坏,形成养分分解和供应障碍,加剧土壤病害蔓延[9-10]。土壤中微生物通过以代谢、降解与利用等方式改变化感物质,同时根系通过分泌各种次生代谢物质对根际微生物的种类、数量和分布产生影响[11]。没有微生物存在下的化感物质活性的评价可能不具有生态相关性。因此,植物化感效应机制的深入研究必须建立在充分了解化感物质与微生物互作关系的基础上,验证生物入侵中化感效应时有必要考虑土壤微生物的影响[12-13],才能使后续的研究更有意义。
草地生态系统化感效应的研究集中在化感效应的识别、化感效应对受体植物种子萌发和幼苗生长的室内观测实验及化感物质的分离和鉴定等方面[3-6,9],对于微生物对化感效应的缓解研究还未见报道。鉴于此,本研究以青藏高原常见毒杂黄帚橐吾(Ligulariavirgaurea)、甘肃马先蒿(Pediculariskansuensis)和细叶亚菊集中分布区域土壤为化感物质来源,以冷地早熟禾(Poacrymophila)和垂穗披碱草(Elymusnutans)生长旺盛区域土壤为优良牧草生长基质,测定种子发芽率及幼苗生长状况,研究土壤微生物对化感物质作用效果的缓解潜力。将化感物质的微生物降解研究纳入化感效应的生物测定中,把化感效应和土壤因素结合起来,以期结果更能反映实际情况,揭示人工植被退化现象背后的本质,为高寒地区退化草地的恢复、重建,以及管理和新技术研发提供参考和理论依据。
1 材料与方法
1.1 试验材料
本研究土壤样品于2020年9月下旬在青海省黄南藏族自治州河南蒙古族自治县(34°41′N,101°46′E)采集。采集地属于典型的高寒草甸型草地,土壤类型以黑钙土为主,主要优势种为冷地早熟禾和垂穗披碱草,伴生有鹅绒委陵菜(Potentillaanserina)、矮嵩草(Kobresiahumilis)、瓣蕊唐松草(Thalictrumpetaloideum)、金露梅(Potentillafruticosa)和高原毛茛(Ranunculustanguticus)等,零散分布有黄帚橐吾、甘肃马先蒿和细叶亚菊等。选择毒杂草相对分布集中的区域土壤制备水浸液,以模拟自然条件下化感物质进入环境的方式,采集时用直径为3.5 cm的土钻,取10 cm上层土壤,装入自封袋中,记为土壤A低温保存带回实验室备用。为保存维持优良牧草正常生长的原有微生物,选择冷地早熟禾和垂穗披碱草生长旺盛区域,将所有土样混合后分装标记为土壤B放入-18℃冰箱,带回实验室用于准备发芽与生长基质。供试土壤信息如表1所示。

表1 供试土壤基本信息Table 1 Main chemical properties of the soil tested
2019年8月下旬种子收获时期,于青海省牧草良种繁殖场(海南藏族自治州同德县;35°15′N,100°38′E)采集供试牧草种子,种子经干燥、清选后,装入种子袋低温保存备用。种子信息如表2所示。
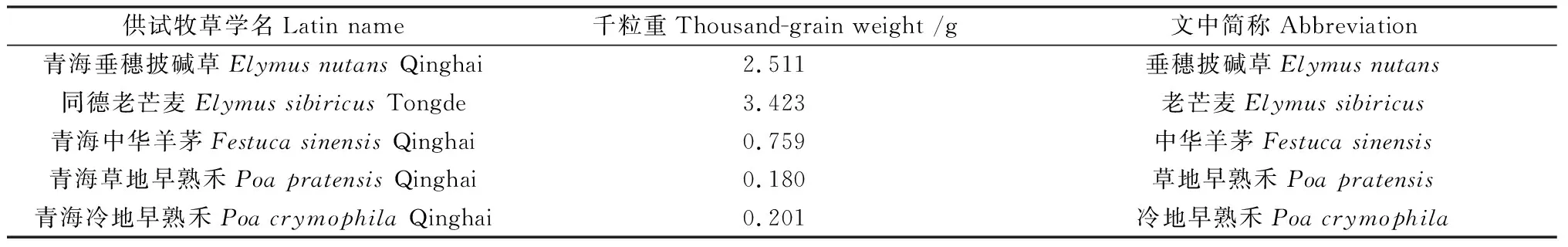
表2 供试牧草种子基本信息Table 2 Forage seeds for testing
1.2 试验设计
土壤A去除残根及杂质后制备水浸液,用于浇灌喷施基质。按照新鲜土壤与蒸馏水(质量比) 1∶2比例,20℃温度下以200r·min-1在旋转摇床中震荡24 h制备根土水浸液。所得土壤水溶液分别通过定性滤纸和0.45 μm水系滤膜过滤,获得每毫升含0.5 g土壤中化感物质的水浸液,分装试剂瓶后4℃保存待用。
将土壤B过2 mm筛后,分成两部分,一部分在高压灭菌锅115℃下20 min,灭菌1次,记为SS;另一份不灭菌,放入光照培养箱中发芽10 d,去除土壤种子库种子,并保留原有微生物,记为US。将未灭菌土与灭菌土按U100(100%US),U75(75%US +25%SS),U50(50%US +50%SS),U25(25%US +75%SS)和U0(100%SS)比例配制种子发芽和幼苗生长基质,每盆使用土壤200 g,将U0即完全灭菌土壤作为对照(CK)。
种子发芽试验中,将供试种子在0.5%次氯酸钠溶液中浸泡10 min,并用蒸馏水冲洗,完成种子表面消毒。每盆挑选籽粒饱满的供试种子50粒,放入装有基质的小花盆中,轻翻基质,使种子完全覆在基质中,按照未灭菌土与灭菌土配比设置,设5个处理,每个处理设5次重复,每种牧草计25盆,5种供试牧草总计125盆。幼苗生长试验中,按照种子发芽试验要求先进行种子预发芽,待种子发芽5 d后,选择长势一致的幼苗移栽至小花盆中,每盆移植10株,3盆作为一个重复;同样设U100,U75,U50,U25和U0共5个处理,每个处理设3次重复,每种牧草计45盆,5种供试牧草总计225盆。在光周期为12 h/12 h,温度为 20℃/16℃,光照为3 000 lx的培养箱中进行试验,每盆每隔两日浇化感物质水浸液20 mL,如遇干旱则喷洒蒸馏水保持土壤润湿。发芽试验连续记录15 d,以胚芽超出基质作为发芽标准,记录后去除已发芽种子。幼苗生长数据测定在移植生长15 d后进行,将植物幼苗从小花盆中取出,洗净根部附着的基质,每个重复随机取10株测量根长(Root length,RL;单位:cm)和苗高(Shoot length,SL;单位:cm)。测量后将10株植株装入纸袋,于65℃下烘干至恒重,称重获得10株植株干重(Dry weight,DW;单位:mg)。
1.3 数据处理
种子发芽率(Germination percentage,GP)、化感效应指数(Allelopathic response index,RI)和综合促进率(Comprehensive effect promotion rate,CE)按照以下公式计算:
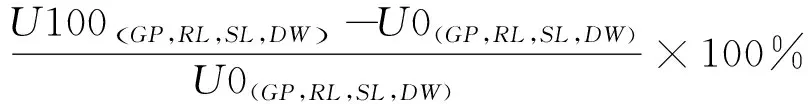
CE(%)=
RI(%)GP+RI(%)RL+RI(%)SL+RI(%)DW
其中,下标GP,RL,SL和DW依次代表发芽率(%)、根长(cm)、苗高(cm)和干重(mg)相对应的数值,CE(%)的绝对值大小表示综合促进率的强弱。
采用单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD)比较不同处理间差异显著性。SPSS 21.0(SPSS Inc.,Chicago,Illinois,USA)进行方差分析,Origin 2018(OriginLab Inc.,Northampton,Massachusetts,USA)绘图。
2 结果与分析
2.1 不同基质组成对种子发芽的影响
土壤微生物调节下的种子发芽率如图1所示,5种栽培牧草种子发芽率表现出随灭菌土壤量的增加而逐渐降低趋势。垂穗披碱草种子发芽率在U100,U75,U50和U25处理下无显著性差异,但这四种处理与U0存在显著性差异(P<0.05)。与U100相比,在U0处理下老芒麦和中华羊茅受到抑制,且与U100差异显著(P<0.05),但这两种处理与U75,U50和U25处理间差异不显著。草地早熟禾和冷地早熟禾种子发芽率在5种处理间无显著性差异,但也呈现出随未灭菌土壤的减少而降低的趋势。

图1 土壤微生物量影响下的种子发芽率Fig.1 Germination percentage of tested grass following microbial biomass注:同族不同小写字母表示不同微生物量U100,U75,U50,U25和U0之间差异显著(P<0.05),下同Note:Difference lowercase letters indicate significant difference among treatments in the same grass at 0.05 level,the same as below
2.2 不同基质组成对幼苗苗高的影响
微生物对栽培牧草幼苗苗高的影响与其对发芽率影响趋势相似,幼苗苗高随灭菌土壤量的增加而逐渐降低(图2)。在U100和U0处理下,垂穗披碱草幼苗苗高表现为差异显著(P<0.05),但二者与U75,U50和U25处理间差异不显著。老芒麦在U100,U75,U50,U25处理间幼苗苗高未表现出显著差异,而U100,U75与U0差异显著(P<0.05)。中华羊茅、草地早熟禾和冷地早熟禾幼苗苗高在各组间无显著性差异。
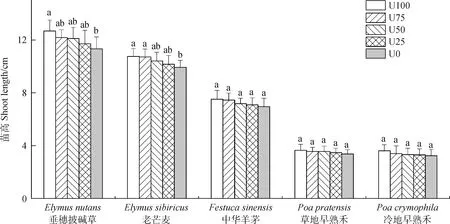
图2 土壤微生物影响下幼苗苗高Fig.2 Shoot length of tested grass following microbial biomass
2.3 不同基质组成物对幼苗根长的影响
土壤微生物对幼苗根长的影响表现如图3所示,在不同土壤微生物影响下不同的牧草表现出一定的差异。垂穗披碱草和冷地早熟禾幼苗根长变化相似,U25和U0处理间差异不显著,但与U100处理差异显著(P<0.05);而三者与U75和U50处理间差异不显著。老芒麦和中华羊茅幼苗根长均表现为U100与其余4组处理间差异显著(P<0.05),而其他4组处理之间无显著性差异。在U100和U0处理下,草地早熟禾幼苗根长为差异显著(P<0.05),但二者与U75,U50和U25间差异不显著。
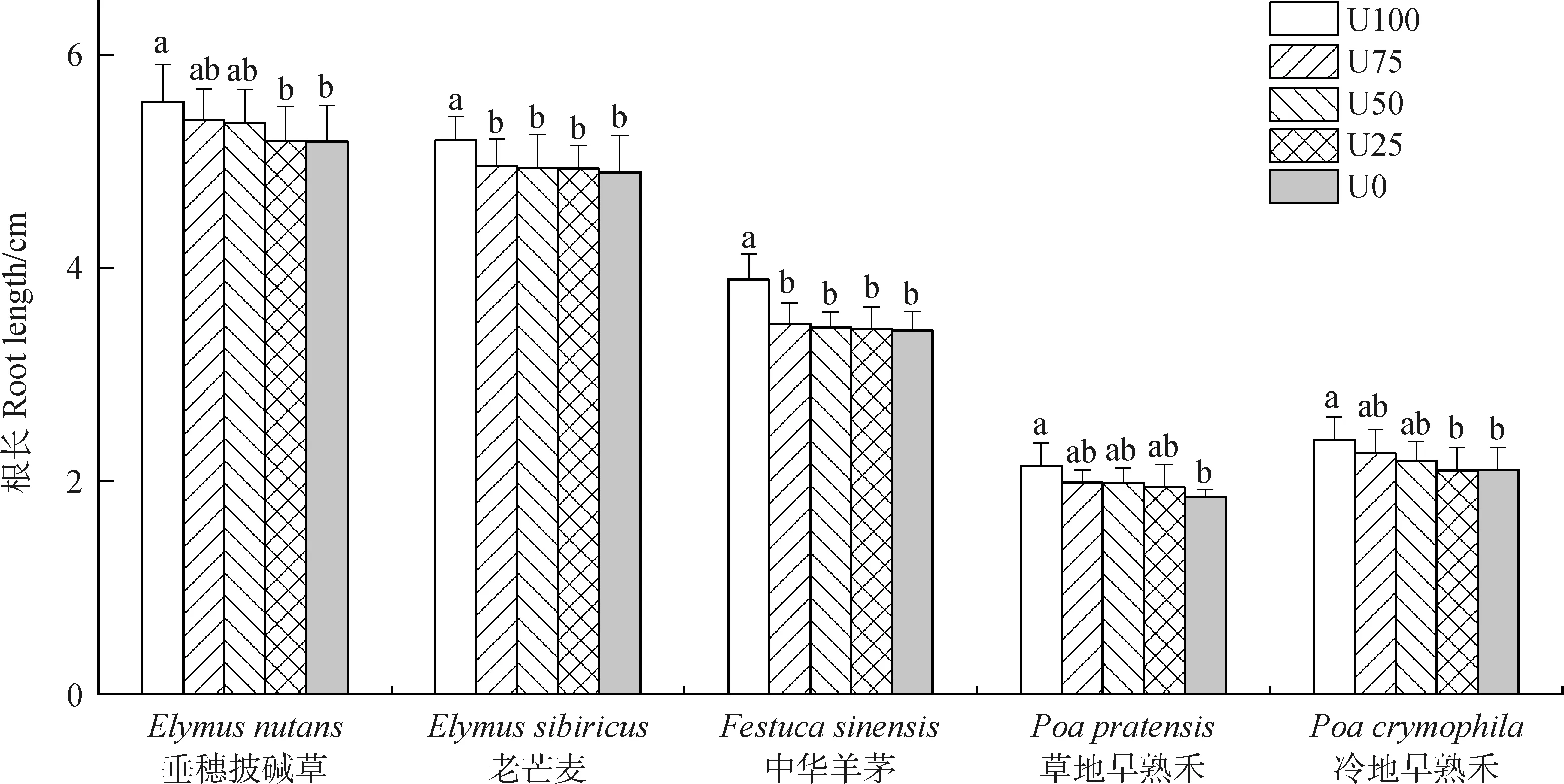
图3 土壤微生物影响下的幼苗根长Fig.3 Root length of tested grass following microbial biomass
2.4 不同基质组成对幼苗干重的影响
微生物量对栽培牧草幼苗干重的影响因栽培牧草的不同和处理的差异而表现出不同的变化(图4)。垂穗披碱草干重在U25和U0处理间差异不显著,但与U100处理差异显著(P<0.05);而三者与U75和U50处理间差异不显著。老芒麦在U25处理下与其4组无显著性差异,U100,U75和U50处理间无显著差异,但同U0间呈显著性差异(P<0.05)。中华羊茅和草地早熟禾干重受抑制,在U100和U0处理下间差异显著(P<0.05),但这两种处理与U75,U50和U25处理间差异不显著。冷地早熟禾在U100和U75处理下干重未表现出显著差异,但与U0差异显著(P<0.05)。
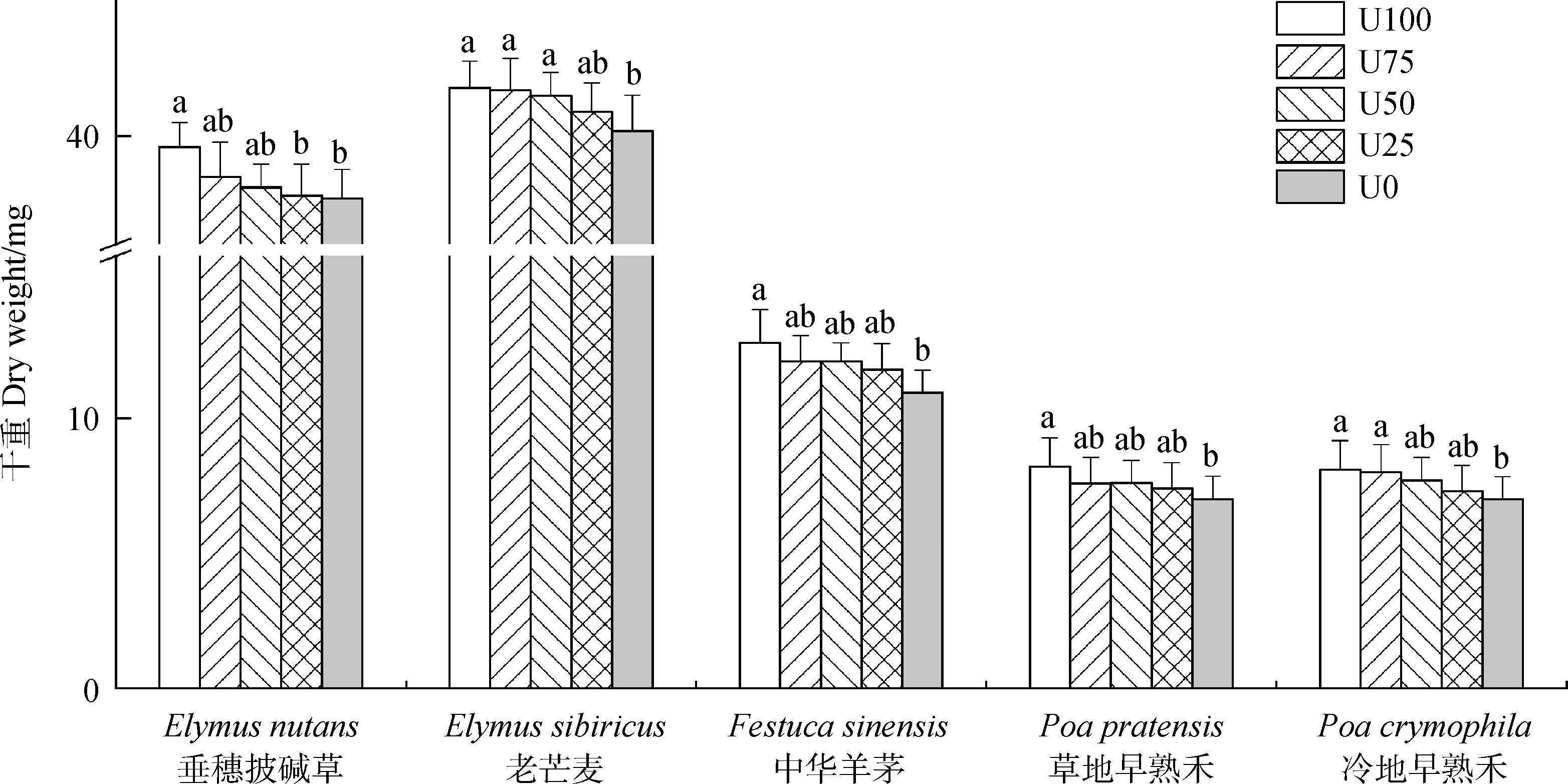
图4 土壤微生物影响下的幼苗干重Fig.4 Dry weight of grasses following microbial biomass and fertility
2.5 不同基质组成对栽培牧草的综合影响
比较未灭菌土壤和灭菌土壤对栽培牧草的综合影响,如图5所示,微生物对栽培牧草发芽和生长的影响因栽培牧草的不同而存在差异。在种子发芽阶段,微生物对中华羊茅种子发芽率促进作用最为明显为7.69%,其后依次为垂穗披碱草(7.02%)、冷地早熟禾(5.59%)、老芒麦(5.08%)和草地早熟禾(4.35%)。在生长阶段,微生物对5种栽培牧草苗高综合促进率平均为9.61%,其中促进率最高值为垂穗披碱草11.92%,最低值为中华羊茅8.06%。微生物对草地早熟禾幼苗根长的促进率高达16.02%,而对老芒麦的促进率仅为6.13%。在幼苗干重方面促进作用差异更为明显,最高综合促进率的草地早熟禾(17.14%)与中华羊茅(16.58%),约为老芒麦(3.98%)4倍。
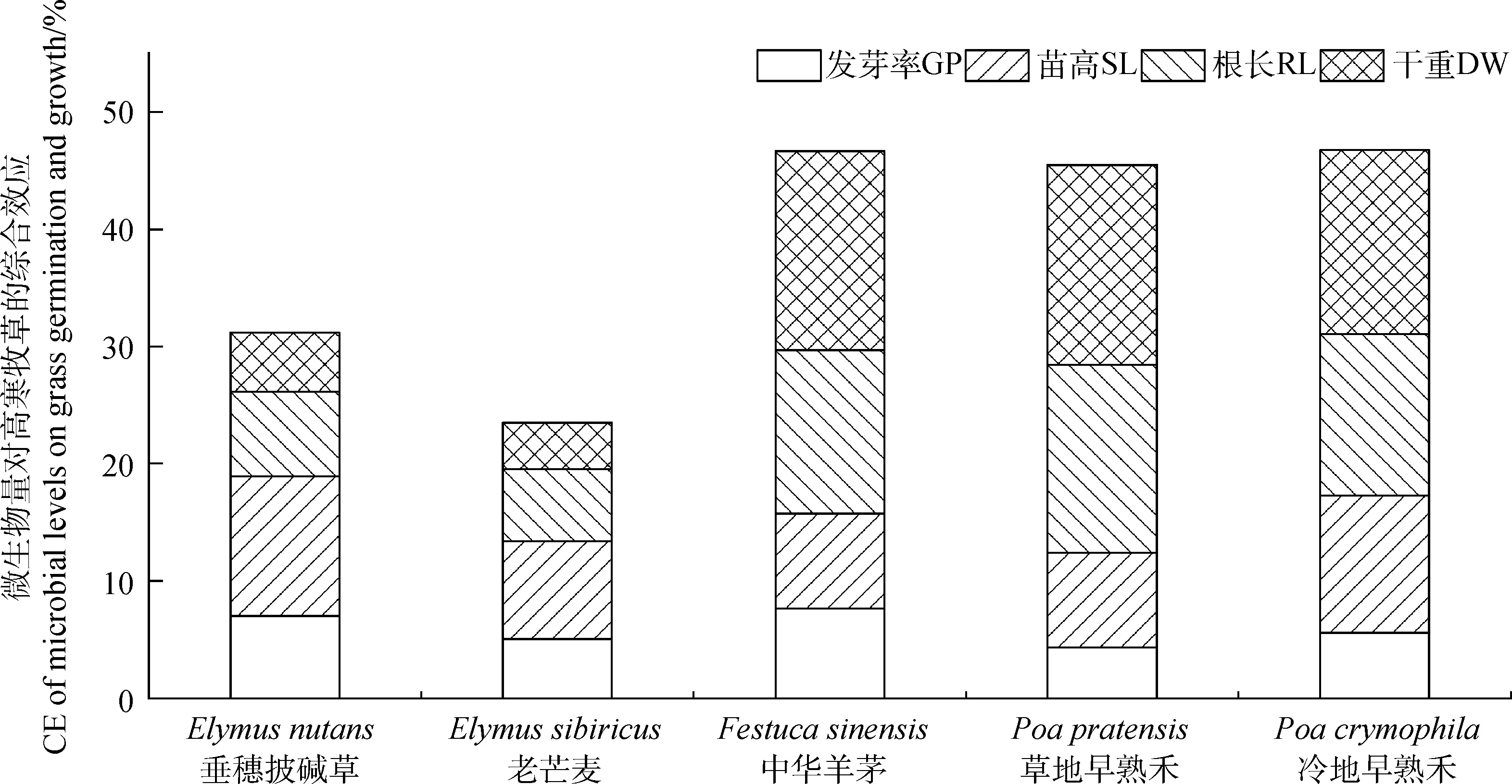
图5 土壤微生物对栽培牧草种子发芽和幼苗生长的综合效应Fig.5 Comprehensive effects of microbial levels on grass germination and growth
3 讨论
土壤微生物量是存在于土壤环境中对环境的变化比较敏感的指标,是生态系统的重要组成部分。土壤微生物种类繁多,数量庞大,不仅在土壤发育形成、基本物质循环和土壤肥力演变中扮演着重要角色,还影响着生态系统的功能完整性[14]。微生物通过自身代谢活动,分泌有机酸等物质黏结土壤粒子组成土壤团粒结构,促进土壤的形成和发育;部分代谢产物能促进矿物质分解,以助植物吸收利用[15-17]。研究显示,土壤微生物量与土壤健康状况密切相关,也能指示草地生态系统中物质循环能力强弱,当土壤微生物量下降时,表明土壤微生物活性降低,土壤出现一定程度的退化[18-20]。
本研究中,以U100,U75,U50和U25为基质的5种栽培牧草种子发芽率均高于U0,且随基质中微生物的减少而有类似的递减规律,虽对不同物种的影响存在差异,但也证明了微生物量的增加提高了种子发芽率。这与Rudgers and Orr研究高羊茅及其内生真菌通过土壤中的化学或生物变化影响树苗生长的结果类似[21],以及Zhu等人[22]对土壤生物区系降低了入侵紫茎泽兰的化感效应的研究结果一致,均表明土壤微生物具有减轻化感效应的重要作用。高小宽等[23]对禾本科植物小麦的研究表明,根际微生物可有效加快小麦种子的萌发速度,提高种子的发芽率结果也与本研究一致。土壤微生物分解动植物残体等有机质形成腐殖质,改善土壤的结构和耕性,释放营养元素供给植物吸收利用[24-26]。同时,残体分解也伴随着化感物质在土壤中的迁移、转化,进入土壤中的化感物质,由于温度、水分、养分等因素与微生物的种类和数量密切相关,因此有的化感物质可被微生物分解而失活[27]。本研究中,微生物对种子发芽率促进可能与其分泌的一些激素等有利于种子萌发的生物活性物质有关;另外,也可能是土壤微生物消耗有机分子,使化感物质不能积累到植物毒性水平,因而受体植物在自然情况下不表现出任何化感效应,但究其具体原因还有待于进一步研究。
比较U100,U75,U50,U25和U0基质下幼苗的生长状况,结果显示垂穗披碱草、老芒麦和中华羊茅幼苗苗高随土壤微生物含量的增加而增加,但对于两种早熟禾的影响不明显。这应该与幼苗的大小存在联系,5种栽培牧草生长时间一致,但早熟禾因种子小,出苗时根与芽生长相对较小,在初期生长阶段受微生物的促进影响较弱,尚未表现出明显性状。研究表明,土壤微生物多样性越丰富,更适合于植物根系的生长[28-29]。本研究显示,在U100处理下,5种栽培牧草幼苗的根长均高于其他处理组,证明在幼苗生长阶段土壤微生物的多样性与生物量对根系生长至关重要。对比以U75,U50,U25和U0为基质的实验组,发现它们之间变异较小,说明完整的土壤微生物组成更能有效促进幼苗根长。在植物生长过程中,根系分泌物向土壤微生物提供大量的营养与碳源,影响微生物群落结构,产生有利于种子发芽和植物生长的生物活性物质,提高了种子发芽率并促进了幼苗生长[30-31]。本研究中,垂穗披碱草、老芒麦和中华羊茅幼苗干重的变化趋势同幼苗苗高一致,幼苗干重可能受幼苗苗高影响更为突出。这可能是垂穗披碱草、老芒麦和中华羊茅种子,种子萌发时胚乳营养储备充裕,满足了萌发后幼苗快速生长的营养需求。
种子的萌芽测试因方法简单、重复性好,易于控制,成为化感潜力分析中最重要和最广泛的方法之一。幼苗生长试验是对受体幼苗生长和发育指标的测定,通常以根长、苗高、干鲜重等指标来判断化感效应。一般认为,幼苗生长试验比种子萌芽测试更为敏感,化感潜力是研究化感效应不可缺少的部分,种子萌发测试和幼苗生长试验是最常见的化感潜力分析方法[32]。综合对比研究结果,基质对5种栽培牧草的平均促进率为38.72%,其中对冷地早熟禾、中华羊茅与草地早熟禾的促进作用较大,依次为46.74%,46.56%和45.49%,且主要表现在根系生长和幼苗干重方面。对垂穗披碱草和老芒麦,两种披碱草属的栽培牧草相对较小,这可能与物种的进化史有关。
4 结论
以U100,U75,U50,U25 和U0为基质的5种栽培牧草种子发芽率呈逐渐降低趋势,土壤微生物能缓解化感效应提高种子发芽率,但对不同物种的影响存在差异。比较U100,U75,U50,U25和U0处理下幼苗苗高的生长状况,结果显示垂穗披碱草、老芒麦和中华羊茅幼苗苗高随土壤微生物含量的增加而增加,但对于两种早熟禾的影响不明显。在U100处理下,5种栽培牧草幼苗的根长均高于其他处理,表明在幼苗生长阶段土壤微生物对根系生长至关重要。幼苗干重的变化趋势同幼苗苗高相似,可能受幼苗苗高影响更为突出。基质的微生物对冷地早熟禾、中华羊茅与草地早熟禾的促进作用较大,依次为46.74%,46.56%和45.49%,且主要表现在根系生长和幼苗干重方面。
——黔南扁穗雀麦

