番茄红素对人内皮祖细胞增殖、迁移、成管能力的影响观察及其机制探讨
陈俊求,蔡洁娜,刘强,熊龙根
1 广州医科大学附属第二医院心内科,广州 510000;2 中国医学科学院阜外医院深圳医院心内科;3 广东省普宁市人民医院检验科
动脉粥样硬化(AS)是动脉粥样硬化性心血管疾病(ASCVD)的病理基础,对AS 发生发展以及调控机制的研究是心脑血管疾病防治的重要一环。血管内皮细胞功能障碍被认为是AS 发病机制中最重要的事件,因此通过减轻血管内皮损伤来防治ASCVD 是一种可行的策略[1]。内皮细胞功能失稳主要与外周血内皮祖细胞(EPCs)数量减少和功能障碍有关,目前已知氧化型低密度脂蛋白(ox-LDL)通过激活内皮细胞AMP依赖的蛋白激酶(AMPK)—哺乳动物雷帕霉素靶蛋白(mTOR)—自噬促进AS 形成[2-3]。然而,ox-LDL 是否诱导 EPCs 自噬以及诱导EPCs 功能损伤的潜在机制仍知之甚少。番茄红素(Lyc)是一种天然类胡萝卜素,具有极强的抗氧化和抗炎作用,对高糖或终末糖基化产物诱导的EPCs损伤具有保护作用,可以通过激活AMPK-mTOR 通路激活自噬[4-7]。2020 年 10 月—2021 年 11 月,我们观察了 Lyc 对 ox-LDL 诱导的 EPCs 细胞增殖、迁移、成管能力的影响,并探讨其可能作用机制。
1 材料与方法
1.1 EPCs及主要试剂、仪器 EPCs:普宁市人民医院中心实验室提供的健康志愿者外周血来源单个核细胞体外诱导分化的晚期EPCs。主要试剂:ox-LDL(北京索莱宝,H7950),Lyc(上海源叶生物,S24983-20 mg),内皮细胞培养基(ECM,美国 ScienCell,1001),CCK-8 试剂盒(上海碧云天,C0042),matrigel基质胶(美国 BD,356234),AMPK(Abcam 公司,ab131512),p-AMPK(Abcam 公司,ab23875),mTOR(Abcam 公 司 ,ab32028),p-mTOR(Abcam 公 司 ,ab109268),β-Actin(赛维尔,GB11001),LC3B(Abcam 公司,192890),小分子化合物C(CC)(APExBio,B3252)。主要仪器:细胞生化恒温孵育箱(美国Thermo,371),Western blot 电泳仪(美国伯乐,1658033),凝胶成像显影仪(美国Thermo,E-Gel),超净工作台(江苏苏净,SW-CJ-iFD),酶标仪(瑞士Tecan,F50)。
1.2 EPCs分组、Lyc给予方法以及细胞增殖活力测算 采用CCK-8 法。将EPCs 接种至96 孔板,每孔3 000细胞,细胞培养24 h。24 h后将细胞分为4组,分别为 A 组、B 组、C 组、空白组(D 组)。A 组加入含10%胎牛血清的培养基和ox-LDL(10 mg/L)的培养基培养24 h 后弃去上清,再加入含10%胎牛血清和 Lyc(10 mg/L)的培养基培养 24 h;B 组加入含10%胎牛血清和ox-LDL(100 mg/L)的培养基培养48 h;C 组加入含 10%胎牛血清和 Lyc(10 mg/L)的培养基培养48 h;D 组细胞加入含10%胎牛血清的培养基培养48 h。细胞处理结束后收集细胞,CCK8试剂盒取出平衡至室温30 min,每孔加100 μL 的ECM 与CCK8(按1 000∶100 比例)混合液。放回培养箱中孵育1~3 h,利用酶标仪检测反应液检测450 nm 处的OD 值,计算细胞增殖活力,细胞增殖活力(%)=(实验组OD 值-空白组OD 值)/(对照组OD值-空白组OD值)×100%。
1.3 EPCs 分组、Lyc 给予方法以及细胞划痕愈合率、形成小管直径测算 分组方法同“1.2”。细胞铺满板底后,用1 mL 枪头垂直于孔板制造细胞划痕,清洗后加入无血清ECM,镜下观察并拍照记录,放回入培养箱培养,24 h 和48 h 镜下观察并拍照记录,以划痕愈合率(%)评价迁移能力。细胞成管实验:预冷 96 孔板,每孔加入 50 μL 的 Matrigel,每孔加入 100 μL 浓度为 4×105/mL 细胞,24 h 和48 h 后镜下观察,以形成小管直径(mm)评价成管能力。
1.4 EPCs分组、Lyc给予方法以及细胞自噬相关蛋白检测 采用Western blot 法。分组方法同“1.2”。收集EPCs提取蛋白样品鉴定,电泳、转膜后予以抗体孵育,本次检测的主要是自噬接头蛋白(P62)、微管相关轻链蛋白3(LC3)的剪切成分LC3-1、LC3-Ⅱ及自噬相关蛋白Beclin-1和信号通路蛋白(MAPK,mTOR)表达情况,一抗、二抗孵育结束后予以显影,用image J软件进行条带灰度值分析,以β-actin作为内参,并计算目标条带与β-actin 的比值进行统计学分析。以p-AMPK/AMPK、p-mTOR/mTOR 的比值分别表示AMPK、mTOR蛋白的磷酸化水平,以LC3-Ⅱ/LC3-Ⅰ的比值表示LC3-Ⅱ的表达水平,以ox-LDL+Lyc处理时LC3-Ⅱ的表达水平评估细胞自噬水平。
1.5 EPCs 分组、CC 给予方法以及细胞增殖活力测算 采用CCK-8 法。将EPCs 接种至96 孔板,每孔3 000细胞,细胞培养24 h。24 h后将细胞分为4组,分别为 E 组、F 组、G 组、H 组。E 组首先加入含 10%胎牛血清和CC的培养基温箱孵育30 min,然后加入含10%胎牛血清和ox-LDL(10 mg/L)的培养基培养24 h 后弃去上清,最后再加入含10%胎牛血清和 Lyc(10 mg/L)的培养基培养 24 h;F 组加入含10%胎牛血清的培养基和ox-LDL(10 mg/L)的培养基培养24 h 后弃去上清,再加入含10%胎牛血清和 Lyc(10 mg/L)的培养基培养 24 h;G 组加入含10%胎牛血清和ox-LDL(100 mg/L)的培养基培养48 h;H 组加入含10%胎牛血清的培养基培养48 h。细胞处理结束后收集细胞,CCK8 试剂盒取出平衡至室温 30 min,每孔加 100 μL 的 ECM 与 CCK8(按1 000∶100 比例)混合液。放回培养箱中孵育1~3 h,利用酶标仪检测反应液检测450 nm 处的OD值,计算细胞增殖活力,细胞增殖活力(%)=(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD值)×100%。
1.6 EPCs 分组、CC 给予方法以及细胞划痕愈合率、形成小管直径测算 分组方法同“1.5”。细胞铺满板底后,用1 mL 枪头垂直于孔板制造细胞划痕,清洗后加入无血清ECM,镜下观察并拍照记录,放回入培养箱培养,24 h和48 h镜下观察并拍照记录,以划痕愈合率(%)评价迁移能力。细胞成管实验:预冷 96 孔板,每孔加入 50 μL 的 Matrigel,每孔加入100 μL 浓度为4×105/mL 细胞,24 h和48 h后镜下观察,以形成小管直径(mm)评价成管能力。
1.7 EPCs 分组、CC 给予方法以及细胞自噬相关蛋白检测 采用Western blot 法。分组方法同“1.5”。收集EPCs 提取蛋白样品鉴定,电泳、转膜后予以抗体孵育,本次检测的主要是自噬相关蛋白Beclin-1、微管相关轻链蛋白3(LC3)的剪切成分LC3-Ⅰ和LC3-Ⅱ、自噬接头蛋白(P62)以及信号通路蛋白(MAPK、mTOR)表达情况,一抗、二抗孵育结束后予以显影,用image J 软件进行条带灰度值分析,以βactin 作为内参,并计算目标条带与β-actin 的比值进行统计学分析。以p-AMPK/AMPK、p-mTOR/mTOR的比值分别表示AMPK、mTOR 蛋白的磷酸化水平,以LC3-Ⅱ/LC3-Ⅰ的比值表示LC3-Ⅱ的表达水平,以ox-LDL+Lyc 处理时LC3-Ⅱ的表达水平评估细胞自噬水平。
1.8 统计学方法 采用SPSS25.0 和R4.0.2 统计软件。符合正态分布的计量资料以表示,组间单一协变量间比较采用one-way ANOVA 分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较 细胞增殖活力、细胞划痕愈合率、形成小管直径比较见表1。
表1 各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较()
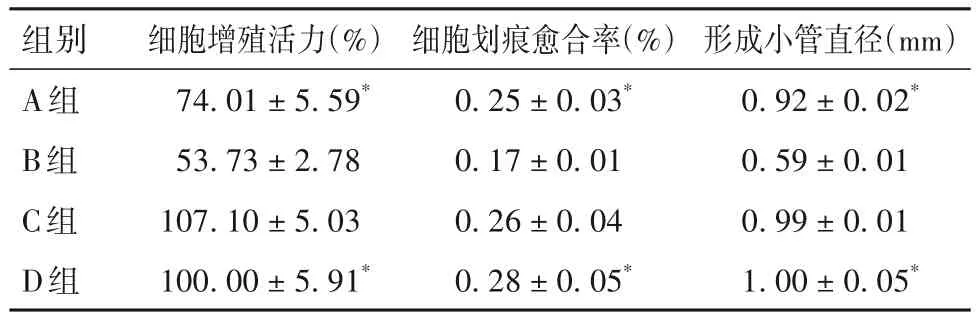
表1 各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较()
注:与B组比较,*P<0.05。
组别A组B组C组D组形成小管直径(mm)0.92±0.02*0.59±0.01 0.99±0.01 1.00±0.05*细胞增殖活力(%)74.01±5.59*53.73±2.78 107.10±5.03 100.00±5.91*细胞划痕愈合率(%)0.25±0.03*0.17±0.01 0.26±0.04 0.28±0.05*
2.2 各组细胞p62、LC3-Ⅱ、Beclin-1 蛋白相对表达量比较 细胞p62、LC3-Ⅱ、Beclin-1 蛋白相对表达量比较见表2。
表2 各组细胞p62、LC3-Ⅱ、Beclin-1蛋白相对表达量比较()

表2 各组细胞p62、LC3-Ⅱ、Beclin-1蛋白相对表达量比较()
注:与B组比较,*P<0.05。
组别A组B组C组D组LC3-Ⅱ1.91±0.17*1.31±1.19 0.96±0.07 1.00±0.07*p62 1.41±0.02*1.85±0.09 0.95±0.05 1.00±0.12*Beclin-1 4.08±0.17*2.95±0.53 0.96±0.33 1.00±0.36*
2.3 各组细胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相对表达量比较 细胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相对表达量比较见表3。
表3 各组细胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相对表达量比较()

表3 各组细胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相对表达量比较()
注:与B组比较,*P<0.05。
组别A组B组C组D组p-mTOR/mTOR 0.57±0.11*1.29±0.02 0.91±0.05 0.94±0.07*p-AMPK/AMPK 1.00±0.08*0.33±0.01 0.61±0.05 0.58±0.07*
2.4 阻断AMPK后各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较 阻断AMPK 后细胞增殖活力、细胞划痕愈合率、形成小管直径比较见表4。
表4 阻断AMPK后各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较()
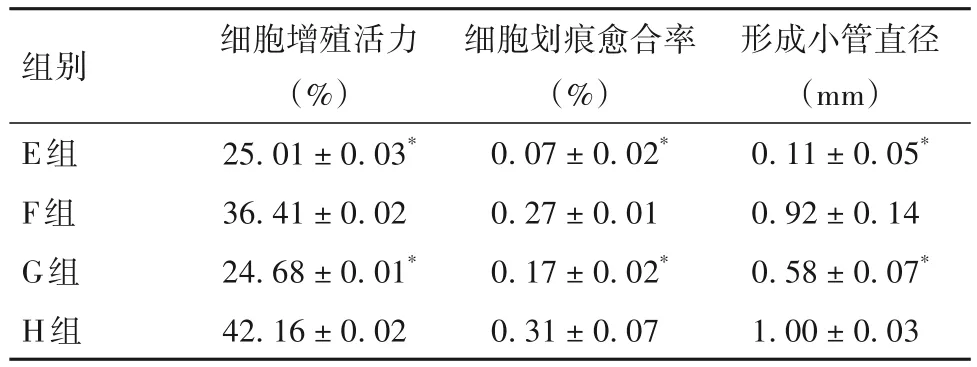
表4 阻断AMPK后各组细胞增殖活力、细胞划痕愈合率、形成小管直径比较()
注:与F组比较,*P<0.05。
组别E组F组G组H组形成小管直径(mm)0.11±0.05*0.92±0.14 0.58±0.07*1.00±0.03细胞增殖活力(%)25.01±0.03*36.41±0.02 24.68±0.01*42.16±0.02细胞划痕愈合率(%)0.07±0.02*0.27±0.01 0.17±0.02*0.31±0.07
2.5 阻断 AMPK 后各组细胞 p62、LC3-Ⅱ、Beclin-1蛋白相对表达量比较 阻断AMPK 后细胞p62、LC3-Ⅱ、Beclin-1蛋白相对表达量比较见表5。
表5 阻断AMPK后各组细胞p62、LC3-Ⅱ、Beclin-1蛋白相对表达量比较()
注:与G组比较,*P<0.05。
组别E组F组G组H组Beclin-1 1.26±0.16*0.79±0.18 1.34±0.02 1.00±0.16*p62 1.19±0.08*1.57±0.08 1.15±0.07 1.00±0.24*LC3-Ⅱ1.33±0.13*1.86±0.06 1.41±0.06 1.00±0.06*
3 讨论
ASCVD 是全球范围内最主要的血管疾病,AS是其病理基础。虽然抗动脉硬化治疗的进步已经使心脏病和脑卒中的病死率显著下降,但是全球疾病负担研究显示,这种下降在低收入或中等收入国家呈现非可持续性[8]。目前,心脑血管病死率的下降主要是脑卒中病死率下降,而ASCVD 的病死率下降幅度并不大,甚至在亚洲某些国家,报告的ASCVD病死率甚至有所上升趋势[9],《中国心血管健康与疾病报告2020 概要》指出我国心血管疾病已超过肿瘤性疾病成为我国城乡居民总体死亡原因的首位病因,报告推算我国冠心病的现患病人数约为1 100万,我国心血管疾病患病人数总体上仍呈现上升趋势[10],因此对AS发生发展以及调控机制的研究和探索是心脑血管疾病防治的重要一环。
AS 的始动因素包括低密度脂蛋白胆固醇(LDL)、炎症以及内皮细胞损伤:动脉长期累积暴露于LDL 仍然是AS 发生和进展的主要决定因素,ox-LDL 是促动 AS 的关键[11],同时 ox-LDL 颗粒的成分会诱发炎症并提供适应性免疫的新表位,炎症反过来又可以以驱动AS 的方式改变动脉壁细胞的功能。ox-LDL 处理巨噬细胞或内皮细胞可以激活NLRP3炎症小体,随后导致巨噬细胞或内皮细胞IL-1β的分泌,而下调NLRP3 炎症小体可提高内皮细胞功能和巨噬细胞存活,从而抑制AS[3]。这些经由危险因素或疾病介导的系统性全身炎症以及血管壁细胞功能损伤引起的局部炎症(例如损伤的血管内皮细胞激活内膜细胞释放炎症细胞因子的炎症过程)均会释放可溶性炎症介质,进而触发以及加速AS的过程[12]。除了脂质学说和炎性学说,早在 1993 年,血管内皮细胞功能障碍就被认为是心血管疾病发病机制中最重要的事件[13]:内皮细胞暴露于导致AS的风险因素后出现内皮细胞功能障碍从而导致脂质沉积、免疫炎症细胞浸润,血管内皮损伤被认为是AS的始动环节,因此通过减轻血管内皮损伤来防治AS是一种可行的策略,而内皮细胞功能失稳则主要与外周血 EPCs 数量减少和功能障碍有关[2]。EPCs 是在血液中循环的单核细胞,来自不同的组织,表达类似于成熟内皮细胞的细胞表面标志物。EPCs 的发现为血管修复和AS 带来了新的方向,也为动AS 的血管稳态修复提供了新的理论。来自骨髓和其他一些器官的EPCs 通过迁移到远处的血管来帮助血管修复,在那里它们分化为成熟的内皮细胞并替换旧的和受损的内皮细胞。EPCs 修复血管损伤的能力则取决于它们的数量和功能[14],因此如何通过减少危险因素对于EPCs 损伤进而维护血管内皮细胞的功能稳态免于ox-LDL 和炎症的损伤是预防AS 这一病理过程的关键步骤之一。
Lyc 是一种天然类胡萝卜素,具有极强的抗氧化和抗炎作用,能预防心血管疾病,包括高血脂与AS[15]。已有研究[5-6]报道,Lyc 对高糖或糖基化终产物诱导的EPCs损伤具有保护作用。Lyc可以通过激活AMPK活性抑制炎症[16]和激活自噬[17]。值得注意关注的是AMPK激活可在冠心病、糖尿病心肌病、脑卒中等病理过程中减弱NLRP3 炎性小体的上调[18-19]。既往研究表明,AMPK/mTOR 信号通路激活自噬下调NLRP3炎性小体[20-23]。然而,Lyc是否对ox-LDL 诱导的EPCs 损伤具有保护作用及其调控机制尚未明确。因此,在本研究拟在体外研究Lyc 对ox-LDL 诱导EPCs 的自噬信号的影响,并进一步探讨了Lyc 参与AMPK/mTOR 信号通路的潜在机制,为Lyc 治疗AS 的机制提供了新的见解。本研究在细胞水平上揭示Lyc对ox-LDL诱导的EPCs增殖、迁移和成管能力的保护作用:在我们用ox-LDL 诱导刺激EPCs 后出现了EPCs 细胞增殖能力的下降,迁移能力和成管能力的减退,而在补充Lyc 干预后,这种损伤能够得到很大程度上的改善,表现为EPCs增殖活力的增加,细胞划痕愈合率增加,小管平均长度的增加,进一步的研究提示这种功能保护作用可能与Lyc 激活AMPK-mTOR-自噬通路有关,在我们加入AMPK 磷酸化激活的阻断剂CC 后进一步验证AMPK 磷酸化激活是Lyc 发挥保护作用的关键信号分子,而AMPK 磷酸化介导的自噬是Lyc 发挥保护作用的关键通路。EPCs 功能障碍在ox-LDL 诱导的AS发病机制中起关键作用,大量研究应用于寻找改善EPCs功能的解决方案[24]。抗炎药、抗高血压药以及补充维生素D都被认为是治疗策略[25]。最近越来越多的研究注目于天然药物及其单体化合物,如丹参酮ⅡA、柴胡皂苷A 以及淫羊藿苷等均被报道改善内皮功能[26-27]。Lyc 是一种四萜类胡萝卜素,广泛存在红色水果中,Lyc 特殊的化学结构(11 个共轭双键)决定了其具有猝灭单线态氧、清除自由基、抑制脂质过氧化等多种生理功能活性[28],因而被认为有光明的应用前景。在既往研究中已经报道过Lyc 对高糖诱导的EPCs损伤具有保护作用[29],在此我们则首次描述了Lyc 对ox-LDL 诱导的EPCs 损伤保护作用,具体表现为ox-LDL 诱导的EPCs 的增殖、迁移和成管能力的改善,并观察到Lyc 对ox-LDL 诱导EPCs自噬流的强化。
为了探究Lyc 如何在EPCs 中发挥其保护作用,我们测试了Lyc 在ox-LDL 刺激下对EPCs 中自噬信号蛋白表达的影响。自噬与心血管疾病密切相关,目前观察自噬主要通过透射电镜直接观察自噬小体形成来判断自噬,或者通过检测标记自噬过程中的标记蛋白。在我们的结果中显示100 mg/L ox-LDL可以诱导EPCs自噬,伴有自噬过程中关键信号蛋白p62、LC3-Ⅱ、Beclin-1 的表达差异。但自噬作为“双刃剑”在ox-LDL 的作用下伴随着EPCs 分化功能受损,在不利的条件下表现为负性的调控作用,而在Lyc 作用下自噬信号显著增强反而伴随着EPCs功能改善,这可能是因为控制自噬小体成熟的机制是动态调节的,以允许自噬通量适应细胞的需要,并使自噬降解与外部输入整合,也可能存在与其他程序性死亡信号串扰可能。自噬是细胞程序性死亡方式[2],对程序性死亡方式的调控是恢复EPCs 功能稳态对抗AS进程的重要方式,既往研究已经报道过调控 EPCs 凋亡[2],自噬[30]改善其功能,而本实验首次报道采用Lyc 干预ox-LDL 诱导的EPCs 呈现自噬活性的增强,且提高了细胞增殖活力伴细胞功能的改善,因此,Lyc 的这种保护作用可能也是通过经典信号调节通路调控程序性死亡方式来实现的,同时,Lyc 调控ox-LDL 诱导的EPCs 自噬以维持内皮稳态是防治AS的一种可行方法。既往研究表明,自噬过程受 mTOR 和 AMPK[31]两个传感器严格调节,AMPK-mTOR-自噬信号轴的反馈回路保证了适当的反应机制。在本次实验中,ox-LDL 诱导的EPCs 自噬伴随AMPK 磷酸化活性增加并抑制mTOR 磷酸化,而予以Lyc干预后则表现p-AMPK表达进一步增高,p-mTOR 表达水平进一步降低,值得注意的是EPCs仅在Lyc的作用下同样伴随AMPK磷酸化活性增加,加入CC 后逆转自噬强化且伴有EPCs 功能损伤,我们的研究结果和前人的研究均确认Lyc 为AMPK的激活剂[17,32],可以直接激活或强化自噬信号。
总之,Lyc可以有效保护EPCs的增殖、迁移和成管功能,上调细胞的自噬水平,作用机制可能是通过AMPK 磷酸化激活有关,此为Lyc 抗AS 的机制提供了新的思路。

