寡转移前列腺癌内分泌治疗联合原发灶放疗的疗效观察
林建贵 陈丽民 卓延红 万金平 陈金飚
(1 福建医科大学附属漳州市医院泌尿外科,福建 漳州 363000;2 福建医科大学附属漳州市医院放疗科,福建 漳州 363000)
前列腺癌是全球第二大常见恶性肿瘤,病死率为男性恶性肿瘤中排第5位[1]。内分泌治疗是转移性前列腺癌标准一线治疗方法[2],寡转移前列腺癌是介于局限性前列腺癌与广泛转移性前列腺癌的中间状态,其肿瘤生物侵袭性较温和[3]。近年来的研究提示对寡转移病例除了内分泌治疗,给予前列腺局部治疗,包括前列腺放疗或前列腺根治术,可获得满意的局部控制,并且有可能生存获益[4]。本研究回顾性分析寡转移前列腺癌患者69 例,比较内分泌治疗联合或不联合前列腺放疗的疗效,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月至2017年6月就诊我院的寡转移前列腺癌患者69例,年龄(70.40±5.30)岁,中位年龄71岁。纳入标准:①所有病例经前列腺穿刺活检病理诊断为前列腺癌。②骨转移灶数目≤5个且无内脏转移的低肿瘤负荷状态。③首次确诊,既往未接受过手术、放化疗等肿瘤治疗方式。④患者一般状况评分卡氏(Karnofsky,KPS)标准≥70分,或ECOG全身状况评估标准(PS)0~1分。⑤临床资料完整,可供分析肿瘤情况及治疗计划者。本研究经医院伦理委员会审查批准(漳医伦2021LWB043)。
1.2 治疗方法 内分泌治疗联合前列腺原发灶放疗患者24例,单纯内分泌治疗患者45例。内分泌治疗(androgen deprivation therpy,ADT)包括睾丸切除术或是每月1次醋酸戈舍瑞林缓释植入剂(商品名:诺雷德,英国阿斯利康制药有限公司)3.6 mg皮下注射及口服抗雄激素药物比鲁卡胺片(商品名:康士得,英国阿斯利康制药有限公司;或商品名:双益安,上海复旦复华药业有限公司)50 mg,每天1次。
前列腺放疗患者采用CT模拟定位,定位前排空直肠,充盈膀胱。常规仰卧位,用真空成型垫固定盆腔。碘对比剂增强扫描,扫描层厚5 mm。扫描范围为第5腰椎至肛门下缘5 cm坐骨结节下1 cm。靶区勾画标准:CTV(临床靶区)包括整个前列腺和包膜,局部中高危患者包括精囊腺,GTVnd(淋巴结肿瘤靶区)定义为盆腔转移淋巴结,CTVnd为GTVnd外扩8 mm,不做盆腔淋巴结预防性照射,PTV(计划靶区)为CTV外扩10 mm,向后直肠方向外扩5 mm。全组患者均采用调强放射治疗技术(intensity modulated radiotherapy technique,IMRT),常规分割剂量每次1.8~2 Gy,每日1次,每周5次,放疗处方剂量前列腺70 Gy,盆腔淋巴结转移灶60~66 Gy。
骨转移灶放疗针对承重骨转移灶或骨转移疼痛病灶放疗。其中内分泌治疗联合原发灶放疗组骨转移灶放疗10例,单纯内分泌治疗组17例。采用CT模拟定位时,患者常规仰卧位,用真空成型垫固定体位。GTV定义为骨转移病灶,PTV为GTV外扩10 mm,放疗处方剂量30 Gy/10F。
1.3 不良反应评价 放疗期间每周、放疗后1个月、之后每3个月评价患者的不良反应。采用RTOG急性放射性损伤分级标准及慢性放射性损伤分级方案进行评价。
1.4 统计学处理 用SPSS 23.0软件进行数据分析。计量资料采用t检验,计数资料采用χ2检验,用K-M法计算生存率并行Log-rank检验,P<0.05为差别有统计学意义。
2 结果
2.1 临床特征 两组患者年龄、临床T分期和N分期、初诊PSA平均值、病理Gleason评分、骨转移中位个数比较差别均无统计学意义。见表1。
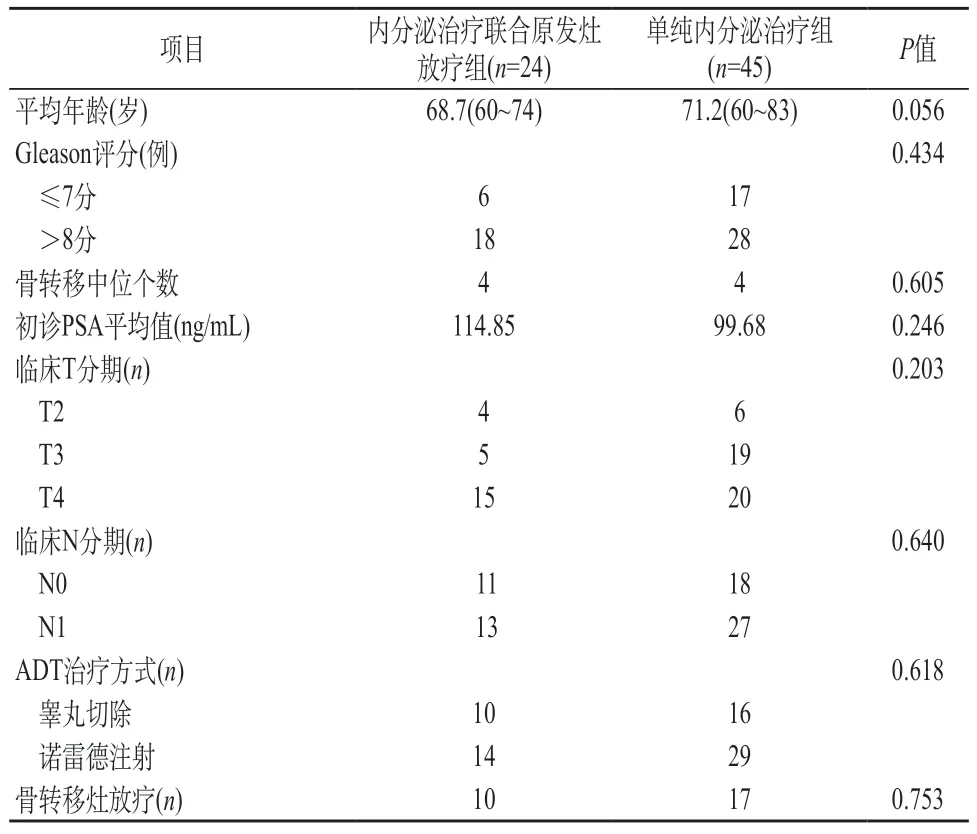
表1 69例寡转移前列腺癌患者一般临床资料及比较
2.2 生存情况 内分泌治疗联合前列腺放疗组的预后明显优于单纯内分泌治疗组,内分泌治疗联合原发灶放疗组与单纯内分泌治疗组的中位生存时间分别为61、42个月。内分泌治疗联合原发灶放疗组与单纯内分泌治疗组3、5年的生存率分别为82.3%和53.4%、49.6%和22.7%(P=0.010,χ2=6.668)。内分泌治疗联合原发灶放疗组和单纯内分泌治疗组3年PSA无生化复发率为45.8%和22.2%,两组比较差别有统计学意义(P=0.042,χ2=4.121)。内分泌治疗联合原发灶放疗组与单纯内分泌治疗组的生存曲线比较。见图1。
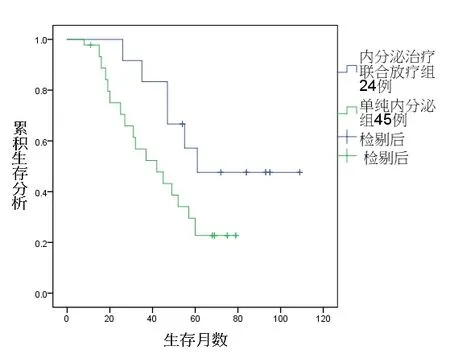
图1 内分泌治疗联合原发灶放疗组与单纯内分泌治疗组的生存曲线比较
2.3 两组治疗的不良反应 去势治疗(手术或药物去势)联合抗雄治疗的常见不良反应是勃起功能障碍、性生活丧失。其他不良反应如潮热、乏力、骨骼酸痛、转氨酶异常在两组患者中发生率差别比较无统计学意义,均P>0.05。见表2。
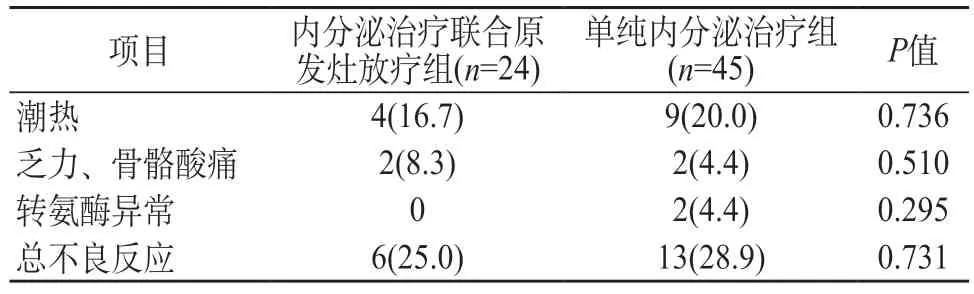
表2 两组内分泌治疗的不良反应[n(%)]
2.4 放疗的不良反应 联合前列腺放疗组1~2级急性直肠反应发生率33.3%,1级急性尿道反应20.8%。1级白细胞减少16.7%。无急性3、4级不良反应。1例患者放疗初期出现急性尿潴留,留置尿管半个月后,顺利拔除尿管,自行排尿通畅。1~2级慢性直肠反应12.5%,其中1例2级肠道反应。1级慢性尿道反应12.5%,无慢性3、4级不良反应(表3)。
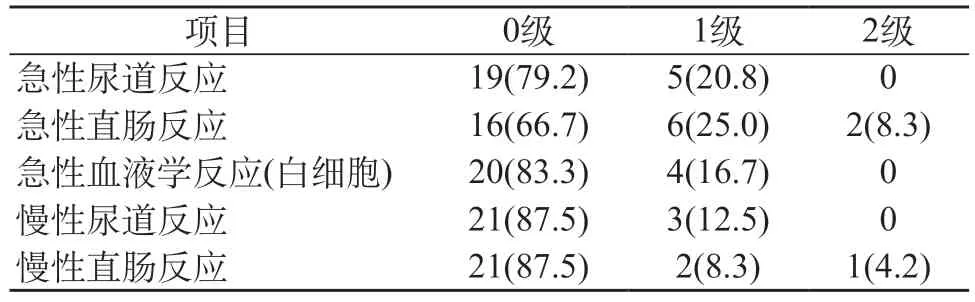
表3 24例寡转移前列腺癌内分泌治疗联合原发灶放疗组的不良反应[n(%)]
3 讨论
前列腺癌是全球第二大常见恶性肿瘤,病死率在男性恶性肿瘤中排第5位[1]。在我国由于前列腺特异性膜抗原(prostate specific antigen,PSA)的筛查尚未全面普及,部分患者初诊时已出现远处转移。转移性前列腺癌患者的主要治疗方法是内分泌治疗[2]。近年,有关转移性前列腺癌局部治疗的研究逐渐增加,在标准内分泌治疗的基础上联合前列腺局部放疗或手术治疗有可能取得生存获益[5-6]。
本研究显示,内分泌治疗联合原发灶放疗组和单纯内分泌治疗组患者的年龄、临床T分期、N分期、初诊PSA平均值、病理Gleason评分、骨转移个数比较差别无统计学意义,但前者的平均年龄略小于后者,原因可能是本研究为回顾性研究,临床上倾向选择年龄小、总体健康良好的患者行原发灶放疗。本研究结果提示,内分泌治疗联合原发灶放疗组的生存率明显高于单纯内分泌治疗,两组的中位生存时间分别为61和42个月,两组3、5年的生存率分别为82.3%和53.4%、49.6%和22.7%,差别比较有统计学意义,且两组的3年无生化复发率为45.8%和22.2%,差别也有统计学意义。提示寡转移前列腺癌内分泌治疗联合前列腺局部放疗可明显提高患者的无生化复发率和总生存率。
STAMPEDE试验研究亚组分析发现,原发肿瘤放疗改善了低转移负荷患者的3年总生存率(81%vs.73%,P=0.007),而在转移负荷高的亚组无失败生存率或总生存率未得到改善[7]。另一项前瞻性HORRAD试验同样显示ADT联合原发肿瘤放疗较单纯ADT改善了骨转移灶≤5处亚组患者的生存,而原发灶放疗不能给未经选择的转移性前列腺癌患者带来生存获益[8]。针对原发灶局部治疗可以起到减瘤目的,缓解症状,并得到生存获益,其原理认为原发肿瘤是转移性癌细胞的来源,针对原发性肿瘤的积极治疗可以阻止转移灶的进展和新转移灶的产生[9]。鉴于上述2个随机对照试验,2020年EAU指南中低肿瘤负荷的转移性前列腺癌强烈推荐治疗方案修改为内分泌治疗联合局部放疗[2]。
除了针对寡转移前列腺癌的局部放疗,欧美国家也尝试对寡转移前列腺癌采用前列腺癌根治术并获得生存获益[10]。Löppenberg等研究结果显示,局部治疗组与未局部治疗组的3年总生存率分别为69%和54%,认为转移性前列腺癌患者可以从前列腺局部治疗中获益,而低肿瘤负荷且总体健康状况良好的患者似乎受益更大[6]。
去势治疗联合抗雄治疗是转移性前列腺癌内分泌治疗的金标准。去势治疗包括手术睾丸切除和药物趋势,已有多项研究表明二者的疗效基本相同,二者总生存期无统计学差异。内分泌治疗的常见不良反应是勃起功能障碍、性生活丧失,其他不良反应如潮热、乏力、骨骼酸痛、转氨酶异常在内分泌治疗联合原发灶放疗组及单纯内分泌治疗组患者中发生率差别比较无统计学意义,P均>0.05,提示联合放疗组治疗毒性反应无增加。
在放疗安全性方面,本研究中内分泌治疗联合原发灶放疗组1~2级急性直肠反应33.3%,1级急性尿道反应20.8%,1级白细胞减少16.7%,未观察到3级及以上的急性不良反应,急性放射性反应在放疗结束半个月后基本缓解。1~2级慢性直肠反应12.5%,其中1例2级直肠反应。1级慢性尿道反应12.5%,未观察到慢性3、4级不良反应。可见前列腺放疗不良反应轻微,治疗耐受性好,在临床上容易推广,有临床应用价值。
综上所述,对于寡转移前列腺癌患者,全身内分泌治疗是主要治疗方法,内分泌治疗基础上给予前列腺原发灶放疗,可取得生存获益,且放疗不良反应轻微。但本研究为回顾研究,入组的病例数较少,可能存在选择选择偏倚问题。对于寡转移患者局部治疗的疗效期待大样本量的前瞻性临床研究结果。

