锂离子电池正极材料改性研究进展
阴启昊,高波,尹俊太,付海洋,胡亮
锂离子电池正极材料改性研究进展
阴启昊,高波,尹俊太,付海洋,胡亮
(东北大学 冶金学院,沈阳 110819)
在高里程新能源动力汽车、电网储能以及5G通信的大背景下,高能量密度的锂离子电池成为了当下研究的热点。而正极材料的比容量大小将直接影响电池的能量密度,因此亟需对正极材料进行改性以改善其性能指标。综述了层状、尖晶石状、橄榄石状正极材料的结构特点及电化学性能,包括晶体结构、电子结构、循环稳定性、离子迁移速率及倍率能力等,比较了各类正极材料的优劣,并对常用的改性手段进行了相应总结。归纳了各类典型的正极材料存在的问题及其发展瓶颈,其中包括晶型变化、导电性能差、电压衰减、电解液侵蚀等,并分析了引起容量损失的因素,如高开路电压引起的电化学极化、材料组成元素的配比、电极/电解液界面的表面活性等。在此基础上,重点综述了近年来针对不同类型正极材料的改性研究进展,其中阴、阳离子掺杂,表面包覆有机物或无机物,特殊形貌设计,选择合适的电解液和黏结剂等手段能有效改善正极材料的比容量及结构稳定性。最后以现有的改性方法及电池体系为理论基础,对今后改性手段的发展趋势以及将正极材料应用于其他电池体系的可能性进行了展望。
锂离子电池;正极材料;电化学;能量密度;存在问题;改性方法
1960年,研究者们首次发现Li+、Na+、H+等插层离子能够改变部分过渡金属二硫化物和氧化物的电子电导率及光学性质,离子嵌入反应还使材料的晶体结构发生变化[1]。基于此理论,Whittingham等[2-3]于1975年首次组装了正负极分别为TiS2和金属锂,LiClO4/EG+THF作电解液的锂离子二次电池,在 4 mA/cm2的电流密度下循环1 100次后仍能保持70%的容量。尽管表现出了较好的容量保持率,但锂枝晶折断后沉积的死锂产生了不可逆容量。更重要的是,刺透隔膜的锂枝晶将使正负极短路、较低工作电压导致的低能量密度限制了该电池的应用。为了进一步寻找高能量密度的含锂负极,研究者们进行了广泛的探索。1980年,Goodenough等[4]根据能带与价带理论首先报道了可替代金属硫化物的LiCoO2正极,该层状材料产生了4 V的工作电压,远高于TiS2。由于仍然采用金属锂作负极,安全性问题依然存在,寻找与正极相匹配、安全性好的负极材料成为亟待解决的问题。Yazami等[5]研究发现石墨化碳材料在低倍率下无锂枝晶产生。在此基础上,Yoshino等[6]于1985年以热处理后的石油焦碳为负极,再配以LiCoO2正极组成了新型二次锂电池。20世纪90年代,Sony公司采用硬碳负极,LiCoO2正极以及LiPF6/PC+DEC电解液组成了第一只商用的锂离子二次电池,工作电压达到了3.6 V[7]。自此,锂离子电池的研究及应用领域不断扩大,热度不断攀升。直到2019年,锂离子电池领域的John B. Goodenough等人成功摘获了诺贝尔化学奖的桂冠,由此引发了锂离子电池研发的新热潮。随着电池商业化进程的不断推进,能量密度低的短板逐渐凸显。目前,LIB正极材料的研究方向主要集中于富镍和富锂三元层状氧化物的研发和改性。
本文以正极材料的晶体结构为切入点,着重介绍了常用的几类正极材料的电化学性质与改性工艺,对典型的正极材料今后的发展趋势进行了展望。
1 层状氧化物LiMO2
1.1 LiCoO2正极材料
α-NaFeO2晶型结构的LiCoO2是首先被研究的层状正极材料,见图1。其中构成晶体骨架的O位于6位,分别位于3和3位的Li和Co交替占据八面体空隙,层状排列于(111)晶面上[8]。Li+和Co3+之间较大的电荷和尺寸差异使阳离子呈现有序性。钴平面中共享八面体边缘上的Co-Co相互作用提供了良好的电子导电性[9]。Dahn等[10]对LiCoO2进行原位X射线衍射后发现,在充电过程中,当脱锂量达到0.5时,材料发生了六方-单斜的相转变。随着Li+的进一步脱出,钴的t2g轨道中的电子不断脱出,更多的Co3+被氧化为Co4+。O的2p轨道与Co的t2g轨道存在着部分重叠,O2‒的2p轨道也会随着脱锂过程的进行而脱出电子,释放出的氧气会导致安全性问题。因此,LiCoO2的实际容量通常被限制在140 mAh/g左右。Amatucci等[11]对LiCoO2/Li可充电电池中的阳极进行定性和定量分析后发现,当充电截止电压超过4.2 V时,容量损失与Co溶解量呈现正相关,电池循环性能随之变差。Ohzuku等[12]发现当充电电压达到4.5 V时,六方相开始转变为单斜相,他们认为该相变与CoO6八面体的Jahn-Teller畸变有关。因此为了减少不可逆容量损失,保持平稳的电压平台,充电截止电压通常被限制在4.2 V以下。
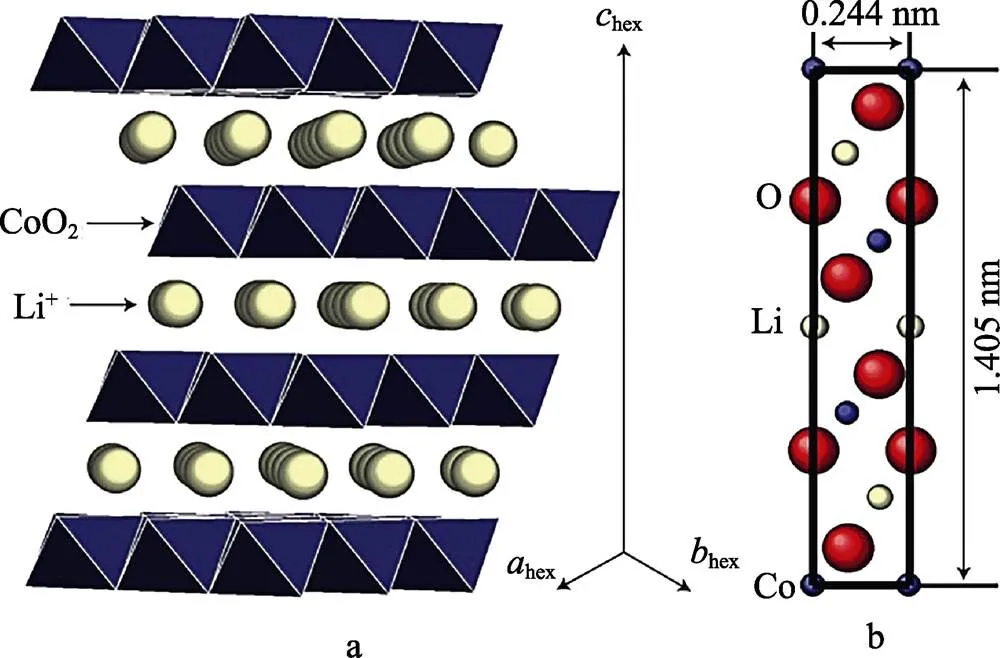
图1 空间群为R-3m的层状LiCoO2的晶体结构模型(a)和晶胞参数(b)[8]
表面包覆与体相掺杂是改善LiCoO2结构及循环稳定性常用的手段。表面包覆的目的是避免LiCoO2表面与电解液直接接触,缓解因Co溶解以及氧气析出导致的循环稳定性差的问题。氧化物、氟化物、磷酸盐等可用作包覆物。Fey等[13]通过机械热涂覆法在LiCoO2表面包覆了20 nm厚的Al2O3薄层,循环14次后的稳定性是原始LiCoO2的13倍,他们认为产生此结果的原因是Al2O3涂层抑制了钴酸锂六方-单斜-六方的特征性结构相变。Aboulaich等[14]以钴氧化物和碳酸锂为原料,通过固相反应法合成了CeF3包覆的 LiCoO2,包覆后的材料表现出160 mAh/g的高容量,多次循环后的容量衰减率也有所减小,产生该现象的原因是CeF3涂层防止了充放电过程中的副反应,减轻了电解液中的酸性成分对电极的侵蚀,钴酸锂的结构稳定性有所增强。Dai等[15]利用磁控溅射法在LiCoO2表面包覆了掺杂Al2O3的ZnO (AZO)导电层,表面修饰后的正极在3.0~4.5 V内经过150次循环后,容量保持率仍高达90%,AZO涂层有效缓解了SEI膜的形成过程,本身固有的高导电性也在一定程度上降低了界面阻抗。
体相掺杂的基本思路是利用掺入元素抑制LiCoO2在充放电过程中的六方-单斜晶相的转换,以稳定锂层,使结构稳定。掺杂的方式有很多,掺杂的位置及方式不同对材料性能的影响也不同。掺杂方式大致可分为2种,即单离子掺杂与多离子掺杂。Shi等[16]利用第一性原理研究了Mg掺杂量对LiCoO2电子结构和晶型转变的影响,他们发现随着Mg掺杂量的增加,Co的3d轨道与O的2p轨道电子重叠更加明显,材料的导电性显著提升。这是由于Mg2+半径(0.072 nm)大于Co3+半径(0.054 nm),掺Mg后钴酸锂的层间距与原始材料相比有所增加,Li+更易嵌入/脱出。但掺入过多的Mg会导致晶格畸变,使材料的理论容量显著降低。Zhang等[17]通过溶胶-凝胶法制备了LiCo0.98Mg0.01Ti0.01O2样品,通过研究发现Mg2+与Ti4+存在协同效应,共掺杂后的样品颗粒尺寸有所减小,粒度分布变得更加均匀,使得Li+的扩散距离缩短,扩散系数提升,从而降低了高充放电率下的极化作用。此外,Mg2+与Ti4+共掺杂几乎完全抑制了LiCoO2在4.09~4.20 V范围内的相变,材料的稳定性得到了提升,在1倍率下循环100次后的容量保持率依然高达82.6%。
作为最早被研究的正极材料,目前关于钴酸锂的研究已经相对成熟,但Co属于稀缺资源,成本较高,研究和寻找新的替代材料与电池体系仍是今后的工作方向。
1.2 LiMO2(M=Mn、Fe、V、Cr、Ni)正极材料
为了寻找Co的其他替代元素,储锂容量高、倍率性较好的过渡金属氧化物逐渐走进了人们的视野。经过深入研究后发现,Fe、V在充放电过程中形成的FeO6、VO6八面体稳定能(OSSE)较低,随着电化学过程的进行,材料会发生层状-尖晶石的晶型结构转变,从而影响材料的循环稳定性,使得两者在层状正极材料中的应用受限[18]。Lyu等[19]研究发现,在带电状态下,铬离子迁移至Li层的过程是不可逆的,而在脱锂时LiCrO2还会发生层状–岩盐结构的表面相变,这使得材料的循环性能受到严重影响。此外,他们利用第一性原理中的密度泛函理论计算后证实嵌入Li层中的铬离子稳定了贫锂区的结构,这导致Li的扩散通道阻塞,正极材料逐渐失活。NEB的计算结果表明,在含Cr的Li层中迁移势垒达到了0.94 eV,是无Cr时的9倍,该计算同样证明了上述结论。此外,LiCrO2正极材料还会随着充电电压的增加而表现出严重的极化,故而该材料也没有得到广泛的应用。由于Mn丰富度较高、理论容量高达286 mAh/g,LiMnO2最初被认为是最有前景的层状正极材料。然而,双重g能级中的单电子占据导致局部Jahn–Teller畸变,使Mn—O键沿其中一个八面体轴伸长,不可逆相变(层状–尖晶石)产生的微应力破坏了材料的结构完整性,导致可逆容量迅速衰减,循环性能恶化[20]。
早在1950年,研究者们就对层状LiNiO2正极材料进行了探索,因其具有自放电率低、实际放电容量较高(180 mAh/g)的优点而受到了广泛关注,但在实际应用中仍面临诸多问题。由于Ni2+较难氧化为Ni3+,未被氧化的Ni2+将取代部分Li位形成非化学计量的[Li1‒xNi]3a[Ni1‒x]3b[O2]6c,使得化学计量的LiNiO2难以合成[21]。值得注意的是,脱锂过程中氧化后的Ni2+因尺寸减小将导致晶格结构局部塌陷,Li+的脱嵌因此受阻,实际放电比容量出现衰减[22]。因此,单纯的LiNiO2正极材料的实际应用价值不大。
1.3 NCA正极材料
在对LiNiO2正极材料进行改性的过程中,Co-Al共掺杂的NCA正极材料由于能量密度高、储能性能较好等特点逐渐受到了研究者们的广泛关注,目前成为了商业化应用较热门的正极材料之一。Co的掺入可以形成连续的固溶体LiNi1‒yCoO2,使晶体结构仍然保持为α-NaFeO2型,而Al一般以Al2O3的形式进行掺杂,Al3+掺入后形成的Al—O键强度更高,提高了材料的结构稳定性[23]。此外,Al2O3熔点高,耐热性好,故而热稳定性也有所提升。Tesla公司首先实现了Li [Ni0.84Co0.12Al0.04]O2正极材料的商业化,应用NCA动力电池的电动汽车销量也在逐年攀升。最近,日本Panasonic公司生产的采用NCA正极材料的21700型圆柱电池达到了300 Wh/kg的高容量。尽管NCA正极材料拥有较好的发展前景,但由于NCA属于LiNiO2基正极材料,所以仍然面临着热稳定性差与合成较困难等问题,其性能恶化的原因可归结于以下几个方面[24]:(1)Ni2+氧化不完全,残余的Ni2+会与Li+发生混排形成非化学计量的(Li1‒xNi2+)(Ni2+Ni1‒2x3+)O2,在充电过程中六方相H2→H3的不可逆相变使得NCM材料的可逆容量受到严重影响;(2)强氧化性的Ni4+与电解液反应后产生的O2还会造成安全问题。
为了进一步扩大市场规模,目前大都采用改善制备工艺和体相掺杂的方法来改善NCA材料的电化学性能。Xiao等[25]以NiO、CoO、Al2O3和Li2O3为原料,通过球磨-喷雾干燥法制备了前驱体,在一定压力下压制后,进行粉碎和筛分,最后在O2气氛中将粉体在750 ℃下煅烧12 h得到了亚微米级的LiNi0.8Co0.15Al0.05O2正极材料。XRD分析表明制备过程中的压制步骤降低了氧离子的无序性,Li+的扩散能力增加。此外,在4 Mpa下压制后的材料初始放电容量与未压制材料相比增加了16.57%,在5倍率下循环100次后容量保持率仍能达到79.08%。Xie等[26]采用少量Li2S作添加剂对LiNi0.8Co0.15Al0.05O2正极材料进行了改性,他们发现引入的S2‒一部分进入了层状氧化物晶格取代了O,另一部分被氧化成一层Li2SO4薄层包覆在NCA颗粒表面,进入晶格内部的S2‒降低了Ni2+的含量,减少了Ni2+与Li+的混排,从而提高了材料的循环稳定性,见图2。掺杂后的NCA材料在1倍率下循环1 100次后容量保持率达到了70.4%,这与理论分析的结果一致。目前,该领域的热点是富镍NCA正极材料的研发。
1.4 富镍NCM正极材料
在商业化的正极材料中,NCM三元材料也占据了很大的份额,它利用镍钴锰3种过渡金属元素的协同作用,极大改善了材料的电化学性能。NCM三元材料仍然属于α-NaFeO2晶型的层状结构,构成骨架的O2‒呈面心立方堆积,镍钴锰分别呈现+2、+3、+4价,与各自周围的6个氧离子构成八面体MO6[27]。选择镍钴锰3种元素的原因可归纳为以下几点[28-29](如图3所示):(1)3种元素很容易形成LiNi1‒x‒yCoMnO2型固溶体,其中的Ni和Mn不会破坏LiCoO2的层状结构,只是取代了Co的位置;(2)Mn3+/4+谱带位于Ni2+/3+谱带之上,Mn3+易被氧化为Mn4+,此时Ni3+则被Mn4+还原为Ni2+,产生的Ni2+与Li+尺寸相近,故Ni2+可作为结构稳定剂且不参与充放电过程; (3)Mn3+/4+谱带在O2–: 2p谱带上方,因此,相比于Co,Mn在价态发生变化的过程中不涉及O从晶格中释放而导致的安全性问题;(4)Co的八面体稳定能(OSSE)较高,不会发生过渡金属层与Li层间的氧离子迁移,在一定程度上减少了Ni2+与Li+的混排。3种过渡元素的含量不同,材料的电化学性能也不同。因此,若其中一种元素含量过高时也会使电池性能恶化。
2001年,Ohzuku等[30]通过固相反应法首次合成了LiNi1/3Co1/3Mn1/3O2,尽管该材料的不可逆容量为15 mAh/g,但电池在2.5~4.2 V电压下工作时可充电容量仍能保持在150 mAh/g左右。当充电截止电压提升至4.5 V以上时,容量衰减程度仍小于LiCoO2和LiNiO2材料,他们认为在高电压下产生不可逆容量损失的原因是电解质的氧化。随着研究的不断深入与商业化的进一步推进,镍钴锰三元材料经历了NCM111→NCM424→NCM523→NCM622→NCM811的发展,主要趋势是增加Ni含量以提高LIB的能量密度。但富镍层状材料仍面临结构不稳定的问题,这是由于Ni4+与电解液反应生成了类NiO岩盐杂质相,使电极材料降解,阻抗增加[31]。富镍NCM材料在合成时因不同程度的应变而产生机械断裂,导致颗粒内部微裂纹的形成,这使得电解液渗入颗粒内部,进一步加速了电极性能的恶化[32]。此外,富镍层状材料热分解温度较低,因而面临热稳定性差的问题[33]。抑制微裂纹的方法可归纳为[34]:(1)表面包覆以缓解体积变化,充当物理屏障,避免电解液渗入导致的电极降解;(2)优化掺杂比,减少阳离子混排;(3)合成单晶材料以减少粒子间相互作用。Schipper等[35]利用第一性原理中的密度泛函理论计算了Zr4+掺杂对NCM622结构稳定性的影响,PEB计算结果表明,掺Zr后材料晶格参数与未掺杂材料相比净变化较少,DFT计算后发现Zr4+的强静电作用使Ni2+在过渡金属层与锂层间的迁移阻力增加,减少了受Jahn-Teller效应影响较大的Ni3+的数量,从而抑制了层状结构到尖晶石结构的相变。Guo等[36]利用高温固相反应与共沉淀相结合的方法制备了单晶富镍材料LiNi0.83Co0.12Mn0.05O2,该材料结晶度较好,减少了Ni2+与Li+的混排程度,单晶材料还可通过各向同性体积变化保持颗粒的完整性。在软包全电池体系中测试后发现,0.3倍率下循环500次后的容量保持率高达88.72%,远高于多晶材料(75.94%)。这说明单晶电极界面反应活性降低,体积变化小。Laskar等[37]利用原子层沉积法在NCM523表面包覆了一层MgO,并与Al2O3涂层、ZrO2涂层以及未涂层的NCM523材料进行了电化学性能比较,涂层后材料的Li+扩散速率增加,循环稳定性更强,明显优于未涂层的NCM523,与ZrO2涂层材料相比容量保持率更高,过电势低于Al2O3涂层材料,倍率性能有所提升。
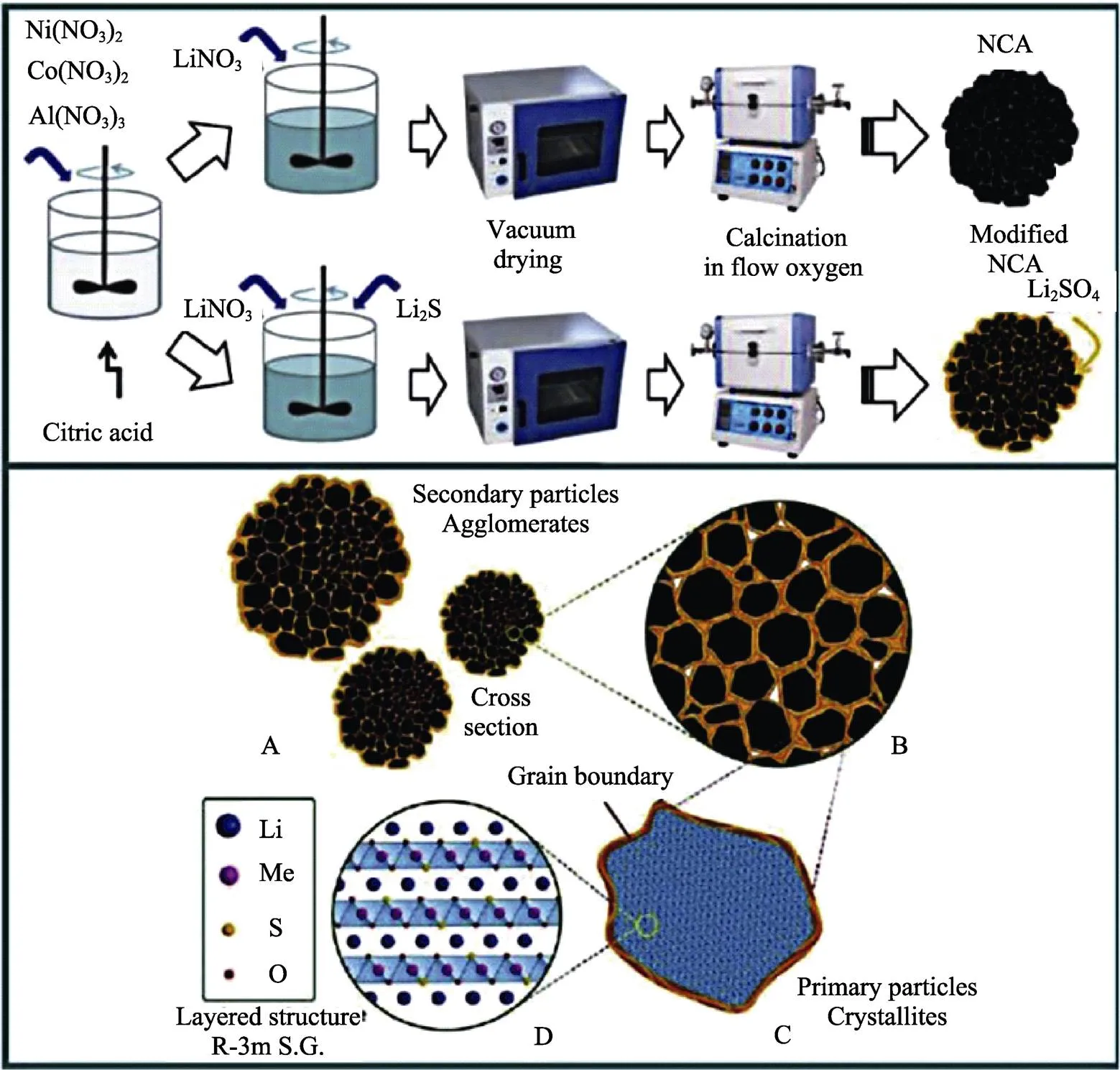
图2 原始NCA和S改性NCA材料的制备过程及S改性NCA材料的晶体结构和形貌[26]

图3 金属费米能级附近电子能量分布图 [28]
1.5 富锂层状氧化物
近年来,三元层状材料市场规模不断扩大,由于富锂层状氧化物Li2MnO3·(1‒)LiMO2(LRLOs)具有比富镍NCM更高的比容量(>250 mAh/g),超过4.5 V(vs. Li+/Li)的高工作电压,使得该材料成为了当下的研究热点[38-39]。迄今为止,LRLOs的微观结构和相变机理(如图4所示)仍然存在争议,有学者认为LRLOs是单斜相Li2MnO3与菱方相LiMO2以固溶体的形式存在于材料中,另一观点认为层状的Li2MnO3与LiMO2形成了纳米尺度上两相均匀分布的混合物[40-42]。目前,大部分研究者更倾向于第二种观点。LRLOs中的M可以是过渡金属元素中的一种,也可以是几种过渡金属氧化物形成的固溶体,合理地改善M中元素的配比,选择合适的过渡金属元素可有效改善材料的比容量与能量密度。尽管能量密度得到了保证,但LRLOs材料仍然面临着电压衰减的问题,这是由于在高充电电压下,材料中的O2‒发生氧化还原反应并脱出晶格,表面层中的过渡金属元素因O配位数的减少而发生了迁移,随着循环的进行,晶体结构从层状转变为类尖晶石状,导致电压衰减[43-44]。
针对这一问题,采用金属氧化物等进行表面包覆以抑制表面层氧空位的产生,以及设计良好的表面结构从初始阶段抑制相变过程是解决电压衰减问题的有效方法。Kim等[45]利用浸干与热处理工艺,以界面自由能与主题材料差异较少的Li2MnO3为涂覆材料,在0.5Li2MnO3-0.5LiNi0.44Mn0.32Co0.24O2表面创建了新型表面结构,Ni从主体相扩散到特定的晶体位点,表面结构进行了自我修饰,修饰后的表面区域仍然保持原始的层状结构,表面层上的原子按照超晶格结构排列,这种原子重排使表层的结晶度提高,一定程度上抑制了材料的相变,修饰后的材料在1倍率下达到了218.3 mAh/g的可逆比容量,容量保持率在100圈后仍能达到94.1%。Wen等[46]通过溶胶-凝胶法和化学沉积法相结合的工艺合成了LaF3包覆的Li1.2Mn0.54Ni0.13Co0.13O2,该材料在0.2倍率下循环50次后,放电比容量为325 mAh/g,容量保留率接近99.21%,而原始材料仅为78.73%。电化学性能改善的原因可归结为表面涂层减少了电极与电解液的接触,减少了副反应的发生,涂层后晶格膨胀所导致的扩展层空间拓宽了锂离子的传输通道,有利于锂离子在充放电过程中的嵌入/脱嵌。
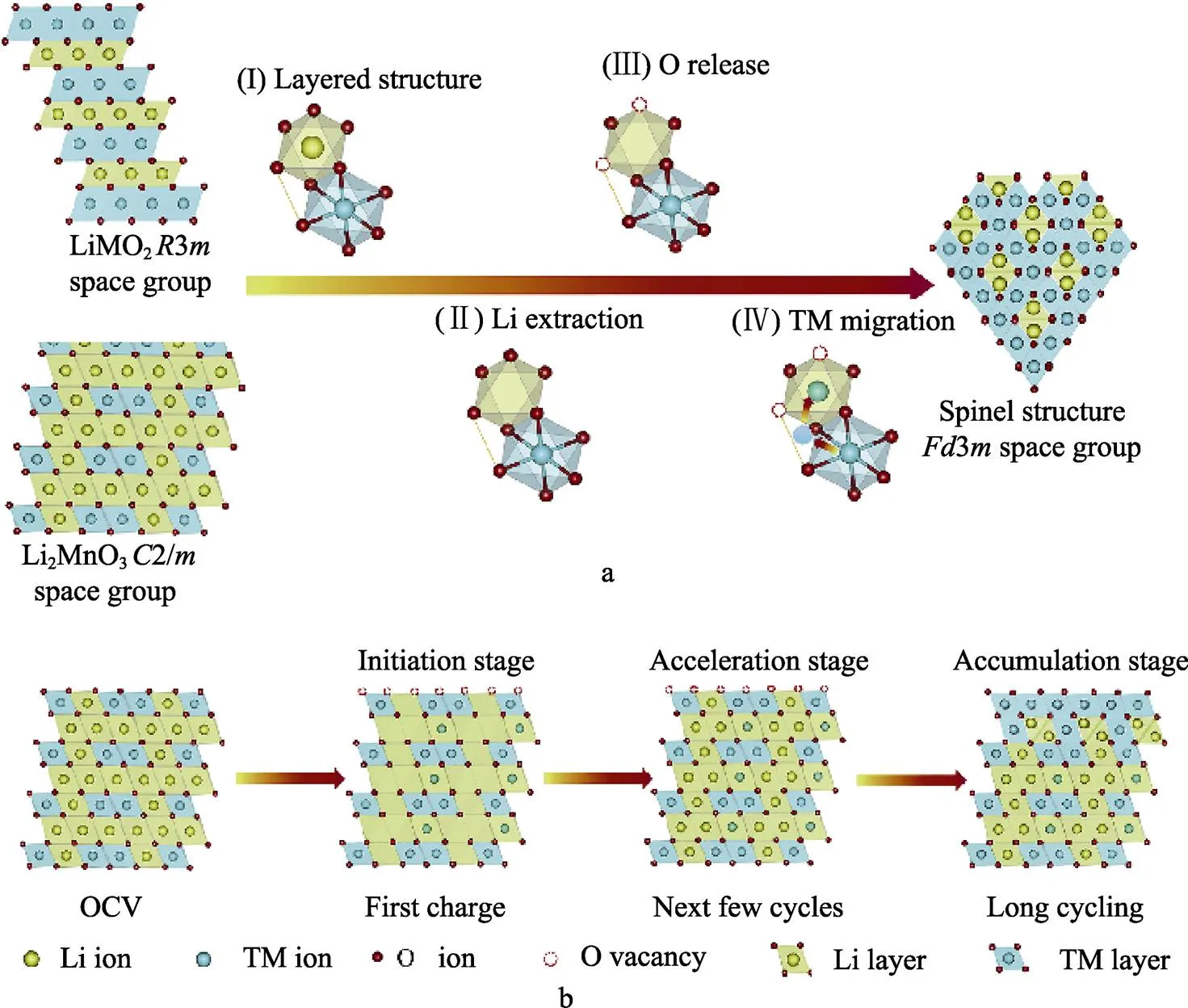
图4 富锂阴极材料相变阶段(a)和电化学循环过程(b)中的结构和相变机理示意图[42]
表1 典型层状氧化物正极材料存在的问题及主要改性方法

Tab.1 Problems of typical layered oxide cathode materials and the main modification methods
为了保持富锂层状材料较高的比容量,进一步降低正极材料的成本,富锂无钴层状氧化物成为了下一代可替代正极的候选材料,但它与常规LRLOs材料类似,仍面临容量损失和电压衰减等问题,进一步探索过渡金属氧化物材料,寻找性质有效的改性方法,是富锂无钴层状氧化物今后面临的挑战。
2 尖晶石状氧化物LiM2O4
2.1 LiMn2O4正极材料
尖晶石结构的LiMn2O4由英国牛津大学的Thackeray团队于1983年首先发现[47]。自从尖晶石结构的正极材料问世以来,研究者们对材料中可替代的过渡金属元素进行了一系列深入的研究。LiCo2O4和LiNi2O4一般以层状的钴酸锂和锰酸锂为原料,在高温条件下合成,由于高温下Co3+/4+和Ni3+/4+极不稳定,会形成CoO或NiO与尖晶石相组成的混合物,这种不稳定的尖晶石相还会导致氧缺陷,因而合成较为困难[48-49]。LiV2O4在循环过程中由于Li+的嵌入和脱嵌会对晶体结构产生影响,发生了尖晶石结构向岩盐结构的转变,3 V的低电压平台也是限制其应用的因素之一[50]。LiTi2O4并不是可行的正极材料,且同样面临电压平台低(约为1.33 V)、合成过程复杂的问题[51]。因此,尖晶石状正极材料中使用最广的是LiMn2O4。
LiMn2O4属于立方晶系,Mn3+/Mn4+占据了O2‒晶格的16八面体位置,不仅维持了基本的晶体结构,还与O构成了八面体结构的[Mn2]16dO4骨架。Li+以8-16-8的低势垒路径进行三维嵌入和脱嵌,其扩散系数与层状材料相比有所提升[52]。LiMn2O4的理论容量为148 mAh/g,在4 V工作电压附近,其脱嵌Li过程的晶格变化是各向同性的,不会表现出明显的体积膨胀或收缩,循环稳定性有所保证,而在3 V电压平台附近,高自旋Mn3+的eg轨道中的单电子引起了Jahn-Teller畸变,导致晶胞参数/增加,使晶体结构发生了立方相到四方相的大体积相变,循环容量迅速衰减,见图5[53]。材料中Mn的溶解也是造成电极循环性能差的原因之一,由于Mn的价态复杂,歧化反应使得[Mn2]16dO4骨架被消耗,结构稳定性下降。此外,电解液中水分与锂盐反应生成的HF会导致Mn溶解,HF与LiMn2O4反应生成的Mn2+还会迁移至负极表面,使Li+的嵌入过程受到影响[54-56]。除了以上造成容量衰减与循环性能差的影响因素外,Xia等[57]通过研究发现两立方相共存现象也会导致LiMn2O4在高电压范围内的容量衰退。Deng等[58]认为材料的氧缺陷会破坏电极结构完整性,而富氧尖晶石材料能够有效缓冲氧缺陷带来的危害。
针对上述问题,LiMn2O4的改性可从减少Mn的溶解、抑制晶型结构变化引起的体积改变、减少合成过程中造成的氧缺陷入手。目前,最有效的改性方法是进行表面包覆与体相掺杂。对LiMn2O4进行掺杂时,阴、阳离子的作用并不相同,适量阳离子能取代Mn位,减少Mn3+的含量,抑制了歧化反应与Jahn-Teller效应,降低了Mn的溶解量,但掺杂量过多会导致容量衰减。而阴离子掺杂取代的是晶格中的O位,一般掺入的阴离子尺寸大于O2‒,Li+的扩散通道尺寸增加,其嵌入和脱嵌过程对晶格的影响减弱。
表面包覆的作用依然是避免电极与电解液的接触,尽量减少H+对电极的腐蚀。Zhang等[59]利用原子层沉积技术在LiMn2O4电极表面沉积了均匀的无定形TiO2纳米涂层,放电曲线表明,改性后的电极在55 ℃下经过15个ALD循环后,放电容量达到了136.4 mAh/g,这是由于表面的TiO2纳米涂层有较好的电导率,有利于减少电荷转移电阻。此外,循环过程中部分TiO2层转变为惰性的TiOF,两者的协同作用抑制了HF对电极的侵蚀。Lu等[60]通过溶胶-凝胶法处理后在LiMn2O4表面得到了LiMn2‒xTiO4表面掺杂层(TSD-LMO),并与利用原子层沉积法得到的TiO2表面涂覆的LiMn2O4材料(TSC-LMO)进行了电化学性能比较(如图6所示)。尽管TSD-LMO材料的初始库仑效率低于TSC-LMO材料,但与未改性的LiMn2O4相比,初始库仑效率提升了2.74%, TSD-LMO 材料在30次循环后的Li+扩散系数最大,他们认为离子传输能力提升可归因于具有电化学活性的表面掺杂层,它维持了材料表面上的离子和电荷传输通道,而循环稳定性提升的原因是LiMn2‒xTiO4掺杂层与LiMn2O4本体结构相似,减少了相分离,它还能发挥类似涂层的作用,保护LiMn2O4免受HF的腐蚀。
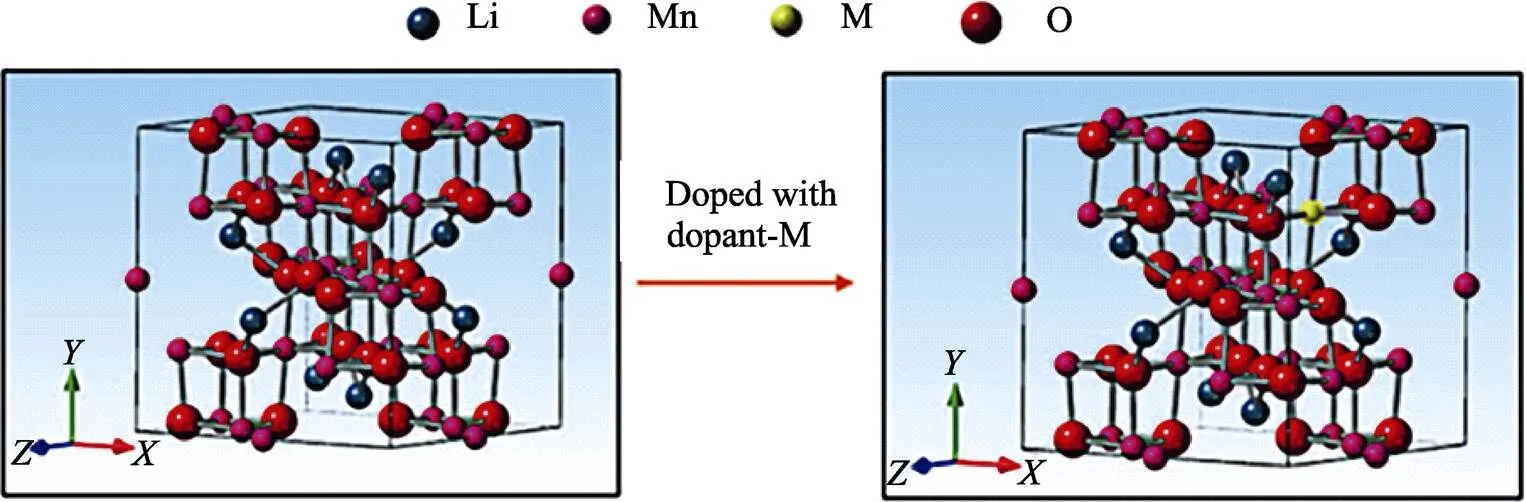
图5 LiMn2O4材料掺杂机理示意图[53]
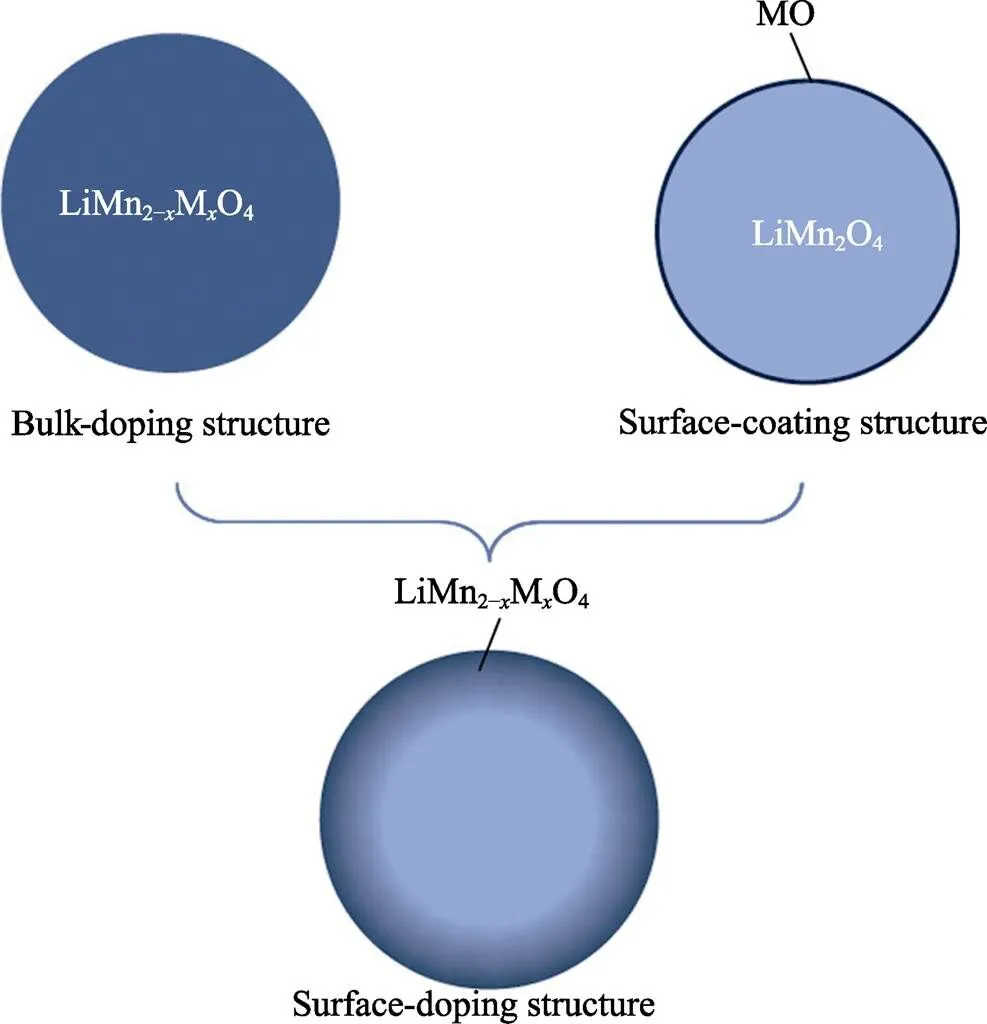
图6 由体相掺杂,表面涂覆和表面掺杂产生的结构(M代表掺杂剂阳离子)[60]
2.2 LiMxMn2‒xO4正极材料
在对LiMn2O4改性的过程中,研究者们发现某些低价过渡金属阳离子部分取代Mn3+所在的八面体16位置后,提高了LiMn2O4中锰元素的价态,减小了尖晶石的晶胞参数,不仅抑制了Jahn-Teller效应引起的晶格畸变,还使材料的结构稳定性得到了提升。此外,Mn自身的活性还有助于抵消掺杂离子取代Ni位而造成的容量损失[61-62]。常用的掺杂元素有Co、Mg、Al、Cr、Ni、Fe、Ti、Zn等,LiMMn2‒xO4材料的容量和电压平台既与掺杂元素的种类有关,也受金属掺杂量的影响,目前研究最多的是LiNiMn2‒xO4正极材料(LNMO)。LNMO正极材料嵌Li电位高达4.7 V,能量密度为650 Wh/kg,比传统钴酸锂正极提升了20%[63]。其晶体结构为多晶型态,其中之一是由4332空间群组成的原始立方相,在此结构中Ni和Mn原子分别占据4和12Wyckoff位置,另一晶型结构是无序的面心立方相,属于3空间群,Ni和Mn原子随机分布在16位置[64]。Amatucci等[65]认为无序LNMO的倍率能力和循环稳定性要优于有序的LNMO,他们利用交流阻抗法测量了一系列具有不同结构有序度的LNMO粉末的电子电导率,结果表明,无序的LNMO的电子电导率比有序的LNMO高出了2.5个数量级,这归因于无序的LNMO中少量Mn3+的存在。Ducan等[66]探究了LiNiMn2‒xO4阴极材料中Mn3+含量、结构有序性、相变和动力学性质之间的关系,他们发现调整Ni/Mn比例造成的化学成分改变以及热处理过程中产生的氧损失均会导致Mn3+含量的增加,进而触发有序相到无序相的转变,晶格结构无序性会增加固溶行为,减少两相转变,降低由于晶格不匹配引起的机械应变,改善Li+的传输过程。然而,Mn3+的存在会对LiMMn2‒xO4正极的电化学性能产生负面影响,Mn3+通过歧化反应生成的Mn2+将导致电极结构损坏。Manthiram等[67]对影响LiMMn2‒xO4电极电化学性能的因素进行了深入研究,Mn4+与Ni2+之间的阳离子有序度、Mn/Ni、Mn3+含量、材料的形貌、表面组成、表面与电解液的表面活性等均会影响电极的容量与循环稳定性。目前,阳离子掺杂、表面改性、加入合适的电解质添加剂是改性的主要手段。Wei等[68]采用共沉淀法合成了多金属离子掺杂的LiNi0.35Cu0.1Mn1.45Fe0.1O4,该材料在1.5倍率下可逆容量为91 mAh/g,200次循环后容量保持率80%,性能的提升可归因于过渡金属离子代替了Ni2+的位置,消除了岩盐杂质相,稳定了晶体的无序结构。Chu等[69]将溶胶-凝胶法与热处理相结合,成功合成了AlF3包覆的LiNi0.5Mn1.5O4正极材料,尽管包覆后的LNMO倍率性能并没有明显提升,但该材料在0.2倍率下循环100次后,容量保持率达到了81.7%,与未包覆的LNMO材料相比提升了14.2%,循环稳定性明显改善。可见,AlF3改性层为正极表面CEI膜的形成创造了有利条件,二者的共同作用抑制了电解液对电极的腐蚀。Hu等[70]使用了一种新型氟化电解质体系 1 mol/l LiPF6+FEC/F-EMC/F-EPE(3∶5∶2,/),并对LiNi0.5Mn1.5O4/石墨电池体系进行了测试,FEC基电解质表现出了较好的高电压稳定性,表现出1.5 V(vs. Li+/Li)的高还原电位,这有助于石墨阳极在高温、高充电电压的条件下形成较为稳定的SEI膜。此外,正极与电解液表面上的固体分解产物较少,对正极的腐蚀作用减弱。
尽管上述改性方法使循环稳定性有所提升,但LiMMn2‒xO4正极材料在高电压下面临的容量衰减问题仍没有得到有效解决。随着研究的不断深入,掺Li的LNMO材料逐渐走进了人们的视野。Lee等[71]比较了裸Li1.1Ni0.45Mn1.5O4样品、700 ℃热处理后的掺Li样品以及900 ℃热处理后掺Li样品的微观结构及电化学性能,他们发现Li的掺入增加了Ni/Mn的无序度,材料的容量有所提升(700 ℃热处理后样品的放电容量为140 mAh/g),而Mn3+对无序度没有影响。NMR结果表明,900 ℃热处理后的掺Li样品,Li+占据了晶体结构的16位置,在700 ℃热处理后的掺Li样品中Li+占据了16位,由于700 ℃热处理后的掺Li样品是由900 ℃时退火得到的,这表明Li+在此过程中由16位移动到了16位。因此,他们认为退火过程中的Li+迁移干扰了尖晶石中的有序化转变路径,并扰乱了Ni/Mn的静电相互作用。
总之,研发在高电压下拥有高锂离子传导性且界面相容性好的固体电解质,寻找能够增加Ni/Mn无序化且不引入Mn3+的新工艺是今后的主要研究方向。
表2 典型尖晶石状氧化物正极材料的性能指标及改性方法

Tab.2 Performance indexes and modification methods of typical spinel-like oxide cathode materials
3 橄榄石状磷酸盐LiMPO4
3.1 LiFePO4正极材料
1987年,Manthiram等[72]研究了氧含量变化对超导体YBa2Cu3O7‒x晶体结构和相组成的影响,带有磷酸盐基团的聚阴离子氧化物首次进入人们的视野。1991年,Ahuja[73]在其博士论文中论述了LiTi2(PO4)3、SbTi(PO4)3等聚阴离子氧化物的电化学性能。由于聚阴离子氧化物电子电导率差,工作电压在3 V左右,因此,聚阴离子氧化物正极材料起初并未引起研究者们的兴趣。直到1997年,Padhi等[74]首次发现橄榄石型的LiFePO4能够可逆地脱嵌Li+,并提出了著名的收缩核模型,他们认为FePO4/LiFeO4界面与电流密度呈现正相关,两相界面越大,Li的有效利用率越低,容量衰减越严重。经过长达10 a的探索,聚阴离子氧化物正极研究的帷幕彻底拉开。LiCoPO4最初被认为是很有前景的金属磷酸盐正极,尽管拥有4.9 V的高放电电压,但脱锂后形成的CoPO4极不稳定,在热处理过程中还会形成第二相Co2P,导致容量损失[75-76]。与LiCoPO4类似,LiNiPO4的嵌锂电位能够达到5.3 V(vs. Li+/Li),但DFT计算表明NiPO4和LiNiPO4两相之间的体积变化高达9.6%,导致该材料的循环稳定性受到限制[77]。此外,以上两者都面临电子电导率低的问题。目前商业化占比最大的聚阴离子氧化物正极仍是LiFePO4。
LiFePO4是空间群中具有正交晶系的正极材料,其中的O以微扭曲的六方密堆积方式排列,O2‒与P5+形成了稳定的PO43‒四面体,稳固的P-O使材料在充电过程中的体积变化保持在6.81%左右[78]。Li+在体相中沿(010)一维扩散,不连续的FeO6八面体网络使电子在Fe-O-Fe路径上的传输受限,导致材料表现出较差的导电性,因而LiFePO4的电导率只有10‒10S/cm[79]。LiFePO4在循环过程中的容量衰减同样不容忽视。Andersson等[80]于2001年提出了径向模型与马赛克模型(如图7所示),并分析了两类模型导致容量损失的原因。前者认为Li+的嵌入/脱嵌过程在FePO4/LiFeO4两相界面上发生,容量损失来源于颗粒中心无活性的LiFePO4。而后者认为Li+的脱嵌过程可发生在LiFePO4颗粒的任一位置,随着充电过程的进行,FePO4区域交叉碰撞会形成无活性的LiFeO4,随后被无定形物质所包覆,造成容量损失。Hu等认为LiFePO4中Fe2+-Fe3+的超交换和Fe2+-Li+的反位缺陷引起了晶体结构的局部对称性破坏,出现了固溶区,从而导致容量损失。
针对电导率差及容量衰减的问题,研究者们提出了表面包覆、体相掺杂、材料纳米化处理等改性手段。表面包覆材料一般选择导电性较好的碳材料或导电聚合物。例如,碳材料包覆会提高颗粒比表面积,使其与电解液充分接触,改善了Li+的脱嵌能力,C还能充当还原剂避免Fe3+的生成。但包覆材料的比表面积、表面缺陷、形态及分布也会影响电极的电化学性能。Luo等[81]采用一步原位水热法制备了具有三维网络结构的LiFePO4/NGO,其中N掺杂的石墨烯(NGO)由改进的Hummers法合成,电化学测试表明由20%的NGO改性后的LiFePO4在5倍率下比容量达到了125 mAh/g,与未包覆材料相比ct降低了71.06%。这是NGO自身的电导率与三维Li+传输路径共同作用的结果。体相掺杂根据掺杂位置的不同可分为Li位掺杂、Fe位掺杂、锂铁位共掺杂、非金属位掺杂。Chung等[82]通过高温固相法合成了Li1‒xMFePO4,材料电子电导率与未掺杂前相比提高了8个数量级,他们认为电子电导率的提升原因是金属离子取代Li位后出现了Fe2+/3+的混合价态,Fe3+和生成的p型半导体对锂化的固溶体进行了电荷补偿。颗粒纳米化能缩短Li+传输路径,比表面积的增加可改善界面润湿性,提高了Li+的嵌入和脱嵌速率,减少极化。Wang等[83]通过水热合成法制备了分别平行于(010)面和(001)面的LiFePO4,并比较了2种不同生长方向上的扩散系数。结果表明,平行于(010)面的方向扩散系数更大,因此缩短(010)上的传输距离可提高离子传输速率。除上述改性方法外,电极/电解液界面的离子传输过程也是不容忽视的一个环节,进一步探索Li+脱嵌过程中的去溶剂化作用,寻找与电极相容性更好的电解液,深入锂离子界面扩散动力学是今后潜在的研究方向。

图7 单个LiFePO4颗粒的径向模型(a)和马赛克模型(b)[80]
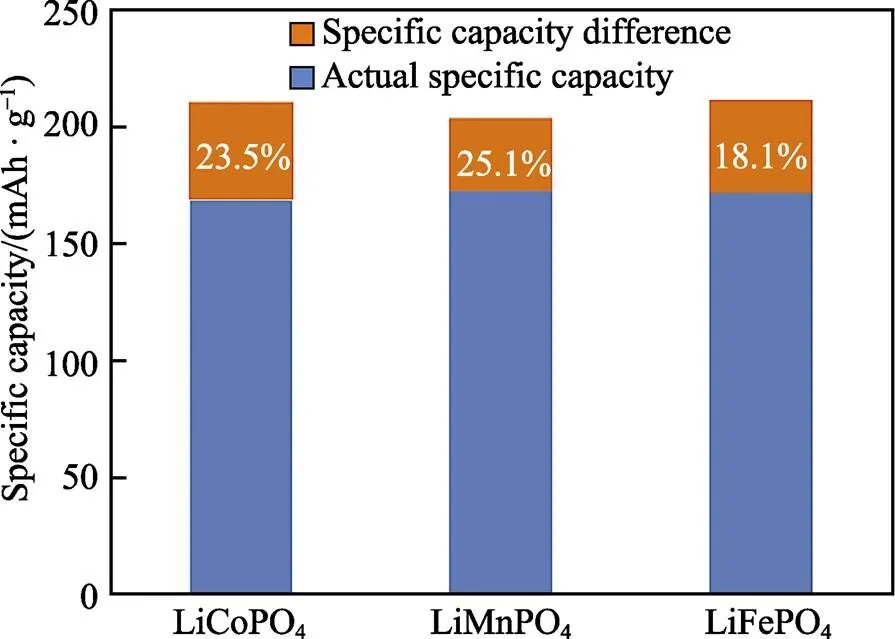
图8 3种橄榄石状磷酸盐正极的理论及实际比容量
3.2 LiMnxFe1‒xPO4正极材料
与LiFePO4结构类似,拥有4 V(vs. Li/Li+)高电压平台的LiMnPO4逐渐引起了研究者的广泛兴趣。然而,由于LiMnPO4/MnPO4两相界面不匹配,LiMnPO4的电子导电率甚至比LiFePO4还要低几个数量级,脱锂相MnPO4中不稳定的Mn3+会导致Jahn-Teller效应,使晶胞MnO6扭曲变形,造成容量衰减[84]。此外,MnPO4在高温下会发生分解反应生成氧气,有点燃电解液溶剂的可能,从而造成安全性问题[85]。LiMnPO4的改性方法与LiFePO4类似,主要集中在表面包覆、纳米化处理与体相掺杂等方向。Chen等[86]通过湿化学工艺,并在550 ℃下热处理后得到了CeO2/C杂化涂层包覆的LiMnPO4复合材料,并比较了CeO2添加量分别为0、0.1%、0.25%、0.5%样品的电化学性能,结果表明,含0.25%CeO2的LiMnPO4/C样品的性能较好,初始放电容量达到了139.9 mAh/g,50次循环后的容量保持率为86.1%。比表面积较大的纳米级杂化涂层增加了电荷传输面积,提高了电荷传输效率。同时,CeO2不仅作为碳网络的连接体,还能将碳层固定在LiMnPO4表面,抑制了充电过程中的体积膨胀,但引入过量CeO2会导致“阻塞效应”,阻碍Li+穿过晶界。
在对LiMnPO4掺杂改性的过程中,研究者们发现LiMnFe1‒xPO4材料的电导率比LiFePO4高出了1个数量级,LiMnFe1‒xPO4是一种固溶体,它在低倍率下的放电曲线存在2个电压平台(4 V和3.5 V),分别对应Mn3+/Mn2+和Fe3+/Fe2+的氧化还原反应[87-88]。Fe的掺入增强了材料的电子电导率,削弱了由Mn3+引起的Jahn-Teller畸变,材料中固有的Mn3+/Mn2+一定程度上弥补了Fe3+/Fe2+电势低的缺点。因此,Mn和Fe之间是一种优势互补的关系。然而,Mn/Fe对LiMnFe1‒xPO4的晶体结构及电化学性能影响较大,Mn/Fe比例过高时反而会引起倍率及循环性能的恶化[89]。因此选择合适的铁锰配比十分重要,LiMn0.5Fe0.5PO4、LiMn0.6Fe0.4PO4、LiMn0.8Fe0.2PO4是目前的研究热点。Yi等[90]采用水热法和高温煅烧制备了碳包覆的LiMn1‒xFePO4(0≤≤0.5)材料,比较了不同Fe掺杂量对复合材料电化学性能的影响,结果表明,LiMn0.5Fe0.5PO4在5倍率下的初始比容量最高,达到了134.5 mAh/g,而LiMn0.6Fe0.4PO4的循环稳定性最高,100次循环后的容量保持率高达89.9%。Hu等[91]认为在α-LiMn1‒xFePO4中尽管高浓度的Fe2+-Li+反位缺陷会阻碍Li+在扩散通道中的传输,但反位缺陷能将两相固溶反应转变为单相固溶反应,使反应速率提高,无电化学活性β-LiMn1−xFePO4的形成也会阻碍Li+沿着(001)/(100)方向扩散。
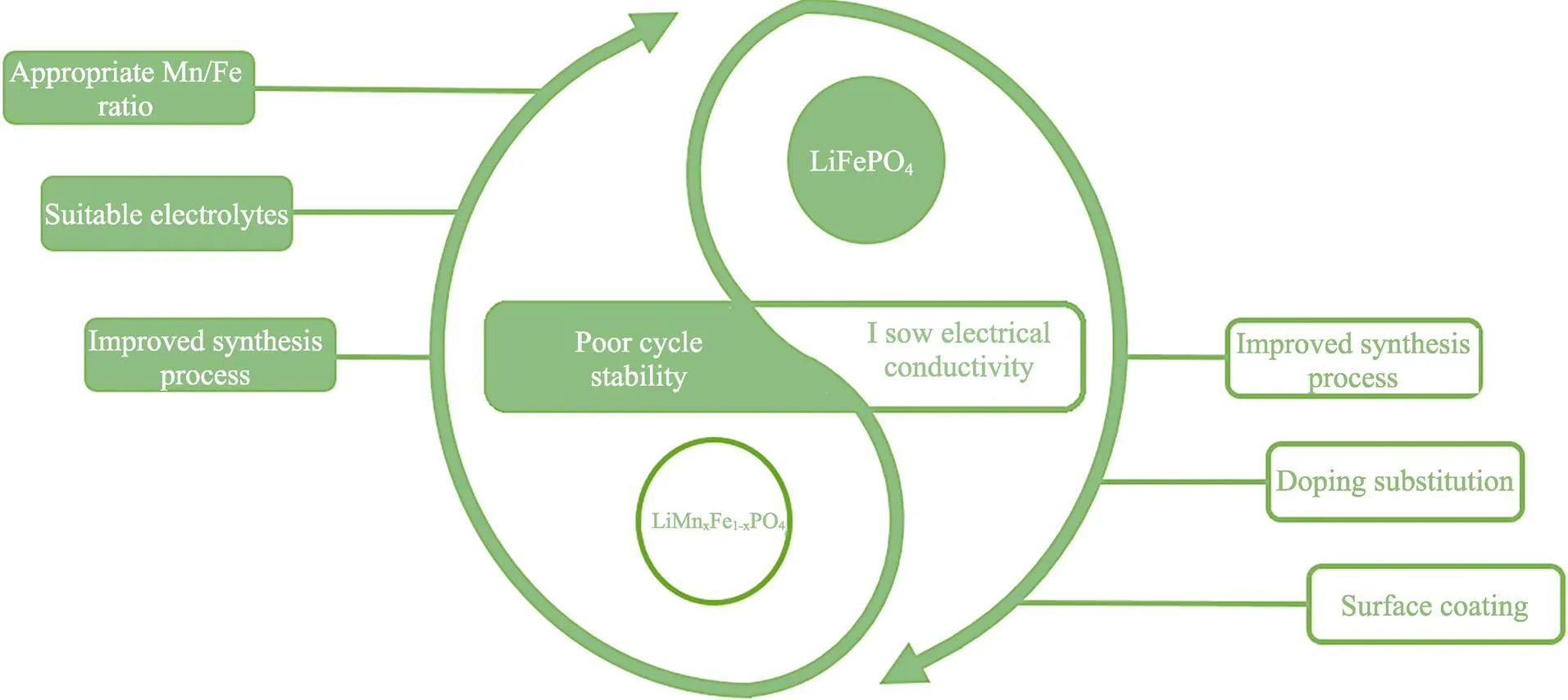
图9 橄榄石状磷酸盐正极材料面临的问题及改性方法
在今后的研究工作中,继续研究最佳的Mn/Fe,改进制备工艺,寻找能在高电压下仍能稳定的电解质是该领域面临的主要挑战。
4 结论及展望
随着新能源汽车研发进程的不断推进以及三元正极商业化规模的不断扩大,上述3类正极材料在今后几年内仍将是混合动力汽车、电动汽车、可穿戴电子设备等领域的主力军。降低LIB的生产成本、能量密度的提高以及电池续航能力是目前亟待解决的问题。多数国家及企业在提升能量密度方面投入了巨大的资金和人力,但研究进度较为缓慢。近日,我国国家动力电池创新中心成功研发出了350 Wh/kg的单体动力电池,使我国新能源汽车行业达到了新的高度。由于Co的大量开采以及非洲政局的动荡,含Co正极的成本进一步上升,传统的LiCoO2正极已不再适用于当前的商业电池体系,提高正极中Ni的含量,降低甚至消除Co已逐渐成为当前的研发趋势。富镍三元正极材料代替了传统NCM成为了当前的研究热点,尽管成本有所降低,但Ni含量增加导致的一系列问题限制了其商业应用。首先,富镍层状氧化物在充放电过程中晶格参数的变化会导致微裂纹的产生。为此,有学者认为通过改变材料的化学及力学性质可消除微裂纹[32]。针对化学性质,表面包覆、体相掺杂及晶界修饰可减少材料的体积变化,选择合适的涂层材料和掺杂剂至关重要;针对力学性质,合成单晶层状正极材料能有效限制颗粒开裂,但单晶材料的单个颗粒大,Li+扩散较为困难,导致比容量偏低,因此,研究者认为设计具有特定一次粒子或浓度梯度的可控合成方法是今后研究的主要方向之一[34]。其次,Ni4+与电解液反应生成NiO,使CEI膜的表面性质变得极为复杂,电极中的Ni不断被消耗,造成容量衰减。因此,电压平台高、比容量高、成本低的富锂无钴层状氧化物应运而生。研究者们发现富锂无钴正极存在电压弛豫现象,这是由于Ni的缓慢动力学迁移,TM的缓慢运动同样限制了低电压下的锂插入量,因此,选择易于迁移的TM有助于增强Li+的扩散动力学过程。LNMO是尖晶石状正极材料中较为成熟的材料,由于具有5 V高电压平台,在高电压下能稳定存在的液体电解质制约了其进一步发展,寻找电导性好、稳定性强的固体电解质可能是该领域潜在的研究方向。LiMnFe1‒xPO4正极材料是橄榄石状正极中研究最多的材料,其电子电导率低、稳定性差的问题依然没有得到较好的解决。因此,寻找商业化生产中可用的Mn/Fe,深入探究α、β相对离子传输及电导率的影响是今后面临的主要挑战。为了更好地满足市场需求及商业标准,可尝试选择其他的电池体系,如锂硫电池、锂空气电池等,但锂硫电池面临多硫离子与电解液互溶导致的低充放电效率的问题。电解质的催化分解导致循环寿命差,缓慢的动力学过程引起的电压滞后是锂空气电池面临的最大挑战。
[1] ARONSON S, SALZANO F J, BELLAFIORE D. Thermodynamic Properties of the Potassium-Graphite Lamellar Compounds from Solid-State Emf Measurements[J]. The Journal of Chemical Physics, 1968, 49(1): 434-439.
[2] WHITTINGHAM M S, GAMBLE F R Jr. The Lithium Intercalates of the Transition Metal Dichalcogenides[J]. Materials Research Bulletin, 1975, 10(5): 363-371.
[3] WHITTINGHAM M S. Electrical Energy Storage and Intercalation Chemistry[J]. Science, 1976, 192(4244): 1126-1127.
[4] MIZUSHIMA K, JONES P C, WISEMAN P J, et al. LiCoO2: A New Cathode Material for Batteries of High Energy Density[J]. Materials Research Bulletin, 1980, 15(6): 783-789.
[5] YAZAMI R, TOUZAIN P. A Reversible Graphite-Lithium Negative Electrode for Electrochemical Generators[J]. Journal of Power Sources, 1983, 9(3): 365-371.
[6] YOSHINO A, SANECHIKA K, NAKAJIMA T. Secondary Battery: US5631100[P]. 1997-05-20.
[7] GOODENOUGH J B, PARK K S. The Li-Ion Rechargeable Battery: A Perspective[J]. Journal of the American Chemical Society, 2013, 135(4): 1167-1176.
[8] SHAO-HORN Y, CROGUENNEC L, DELMAS C, et al. Atomic Resolution of Lithium Ions in LiCoO2[J]. Nature Materials, 2003, 2(7): 464-467.
[9] ALCÁNTARA R, LAVELA P, TIRADO J L, et al. Structure and Electrochemical Properties of Boron-Doped LiCoO2[J]. Journal of Solid State Chemistry, 1997, 134(2): 265-273.
[10] REIMERS J N, DAHN J R. Electrochemical and in Situ X-Ray Diffraction Studies of Lithium Intercalation in LiCoO2[J]. Journal of the Electrochemical Society, 1992, 139(8): 2091-2097.
[11] AMATUCCI G G, TARASCON J M, KLEIN L C. Cobalt Dissolution in LiCoO2-Based Non-Aqueous Rechargeable Batteries[J]. Solid State Ionics, 1996, 83(1-2): 167-173.
[12] OHZUKU T, UEDA A. Solid-State Redox Reactions of LiCoO2(R3m) for 4 Volt Secondary Lithium Cells[J]. Journal of the Electrochemical Society, 1994, 141(11): 2972-2977.
[13] FEY G T K, KAO H M, MURALIDHARAN P, et al. Electrochemical and Solid-State NMR Studies on LiCoO2Coated with Al2O3Derived from Carboxylate-Alumoxane[J]. Journal of Power Sources, 2006, 163(1): 135- 143.
[14] ABOULAICH A, OUZAOUIT K, FAQIR H, et al. High voltage stability and enhanced electrochemical performances of LiCoO2by CeF3coating[C]//2015 3rd International Renewable and Sustainable Energy Conference (IRSEC). Marrakech, Morocco. IEEE: 1-6.
[15] DAI Xin-yi, ZHOU Ai-jun, XU Jin, et al. Superior Electrochemical Performance of LiCoO2Electrodes Enabled by Conductive Al2O3-Doped ZnO Coating via Magnetron Sputtering[J]. Journal of Power Sources, 2015, 298: 114-122.
[16] SHI Si-qi, OUYANG Chu-ying, LEI Min-sheng, et al. Effect of Mg-Doping on the Structural and Electronic Properties of LiCoO2: A First-Principles Investigation[J]. Journal of Power Sources, 2007, 171(2): 908-912.
[17] ZHANG Mei-ling, TAN Ming, ZHAO Hong-yuan, et al. Enhanced High-Voltage Cycling Stability and Rate Capability of Magnesium and Titanium Co-Doped Lithium Cobalt Oxides for Lithium-Ion Batteries[J]. Applied Surface Science, 2018, 458: 111-118.
[18] DE PICCIOTTO L A, THACKERAY M M, DAVID W I F, et al. Structural Characterization of Delithiated LiVO2[J]. Materials Research Bulletin, 1984, 19(11): 1497-1506.
[19] LYU Ying-chun, BEN Liu-bin, SUN Yang, et al. Atomic Insight into Electrochemical Inactivity of Lithium Chromate (LiCrO2): Irreversible Migration of Chromium into Lithium Layers in Surface Regions[J]. Journal of Power Sources, 2015, 273: 1218-1225.
[20] ZHU Xiao-hui, MENG Fan-qi, ZHANG Qing-hua, et al. LiMnO2Cathode Stabilized by Interfacial Orbital Ordering for Sustainable Lithium-Ion Batteries[J]. Nature Sustainability, 2021, 4(5): 392-401.
[21] WANG G X, ZHONG S, BRADHURST D H, et al. Synthesis and Characterization of LiNiO2Compounds as Cathodes for Rechargeable Lithium Batteries[J]. Journal of Power Sources, 1998, 76(2): 141-146.
[22] KALYANI P, KALAISELVI N. Various Aspects of LiNiO2Chemistry: A Review[J]. Science and Technology of Advanced Materials, 2005, 6(6): 689-703.
[23] LEBENS-HIGGINS Z, FAENZA N, MUKHERJEE P, et al.Electrochemical and Thermal Stress of LiNi0.8Co0.15Al0.05O2Electrodes: Evolution of Aluminum Surface Environments[J]. ECS Transactions, 2017, 80(10): 197-206.
[24] MAJUMDER S B, NIETO S, KATIYAR R S. Synthesis and Electrochemical Properties of LiNi0.80(Co0.20–xAl)O2(= 0.0 and 0.05) Cathodes for Li Ion Rechargeable Batteries[J]. Journal of Power Sources, 2006, 154(1): 262- 267.
[25] XIAO Peng, LV Ting-jian, CHEN Xue-ping, et al. LiNi0.8Co0.15Al0.05O2: Enhanced Electrochemical Performance from Reduced Cationic Disordering in Li Slab[J]. Scientific Reports, 2017, 7: 1408.
[26] XIE Zhi-cheng, ZHANG Ying-ying, MIN Xiu-qin, et al. One- Step Bulk and Surface Co-Modification of LiNi0.8Co0.15Al0.05O2Cathode Material towards Excellent Long-Term Cyclability[J]. Electrochimica Acta, 2021, 379: 138124.
[27] FU Ze-wei, HU Jun-tao, HU Wen-long, et al. Quantitative Analysis of Ni2+/Ni3+in Li[NiMnCo]O2Cathode Materials: Non-Linear Least-Squares Fitting of XPS Spectra[J]. Applied Surface Science, 2018, 441: 1048-1056.
[28] MANTHIRAM A. A Reflection on Lithium-Ion Battery Cathode Chemistry[J]. Nature Communications, 2020, 11: 1550.
[29] CHEBIAM R V, PRADO F, MANTHIRAM A. Soft Chemistry Synthesis and Characterization of Layered Li1-xNi1-yCoO2-δ(0≤≤1 and 0≤≤1)[J]. Chemistry of Materials, 2001, 13(9): 2951-2957.
[30] OHZUKU T, MAKIMURA Y. Layered Lithium Insertion Material of LiCo1/3Ni1/3Mn1/3O2for Lithium-Ion Batteries[J]. Chemistry Letters, 2001, 30(7): 642-643.
[31] PARK K J, HWANG J Y, RYU H H, et al. Degradation Mechanism of Ni-Enriched NCA Cathode for Lithium Batteries: Are Microcracks Really Critical? [J]. ACS Energy Letters, 2019, 4(6): 1394-1400.
[32] YOON C S, RYU H H, PARK G T, et al. Extracting Maximum Capacity from Ni-Rich Li[Ni0.95Co0.025Mn0.025]O2Cathodes for High-Energy-Density Lithium-Ion Batteries[J]. Journal of Materials Chemistry A, 2018, 6(9): 4126-4132.
[33] NOH H J, YOUN S, YOON C S, et al. Comparison of the Structural and Electrochemical Properties of Layered Li[NiCoMn]O2(= 1/3, 0.5, 0.6, 0.7, 0.8 and 0.85) Cathode Material for Lithium-Ion Batteries[J]. Journal of Power Sources, 2013, 233: 121-130.
[34] YIN Shou-yi, DENG Wen-tao, CHEN Jun, et al. Fundamental and Solutions of Microcrack in Ni-Rich Layered Oxide Cathode Materials of Lithium-Ion Batteries[J]. Nano Energy, 2021, 83: 105854.
[35] SCHIPPER F, DIXIT M, KOVACHEVA D, et al. Stabilizing Nickel-Rich Layered Cathode Materials by a High-Charge Cation Doping Strategy: Zirconium-Doped LiNi0.6Co0.2Mn0.2O2[J]. Journal of Materials Chemistry A, 2016, 4(41): 16073-16084.
[36] GUO Qian-kun, HUANG Ji-li, LIANG Zhao, et al. Correction: The Use of a Single-Crystal Nickel-Rich Layered NCM Cathode for Excellent Cycle Performance of Lithium-Ion Batteries[J]. New Journal of Chemistry, 2021, 45(11): 5273-5274.
[37] LASKAR M R, JACKSON D H K, XU Shen-zhen, et al. Atomic Layer Deposited MgO: A Lower Overpotential Coating for Li[Ni0.5Mn0.3Co0.2]O2Cathode[J]. ACS Applied Materials & Interfaces, 2017, 9(12): 11231-11239.
[38] DING Xiang, LI Yi-xuan, DENG Miao-miao, et al. Cesium Doping to Improve the Electrochemical Performance of Layered Li1.2Ni0.13Co0.13Mn0.54O2Cathode Material[J]. Journal of Alloys and Compounds, 2019, 791: 100-108.
[39] YU Hai-jun, ZHOU Hao-shen. High-Energy Cathode Materials (Li2MnO3-LiMO2) for Lithium-Ion Batteries[J]. The Journal of Physical Chemistry Letters, 2013, 4(8): 1268-1280.
[40] DOGAN F, LONG B R, CROY J R, et al. re-Entrant Lithium Local Environments and Defect Driven Electrochemistry of Li- and Mn-Rich Li-Ion Battery Cathodes[J]. Journal of the American Chemical Society, 2015, 137(6): 2328-2335.
[41] BOULINEAU A, SIMONIN L, COLIN J F, et al. First Evidence of Manganese-Nickel Segregation and Densification Upon Cycling in Li-Rich Layered Oxides for Lithium Batteries[J]. Nano Letters, 2013, 13(8): 3857-3863.
[42] CUI Shao-lun, WANG Yang-yang, LIU Sheng, et al. Evolution Mechanism of Phase Transformation of Li-Rich Cathode Materials in Cycling[J]. Electrochimica Acta, 2019, 328: 135109.
[43] HY S, FELIX F, RICK J, et al. Direct in Situ Observation of Li2O Evolution on Li-Rich High-Capacity Cathode Material, Li[NiLi(1-2x)/3Mn(2-x)/3]O2(0≤≤0.5)[J]. Journal of the American Chemical Society, 2014, 136(3): 999-1007.
[44] HUA Wei-bo, WANG Su-ning, KNAPP M, et al. Structural Insights into the Formation and Voltage Degradation of Lithium- and Manganese-Rich Layered Oxides[J]. Nature Communications, 2019, 10: 5365.
[45] KIM S, CHO W, ZHANG Xiao-bin, et al. A Stable Lithium-Rich Surface Structure for Lithium-Rich Layered Cathode Materials[J]. Nature Communications, 2016, 7: 13598.
[46] WEN Le. Improved Electrochemical Performance of LaF3-Coated Layered Oxide Li1.2Mn0.54Ni0.13Co0.13O2Cathode Material for Lithium- Ion Batteries Prepared by Sol-Gel Method[J]. International Journal of Electrochemical Science, 2021: 210344.
[47] THACKERAY M M, DAVID W I F, BRUCE P G, et al. Lithium Insertion into Manganese Spinels[J]. Materials Research Bulletin, 1983, 18(4): 461-472.
[48] KAN W H, HUQ A, MANTHIRAM A. Low-Temperature Synthesis, Structural Characterization, and Electrochemistry of Ni-Rich Spinel-Like LiNi2-yMnO4(0.4≤≤1)[J]. Chemistry of Materials, 2015, 27(22): 7729-7733.
[49] MOUHIB Y, BELAICHE M, FERDI C A, et al. New Technique for Elaboration and Characterization of a High Voltage Spinel LiCo2O4Cathode and Theoretical Investigation[J]. New Journal of Chemistry, 2020, 44(6): 2538-2546.
[50] CHMAISSEM O, JORGENSEN J D, KONDO S, et al. Structure and Thermal Expansion of LiV2O4: Correlation between Structure and Heavy Fermion Behavior[J]. Physical Review Letters, 1997, 79(24): 4866-4869.
[51] WANG Qi, YU Hai-tao, XIE Ying, et al. Structural Stabilities, Surface Morphologies and Electronic Properties of Spinel LiTi2O4as Anode Materials for Lithium-Ion Battery: A First-Principles Investigation[J]. Journal of Power Sources, 2016, 319: 185-194.
[52] THACKERAY M M. Structural Considerations of Layered and Spinel Lithiated Oxides for Lithium Ion Batteries[J]. Journal of the Electrochemical Society, 1995, 142(8): 2558-2563.
[53] WANG Guan-yu, FEARN T, WANG Teng-yao, et al. Insight Gained from Using Machine Learning Techniques to Predict the Discharge Capacities of Doped Spinel Cathode Materials for Lithium-Ion Batteries Applications[J]. Energy Technology, 2021, 9(5): 2100053.
[54] NAYAK P K, LEVI E, GRINBLAT J, et al. High-Capacity Layered-Spinel Cathodes for Li-Ion Batteries[J]. ChemSusChem, 2016, 9(17): 2404-2413.
[55] GUMMOW R J, DE KOCK A, THACKERAY M M. Improved Capacity Retention in Rechargeable 4 V Lithium/Lithium-Manganese Oxide (Spinel) Cells[J]. Solid State Ionics, 1994, 69(1): 59-67.
[56] CHOI W, MANTHIRAM A. Comparison of Metal Ion Dissolutions from Lithium Ion Battery Cathodes[J]. Journal of the Electrochemical Society, 2006, 153(9): A1760.
[57] XIA Yong-yao, YOSHIO M. An Investigation of Lithium Ion Insertion into Spinel Structure Li-Mn-O Compounds[J]. Journal of the Electrochemical Society, 1996, 143(3): 825-833.
[58] DENG Bo-hua, NAKAMURA H, YOSHIO M. Capacity Fading with Oxygen Loss for Manganese Spinels Upon Cycling at Elevated Temperatures[J]. Journal of Power Sources, 2008, 180(2): 864-868.
[59] ZHANG Cong-cong, SU Jun-ming, WANG Tao, et al. Significant Improvement on Electrochemical Performance of LiMn2O4at Elevated Temperature by Atomic Layer Deposition of TiO2Nanocoating[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(6): 7890-7901.
[60] LU Jun, ZHAN Chun, WU Tian-pin, et al. Effectively Suppressing Dissolution of Manganese from Spinel Lithium Manganate via a Nanoscale Surface-Doping Approach[J]. Nature Communications, 2014, 5: 5693.
[61] OH S H, JEON S H, CHO W I, et al. Synthesis and Characterization of the Metal-Doped High-Voltage Spinel LiNi0.5Mn1.5O4by Mechanochemical Process[J]. Journal of Alloys and Compounds, 2008, 452(2): 389-396.
[62] ZHONG G B, WANG Y Y, ZHANG Z C, et al. Effects of Al Substitution for Ni and Mn on the Electrochemical Properties of LiNi0.5Mn1.5O4[J]. Electrochimica Acta, 2011, 56(18): 6554-6561.
[63] PATOUX S, SANNIER L, LIGNIER H, et al. High Voltage Nickel Manganese Spinel Oxides for Li-Ion Batteries[J]. Electrochimica Acta, 2008, 53(12): 4137-4145.
[64] KIM J H, MYUNG S T, YOON C S, et al. Comparative Study of LiNi0.5Mn1.5O4-δand LiNi0.5Mn1.5O4Cathodes Having Two Crystallographic Structures: Fd3̄m and P4332[J]. Chemistry of Materials, 2004, 16(5): 906-914.
[65] KUNDURACI M, AL-SHARAB J F, AMATUCCI G G. High-Power Nanostructured LiMn2-xNiO4High-Voltage Lithium-Ion Battery Electrode Materials: Electrochemical Impact of Electronic Conductivity and Morphology[J]. Chemistry of Materials, 2006, 18(15): 3585-3592.
[66] DUNCAN H, HAI Bin, LESKES M, et al. Relationships between Mn3+Content, Structural Ordering, Phase Transformation, and Kinetic Properties in LiNiMn2-xO4Cathode Materials[J]. Chemistry of Materials, 2014, 26(18): 5374-5382.
[67] MANTHIRAM A, CHEMELEWSKI K, LEE E S. A Perspective on the High-Voltage LiMn1.5Ni0.5O4Spinel Cathode for Lithium-Ion Batteries[J]. Energy & Environmental Science, 2014, 7(4): 1339-1350.
[68] WEI Shuang-ying, DI LECCE D, HASSOUN J. A High- Voltage, Multi-Metal LiNi0.35Cu0.1Mn1.45Fe0.1O4Spinel Cathode for Lithium Batteries[J]. Journal of the Electrochemical Society, 2021, 168(3): 030537.
[69] CHU C T, MONDAL A, KOSOVA N V, et al. Improved High-Temperature Cyclability of AlF3Modified Spinel LiNi0.5Mn1.5O4Cathode for Lithium-Ion Batteries[J]. Applied Surface Science, 2020, 530: 147169.
[70] HU Li-bo, ZHANG Zheng-cheng, AMINE K. Fluorinated Electrolytes for Li-Ion Battery: An FEC-Based Electrolyte for High Voltage LiNi0.5Mn1.5O4/Graphite Couple[J]. Electrochemistry Communications, 2013, 35: 76-79.
[71] LEE J, DUPRE N, AVDEEV M, et al. Understanding the Cation Ordering Transition in High-Voltage Spinel LiNi0.5Mn1.5O4by Doping Li Instead of Ni[J]. Scientific Reports, 2017, 7: 6728.
[72] MANTHIRAM A, SWINNEA J S, SUI Z T, et al. ChemInform Abstract: The Influence of Oxygen Variation on the Crystal Structure and Phase Composition of the Superconductor YBa2Cu3O7-x[J]. ChemInform, 1988, 19(4): 589.
[73] AHUJA G. An Investigation of Some Lithium Insertion Compounds[D]. Austin: The University of Texas at Austin, 1991.
[74] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-Olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries[J]. Journal of the Electrochemical Society, 1997, 144(4): 1188-1194.
[75] MOUHIB Y, BELAICHE M, FERDI C A, et al. New Technique for Elaboration and Characterization of a High Voltage Spinel LiCo2O4Cathode and Theoretical Investigation[J]. New Journal of Chemistry, 2020, 44(6): 2538- 2546.
[76] WOLFENSTINE J, READ J, ALLEN J L. Effect of Carbon on the Electronic Conductivity and Discharge Capacity LiCoPO4[J]. Journal of Power Sources, 2007, 163(2): 1070-1073.
[77] CHERKASHININ G, YU Zhi-hang, EILHARDT R, et al. The Effect of Interfacial Charge Distribution on Chemical Compatibility and Stability of the High Voltage Electrodes (LiCoPO4, LiNiPO4)/Solid Electrolyte (LiPON) Interface[J]. Advanced Materials Interfaces, 2020, 7(12): 2000276.
[78] MORGAN D, VAN DER VEN A, CEDER G. Li Conductivity in LiMPO4(M = MN, Fe, Co, Ni) Olivine Materials[J]. Electrochemical and Solid-State Letters, 2004, 7(2): A30.
[79] FISHER C A J, HART PRIETO V M, ISLAM M S. Lithium Battery Materials LiPO4(= Mn, Fe, Co, and Ni): Insights into Defect Association, Transport Mechanisms, and Doping Behavior[J]. Chemistry of Materials, 2008, 20(18): 5907-5915.
[80] ANDERSSON A S, THOMAS J O. The Source of First- Cycle Capacity Loss in LiFePO4[J]. Journal of Power Sources, 2001, 97-98: 498-502.
[81] LUO Gui-yang, GU Yi-jing, LIU Yuan, et al. Electrochemical Performance of in Situ LiFePO4Modified by N-Doped Graphene for Li-Ion Batteries[J]. Ceramics International, 2021, 47(8): 11332-11339.
[82] CHUNG S Y, BLOKING J T, CHIANG Y M. Electronically Conductive Phospho-Olivines as Lithium Storage Electrodes[J]. Nature Materials, 2002, 1(2): 123-128.
[83] WANG Yong-qiang, ZHANG Dong-yun, CHANG Cheng- kang, et al. Controllable Growth of LiFePO4Microplates of (010) and (001) Lattice Planes for Li Ion Batteries: A Case of the Growth Manner on the Li Ion Diffusion Coefficient and Electrochemical Performance[J]. Materials Chemistry and Physics, 2014, 148(3): 933-939.
[84] ZHUO Zeng-qing, HU Jiang-tao, DUAN Yan-dong, et al. Transition Metal Redox and Mn Disproportional Reaction in LiMn0.5Fe0.5PO4 Electrodes Cycled with Aqueous Electrolyte[J]. Applied Physics Letters, 2016, 109(2): 023901.
[85] BAKENOV Z, TANIGUCHI I. Electrochemical Performance of Nanocomposite LiMnPO4/C Cathode Materials for Lithium Batteries[J]. Electrochemistry Communications, 2010, 12(1): 75-78.
[86] CHEN Fang-jie, TAO Fen, WANG Chun-mei, et al. The Influence of Improved Carbon Coating Layer with Nanometer-Sized CeO2Interconnector on the Enhanced Electrochemical Performance of LiMnPO4[J]. Journal of Power Sources, 2015, 285: 367-373.
[87] YAMADA A, KUDO Y, LIU Kuang-yu. Reaction Mechanism of the Olivine-Type Li(Mn0.6Fe0.4)PO4(0≤x≤1)[J]. Journal of the Electrochemical Society, 2001, 148(7): A747.
[88] CHEN Li, YUAN Yong-qiang, FENG Xia, et al. Enhanced Electrochemical Properties of LiFe1–xMnPO4/C Composites Synthesized from FePO4·2H2O Nanocrystallites[J]. Journal of Power Sources, 2012, 214: 344-350.
[89] NAVA-AVENDAÑO J, PALACÍN M R, ORÓ-SOLÉ J, et al. High Temperature Electrochemical Performance of Hydrothermally Prepared LiMn1–xMPO4(M = Fe, Mg)[J]. Solid State Ionics, 2014, 263: 157-160.
[90] YAN Su-yuan, WANG Cheng-yang, GU Rong-min, et al. Synergetic Fe Substitution and Carbon Connection in LiMn1–xFePO4/C Cathode Materials for Enhanced Electrochemical Performances[J]. Journal of Alloys and Compounds, 2015, 628: 471-479.
[91] HU Jiang-tao, XIAO Yin-guo, TANG Han-ting, et al. Tuning Li-Ion Diffusion in Α-LiMn1-xFePO4Nanocrystals by Antisite Defects and Embedded Β-Phase for Advanced Li-Ion Batteries[J]. Nano Letters, 2017, 17(8): 4934-4940.
Research Progress on Modification of Cathode Materials for Lithium-ion Batteries
,,,,
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
Since Yoshino first invented the C/LiCoO2battery system in 1983, rechargeable lithium-ion secondary batteries have undergone nearly 40 years of development. They are widely used in mobile electronic devices, new energy vehicles and other fields due to their portability, safety and long cycle life. In recent years, cathode materials such as binary and ternary layered oxides and LiFePO4have gradually become prevalent for research in the field of energy storage. However, the disadvantages of the above cathode materials are also obvious, such as poor reversibility, degradation during the reaction process, low energy density and low electrical conductivity, which have become problems that cannot be ignored. The modification methods of three types of commonly used cathode materials are introduced, the main problems faced by each type of cathode materials are discussed, and the research progress of the corresponding modification methods are summarized.
Starting from the different crystal structures of the three types of cathode materials, the basic principles of various modification methods are described, and the effects of various modification methods on the crystal structures and electrochemical properties of the materials are clarified. The development history of lithium-ion batteries is summarized accordingly, and the current research status of modification methods at home and abroad is investigated. Through the comparison of these modification methods, the modification means of popular domestic cathode materials in recent years are analyzed and the future research directions are prospected.
The modification methods of cathode materials mainly include surface coating, anion and cation doping, material morphology and structure design, and electrolyte composition other than the material itself. Surface coating is the most commonly used method in the modification process. The coating layer usually acts as a physical barrier to reduce the side reaction between the active material and the electrolyte, but too thick a coating layer will also affect the diffusion rate of lithium ions. Cationic doping can be divided into lithium-stop doping and transition metal positions depending on the substitution position, both of them can improve the structural stability of the material. In contrast, anion doping is used to improve the cyclic stability by inhibiting the release of oxygen from the material. Material morphology and structure design generally include material nanosizing, special morphology design and so on. The fundamental purpose is to shorten the diffusion path of lithium ions and increase the specific surface area of the material to improve the multiplier performance. In addition, the selection of suitable electrolyte and additives can also indirectly modify the cathode material, which is in essence the regulation of the electrode/electrolyte interface. At present, there are more research and development of lithium-rich layered materials and polymer phosphates in China, and surface coating and bulk phase doping are more mature and widely used modification methods.
With the gradual popularization of new energy vehicles, the cost of batteries and their range at high mileage have become issues that cannot be overlooked. Further optimization of the preparation process and improvement of the energy density of the battery is still an urgent problem to be solved. In the future, all-solid electrolyte and other different battery systems need to be further explored.
lithium-ion battery; cathode materials; electrochemistry; energy density; existing problems; modification methods
TM912
A
1001-3660(2022)11-0099-14
10.16490/j.cnki.issn.1001-3660.2022.11.009
2021–07–05;
2021–12–14
2021-07-05;
2021-12-14
国家自然科学基金(51671052);中央高校基本科研业务费专项资金(N182502042);辽宁省兴辽英才(XLYC1902105)
National Natural Science Foundation of China (51671052); the Fundamental Research Funds for the Central Universities (N182502042); the Liaoning Revitalization Talents Program (XLYC1902105)
阴启昊(1997—),男,硕士研究生,主要研究方向为超级电容器。
YIN Qi-hao (1997-), Male, Postgraduate, Research focus: supercapacitors.
高波(1976—),男,博士,教授,主要研究方向为电子束表面改性、锂离子电池。
GAO Bo (1976-), Male, Doctor, Professor, Research focus: electron beam surface modification, lithium-ion battery.
阴启昊, 高波, 尹俊太, 等. 锂离子电池正极材料改性研究进展[J]. 表面技术, 2022, 51(11): 99-113.
YIN Qi-hao, GAO Bo, YIN Jun-tai, et al. Research Progress on Modification of Cathode Materials for Lithium-ion Batteries[J]. Surface Technology, 2022, 51(11): 99-113.
责任编辑:万长清

