电针联合跑轮训练对脑缺血再灌注损伤模型大鼠神经及运动功能恢复的影响*
廖 恒,郭俐宏,高玉姣,穆敬平
(十堰市太和医院湖北医药学院附属医院 十堰 442000)
脑卒中是由于脑血管破裂或血管阻塞导致的脑组织进行性损伤的疾病,包括缺血性和出血性卒中,有较高发病率、致残率及死亡率[1]。临床资料显示,缺血性脑卒中占脑卒中的87%,是我国成年人残疾和死亡的首要原因[2-3]。目前常见的治疗方法是及时恢复脑血流,然而临床上部分患者在大脑恢复供血后因脑缺血引发的神经功能障碍不仅未能减轻,脑缺血后脑水肿和继发性神经功能损伤的发生率反而进一步增多,表现出复杂的病理生理改变,如炎症反应、氧化应激、细胞凋亡、自噬或血脑屏障破坏并最终导致大量大脑神经元死亡、临床则表现为中枢神经系统功能障碍,此即预示着脑缺血再灌注(cerebral ischemiareperfusion,CIR)损伤已然发生[3-4]。基于CIR的病理过程,缺血性脑卒中治疗的根本在于血液再通后预防脑缺血再灌注损伤,改善患者神经功能[5]。研究表明,电针疗法可以保护脑缺血再灌注受损的神经细胞,改善CIR大鼠神经功能损伤[6];电针“水沟”穴具有脑保护作用,可提高CIR模型大鼠学习能力[7];而跑台训练可促进脑缺血后神经功能恢复和运动功能重建[8]。为避免或降低临床治疗过程中局部脑组织发生缺血缺氧性坏死及再通后再灌注损伤神经加重,及时的干预具有重要意义。本项目基于上述研究成果的基础上,将两种方法结合起来并增加同样具有醒脑开窍的“百会、神庭”,对观察大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)CIR损伤模型大鼠神经和运动功能重建之间的关系具有一定的意义。
1 材料与方法
1.1 实验动物
雄性SPF级SD大鼠50只,56日龄,体质量(235±5)g。动物购自武汉市万千佳兴生物科技有限公司,许可证:SCXK(鄂)2017-0008。动物的使用符合3R原则,实验期间满足动物福利,饲养间湿度60-70%,恒温:22-24℃。自然采光,动物饲养普通饲料、自由饮水。
1.2 主要仪器与试剂
LH202H型四导韩氏穴位神经刺激仪(北京华运安特);0.25 mm×25 mm毫针(苏州医疗用品厂);JBPL型大鼠跑轮(淮北九百电子科技有限公司);NeuroExam M-800型肌电图/诱发电位仪购自珠海市迈康科技有限公司(型号:NeuroExam M-800A);SpectraMax Paradigm多功能酶标仪酶标仪(美谷分子仪器(上海)有限公司);BL-410N生物机能实验系统(成都泰盟);戊巴比妥钠购自扬州市奥鑫助剂厂(批号:302-17-0);Evans Blue伊文思蓝(上海懋康生物科技有限公司)。
1.3 实验步骤
1.3.1模型制备及分组
选取10只体重相近的设为假手术组,将另40只参照Longa线栓法制作CIR模型[9-10],具体步骤如下:术前不禁水但禁食12 h。动物经腹腔注射3%戊巴比妥钠(30 mg·kg-1)麻醉,待动物完全麻醉后仰位固定于鼠板,剪去颈部鼠毛后碘伏消毒。于颈前正中线右侧0.3 mm纵行切开皮肤(长约2 cm),钝性分离出右侧颈总动脉及颈内、外动脉,结扎颈总动脉和颈外动脉近心端并夹闭颈内动脉,在紧靠颈内动脉近心端剪口后用栓线小心插入,当栓线到达颈内动脉至阻断颈内动脉血流动脉夹夹闭处时,松开微动脉夹,继续缓慢推进18-20 mm出现明显的阻力感即表明栓线已插入颅内至大脑前动脉并恰好堵塞大脑中动脉开口;栓线阻断供血2 h后将栓线头端退至颈总动脉复灌,剪去多余栓线,缝合皮肤[6,9-10]。假手术组除不插栓线外,完成造模相同手术。待麻醉清醒后6 h时参照改良Zea-Longa神经功能缺损评分(0-7分)评价、判断模型是否成功。以评分为1-6分的纳入本研究。造模后假手术组全部存活,40只进行造模手术的死亡5只,3只不符合模型标准,32只大鼠符合标准,成功率为(80%);分组:假手术组10只,将符合模型标准的32只大鼠编号后采用随机数字表法随机均分为模型组、电针组、跑轮组和电针+跑轮组,每组8只。
1.3.2治疗
各组治疗均于术后第2天进行。大鼠在清醒状态下固定于鼠台,电针组参考《华兴邦大鼠穴位图谱》取“百会、神庭、水沟”穴。用0.25 mm×25 mm针灸针提插捻转后接电25 min,给予2 Hz/15 Hz的疏密波(疏波:2 Hz;密波:15 Hz)、电流强度为2 mA的电刺激,并以穴位周围肌肉轻微抖动为度[6]。1次/天,25 min/次。跑轮组于笼中配置JB-PL型自主跑轮,大鼠自主上轮跑步,通过红外线检测装置和数据采集系统记录每日跑步距离、速度和时间[11]。电针+跑轮组治疗同电针组和跑轮组。治疗共4周,5次/周。模型组、假手术组不予治疗。
1.3.3神经及运动功能评估
治疗结束后(4周)开始评估。①Zea-Longa神经功能评分标准:0分:术后大鼠无任何不对称活动;1分:提尾时大鼠左前爪不能完全伸展;2分:左前肢活动障碍为主;3分:左前肢紧贴胸壁;4分:自由活动时向左侧偏转或转弯;5分:左前爪伴有明显的后推动作;6分:围绕停留点旋转;7分:大鼠左侧肢体完全不能支撑身体,躺向左侧或甚至意识丧失[9-10]。②悬吊试验:主要评价肢体肌力和躯体平衡功能,实验时将鼠前爪搭在离桌面45 cm铁丝上记录悬吊时间。③Grip test评分可评估运动功能协调性。记分标准:松手后以不能悬吊于铁丝、跌落评定为0分:一只或两只前爪可紧握铁丝记1分;试图爬上铁丝记2分;一只或两只前爪和一只或两只后爪紧握铁丝记3分;前爪和后爪紧握铁丝和尾巴缠绕铁丝记4分;逃跑记5分[12]。
1.3.4经皮层电刺激运动诱发电位(motor evoked potential,MEP)检测
于治疗1周时,经腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉大鼠,俯卧位固定于脑立体定位仪。颅骨钻孔暴露硬脑膜(前囟后l mm,矢状缝旁开1 mm),银球刺激电极与硬脑膜接触(骨科水泥封闭固定便于2周、3周、4周实验记录);参考电极安放于硬腭粘膜下,左小腿腓肠肌接双极银针参考和记录电极,腰部固定地线,采用刺激强度:25 mA,波宽:1 ms,频率:40 Hz的单个方波电脉冲刺激50次[13]。
1.3.5伊文思蓝渗透实验
MEP检测结束后(4周)从大鼠股静脉注射2%伊文思蓝溶液(4 mL·kg-1)。2 h后断头处死,快速取脑组织浸入甲酰胺溶液(10 mL·g-1)中10 min,研磨、匀浆,60℃孵育24 h,离心机离心半径设为7 cm,4 000 r/min离心15 min。酶标仪波长设置为520 nm,测量上清液的光密度(optical density,OD)值,根据OD值绘制标准曲线后取读取伊文思蓝浓度以评价血脑屏障通透性[14]。
1.3.6腓肠肌实验
取腓肠肌2 cm(4周),接张力传感器和BL-410N生物机能实验系统,场刺激增量设置为0.1 mm,逐步刺激以记录等长收缩肌力[15]。
1.4 统计学方法
采用SPSS Statistics 21.0统计软件处理数据,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有显著性意义。
2 结果
2.1 运动和神经功能评估
表1显示,与假手术组相比,模型组Zea-Longa评分提高,Grip test和悬吊时间均降低(P<0.05)。与模型组相比,电针组和跑轮组Zea-Longa评分均较模型组降低,Grip test和悬吊时间较模型组提高(P<0.05)。但电针组Zea-Longa、Grip test和悬吊时间均低于跑轮组(P<0.05)。而电针+跑轮组Zea-Longa评分均低于电针组和跑轮组,Grip test和悬吊时间高于电针组和跑轮组(P<0.05)。
表1 大鼠运动和神经功能评估结果比较(±s)

表1 大鼠运动和神经功能评估结果比较(±s)
注:与假手术组比较,△P<0.05;与模型组比较,▲P<0.05;与电针组比较,#P<0.05;与跑轮组比较,&P<0.05。
?
2.2 大鼠MEP记录结果
表2显示,模型组MEP潜伏期较假手术组同期明显延长、波幅峰值较假手术组同期降低(P<0.05)。与模型组同期相比,电针组和跑轮组MEP各时相点潜伏期明显降低、波幅峰值升高(P<0.05)。且电针组MEP各时相点波幅峰值均高于跑轮组同期水平,潜伏期低于跑轮组同期水平(P<0.05)。与电针组同期水平和跑轮组同期水平相比,电针+跑轮组MEP各时相点潜伏期明显降低、波幅峰值升高(P<0.05)。
表2 大鼠各时相点MEP变化比较(±s)
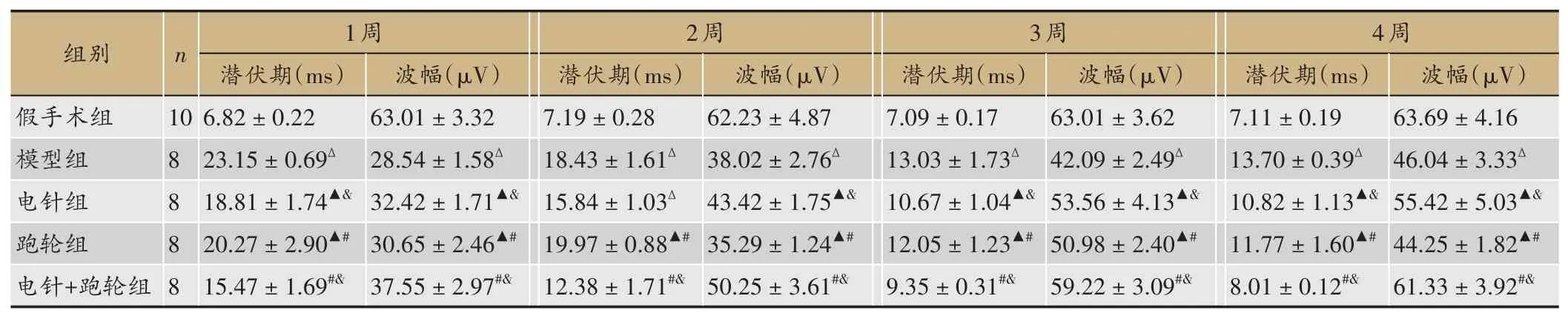
表2 大鼠各时相点MEP变化比较(±s)
注:与假手术组同期比较,△P<0.05;与模型组同期比较,▲P<0.05;与电针组同期比较,#P<0.05;与跑轮组同期比较,&P<0.05。
?
2.3 腓肠肌实验和伊文思蓝渗透实验结果
表3显示,模型组等长收缩肌力较假手术组降低,伊文思蓝含量较假手术组显著升高(P<0.05)。与模型组相比,跑轮组、电针组等长收缩肌力提高,伊文思蓝含量明显降低(P<0.05)。跑轮组等长收缩肌力高于电针组(P<0.05),但2组伊文思蓝含量两两比较差异无统计学意义(P>0.05)。与电针组和跑轮组相比,电针+跑轮组等长收缩肌力提高,伊文思蓝含量明显降低(P<0.05)。
表3 大鼠腓肠肌张力和伊文思蓝含量结果比较(±s)
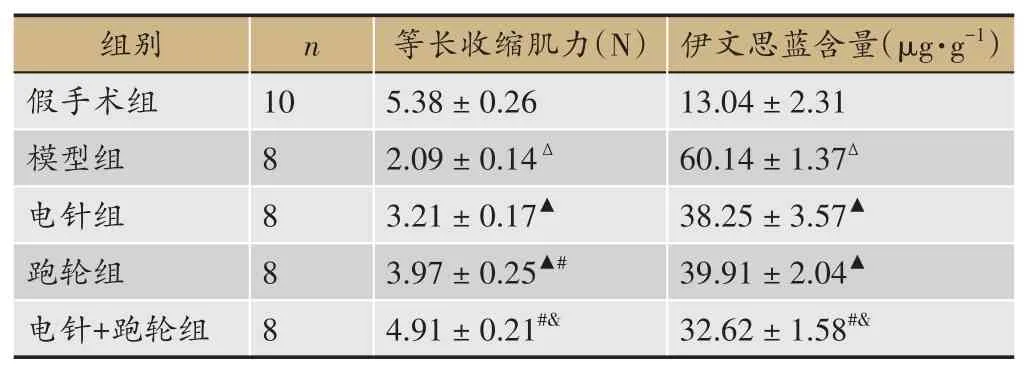
表3 大鼠腓肠肌张力和伊文思蓝含量结果比较(±s)
注:与假手术组比较,△P<0.05;与模型组比较,▲P<0.05;与电针组比较,#P<0.05;与跑轮组比较,&P<0.05。
?
3 讨论
大脑组织的能量消耗占全身耗氧量20%以上,是能量消耗最大的器官,也是学习记忆的最重要、最高级和最基本的神经单元[16]。维持脑组微环境稳态并保证其正常功能的基本结构是血脑屏障,也是维持脑微环境稳态、保证其正常功能的特殊结构,CIR后发生的氧化应激和血管内皮损伤是造成血脑屏障完整性被破坏的主要因素,血脑屏障完整性被破坏后血脑屏障通透性发生改变,故改善或维持血脑屏障的完整性可能是防止脑缺血再灌注损伤的关建[17-18]。研究表明,当血脑屏障因缺血再灌注而遭受破坏时,伊文思蓝与白蛋白结合后随之渗漏至脑组织中,故伊文思蓝是目前评价大鼠脑缺血再灌注损伤血脑屏障通透性的可靠指标,伊文思蓝含量降低则预示血脑屏障完整性得以恢复[14,19]。
在本实验中,电针组和跑轮组伊文思蓝含量两两比较差异无统计学意义,但电针+跑轮组伊文思蓝含量明显低于电针组或跑轮组,提示电针和跑轮均有肋于改善血脑屏障通透性,且二者结合在维持血脑屏障完整性方面要优于单独的电针或跑轮训练,这也进一步证实血脑屏障通透性改变可能是脑缺血再灌注损伤发生的重要环节,而维持血脑屏障完整性可能是电针结合跑轮训练促康复作用的关键因素。另外,电针组MEP各时相点波幅峰值高于跑轮组,Zea-Longa及MEP各时相点潜伏期低于跑轮组,提示电针“百会、神庭、水沟”穴有利于CIR模型大鼠神经传导功能重建,其神经功能恢复要优于跑轮训练。MEP可客观体现实验动物运动功能完整性及传导通路功能状态,通过记录皮质运动区突触传递及轴索传导功能,可准确反应运动神经传导通路功能状态、兴奋性及功能损伤范围[13]。临床应用方面,MEP与脑缺血神经功能受损的程度及运动功能缺失相关、也可客观反应大脑运动信号皮层下传导功能、对判断临床预后有一定的意义[20]。研究表明,生理或病理状况下,电针均具有调节大脑运动皮层兴奋性的作用[21]。“水沟穴”电针可抑制缺血后脑动脉血管平滑肌痉挛并增加脑梗死区周围血流灌注[22]。电针“百会、神庭穴”可改善脑缺血再灌注损伤后认知障碍模型大鼠认知功能[23]。MEP各时相点波幅峰值升高、潜伏期降低,说明中枢运动传导时间缩短、神经传导速度加快[24]。电针还可减少脑出血量,减轻脑缺血再灌注损伤、显著促进卒中大鼠促进神经功能恢复[25]。另有研究显示,认知损害与运动功能有重要联系,认知受损程度与功能障碍相互关联,也与康复结局关联,良好及时的认知训练可促进上肢功能恢复[26]。而针刺可改善脑卒中后上肢痉挛且有一定远期临床疗效[27]。分析认为,电针对于增加大鼠CIR后缺血区血流量,缓解血管及肌肉痉挛、改善CIR后上、下肢运动功能也有积极作用。实验选用的“百会、神庭、水沟”穴为传统醒脑开窍要穴,电针输出与人体生物电相似的微量低频脉冲电流,在合理、固定的电流刺激下,产生神经冲动信号能更好地调理经络之气,增加组织灌注、刺激受损脑组织“觉醒”[28]。总之,从MEP各时相点变化规律中可以看出,CIR模型大鼠大脑运动皮层的兴奋性逐步提高,这可能是电针调节大脑运动皮层兴奋性进而促进神经功能恢复的关键。
缺血性脑卒的另一最常用的治疗方法为运动疗法。而不同的运动方法可增加肌力和协调性、改善恢复期脑卒中患者上肢、下肢运动功能,平衡功能、本体感觉等[29]。运动可改善脑缺血再灌注模型大鼠运动功能[30]。还可维持血脑屏障完整性并减少脑缺血再灌注大鼠神经功能缺损[14,31]。本实验观察到跑轮组Grip test评分、悬吊时间和等长收缩肌力均高于电针组,提示跑轮训练可促进CIR模型大鼠骨骼肌重塑和运动功能恢复,其运动功能恢复要优于电针。为达到认知与运动功能重建的目的,本实验结合电针和跑轮训练各自的优点,对CIR模型大鼠同时进行电针和跑轮训练,以期在促进神经功能重建的同时,有针对性的进行运动协调性训练。结果在电针+跑轮组中,二种方法出现协同作用。如我们观察到Zea-Longa评分,悬吊时间均较单独治疗方法(电针或跑轮)延长,MEP各时相点潜伏期降低,而Grip test评分、MEP各时相点波幅峰值及等长收缩肌力均较单独治疗方法提高。这提示电针有利于神经传导功能重建,跑轮训练可促进CIR模型大鼠骨骼肌重塑和运动功能恢复。
综上所述,本研究提示电针有利于神经传导功能重建,跑轮训练可促进CIR模型大鼠骨骼肌重塑和运动功能恢复,在治疗脑缺血再灌注损伤时二者具有协同作用。跑轮训练和电针治疗都可能通过改变CIR模型大鼠血脑屏障通透性而增加脑组织供能,这在一定程度上有利于减轻脑缺血再灌注损伤这一复杂病理过程中造成的脑损伤。同时,二者联合对于提高CIR模型大鼠骨骼肌肌力、增强肢体运动协调性并促进整体运动和神经功能恢复有利。

