健脾清化颗粒对胃食管反流病脾虚湿热证病证结合大鼠食管黏膜肥大细胞活化的影响*
车 慧,王凤云,张佳琪,谢璟仪,唐旭东**
(1.中国中医科学院西苑医院脾胃病研究所 北京 100091)
胃食管反流病(Gastroesophageal reflux disease,GERD)是胃内容物(食物、胃酸、胆汁等)反流入食管或口腔,引发不适症状和(或)并发症的一类疾病。除典型症状反酸和烧心外,临床表现极具异质性。GERD为复杂因素致病,食管的病理改变不能完全反应症状的严重程度。流行病学调查发现,我国约82.8%有反流症状的患者内镜下未见食管黏膜损伤[1]。目前,引发反流相关症状的机制尚未完全阐明。除异常酸暴露外,当食管上皮抵抗力减弱时,感觉阈值下降,正常的酸暴露也可引起症状的发生[2]。MCs是介导神经源炎症的重要细胞,广泛分布于胃肠道黏膜固有层和黏膜下层,又被称为免疫系统和神经系统的桥梁。其活化受到炎性因子和神经肽的调节,并通过自分泌、旁分泌等方式发挥正反馈效应,加重外周的神经源炎症,导致食管黏膜下层的神经末梢敏化,进一步通过中枢神经系统的传导,引起食管感觉异常。在药物治疗上,相对于质子泵抑制剂(Proton pump inhibitors,PPIs)单靶点的作用机制,中医药在针对GERD复杂病机的治疗上则更具优势。
GERD易反复发作,病程迁延。久病以虚实夹杂证多见,脾虚湿热证为临床常见证型[3]。健脾清化颗粒(党参、黄连、苍术等11味中药组成)是中国中医科学院西苑医院脾胃病研究所唐旭东教授长期以来治疗脾虚湿热型GERD的经验方,临床实践基础较好。本实验以SD大鼠为研究对象,探讨了GERD脾虚湿热证大鼠食管粘膜MCs的活化情况及健脾清化颗粒的干预机制。
1 材料
1.1 动物
SPF级SD大鼠由斯贝福生物技术有限公司提供72只(8-12周龄),许可证号:SCXK(京)2016-0002。由西苑医院实验动物中心饲养,动物室条件为Ⅱ级,室温22-25℃,相对湿度45-60%,颗粒饲料喂养、自由饮水。该实验通过中国中医科学院西苑医院医学伦理委员会审查(No.2019XLC008-2)。
1.2 药物
健脾清化颗粒浸膏粉由西苑医院制剂室制备,每克干粉相当于6.06 g生药,25℃以下室温保存。奥美拉唑片(批号H20044871,每片10 mg),由山东新时代药业有限公司生产。
1.3 仪器设备与试剂
医用石蜡、无水乙醇、4%多聚甲醛、二甲苯、苏木素-伊红染色液及中性树胶等(中国中医科学院西苑医院病理科提供),甲苯胺蓝染色液(上海歌凡生物科技有限公司,批号:M026),Anti-Mast Cell Tryptase(abcam,批号:ab2378),anti-PAR2抗体(abcam,批号:ab180953),Anti-TRPV1抗体(NOVUS,批号:NB100-1617),卵清蛋白(Sigma-Aldrich,A5378),氢氧化铝凝胶(Thermo Fisher),百花牌蜂蜜(1000 g/瓶,北京百花蜂业科技发展股份公司),金锣精致猪油(1000 g/桶,新程金锣肉制品集团有限公司),56%vol红星二锅头白酒(500 mL/瓶,北京红星股份有限公司)。
人工气候箱:PVC材质,大小100 cm×40 cm×40 cm。内含风暖加热器2支(气候箱两侧,对吹),加湿器1个(开口位于气候箱中间),温度计1支,中间由金属网(直径1.5 mm,不锈钢)平均分成5格(每格里放5只大鼠+食盒水盒),内设智能温控、湿控,箱体下部装金属网将大鼠托起,底部放置粪便托盘,内铺垫料。
2 方法
2.1 模型建立、分组及给药
采用(改良食管十二指肠侧侧吻合术+腹腔蛋白注射)+内外因湿热干预法建立GERD脾虚湿热证大鼠模型。疾病造模参照文献[4],证候造模参照文献[5-6]。术后第5天注射(卵清蛋白30 mg+氢氧化铝凝胶10 mg)/mL混匀液1 mL,假手术组注射生理盐水1 mL。术后第8天,模型组隔日喂食,每次足量喂食,蜂蜜水(200 g/L)自由饮用,隔日以10 g/kg标准根据大鼠体质量油脂灌服,隔日再以10 mg/kg标准灌服白酒,共14天,于手术后第17天将模型大鼠放在温度为(32±2)℃,湿度为95%的人工气候箱中,共5天。假手术组大鼠术后第8天予蒸馏水灌胃,连续14天。
模型评价后,随机分为5组,分别为模型组(Model)、奥美拉唑组(OM)、健脾清化颗粒低剂量组(JPQH-L)、中剂量组(JPQH-M)、高剂量组((JPQH-H),每组12只。按照健脾清化颗粒成人每日处方量计算大鼠给药剂量。模型组建立完成后次日根据组别给药,按照10 mL/kg灌胃。健脾清化低、中、高剂量组给药浓 度 分别为0.193、0.385、0.770 g/100 g,1次/日。奥美拉唑组:按照成人剂量20 mg/日计算,按照大鼠10 mL/kg灌胃,奥美拉唑灌胃浓度为0.417 mg/100 g。假手术组(Sham)按照大鼠10 mL/kg计算,每日蒸馏水灌胃。
2.2 一般行为学评价
2.2.1体重测量
各组大鼠在给药前、给药14天称重,比较给药前后大鼠的体重变化差异。
2.2.2进食量的确定
各组大鼠在给药前、给药14天称重,比较给药前后大鼠的体重变化差异。早上8-9点给予一定量饲料,隔日早上8-9点测定剩余饲料量。两次天平称重,比较前后差值除以大鼠数量计算出每只大鼠平均进食量。
2.2.3肛温测定
两届马萨诸塞州州长,不仅让杜卡基斯成为第二位希腊裔美国州长,还使他成为马萨诸塞州任期最长的州长。大选中他仅仅获得10个州和哥伦比亚特区的选举人票,输给了前副总统布什。败选后杜卡基斯继续担任马萨诸塞州州长直到1991年初。后成为美国铁路公司董事会董事,同时受聘东北大学(Northeastern University)政治学教授、洛约拉马利蒙特大学(Loyola MarymountUniversity)政治学系客座教授以及加州大学洛杉矶分校(UCLA)公共事务学院公共政策系客座教授。沃尔特·蒙代尔WalterMondale
各组大鼠给药前、给药14天于上午9点测量,肛温计测量大鼠肛温,每只大鼠测2次,取平均值。
2.2.4粪便含水量的测定
收集的24小时粪便,称重记录粪便湿重。后用烘干机将粪便烘干,称重,记录粪便干重。粪便含水量(%)=粪便(湿重-干重)/粪便湿重×100%。
2.3 取材
药物干预第14天灌胃完成后,大鼠腹腔注射3%戊巴比妥(30 mg/kg)麻醉后固定,上腹部正中线行2-3 cm切口,使胃部暴露,结扎幽门与十二指肠结合部,腹腔关闭。于60 min后处死大鼠,暴露腹腔,结扎贲门部后摘取全胃。剪开胃部,将胃内容物倒入离心管中,离心15 min后,检测上清液成分。腹主动脉取血,离心取上清液,放入液氮中后转入-80℃冰箱保存。取食管组织(贲门上1 cm左右),用生理盐水清洗,放入福尔马林固定液或转入-80℃冰箱保存。
2.4 HE染色
大鼠食管黏膜组织石蜡包埋,切片,二甲苯脱蜡,乙醇水化,苏木素染色10 min,冲洗,伊红染色5 min,脱水,透明,封片。
2.5 甲苯胺蓝染色
切片,脱蜡水洗,甲苯胺蓝染色30 min,冲洗,脱水,透明,封片。在光镜200倍视野下拍照,在400倍视野下每张切片随机选取3个食管黏膜部位进行观察并计数。
2.6 免疫组化检测食管黏膜组织中MCT、PAR2、TRPV1的表达
大鼠食管黏膜组织石蜡包埋切片,水洗;抗原修复,内源性过氧化氢酶封闭液室温孵育,PBS冲洗;滴加山羊血清封闭液60 min,PBS冲洗;滴加一抗,4℃过夜,PBS冲洗;滴加二抗孵育60 min,PBS冲洗,加入显色液至显色后终止,苏木素复染,PBS冲洗,脱水,透明,封片。每张切片在200倍视野下拍照,在400倍视野下每张切片随机选取3个食管黏膜部位进行观察,应用image J对图片上棕黄色阳性区域MOD值进行分析。
2.7 统计学方法
3 结果与分析
3.1 一般行为学指标
3.1.1各组大鼠用药前后体重变化
给药前与假手术组比较,模型组及各给药组体重显著降低(P<0.01)。给药后与模型组比较,各给药组体重均显著增加(P<0.01)。对各组给药前后值变化进行比较,健脾清化颗粒低、中、高剂量组、奥美拉唑组体重显著增加,均高于模型组(P<0.01);与奥美拉唑组比较,健脾清化颗粒中、高剂量组体重显著增加(P<0.01)(表1)。
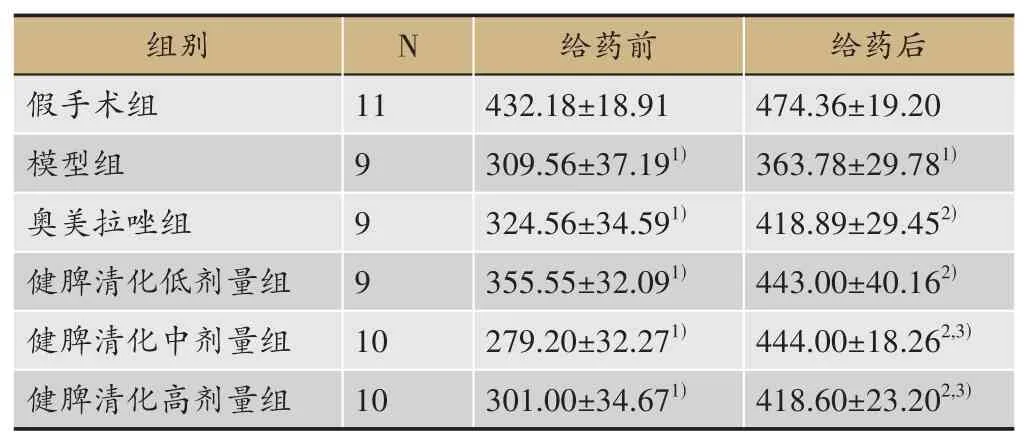
表1 各组大鼠体重比较(xˉ±S,g)
3.1.2各组大鼠用药前后进食量变化
给药前与假手术组比较,模型组及各给药组体重显著减少(P<0.01)。给药后与模型组比较,各给药组进食量均显著增加(P<0.05或P<0.01)。对各组给药前后值变化进行比较,健脾清化颗粒低、中、高剂量组、奥美拉唑组进食量显著增加,均高于模型组(P<0.05或P<0.01);与奥美拉唑组比较,健脾清化颗粒中、高剂量组进食量显著增加(P<0.01)(表2)。
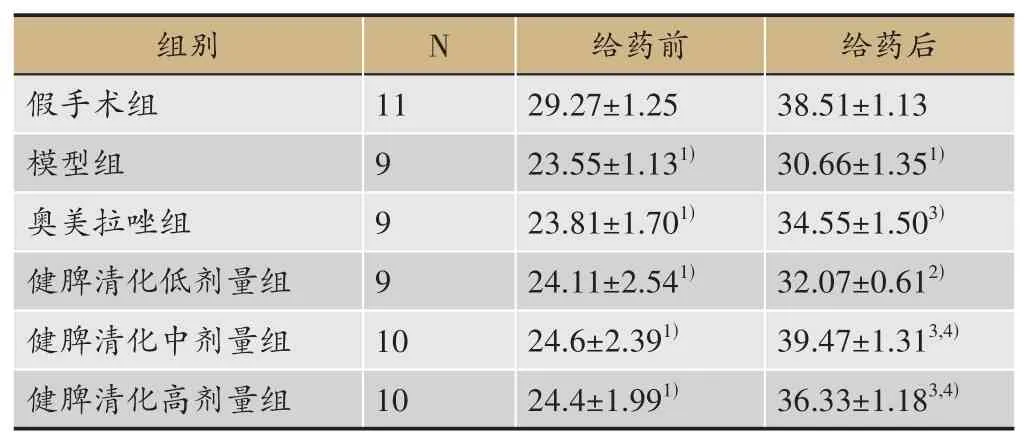
表2 各组大鼠进食量比较(xˉ±S,g)
3.1.3各组大鼠给药前后肛温比较
给药前与假手术组比较,模型组及各给药组肛温显著升高(P<0.01)。给药后与模型组比较,各给药组肛温均低于模型组,健脾清化颗粒中、高剂量组显著降低(P<0.05)。对各组给药前后肛温变化进行比较,与模型组比较,健脾清化颗粒中、高剂量组显著降低(P<0.05);与奥美拉唑组比较,健脾清化颗粒中剂量肛温显著降低(P<0.05)(表3)。
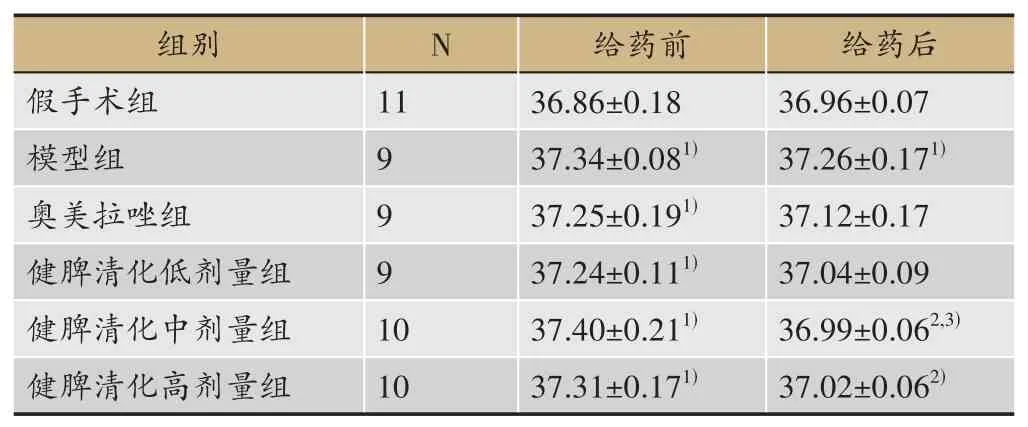
表3 各组大鼠肛温比较(xˉ±S,g)
3.1.4各组大鼠给药前后粪便含水量比较
给药前与假手术组比较,模型组及各给药组显著升高(P<0.01)。给药后与模型组比较,各给药组粪便含水量均显著降低(P<0.05或P<0.01)。对各组给药前后粪便含水量变化进行比较,与模型组比较,健脾清化颗粒低、中剂量组显著降低(P<0.05或P<0.01);与奥美拉唑组比较,健脾清化颗粒中剂量组显著降低(P<0.05)(表4)。
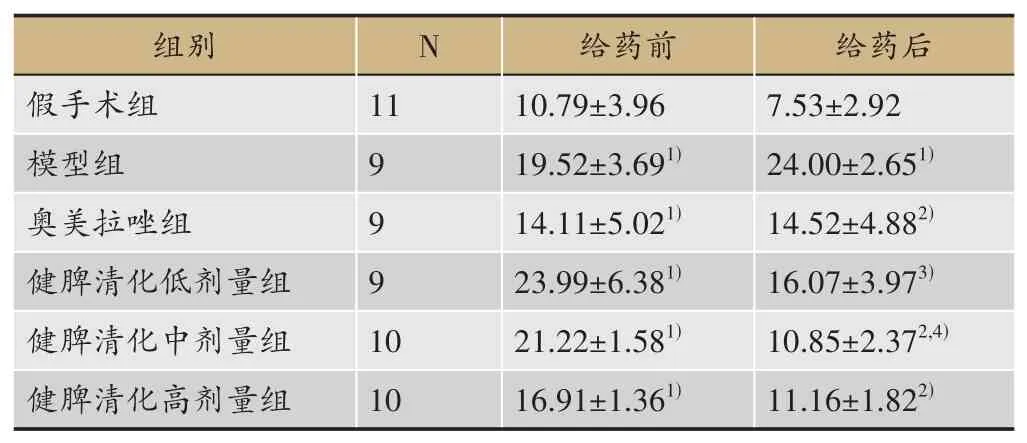
表4 各组大鼠粪便含水量比较(xˉ±S,g)
3.2 HE染色观察各组大鼠食管黏膜组织病理学结果
光镜下观察各组大鼠食管黏膜:假手术组大鼠食管黏膜表面较平整,粘膜表面复层鳞状上皮光滑,黏膜下组织致密,基底细胞形态正常。模型组大鼠食管黏膜组织水肿,上皮细胞欠平整,基底细胞增生,排列不整齐,乳头肌延长可达黏膜上皮厚度的2/3,存在炎性细胞浸润。健脾清化颗粒各剂量组、奥美拉唑组大鼠食管黏膜损伤的情况均有一定程度的恢复,以高剂量组恢复最为明显(图1)。
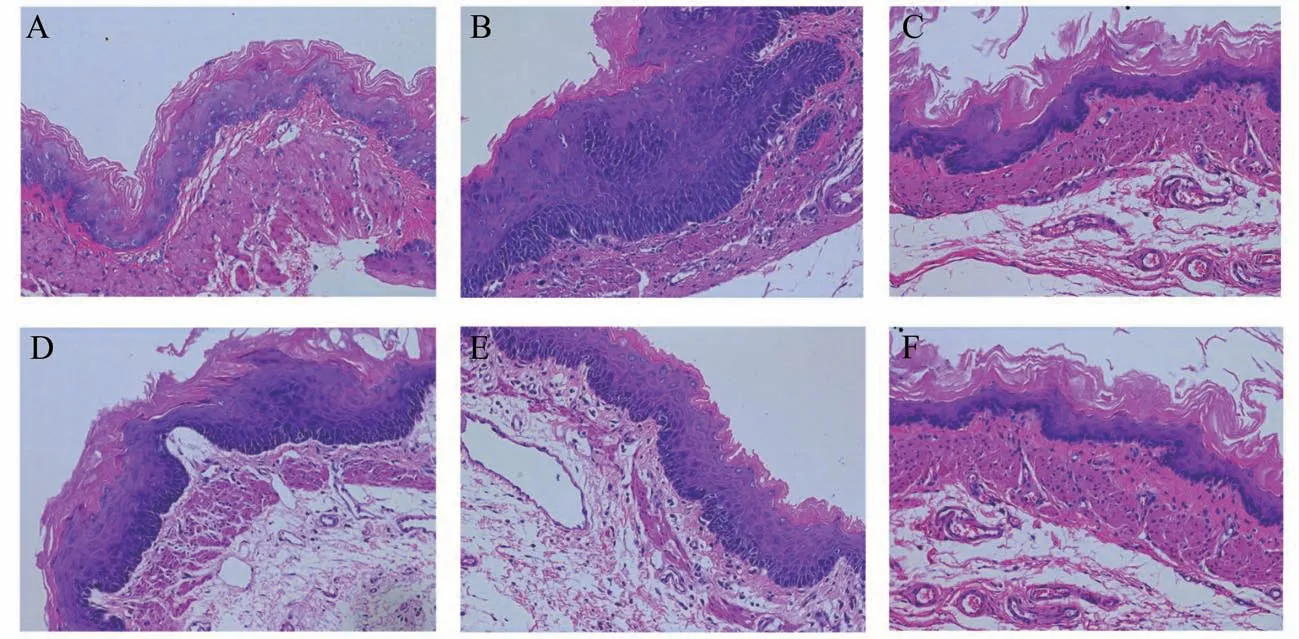
图1 各组大鼠食管黏膜组织病理学结果(HE×200)
3.3 甲苯胺蓝染色观察各组大鼠食管黏膜MCs
光镜下观察食管黏膜固有层、黏膜下层可见散在的MCs,呈椭圆形或梭形,胞质内含有蓝紫色颗粒。MCs脱颗粒后可见胞膜边界模糊,性状不规则,胞质呈空泡状或染色变浅。对各组大鼠食管黏膜MCs进行计数。结果见表5,与假手术组比较,模型组显著增多(P<0.01),健脾清化颗粒各剂量组及奥美拉唑组与模型组比较显著减少(P<0.01),各给药组比较无统计学意义(P>0.05)(表5、图2)。
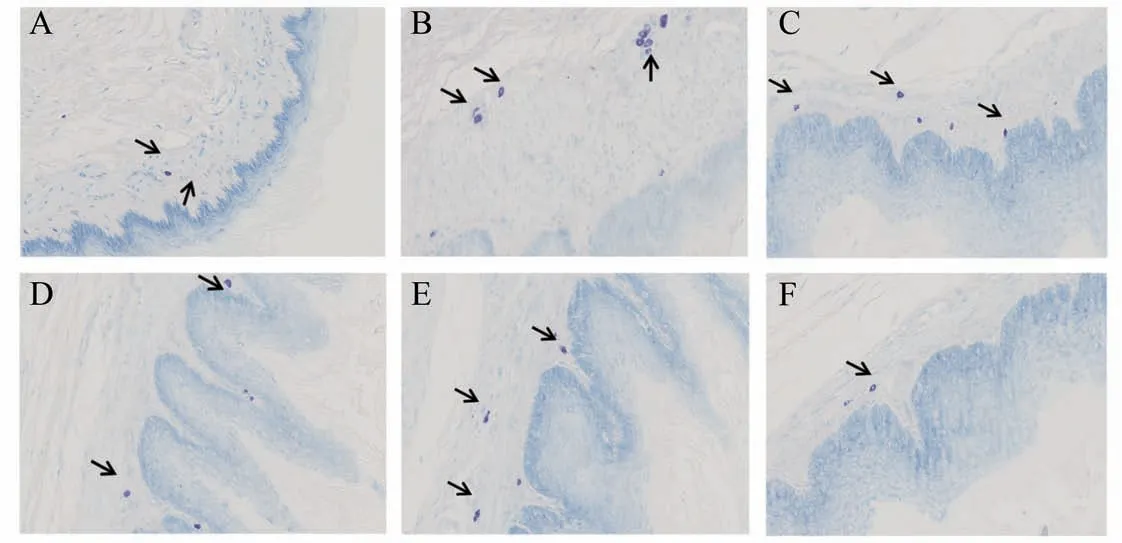
图2 各组大鼠食管黏膜MCs染色结果(×200)
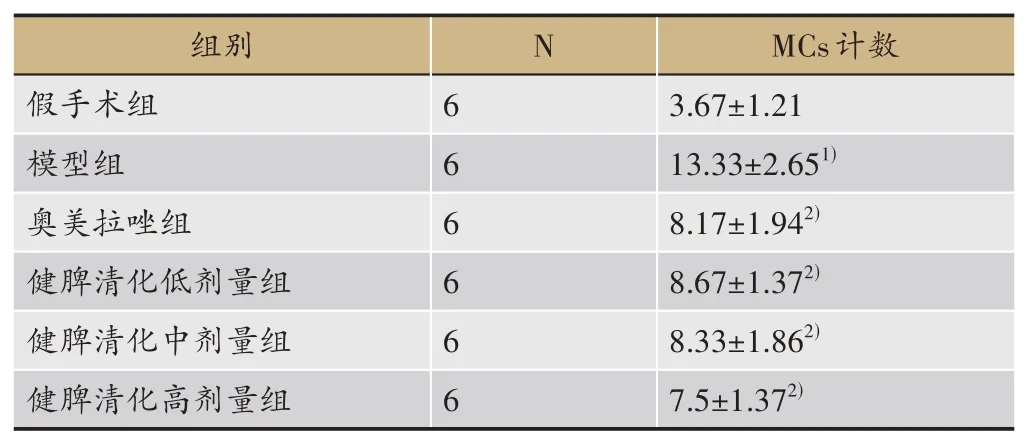
表5 各组大鼠食管黏膜MCs计数(xˉ±S,n)
3.4 各组干预后大鼠食管黏膜MCT、PAR2、TRPV1表达情况
MCT、PAR2、TRPV1在各组大鼠食管黏膜组织中均有广泛黄染,黄染部分即阳性表达。结果见表6,与假手术组比较,模型组MCT、PAR2、TRPV1MOD值升高(P<0.01),与模型组比较,各给药组大鼠均降低(P<0.05或P<0.01),各给药组比较,差异无统计学意义(P>0.05)(表6、图3、图4、图5)。
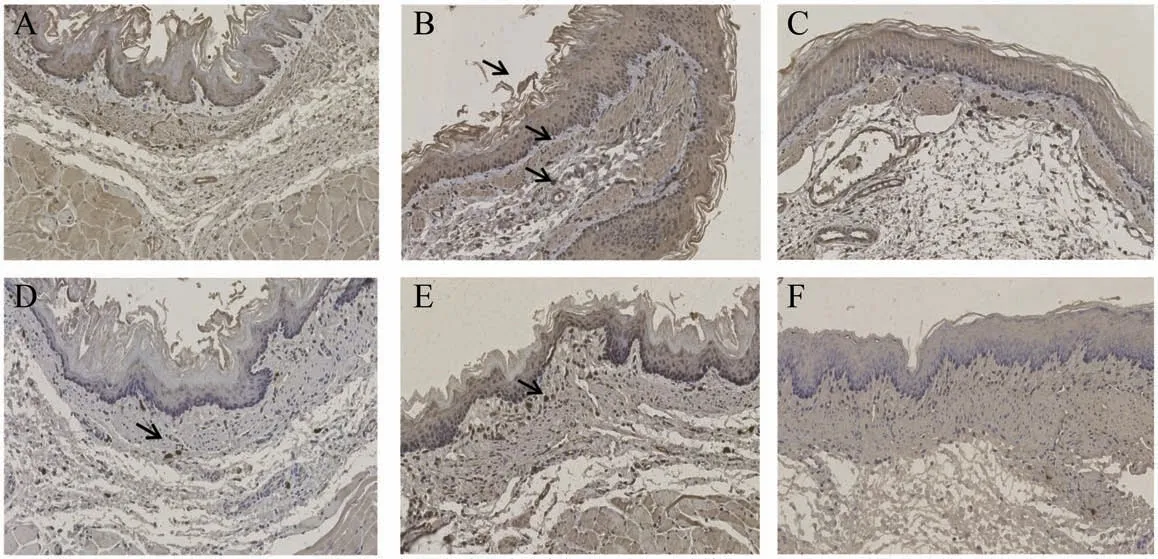
图3 各组大鼠食管黏膜MCT表达(×200)
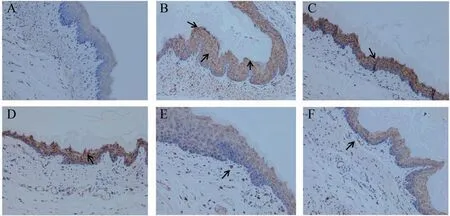
图4 各组大鼠食管黏膜PAR2表达(×200)
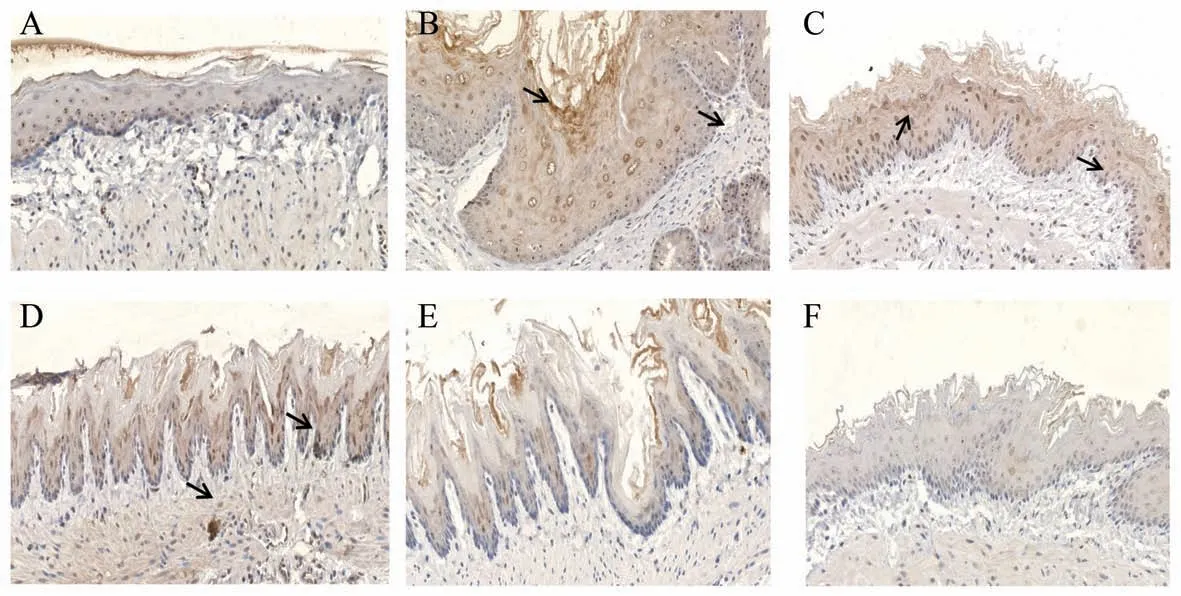
图5 各组大鼠食管黏膜TRPV1表达(×200)
表6 各组大鼠食管黏膜MCT、PAR2、TRPV1表达比较(±s)
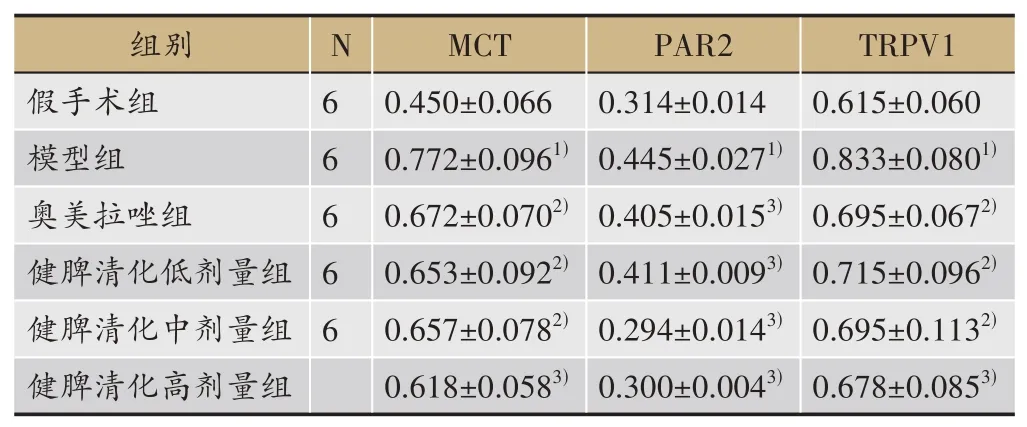
表6 各组大鼠食管黏膜MCT、PAR2、TRPV1表达比较(±s)
注:与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01。
?
4 讨论
GERD病机具有复杂性,约30%接受PPIs治疗的GERD患者仍然存在临床症状[7]。其中,以非糜烂性反流病(Non-erosive reflux disease,NERD)所占比例最高[8]。内脏敏感性增高是临床治疗的难点之一,其发病机制仍不明确,目前尚缺乏有针对性的特效药物。既往研究报道了内镜阴性的GERD仍存在食管黏膜微观结构的改变,如食管黏膜阻抗降低,炎性细胞活化等[9-10]。因此,内脏敏感性增高可能与炎性因子、神经肽释放增加引起神经末梢的敏化和内脏感觉阈值降低有关。当伤害性信号由外周向中枢的传导增强,进而投射到大脑皮层引发症状[11]。TRPV1在消化道的表达上调能够增加黏膜对刺激的感受性,此外,MCs是功能性胃肠病内脏高敏感机制的重要效应细胞[12]。有学者研究发现,GERD患者食管远端黏膜出现MCs增殖活化现象,使得胞内的特异性酶——MCT释放增加,与本研究的结果一致。MCT的释放将进一步激活食管上皮的PAR2,促进伤害性感受器TRPV1的表达,增强食管黏膜对刺激的感受性,引起不适症状[13-14]。
中医认为该病病机多虚实夹杂,初病在胃,久病及脾。脾虚为“本”,气滞、郁热、湿热为“标”。脾虚为关键,从“脾”论治在临床中收到了良好的效果[15-18]。脾虚一方面表现为运化不利,影响胃之顺降,则水反为湿,谷反为滞,壅滞中焦,日久化热,形成湿热实邪反伤脾胃;另一方面脾虚肝木乘之,中焦气机升降失常,郁而化火,与湿搏结,易形成湿热、痰火。以现代医学视角来看,脾胃湿热体现在免疫系统、神经系统、胃肠动力、微生态等多方面功能的异常,突出表现为免疫调节动态失衡,机体炎症反应增加等[19-20]。
健脾清化颗粒是唐旭东教授在董建华“通降理论”指导下的临床经验方,具有健脾清热、化湿和胃降逆之功效。全方由党参、苍术、黄连等11味药物组成,其中,党参味甘、性平,归脾、肺经,擅于益气健脾。《本草正义》云:党参能“健脾运而不燥,滋胃阴而不湿……鼓舞清阳,振动中气,而无刚燥之弊。”苍术味辛、苦,性温,归脾、胃经,擅于燥湿运脾。《珍珠囊》云:苍术能“健胃安脾,诸湿肿,非此不能除。”黄连味苦,性寒,归心、肝、胃、大肠经,擅于清热燥湿。《珍珠囊》云:黄连能“祛中焦湿热。”课题组前期开展多中心、随机、双盲、安慰剂对照的RCT研究证实健脾清化颗粒可以改善GERD症状,减少PPIs的剂量且能够提高患者的生活质量[21]。
本实验采用改良食管十二指肠侧侧吻合术+内外因湿热干预建立GERD病证结合大鼠模型,在造模过程中控制了食管十二指肠吻合口的大小,既保留了反流的病理机制,又能够减少食管黏膜糜烂程度。通过观察远端食管黏膜MCs数量和活化情况,以及PAR2、TRPV1表达水平来进一步评价健脾清化颗粒对于食管高敏感的关键效应细胞的干预机制。实验结果表明,与假手术组比较,GERD脾虚湿热证大鼠体重、进食量减少,肛温、粪便含水量增加,食管黏膜形态学观察发现大鼠食管黏膜可见明显基底层细胞增生,炎性细胞浸润、乳头肌延长,细胞间隙疏松等形态学改变,符合了GERD脾虚湿热证的特征。甲苯胺蓝MCs染色发现大鼠食管黏膜MCs显著增多,健脾清化颗粒能够增加模型大鼠体重和进食量,降低肛温和粪便含水量,改善食管黏膜的炎症状态。同时,能够减少食管黏膜MCs数量,减轻其活化脱颗粒及MCT的释放,下调PAR2、TRPV1的蛋白表达水平,从而进一步抑制神经元的兴奋,降低食管高敏感。
综上所述,在GERD脾虚湿热证模型大鼠的食管黏膜中可见MCs活化脱颗粒现象明显,MCT释放增多、同时PAR2、TRPV1蛋白表达增加。健脾清化颗粒通过减少MCs脱颗粒,下调MCT、PAR2、TRPV1的表达,从而发挥降低食管高敏感的作用。上述结果可能为中医药治疗GERD食管高敏感的新靶点提供一定的证据,然而MCs活化所引起的食管高敏感机制尚未完全清楚,尚有待于进一步研究。

