复方贞术调脂胶囊干预糖尿病肾病的网络药理学分析及实验验证研究*
谭海波,张小雨,任宇晴,杨祎琦,贝伟剑,兰 天,郭 姣
(广东药科大学/广东省代谢病中西医结合研究中心 广州 510006)
1 引言
根据国际糖尿病联盟最新数据显示,全球成年糖尿病患者的数量达到了4.63亿,而中国人患病率占比接近1/4,糖尿病早已成为中国乃至全世界最严重的公共健康问题之一[1]。糖尿病肾病(Diabetic Kidney Disease,DKD)是糖尿病最常见的微血管并发症之一,约40%糖尿病患者最终会发展成为DKD[2],其是当今许多国家终末期肾病和肾衰竭最常见的原因[1]。但目前临床针对DKD为对症治疗,尚无特效疗法。近期研究证实,钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)能够有效降血糖,且对糖尿病患者的肾脏有较好的保护作用,但其泌尿生殖系统感染的副作用也不容忽视[3];肾素-血管紧张素-醛固酮系统抑制剂虽能降低尿蛋白,改善肾功能及DKD的预后,但不足之处是容易造成水和电解质代谢紊乱[2]。而中医药以其毒副作用低且药效良好的特点,在DKD的防治中发挥了重要作用。
DKD的中医病名为消渴肾病,属本虚标实之证,本虚为肝脾肾虚,标实为气滞、血瘀、浊毒、湿热、痰浊等。DKD在2019年《糖脂代谢病(瘅浊)中西医结合诊疗技术规范》中归属于糖脂代谢病Ⅲ期[4]。复方贞术调脂胶囊(Fufang Zhenzhu Tiaozhi Capsule,FTZ)是郭姣教授多年临床验方,主要由佛手、黄连、三七、大蓟等8味中药组成,具有补肾调肝健脾、化浊祛瘀之功效,在临床上常用于治疗糖尿病、高脂血症等糖脂代谢性疾病。文献研究显示FTZ中的某些单体成分对DKD有良好的治疗效果,如黄连的有效成分小檗碱[5]、三七的有效成分三七皂苷R1[6]等。而FTZ在治疗DKD中的作用及机制尚未阐明。
网络药理学是融合了系统生物学、生物信息学等多个学科,从系统层次和生物网络的整体角度出发,揭示药物的系统性药理机制的新兴学科[7]。网络药理学的思维与中医的整体观有很大的相似性,并满足了系统地干预复杂疾病的要求,以高通量、大网络的方式揭示中医药治疗复杂疾病的机制,这将为中医药由经验医学过渡为循证医学提供一种新的研究策略[8]。因此,本研究将应用网络药理学分析和动物实验验证的方法,从“药物-靶点-通路-疾病”角度综合探讨FTZ防治DKD的作用及机制[9]。
2 研究思路与方法
首先采用中药系统药理数据库和分析平台(TCMSP)进行FTZ的化学成分收集,按照口服生物利用度(Oral bioavailability,OB)≥30%和类药性(Drug likeness,DL)≥0.18作为标准进行筛选,再通过TCMSP收集化学成分对应的靶点,利用Uniprot数据库将蛋白靶点转换成基因靶点。通过GeneCards和Comparative Toxicogenomics Database(CTD)数据库进行DKD疾病靶点收集。利用Venny 2.1工具对FTZ靶点和DKD靶点进行交集,得到FTZ干预DKD靶点。采用STRING 11.0和DAVID 6.8数据库对交集靶点进行蛋白相互作用网络(Protein-protein Interaction,PPI)分析、基因本体功能分析(Gene Ontology,GO)和基因组百科全书通路(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。再通过建立DKD小鼠模型,验证FTZ的药效及网络药理学分析得到的靶点和通路(如图1)。
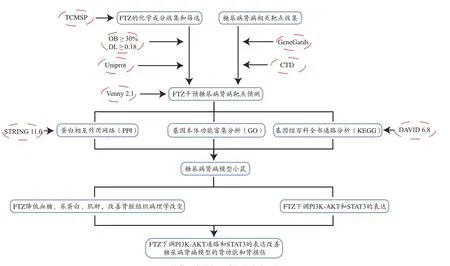
图1 网络药理学分析和动物实验验证流程图
3 材料与方法
3.1 实验材料
3.1.1动物
4-6周龄的SPF级C57BL/6雄性 小 鼠,体重15-17 g,由广东省医学实验动物中心提供,生产许可证号SCXK(粤)2018-0002。饲养于广东药科大学实验动物中心(湿度40-70%,温度20-26℃),适应性饲养1周后进行实验。本实验经广东药科大学实验动物伦理委员会批准(gdpulac2019180)。
3.1.2药物
复方贞术调脂胶囊(批号200501),购买于广东药科大学附属第一医院;氯沙坦(Losartan,默沙东,批号H20171245)。
3.1.3试剂
链 脲 佐 菌 素(Streptozotocin,STZ,sigma,CAS:18883-66-4);肌酐测定试剂盒(南京建成,C011-2-1,批号:20210315);尿蛋白测定试剂盒(南京建成,C035-2-1,批号:20200915);磷脂酰肌醇3-激酶抗体(Phosphatidylinositide 3-kinases,PI3K)(CST,#4249);磷酸化蛋白激酶B抗体(p-protein kinase B,p-AKT)(CST,#4046);甘油醛-3-磷酸脱氢酶抗体(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(CST,#5174);信号转导及转录激活蛋白3抗体(Signal transducer and activator of transcription 3,STAT3)(CST,#9139);山羊抗兔IgG(CST,#7074);马抗鼠IgG(CST,#7076);高脂饲料(广东省医学实验动物中心,许可证号:粤饲证(2019)05073);羧甲基纤维素钠(Carboxymethylcellulose sodium,CMCNa)(国药沪试,30036365)。
3.1.4仪器
酶 标 仪(Mithras,LB940);显 微 镜(Olympus,BX53);电泳仪(Bio-Rad,153BR 110099);电转仪(Bio-Rad,552BR 221397);化学发光成像仪(Bio-Rad,Chemidoc XRS+)。
3.2 网络药理学分析方法
3.2.1复方贞术调脂方的化学成分收集和筛选
利用中药系统药理数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php)[10]对FTZ的八味中药(女贞子、丹参、白术、三七、佛手、大蓟、黄连、杜仲)分别进行化学成分的检索,筛选标准为:口服生物利用度(OB)≥30%和类药性(DL)≥0.18[11-12]。
3.2.2 FTZ和DKD靶点基因的收集
将筛选出的FTZ化学成分通过TCMSP数据库获得其相对应的靶点蛋白,将靶点蛋白上传至Uniprot数据库(https://www.uniprot.org/)[13]转化成与其对应的基因靶点。利用GeneCards数据库(https://www.genecards.org/)[14]和Comparative Toxicogenomics Database(CTD)数 据 库(http://ctdbase.org/)[15]检索关键词“diabetic nephropathy”和“diabetic kidney disease”,得到DKD相关的靶点基因。
3.2.3 FTZ干预DKD靶点预测
利 用Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/)分析工具对FTZ的作用靶点和DKD靶点进行靶点交集,然后上传至STRING11.0数据库(https://string-db.org/)[16]获取蛋白相互作用信息,最低相互作用评分设置为“highest confidence(0.900)”[17],将信息上传至Cytoscape3.7.2软件进行可视化及网络拓扑学分析,构建蛋白相互作用网络(PPI),并筛选核心作用靶点。
3.2.4靶点的GO功能分析和KEGG通路富集分析
将获得的FTZ-DKD交集靶点上传至DAVID 6.8数据库(https://david.ncifcrf.gov/tools.jsp)进行基因本体(GO)功能富集分析和基因组百科全书(KEGG)通路分析[18]。GO分析包括生物过程(Biological Process,BP)、分子功能(Molecular Function,MF)和细胞组成(Cellular Component,CC)分析。
3.3 动物实验
3.3.1 DKD模型建立及分组给药
DKD小鼠模型的建立参考Ding的造模方法[19]。具体如下:首先采用高脂饲料喂养4周,其次连续注射链脲佐菌素(STZ,40 mg/kg/天,5天),然后继续进行高脂饲料喂养;当空腹血糖(fasting blood glucose,FBG)≥11.1 mmol/L判定为糖尿病模型成功,尿常规测定出尿微量蛋白阳性,判定为DKD形成。小鼠分组:Control组(空白组,0.5% CMCNa)、Model组(模型组,0.5%CMCNa)、Losartan组(氯沙坦,30 mg/kg/天)和FTZ组(2 g/kg/天);各组动物每天灌胃给药1次,持续治疗12周。
3.3.2生化指标检测
测定各组小鼠空腹血糖以及肾功能指标(24 h尿蛋白、血肌酐),操作流程按试剂盒操作说明进行。
3.3.3肾脏病理学检测
肾脏组织切片苏木精-伊红染色(H&E)、马松染色(Masson)和碘酸雪夫染色(PAS)步骤参照文献方法进行[6]。H&E染色:石蜡切片进行梯度脱蜡,将脱蜡后的切片放入苏木素染液中染3 min,自来水冲洗,分色液分色,自来水冲洗,再梯度酒精脱水各5 min,伊红染液染色5 min,最后再依次梯度复水透明,封片后显微镜镜检。Masson染色:石蜡切片进行梯度脱蜡,放入重铬酸钾浸泡过夜,流水清洗,铁苏木素A液和B液等比例混合成铁苏木素染液,切片放入铁苏木素中染色3 min,流水冲洗,分色液分色,流水清洗,再放入丽春红酸性品红浸染10 min,流水清洗,磷钼酸水溶液浸染3 min,直接入苯胺蓝染液染6 min,用1%冰醋酸分化后,脱水透明,封片后显微镜镜检。PAS染色:石蜡切片脱蜡,放入高碘酸染液中染色15 min,流动水冲洗,避光环境下于雪弗染液中染色30 min,流水清洗5 min,切片放入苏木素染液中染色5 min,分化液分化,流水清洗,脱水透明,封片后显微镜镜检。
3.3.4 Western blot检测
取适量肾脏组织,加含蛋白酶和磷酸酶抑制剂的组织裂解液,使用匀浆机进行匀浆,4℃离心(12000 r/min)15 min,转移上清备用。将各组蛋白定量到相同的浓度,加入上样缓冲液(loading buffer),于100℃水中使蛋白变性。样品通过80 V恒压浓缩胶和120 V恒压分离胶电泳后,再通过300 mA恒流电转2 h转移到PVDF膜上,用5%脱脂奶粉在室温下封闭1.5 h,TBST清洗后,加入一抗4℃过夜孵育,TBST清洗,加入二抗,摇床室温孵育1 h[20],应用凝胶成像系统成像,采用Image Lab软件进行灰度分析。
3.3.5统计学分析
用SPSS 22.0软件进行统计分析。数据以平均数±标准差(±s)表示,组间采用单因素方差分析,以P<0.05作为差异具有统计学意义的标准。
4 结果
4.1 FTZ作用靶点和DKD疾病靶点的筛选结果
采用TCMSP数据库获得FTZ的8味中药活性化学成分共150个,逐一搜索其对应的靶点蛋白,按照筛选标准获得FTZ的作用靶点蛋白,经过Uniprot数据库转换成靶点基因237个。检索GeneCards和CTD数据库获得DKD相关疾病靶点803个。
4.2 FTZ对DKD作用靶点及关键靶点筛选
将得到的FTZ作用靶点和DKD疾病靶点进行交集筛选,发现FTZ与DKD的共有靶点94个(图2)。94个交集靶点上传至STRING 11.0数据库获取其蛋白相互作用信息,并剔除掉孤立的靶点(未发生蛋白相互作用的靶点),利用Cytoscape3.7.2软件进行可视化及网络拓扑学分析得到FTZ对DKD作用相关靶点互作网络(图3)。图中节点表示靶点,边表示靶点之间的相互作用关系,网络中有94个节点,372条边。网络图中节点度值的大小用节点的大小来表示,节点越大表示度值越大。边的粗细与靶点间的Combine score值呈正相关关系。网络中度值排名前10的靶点如表-1,这10个靶点与其他作用靶点关联相对密切,对FTZ-DKD的PPI网络有关键的枢纽作用,表明了这些靶点在FTZ干预DKD中有核心地位。
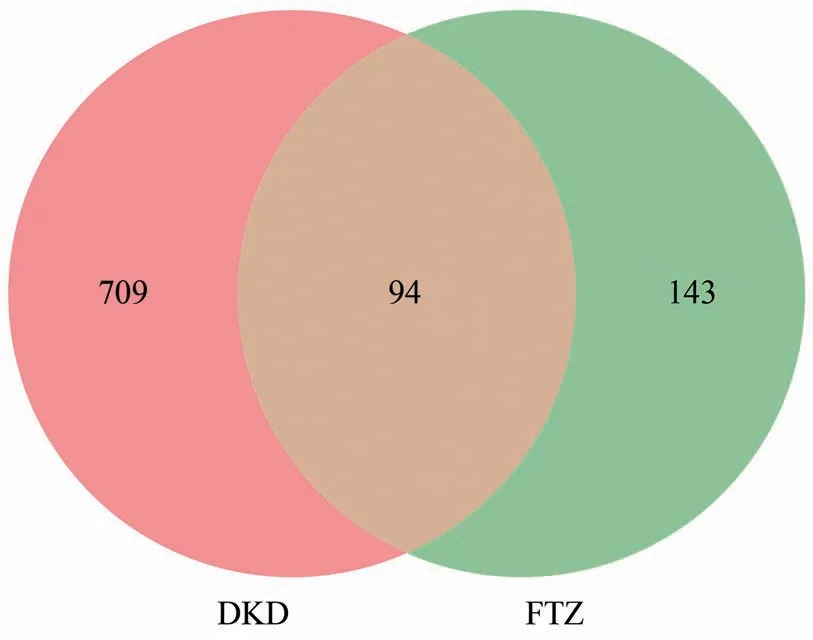
图2 FTZ和DKD靶点交集Venny图

图3 FTZ干预DKD蛋白互作关系图
4.3 GO功能富集分析和KEGG通路富集分析

表1 度值排名前10靶点
采用DAVID 6.8数据库对FTZ干预DKD靶点进行KEGG通路富集分析,结果显示,FTZ干预DKD可能是通过调控PI3K/AKT信号通路,缺氧诱导因子-1(Hypoxia inducible factor,HIF-1)信号通路,肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路,叉头盒蛋白O(forkhead box O,FoxO)信号通路和Toll样受体(Tolllike)信号通路等(图4D)。GO分析结果显示,FTZ干预DKD可能是通过调控细胞转录和凋亡、炎症应答、影响DNA转录、转录因子活性、蛋白质结合等途径(图4A-C)。

图4 FTZ干预DKD潜在生物过程和通路预测
4.4 FTZ对DKD小鼠肾脏功能的影响
STZ合并高脂饮食造模会造成小鼠血糖显著升高,24 h尿蛋白和血肌酐是反应肾功能损伤的指标,DKD造模成功后的小鼠24 h尿蛋白和血肌酐也会显著升高[21-22]。FBG结果显示:与Control组相比,DKD组小鼠FBG显 著 升高(P<0.01),而FTZ能 够显 著降低DKD小鼠的FBG(P<0.05)。24 h尿蛋白结果显示:与Control组相比,DKD组小鼠24 h尿蛋白显著升高(P<0.01),而FTZ能够显著降低DKD小鼠的24 h尿蛋白(P<0.01)。肌酐结果显示:与Control组相比,DKD组小鼠肌酐显著升高(P<0.01),而FTZ能够显著降低DKD小鼠的肌酐(P<0.01)(表2)。FTZ与Losartan的降低尿蛋白和血肌酐的效果相当。
表2 FTZ对DKD小鼠空腹血糖、24 h尿蛋白和血肌酐的影响(±s,n=6)
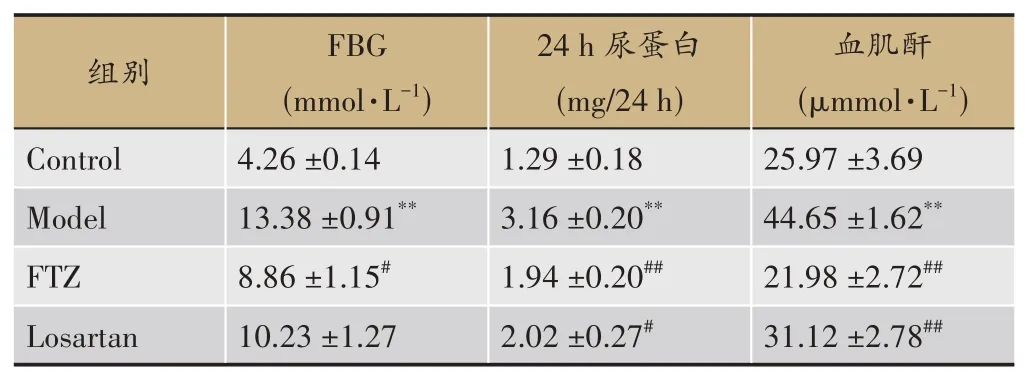
表2 FTZ对DKD小鼠空腹血糖、24 h尿蛋白和血肌酐的影响(±s,n=6)
注:与Control组(对照组)比较,*P<0.05,**P<0.01。与Model组(模型组)比较,#P<0.05,##P<0.01。
?
4.5 FTZ对DKD小鼠肾脏病理损伤的影响
DKD小鼠的肾脏会发生一系列病理改变:糖原堆积,肾小球逐渐肿大,炎性细胞浸润,系膜基质增生,胶原纤维堆积,可以分别采用H&E、PAS和Masson染色来反应[23]。H&E染色结果显示:Control组小鼠肾小球结构正常;Model组小鼠肾小球肿大,肾脏炎性细胞浸润;FTZ组改善了肾小球肿大及肾脏炎性细胞浸润的病理表现(图5)。PAS染色结果显示:与Control组相比,Model组小鼠肾小球内发生糖原的积累和系膜细胞增生,而FTZ组相较于Model组有所缓解(图6)。Masson染色结果显示:Control组小鼠肾脏组织无病理性胶原纤维沉积,与Control组相比,Model组小鼠肾脏组织有大量蓝染的胶原纤维堆积,而FTZ组胶原纤维的堆积现象有所改善(图7)。
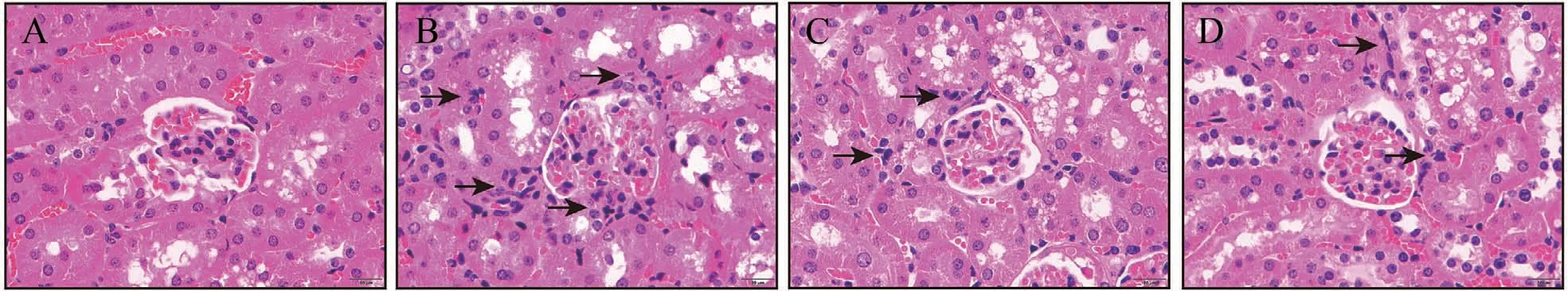
图5 FTZ对DKD小鼠肾脏组织病理学的影响(H&E染色)(400×)
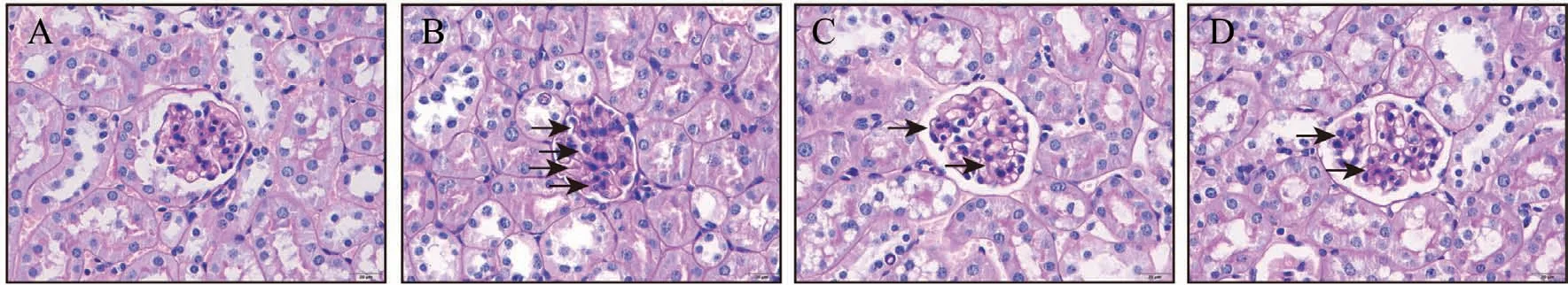
图6 FTZ对DKD小鼠肾脏组织系膜增生及糖原堆积的影响(PAS染色)(400×)

图7 FTZ对DKD小鼠肾脏组织胶原沉积的影响(MASSON染色)(400×)
4.6 FTZ改善DKD的机制与PI3K/AKT和STAT3相关
对网络药理学分析得到的靶点和通路进行文献检索,最终选择STAT3和PI3K/AKT核心通路进行实验验证。文献报道PI3K/AKT和STAT3是多种自身免疫性病理损伤的关键通路和因子,PI3K/AKT和STAT3的激活介导了DKD肾脏的损伤,因此,下调PI3K/AKT和STAT3的表达能改善DKD的肾脏损伤[24-25]。Western Blot(WB)及统计结果显示:Model组相较于Control组的肾脏组织PI3K和p-AKT及STAT3蛋白表达显著上升(P<0.05),而FTZ组显著下降(P<0.05),说明FTZ改善DKD的机制与抑制PI3K/AKT和STAT3信号通路相关(图8)。
5 讨论
DKD是糖尿病患者最常见的并发症之一,也是糖尿病并发症中最主要的死亡风险因素。因此,寻找有效治疗DKD的药物对临床防治DKD具有重大意义。本研究显示FTZ在改善DKD小鼠的肾功能以及肾脏病理损伤有一定的疗效。文献报道FTZ在治疗糖脂代谢性疾病方面具有较好的效果,并部分阐明了其作用机制。胡旭光等[26]研究发现FTZ可以降低代谢综合征大鼠的血清甘油三酯、总胆固醇和空腹血糖,重新激活胰岛素抵抗HepG2细胞中胰岛素相关的胰岛素受体底物-1通路。黎土娣等[27]发现FTZ能有效降低血脂并改善兔动脉血管成形术后再狭窄,其机制与激活脂联素(Adiponectin,APN)信号通路相关;另外,陈羽等[28]发现FTZ缓解高脂高胆固醇饮食诱导的非酒精性脂肪肝小鼠的肝脏脂肪变性、炎症和纤维化改变,可能是通过抑制核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体形成和激活实现的。由此可知FTZ在治疗糖脂代谢性疾病方面具有较好的疗效。本研究也显示FTZ可有效改善DKD小鼠的肾功能及肾脏病理损伤,但作用机制不明。
因此,本研究首先采用网络药理学技术初步分析了FTZ干预DKD的潜在作用靶点及机制,其中PPI结果 显 示 其 核 心 靶 点 为STAT3、AKT1、JUN、IL-6、MAPK1、VEGFA、RELA、MAPK14、TP53、EGFR等。文献研究表明肾小球系膜细胞中STAT3通路的激活可刺激细胞过度增殖,并增强胶原和纤维连接蛋白的生成,促进DKD肾小球硬化[29]。此外,在STZ诱导的条件下,正常小鼠与STAT3基因敲除的小鼠相比,会发生更严重的蛋白尿、肾小球细胞增生和纤维化活动[30]。Zheng等[31]发现抑制STZ诱导的糖尿病小鼠肾脏中STAT3的表达能够缓解肾脏损伤和纤维化病变。因此,STAT3对DKD的发展起着重要作用,抑制STAT3可能是治疗DKD的有效策略。本研究通过动物实验验证发现STAT3在DKD小鼠肾脏的表达显著上调,而FTZ可显著抑制其表达。由于PPI网络显示的靶点较多,FTZ成分的明确和靶点验证将会在后续实验继续探究。GO分析结果得到的生物过程为调控细胞转录和凋亡、炎症应答、影响DNA转录等。KEGG分析显示得到的通路为PI3K/AKT信号通路、HIF-1信号通路、TNF信号通路、FoxO信号通路、Toll样受体信号通路等。有研究证实在DKD动物模型中,PI3K/AKT通路显著上调[32],且可通过激活肾脏自噬和炎症介导肾小球和肾小管细胞损伤[33],而抑制PI3K/AKT通路能够改善肾功能和肾脏纤维化病变[34]。另有文献表明在DKD中TNF通路的激活会导致下游大量炎症因子的释放和凋亡相关蛋白caspase-3的激活[35],HIF-1信号通路激活会加重DKD的肾小球硬化和蛋白尿的排泄[36]。Toll样受体通路的激活使巨噬细胞等一系列炎症细胞在肾脏浸润,均加重了DKD的进展[37]。本研究结果进一步验证了FTZ能够有效抑制PI3K/AKT信号通路改善DKD。
综上所述,FTZ干预DKD的机制可能是通过抑制PI3K/AKT通路及STAT3通路,减少DKD小鼠尿蛋白的排泄,减轻肾脏胶原、糖原的堆积。这为FTZ治疗DKD提供了实验基础。但是,本研究仍然存在一些不足,如检索药物化学成分和筛选靶点过程中使用的数据库较单一,虽然TCMSP数据库整合了药物化学、药代动力学、网络靶点预测等信息,并提供成分作用靶点等关键信息,且是目前中药网络药理学领域运用较广泛的数据库,但不同数据库之间信息存在差异,使用单一数据库对数据收集的丰富度和完整性有一定影响[38-39];方剂中的君臣佐使搭配是中医辩证论治的特色,而网络药理学分析将所有药物的成分和靶点都同等考究,未考虑药物的剂量、配比和入血代谢等对药物吸收的影响,因此需要通过进一步实验对药物的入血活性成分及靶点进行探究。另外,动物体内实验仅对STAT3和PI3K/AKT通路进行了验证,网络药理学分析得到的其他靶点和通路需要进一步实验的验证。
6 结论
本研究通过网络药理学分析及动物实验初步探讨了FTZ治疗DKD的作用及机制。发现了FTZ可有效改善DKD小鼠肾脏功能,缓解肾脏病理损伤,其机制可能与抑制STAT3及PI3K/AKT通路有关。

