1H MRS评价长期胰岛素治疗1型糖尿病大鼠海马代谢物的变化
徐 慧,吴伊婷,王旭霞,康 彦, 雷 皓,高丽凤*
1.波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院 精密测量科学与技术创新研究院 武汉物理与数学研究所),湖北 武汉 430071;2.中国科学院大学,北京 100049;3.江汉大学医学院 医学影像系,湖北 武汉 430056
引 言
1 型糖尿病(T1DM)又称自身免疫性糖尿病,是一种以胰腺β细胞的丢失或破坏导致绝对胰岛素缺乏为特征的慢性疾病,可导致高血糖[1].尽管症状出现的年龄多为童年或青春期,但也可出现在中年.T1DM 占所有类型糖尿病的5%~10%,而且发病率和患病率正在逐年增加[2].T1DM 对大脑结构与功能产生负面影响,可导致糖尿病脑病[3],出现诸如灰质萎缩[4,5]、白质改变[6-8]、认知功能[9,10]、脑代谢异常[11]等多种糖尿病脑损伤表现.
活体质子定域磁共振波谱(1H MRS)是一种利用磁共振现象和物质化学位移作用相结合来研究化合物浓度、结构等信息的分析技术,因具备安全无创的优点而广泛用于研究生物体不同区域的神经化学水平和能量代谢水平的变化[12].检测代谢物浓度和代谢物比率的变化可以提供有关神经损伤、膜代谢功能障碍和神经系统疾病中发生的传播缺陷的信息.1H MRS 已多次被用来检测临床和临床前糖尿病及其相关动物模型的代谢改变,如大脑、肝脏、骨髓等器官的激素调节,葡萄糖(Glc)利用、氧化应激、渗透梯度调节,以及酮体水平等方面的改变[13-15].不同阶段的糖尿病和不同的糖尿病并发症可能呈现不一样的代谢水平.此前,本课题组应用1H MRS 发现链脲佐菌素(STZ)诱导T1DM 大鼠4 周后,海马的胶质细胞代谢、神经元代谢等出现紊乱,而单次胰岛素治疗未对胶质细胞代谢损伤产生显著的改变[16].目前,糖尿病脑代谢研究尚缺乏应用1H MRS 探讨长期T1DM 动物模型与持续胰岛素治疗T1DM 动物模型间的脑代谢水平比较的数据.本研究的目的即是评价STZ诱导的T1DM 大鼠及长期胰岛素治疗的T1DM 大鼠的海马的波谱学特征.
1 实验部分
1.1 实验动物
8 周龄成年雄性SD 大鼠购于武汉大学实验动物中心(动物许可证编号:SCXK(鄂)2019-0004).正式实验前,进行一周的适应性饲养.所有动物随机分组,2~3 只/笼饲养于无特定病原体(SPF)级动物房,温度为24±1℃,相对湿度为50%±5%,12 h/12 h 昼夜循环(光照时间:8:00~20:00),饮食和水供应充足.所有实验流程及操作均符合国家实验动物伦理和使用委员会规定.
1.2 实验模型建立
T1DM 模型组大鼠腹腔注射一针剂量为62 mg/kg 的STZ(Sigma,St.Louis,MO),STZ 使用0.01 mol/L 的柠檬酸-柠檬酸钠缓冲液(pH=4.5)配置,并保存于0℃冰浴中;对照组大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液.为了避免STZ 注射后动物出现低血糖,在STZ 注射后的24 h 内给予大鼠5%糖水.注射STZ 后第3 天(Day 3)从尾静脉采集大鼠血液样本,通过血糖仪测定血糖.STZ 诱导大鼠空腹血糖≥7.1 mmol/L 被认为造模成功;空腹血糖<7.1 mmol/L 的STZ 诱导大鼠排除在实验范围之外.胰岛素治疗组大鼠首先按照T1DM 模型组给药范式成功建造T1DM 模型;之后每日一次在腹部皮下注射长效甘精胰岛素(Lantus SoloStar,100 U/mL),初始胰岛素注射剂量为4~6 U/只/天,注射STZ 后第28 天起,为防止动物因为胰岛素治疗产生低血糖,胰岛素注射剂量下调至3~4 U/只/天.最终成功建立了用于1H MRS 的对照组大鼠8 只,T1DM 模型组大鼠9 只,胰岛素治疗组大鼠8 只.分别于注射STZ 前一天(Day 0)和注射STZ 后(Day 3、Day 7、Day 14、Day 28、Day 42、Day 56 和Day 84)监测各组大鼠体重与空腹血糖水平,在注射STZ 后第84 天进行1H MRS 数据采集.
1.3 磁共振实验
所有磁共振实验均在Bruker 7.0 T/20 cm 成像仪上进行,使用直径为72 mm 的体线圈进行射频脉冲的发射,使用直径为40 mm 的四通道正交表面线圈进行信号的接收.在实验过程中,使用与纯O2混合后浓度为1.5%~2.5%的异氟烷麻醉大鼠,并用热水循环系统使动物体温维持在37±1℃.实时监控动物的呼吸速率以保证动物不会被麻醉过深或过浅.
首先使用快速采集弛豫增强(RARE)序列采集定位像,参数设置如下:视野大小(FOV)为3.0 cm×3.0 cm,矩阵大小为256×256,片厚为0.6 mm,片数为20,重复时间(TR)为5 250 ms,有效回波时间(TEeff)为36 ms,回波链长(RARE factor)为4,重复次数为4.
1H MRS数据采集使用PRESS序列,具体参数为TR=4 000 ms,单侧海马FOV=1 cm×4 cm× 4 cm,回波时间TE=14 ms,谱宽为4 000 Hz,采样点数为2 048.所有体素先采集一个重复次数为1 的未压水的谱,然后采集一个重复次数为256 的压水后的谱,水信号的抑制采用弛豫优化的变间隔射频脉冲技术.
1.4 数据处理与分析
1H MRS 数据用LCModel6.3-1A 软件处理.原始自由感应衰减(FID)数据在LCModel 处理之前,没有经过任何预处理.经相位、频率、基线及涡流矫正后,运用约束正则化算法和分峰拟合对各代谢物进行定量分析.以未被压制的水信号作为内标.1H MRS 检测到多种神经化学物质,包括丙氨酸(Ala)、天冬氨酸(Asp)、肌酸(Cr)、磷酸肌酸(PCr)、γ-氨基丁酸(GABA)、Glc、谷氨酰胺(Gln)、谷氨酸(Glu)、甘油磷酸胆碱(GPC)、磷酸胆碱(PCh)、谷胱甘肽(GSH)、肌醇(Ins)、乳酸(Lac)、氮乙酰天冬氨酸(NAA)、氮乙酰天冬氨酸谷氨酸(NAAG)、牛磺酸(Tau)、Cr+PCr(tCr)、GPC+PCh(tPC)、NAA+NAAG(tNAA)、Glu+Gln(Glx),以及部分脂质(Lip)与大分子(MM).代谢物的拟合不确定性(CRLB)采用LCModel 中代谢产物浓度的误差估计:当CRLB低于15%时,所得到的数据才被认为可靠,并被用于最后的分析.代谢物浓度、体重与血糖均以平均值±标准偏差形式表示.采用SPSS 18.0 软件,体重与血糖使用双因素重复测量方差分析,代谢物浓度使用单因素方差分析.组间多重比较采用Bonferroni 校正,校正后p<0.05 被认为存在统计学差异.
2 结果与讨论
2.1 体重与空腹血糖比较
图1显示STZ 注射前后各组大鼠的体重与血糖双因素重复测量方差分析比较结果.三组大鼠体重间的给药主效应结果显示存在显著性差异[F(2,14)=26.983,p=0.000],时间的主效应[F(1.174,8.217)=190.378,p=0.000]以及时间×给药的交互效应[F(3.024,21.168)=44.177,p=0.000]同样具有显著性差异.三组大鼠血糖间的给药主效应结果显示存在显著性差异[F(2,14)=374.028,p=0.000],时间的主效应[F(7,49)=37.544,p=0.000]以及时间×给药的交互效应[F(14,98)=25.964,p=0.000]同样具有显著性差异.在各时间点,组间两两比较的结果显示,造模成功后(Day 3~Day 84),T1DM 模型组较对照组体重显著降低,血糖显著升高.胰岛素给药后,胰岛素治疗组与对照组相比,血糖无显著性差异;体重除在Day 14 显著降低外,其他时间点无显著性差异.胰岛素治疗组较T1DM 模型组血糖显著降低,体重自Day 28 起显著升高.
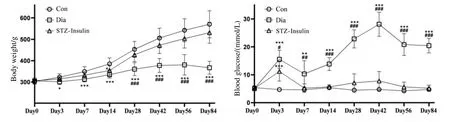
图1 各组大鼠的体重与血糖比较.数据以平均值±标准差的形式呈现.* p<0.05,** p<0.01,*** p<0.001,与对照组比较;# p<0.05,## p<0.01,### p<0.001,与胰岛素治疗组比较.Con:对照组;Dia:T1DM 模型组;STZ-Insulin:胰岛素治疗组Fig.1 Comparison of body weight and blood glucose levels among groups.Data is presented as mean ± standard deviation.* p<0.05,** p<0.01, *** p<0.001, compared to the control group; # p<0.05, ## p<0.01, ### p<0.001, compared to the insulin-treated group.Con: control group; Dia: type 1 diabetes mellitus group; STZ-Insulin: insulin-treated type 1 diabetes mellitus group
2.2 活体1H MRS 实验结果
图2显示活体定域波谱兴趣区右侧海马脑区的定位.图3分别显示了对照组大鼠、T1DM 模型组大鼠,以及胰岛素治疗组大鼠海马脑区活体波谱、LCModel 的拟合结果、拟合与原始数据的残差.

图2 T2加权像上右侧海马感兴趣区的位置.Axi:横断面;Sag:矢状面;Cor:冠状面Fig.2 The locations of the right hippocampus voxels on T2-weighted templates.Axi: axial image; Sag: sagittal image; Cor: coronal image

图3 各组具有代表性的海马1H MRS.谱中黑色线为原始谱,红色线为LCModel 对原始谱的拟合,谱上方为拟合与原始谱的残差.Con:对照组;Dia:T1DM 模型组;STZ-Insulin:胰岛素治疗组Fig.3 The representative 1H MRS of the hippocampus in each group.The corresponding LCModel fits (red lines in the spectra) to the raw spectra (black lines in the spectra) and fitting residuals (above the spectra) were shown.Con: control group; Dia: type 1 diabetes mellitus group; STZ-Insulin: insulin-treated type 1 diabetes mellitus group
表1显示了符合标准(每个谱中量化的CRLB 均小于15%)的9 个代谢物的拟合准确度(平均CRLB±标准偏差),图4显示了海马代谢物的定量分析结果.
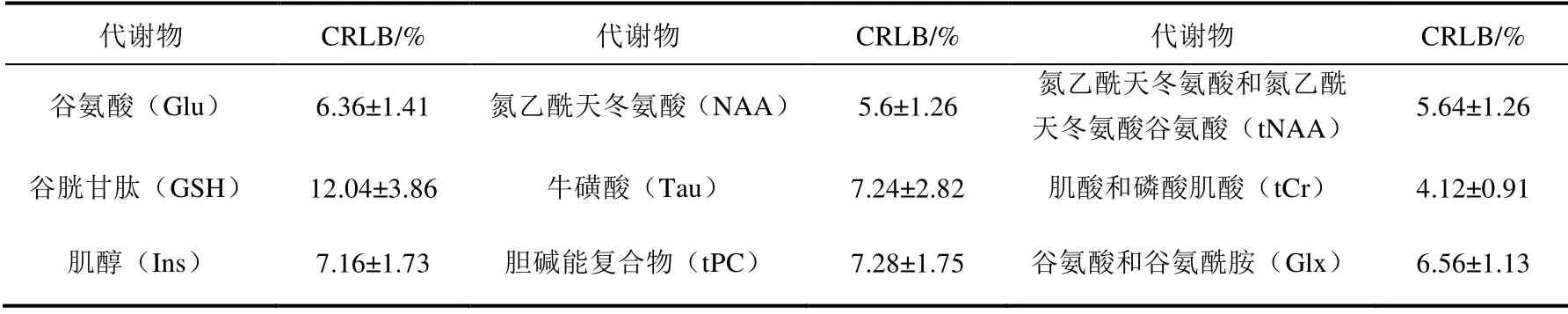
表1 海马代谢物拟合准确度Table 1 The fitting accuracy of hippocampal metabolites
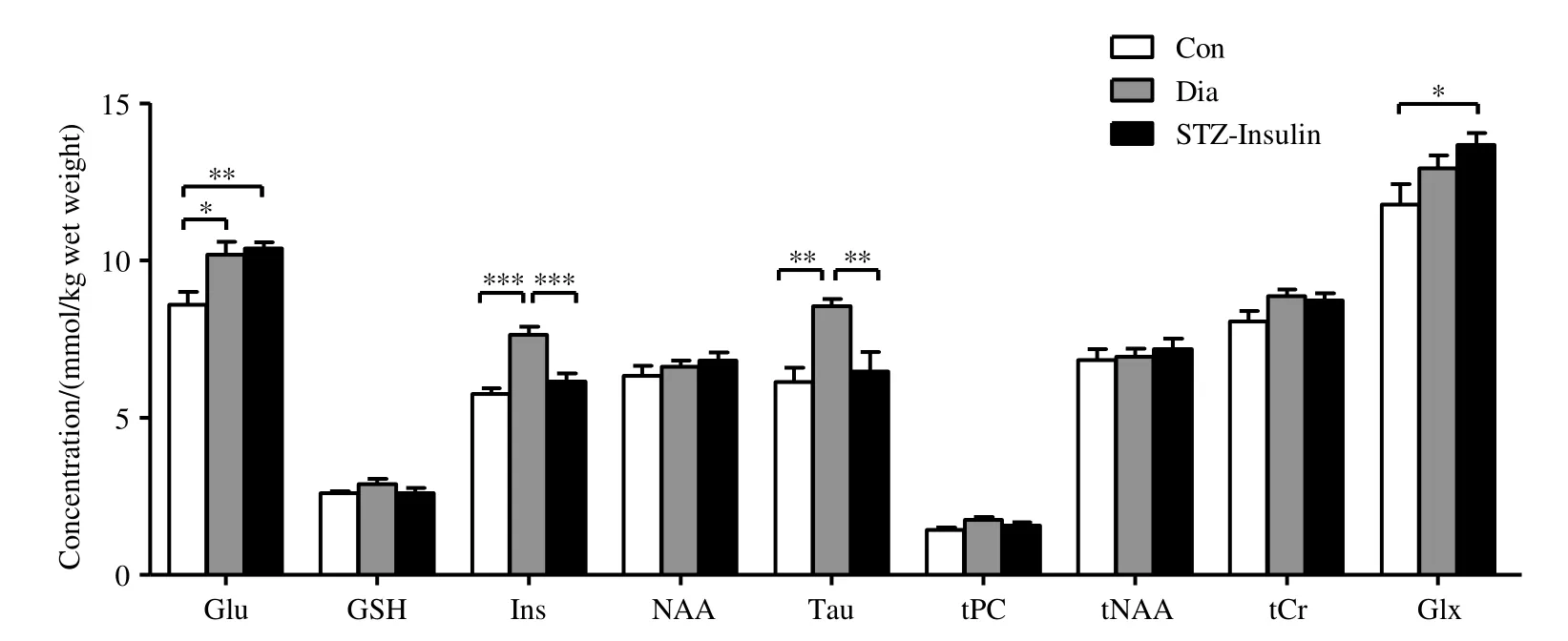
图4 各组海马代谢物的定量分析结果.Con:对照组;Dia:T1DM 模型组;STZ-Insulin:胰岛素治疗组;* p<0.05;** p<0.01;*** p<0.001Fig.4 Quantitative analysis results of the hippocampal metabolites in each group.Con: control group; Dia: type 1 diabetes mellitus group; STZ-Insulin: insulin-treated type 1 diabetes mellitus group; * p<0.05; ** p<0.01; *** p<0.001
由STZ 诱导的T1DM 模型组的Ins 和Tau 的浓度与对照组相比显著上升(p=0.000、p=0.003);胰岛素治疗组较T1DM 模型组Ins 和Tau 的浓度显著下降(p=0.000、p=0.010),与对照组无显著性差别.T1DM 模型组、胰岛素治疗组较对照组Glu 浓度均显著上升(p=0.014、p=0.007),胰岛素治疗组较对照组Glx 浓度显著上升(p=0.042).其余观测值(GSH、NAA、tPC、tNAA、tCr)在三组间均无统计学差异(p>0.05).
2.3 讨论
本研究发现长期胰岛素治疗T1DM大鼠血糖与体重控制良好,较T1DM模型大鼠血糖显著降低、体重显著升高.1H MRS 检测的代谢物的浓度变化表明了长期胰岛素治疗改变了STZ 诱导的T1DM大鼠的海马代谢,可能影响渗透调节、神经传导等方面.
Ins 主要存在于神经胶质细胞中,因此常被作为神经胶质细胞的标志物.Ins 浓度异常升高可以反映胶质增生的水平[17].同时Ins 作为生物膜脂质成分的组成部分,也是磷脂酰肌醇第二信使系统的重要组成部分,可通过不同机制参与胰岛素代谢信号的细胞内传递[18].Tau 是一种含硫的β-氨基酸,以游离形式存在于神经元及胶质细胞内,在大脑发育过程中具有神经营养作用,作为神经递质、抗氧化剂和渗透调节剂参与神经调节等多种大脑功能[19].在啮齿类动物中,Ins 与Tau 同是大脑内主要的渗透物,对维持细胞形态、参与大脑的渗透/容积调节有重要作用[20].本研究发现高血糖时大鼠海马Ins 和Tau 浓度上升,与前人的结果[16,21]一致.一方面,当糖尿病及其并发症发生时,Glc 代谢受到影响,高血糖导致胰岛素抵抗,炎症反应增加,诱导胶质细胞的胶质化过程,高血糖下Tau 和Ins 水平的平行上升伴随着星形胶质细胞的主要成分胶质纤维酸性蛋白表达的增加[22];另一方面,高血糖导致细胞膜内外的渗透压梯度增大,使水从胞内转移到胞外,引起细胞体积收缩.胶质细胞内渗透调节物质Ins 和Tau 水平升高对维持神经元和神经胶质细胞体积起促进作用.STZ 诱导的糖尿病大鼠造模成功4 周后单次注射胰岛素,海马Ins 水平与Tau 水平较生理盐水对照组显著升高[16],本实验中注射STZ 后第84 天,胰岛素治疗组大鼠海马的Ins 浓度和Tau 浓度与正常对照无差异,较T1DM 模型组显著降低.我们的结果表明可能不同于长期未受控制的高血糖导致的海马胶质细胞增生与渗透调节受损,在胰岛素长期干预下血糖受控的糖尿病动物海马胶质细胞未明显增生,渗透平衡未失调.
NAA 主要存在于神经元,尤其是线粒体中,因此NAA 被认为是神经元的标记物,NAA 的变化可以反映神经元丢失的信息[23].T1DM 患者海马区NAA 水平显著性下降[24]和没有显著性差异的发现均有报道[25],在动物模型中的报道也不一致.例如:STZ 诱导后4 天和4 周时,大鼠海马NAA水平出现显著下降[16];STZ 诱导大鼠后1~29 天,包含海马和皮层区域的NAA 浓度无变化,45~87天NAA 浓度下降[21];STZ 诱导后30 天,高血糖大鼠海马NAA 浓度上升,在注射胰岛素血糖恢复正常后,NAA 浓度也恢复到了对照组的水平[22].本实验中注射STZ 后第84 天,T1DM 模型组和胰岛素治疗组与对照组相比,均未出现NAA 浓度的显著差异.近来也有其他模型发现大脑NAA 的含量是可以恢复的[26],这可能是大脑神经元对长期疾病刺激所做的可塑性调节.
Glu 是大脑主要的兴奋性神经递质,对脑区之间的信号传递有至关重要的作用[23].Gln 在T1DM中是条件性必需氨基酸,可能有助于中和低血糖[27].Glu 在神经胶质细胞中的谷氨酰胺合成酶作用下合成Gln,Gln 经神经元中的谷氨酰胺酶转化为Glu,形成Glu-Gln 循环[28].Glu 与Gln 都参与了许多重要的代谢途径,如能量供应、蛋白质合成等.本实验中,相较于对照组,T1DM 模型组与胰岛素治疗组大鼠海马的Glu浓度均显著升高,与血糖控制下的T1DM患者的脑Glu 水平升高结果一致[10];T1DM 患者前额叶、T1DM 大鼠顶叶均被观察到Glu 水平升高[29,30].有研究表明,T1DM 患者急性低血糖时,脑Glu 水平会下降,这是由于Glu 作为替代的能量物质,用以补充Glc 的消耗[31].高Glu 水平可能是大脑保护机制对反复低血糖损伤的反应.因此长期胰岛素治疗造成的Glu 增加可能由于脑代谢活动增加[23].此外,Glu 具有神经毒性,导致神经元细胞死亡,Glu 水平的升高可能反映了兴奋性毒性增加,而糖尿病患者相关的认知功能下降及糖尿病并发症等障碍与增加的Glu 兴奋性毒性相关[30].
3 结论
本文利用活体1H MRS 研究了由STZ 诱导的T1DM 大鼠模型及长期胰岛素治疗T1DM 大鼠单侧海马区代谢物的变化,发现Ins 浓度与Tau 浓度对胰岛素治疗敏感,提示相比高血糖未受控制的T1DM 大鼠,血糖控制良好的T1DM 大鼠海马的神经胶质细胞增生得到改善.
致谢
感谢江汉大学校级科研项目资助计划(2022SXZX26)和国家自然科学基金(81601204)对本研究的支持.
利益冲突
无

