青光眼术后浅前房并发症相关因素分析及护理对策
桑红艳,韩 婷,秦丽娜
(常熟市第一人民医院 江苏常熟215500)
青光眼是一种可致盲性的眼病,到2020年,全世界青光眼患者约7960万例。目前,抗青光眼药物、手术、激光等治疗方法的应用,使得青光眼的治疗成功率有了很大提升,但仍然存在一些不容忽视的并发症[1]。滤过手术是青光眼外科的主要治疗手段[2]。但术后发生浅前房是一种常见并发症,如果不及时治疗,会造成角膜内皮丢失、虹膜前粘连、并发性白内障、睫状体环阻滞性青光眼等严重问题,甚至永久性致盲。近年来,随着滤过手术方法的发展,小梁手术中使用青光眼阀、青光眼引流器和抗代谢药物导致术后浅前房的发病率难以预测。为此,分析青光眼术后浅前房的危险因素,对预防和早期治疗青光眼浅前房十分必要。本研究回顾分析我院青光眼患者术后发生浅前房的危险因素。现报告如下。
1 资料与方法
1.1 临床资料 选取2019年10月1日~2021年9月30日收治82例青光眼患者作为研究对象。纳入标准:术前眼压>30 mm Hg(1 mm Hg=0.133 kPa);符合《中国青光眼指南(2020年)》相关诊断标准[3];满足青光眼手术指征或房角分离术指征;年龄>18周岁;术前瞳孔活动良好;神志清晰,语言理解能力正常。排除标准:合并其他眼科疾病,如白内障、视网膜脱落等;合并全身性疾病,如高血压、糖尿病等;晚期青光眼或视神经萎缩者,最佳矫正视力<1;黏膜粘连严重或广泛粘连;出血倾向及有抗凝药物服用史者;资料不全者。经眼科A/B超等诊断术后1 d或前房形成后几日内消失为浅前房的诊断标准,以是否发生浅前房为依据分为浅前房组21例和非浅前房组61例。本研究符合《赫尔辛基宣言》相关伦理原则。
1.2 方法
1.2.1 手术方法 术后眼球后麻醉、上方球结膜下、上直肌浸润麻醉后,沿着顺时针方向将球结膜切成弧形,向后钝性分开,用巩膜电凝止血,将(4×6)mm的巩膜瓣从角膜缘边缘处划开,然后在角膜边缘处完全切开,将房内的小梁组织切除(1×4)mm,并将虹膜切除,重建虹膜,形成前房。虹膜根切除清晰,2针巩膜瓣,2针球结膜,地塞米松注射液2 mg注射入球结膜。对Ⅰ度浅前房伴低眼压应加强观察,浅前房可自行加深,使其恢复正常。对Ⅱ度浅前房合并低眼压患者采用保守疗法,如房水滤过强,应用1%阿托品眼液进行散瞳,4次/d,同时进行局部加压包扎。合并结膜切口渗漏:临床应用2%萤光素点于结膜囊处,钴蓝光下裂隙灯下观察,若有小切口漏,应加压包扎,大切口漏行外科治疗。用扩瞳药物滴眼。如果症状没有改善,应采用后巩膜切开术,使巩膜下渗出,并行前房成形;治疗后,浅前房会逐渐加深,并能恢复到正常状态。Ⅲ度浅前房伴低眼压时,早期行前房成形手术。Ⅲ度浅前房伴高眼压,在睫状体阻滞性青光眼中比较常见,需要及时手术切除晶体并进行玻璃体切除,以避免形成前房。
1.2.2 检查项目 根据青光眼类型结合临床经验,选择验光、裂隙灯检查、眼压、眼底检查、超声生物显微镜、视野、前房角镜、眼科A/B超等检查明确诊断。
1.2.3 仪器 裂隙灯显微镜:苏州六六鹤牌YZ-5J型。全自动电脑视野计:APS-6000CER。非接触式眼压计:日本TOPCOMCT-80非接触式眼压计。房角镜:Ocular OSMG单面房角镜。超声生物显微镜:MD300W。眼AB超:法国Quentel Medical眼A/B超仪。直接眼检镜:苏州六六YZ11D,将仪器的探针频率设定为10 MHz,并与角膜表面垂直。每例患者的眼睛进行10次测量,并取其平均值。
2 结果
2.1 两组患者临床特征单因素分析 单因素分析显示,年龄、青光眼类型、术前眼压、眼轴长度、前房深度是青光眼患者发生浅前房的影响因素(P<0.05)。见表1。
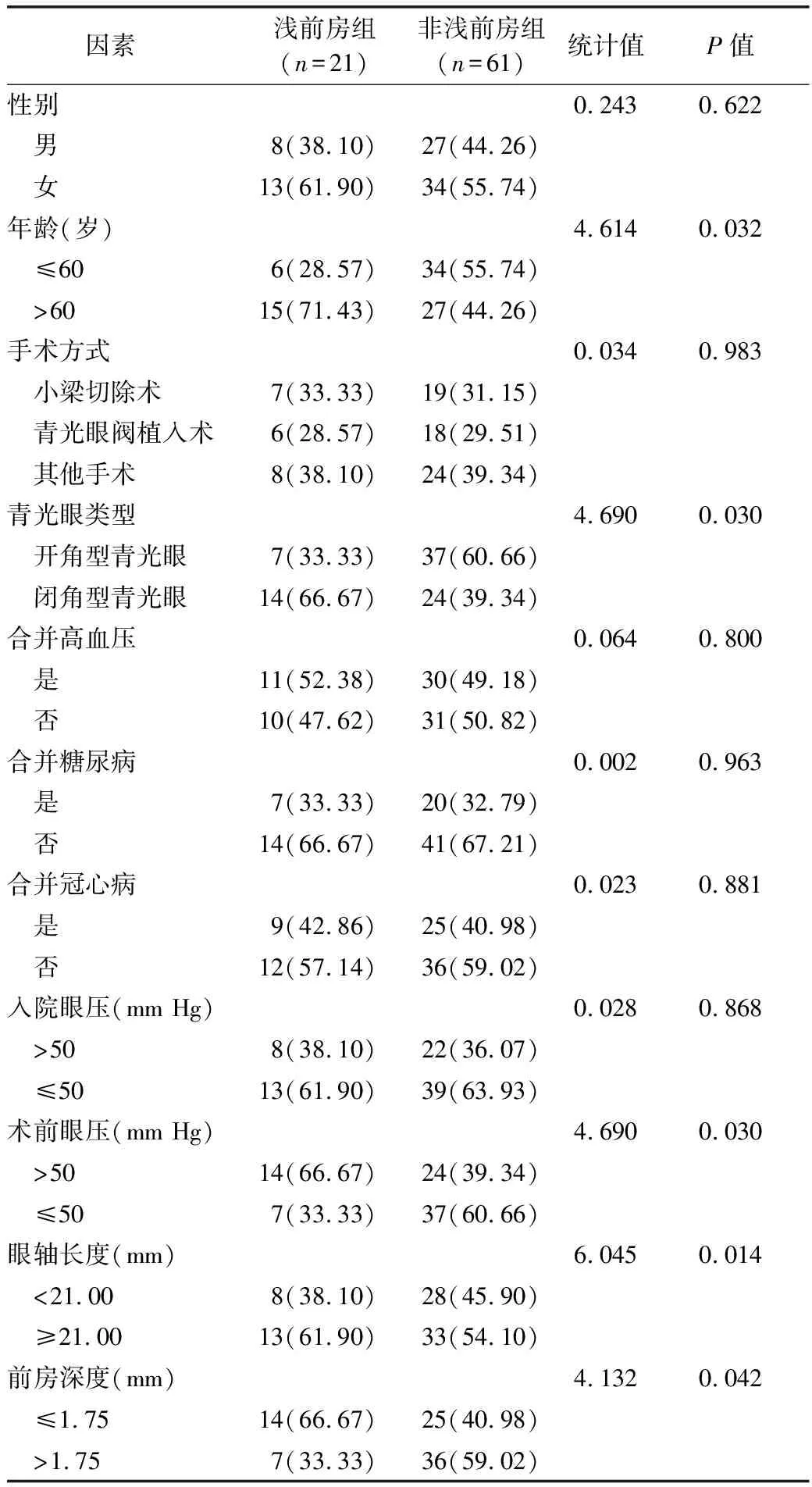
表1 两组患者临床特征单因素分析[例(%)]
2.2 青光眼患者发生浅前房影响因素Logistic多因素分析 Logistic多因素分析显示,年龄>60岁、术前眼压>50 mm Hg、眼轴长度≥21.00 mm、前房深度≤1.75 mm是青光眼患者发生浅前房的独立影响因素(P<0.05)。见表2。
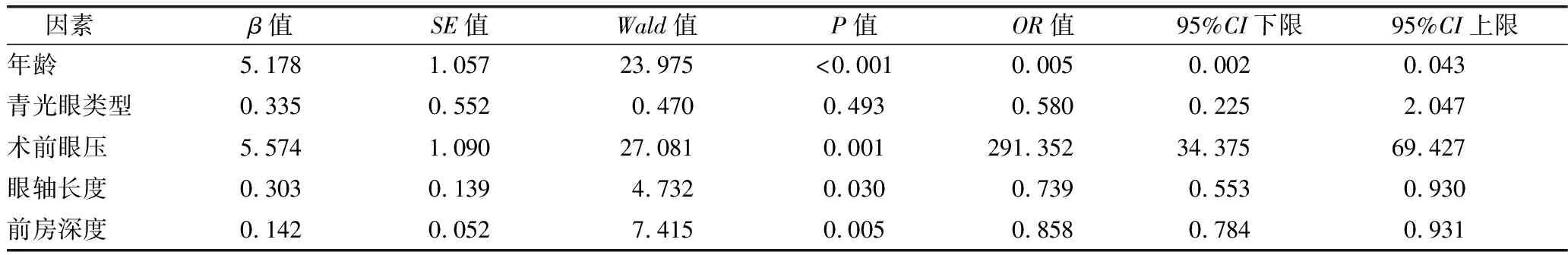
表2 青光眼患者发生浅前房影响因素Logistic多因素分析
3 讨论
滤过性手术在当前对青光眼患者有重要意义的措施之一。由于青光眼的并发症发生率较高,部分并发症会发展为青光眼、致盲等,这对患者的生理和心理造成了严重影响。因此,应对患者加强监护,以预防术后浅前房区是临床医务人员的共识。因此,要进一步探讨其影响因素,以减少浅前房的发生。目前,单一使用滤过手术仍是治疗青光眼的主要手段。虽然手术方式多种多样,但其基本原理和方法都差不多,都可能通过建立新的房水通路使眼压恢复到正常水平,防止发生视神经损害[4]。浅前房是滤过手术后一种常见并发症,尤其是角膜水肿、角膜内皮细胞减少、晶体混浊[5]。若不及时处理,可能造成永久性失明。研究结果显示,年龄>60岁是青光眼术后浅前房的主要影响因素,提示青光眼手术应重点关注高龄人群。分析原因:老年人的筋膜组织较薄,术后滤过过多,容易造成睫状体和脉络膜脱落,损害了眼睫状体,使房内排汗功能受到影响,其术后浅前房更加恶化;高龄患者晶体扩张,瞳孔阻塞加剧,同时悬韧带松弛也会造成前房的轴深比较浅;随着年龄增长,玻璃体后分离和液化的现象越来越严重,变性的玻璃体丧失了支撑功能,难以抵御脉络膜的渗透;由于老年患者血管广泛硬化,脉络膜血管的弹性和收缩能力降低,容易出现脉络膜渗漏,从而引起脉络膜脱落。采取以下护理措施:①健康教育。治疗后患者需定期到医院复查,检查视力、眼压等情况,遵医嘱合理用药,护士向患者讲解患病注意事项、用药相关标准等内容。适当情况下可通过健康教育讲座为患者科普浅前房护理内容,并制成图册分发给陪同家属。②心理护理。鼓励家人、朋友多与患者沟通,通过亲情陪伴、社会支持等方式降低患者术后孤独感或疾病负担,树立治疗信心,避免病情恶化或出现其他心理问题。③运动护理。每周保持至少3次低强度运动训练,如慢走、太极拳等,保持良好的身体机能,持续时间1个月,对护理过程进行持续跟踪随访。
有报道显示,眼压控制在50 mm Hg以内的患者术后浅前房的发病率低,这是由于术前眼压过高,导致术中房水有节律地流出,导致眼压逐渐降低,前房的高度不会在术后迅速消失,因此可以很好地复原[6]。维持正常的眼压依赖于房水产生和排泄的动态均衡,由于眼容积是一定的,所以晶状体、玻璃体、眼内血液量以及房水改变都会导致眼压变化[7],但一般这三种情况不会发生太大改变,因为只有房水流动,才会影响眼压稳定。引起眼压增高的病理生理机制包括:睫状突产生房水速率增加,房水通过小梁网络流出的阻力增加,表面巩膜血管内的压力增加。结果显示,术前眼压>50 mm Hg是青光眼术后浅前房发生的主要影响因素,提示在术前控制眼压有助于降低青光眼术后浅前房发生率,因为高眼压会引起眼内血流紊乱,造成眼部组织缺氧缺血、血管渗透、组织坏死等。高眼压性损害和眼内压降低会导致睫状体肿胀,使晶体向前方移动,造成睫状环阻塞。由于眼部压力差异,导致静脉膜的血管膨胀,导致静脉内的液体流出,聚集在静脉内,导致静脉膜脱落。护理对策:对未控制眼压的患者,术前30 min内静脉注入250 ml 20%甘露醇注射液(规格:250 ml,50 g),在麻醉过程中适当对眼球进行挤压和软化,减小眼内压力;根据患者身体状况在术前控制眼压,避免渗漏发生,合理掌握控制缝合线时机;避免辛辣刺激性食物,多食用富含蛋白质和维生素的食物,如豆类、花生、鱼类,新鲜蔬菜水果等[8]。
浅前房是青光眼滤过术后易发生的并发症,青光眼术前应严格控制眼压在30 mm Hg以下,3 d以上可以考虑手术,以降低术后浅前房发生率。青光眼术后发生浅前房多见于小眼球、短眼轴、大晶体的闭角青光眼[9]。小梁手术治疗后,睫状环缩小,虹膜前倾,睫状体水肿;由于眼球解剖结构异常、房水循环障碍、房水向后倒灌,导致晶状体、睫状体和玻璃体向前移动对眼球造成病理损伤[10]。结果显示,眼轴长度≥21.00 mm、前房深度≤1.75 mm是青光眼术后浅前房并发症发生的主要影响因素,提示眼部解剖结构异常对患者青光眼手术成功率具有极大影响。在临床上,眼解剖学结构异常是一种公认的风险因素,由于眼轴长度较短、前房深度较浅等原因,房角入口处狭窄,前房容积减小,眼球容积改变,容易将晶体-虹膜隔向前推,造成房角闭合、前房变浅,发展为恶性青光眼。护理对策:①镇痛护理。出现眼痛、畏光、流泪、视力减退患者给予镇痛药物干预,以缓解疼痛和不适,建议患者多卧床休息。②预防感染。给予抗感染处理,清除患者眼睛分泌物,1%阿托品滴眼液散瞳,使用时注意按时滴眼,以减少不良反应。③合理用药。合理使用抗代谢药物和抗感染药物,严格践行药物使用标准,尽量避免使用抗生素,选择眼药水等温和性质的药物,其中输注20%甘露醇注射液需要密切观察心率和血压变化,但由于利尿和脱水作用太大,会造成多种伤害,所以需要有专门人员监控输液速度,避免水电解质紊乱。最好使用中心静脉注射甘露醇,注意避免药物在血管内渗漏。④对症护理。对于眼痛、畏光、流泪等症状,可以使用镇痛药物缓解疼痛和不适,建议患者卧床休息。及时给予抗感染处理,清除眼睛分泌物,嘱患者多洗手,少用手触摸眼睛[11]。⑤强化护理巡视,密切观察有无不良反应。定时巡查病房,及时观察并询问患者有无不适,如有疼痛,可区别病因。如果发现浅前房,应立即通知医生采取相应治疗措施,耐心讲解,了解术后浅前房基本情况,避免产生不良情绪[12]。
综上所述,青光眼术后浅前房的形成与多种因素相关,可针对年龄、术前眼压、眼轴长度、前房深度等因素制订护理对策,促进患者尽快康复,降低手术风险,使其积极配合手术。

