纳米硒对低氧胁迫下中华绒螯蟹免疫保护和抗氧化能力的影响
贾慧凝,侍苗苗,卞永乐,侍崇敬,刘恒蔚,宋学宏,秦粉菊
1. 苏州科技大学 化学与生命科学学院,江苏 苏州 215009
2. 苏州大学 基础医学与生物科学学院,江苏 苏州 215123
作为世界第一水产养殖和贸易大国,中国2020年淡水养殖总产量为3 088.9×104t,其中中华绒螯蟹 (Eriocheir sinensis) 总产量为 77.59×104t,在水产养殖中具有重要地位[1]。同时,随着经济水平的提高、电子商务的迅速发展和冷链物流配套设施的逐步完善,中华绒螯蟹的消费增速较快,具有巨大的发展潜力。
中华绒螯蟹养殖以家庭农场为主,养殖难度较高,各种环境因素和病害的频繁爆发严重限制了其发展。河塘养殖条件下,夏季高水温、有机物输入以及残饵和粪便积聚等因素会导致养殖水体溶解氧(DO) 浓度降低[2],使生长在河塘底部的中华绒螯蟹组织或血管中的氧浓度降低,产生低氧胁迫。低氧胁迫会影响蟹的免疫机能和抗氧化能力[3],导致其对病原体的抵抗能力下降、易于感染致病菌而造成损伤甚至死亡[4]。近年研究发现,一些营养物质具有提高抗氧化能力、改善低氧耐受能力、降低细胞代谢和氧消耗等多种功效[5]。因此,开展中华绒螯蟹营养调控以应对低氧胁迫的研究,具有十分重要的理论价值和现实意义。
生物机体必需微量元素——硒 (Se),对细胞抗氧化和动物机体免疫能力起重要调节作用[6-7]。研究表明,饲料中补充硒可以显著改善中华绒螯蟹的抗氧化能力、营养品质、免疫应答和生长代谢[8-9],但传统硒源的安全范围较窄,纳米硒 (nano-Se) 高效低毒的特性能够解决传统硒源最佳使用剂量和致毒浓度之间安全限度非常狭窄的问题,且其抗氧化和免疫调节功能优于传统硒源[10],而揭示纳米硒对低氧胁迫下中华绒螯蟹抗氧化能力和免疫保护作用机制的研究尚未见报道。在笔者课题组前期纳米硒营养研究的基础上[11],本研究设置了不同添加水平的纳米硒处理,探索其对低氧胁迫下中华绒螯蟹的免疫保护作用及抗氧化调控机制,以期为纳米微量元素营养调控应对中华绒螯蟹低氧胁迫提供一定的理论依据和应用参考。
1 材料与方法
1.1 实验材料
纳米硒由中国科学技术大学苏州研究院提供;嗜水气单胞菌 (Aeromonas hydrophila, CL99920) 由江苏省水生动物疫病预防控制中心提供 (编号SC097);中华绒螯蟹基础饲料购于苏州鑫裕饲料有限公司 (表1),采用逐级扩大混合的方法,将纳米硒分别按 0、0.1、0.2、0.4、0.8 和 1.6 mg·kg−1的水平加入基础饲料中,加水混匀,用小型绞肉机制成直径2.5 mm左右的颗粒饲料,晾干后密封与空气隔绝,置于−20 ℃冰箱保存备用。

表1 基础饲料配方组成Table 1 Ingredients of composition of basal diets
1.2 实验方法
1.2.1 中华绒螯蟹的养殖
1 800只中华绒螯蟹幼蟹购于苏州市临湖现代渔业产业园,体质量 (4.5±0.4) g;适应性饲养1周后,随机分为6个添加水平组,分别以0 (对照组)、0.1、0.2、0.4、0.8 和 1.6 mg·kg−1纳米硒添加实验饲料饲喂90 d,养殖于玻璃钢水族箱 (长60 cm×宽50 cm×高100 cm)。饲养期间,水温 (25±1) ℃,pH 7.95±0.06,DO 质量浓度 (6.4±0.2)mg·L−1,总氨质量浓度 (0.35±0.02) mg·L−1,氯化物质量浓度 (135±16) mg·L−1,亚硝酸盐质量浓度低于0.05 mg·L−1,盐度3‰,光暗交替12 h。每天早晚各投喂实验饲料1次,投喂量为蟹体质量的2%,饲喂期间蟹正常取食,换水率为20%·d−1,每天清除粪便。
1.2.2 低氧胁迫实验
将用塑料薄膜封口的储水桶 (87 cm×63 cm×61 cm) 一侧通入氮气,使用碘量法[12]实时测定储水桶中的DO水平,使DO质量浓度保持在 (2.0±0.4)mg·L−1,形成低氧水环境。饲喂90 d后,从每个添加水平组中选取120只体格相当、健康、肢体健全的中华绒螯蟹,平均体质量为19.74 g,设置6个平行组,每组20只,分别置于3 L的密闭具塞三角烧瓶中,接通低氧水系统。其中3个平行组用于测定免疫保护率:在低氧胁迫第0、第12和第24小时记录死亡率,计算纳米硒对中华绒螯蟹的免疫保护率。另3个平行组用于测定低氧胁迫第0、第12和第24小时其他指标:采集血淋巴与抗凝剂按1∶1体积比混匀以备血细胞计数,部分血淋巴经凝固离心制备上清,对肝胰腺、鳃进行采样,将组织样品和血淋巴上清置于−70 ℃冰箱保存。
免疫保护率 (IPR, %) 的计算公式为:

式中:M0为 0 mg·kg−1纳米硒组蟹的死亡率 (%);Mn为不同添加水平纳米硒组蟹的死亡率 (%)。
1.2.3 低氧胁迫下嗜水气单胞菌对中华绒螯蟹攻毒实验
饲喂90 d后,从每个添加水平组中选取60只体格相当、健康、肢体健全的中华绒螯蟹,平均体质量为19.74 g,设置3个平行组,每组20只,从第三步足与体壁关节膜肌肉处注射4×106CFU·kg−1剂量的嗜水气单胞菌,置于3 L的密闭具塞三角烧瓶中,接通低氧水系统。实时观察并记录死亡情况,计算纳米硒对中华绒螯蟹的免疫保护率。
1.3 指标测定及方法
取低氧胁迫下中华绒螯蟹经抗凝剂处理的血淋巴20 μL,使用血球计数板和光学显微镜统计总血细胞数量 (THC)、大颗粒细胞 (LGC)、小颗粒细胞(SGC)、透明细胞 (HC)。参考Nickerson等[13]的方法,使用紫外吸收比色法测定血清中血蓝蛋白浓度。选取组织样本,按照南京建成生物工程研究所和苏州科铭生物技术有限公司提供的试剂盒,测定乳酸 (LD) 浓度,超氧化物歧化酶 (SOD) 、过氧化氢酶 (CAT) 、谷胱甘肽过氧化物酶 (GSH-Px) 活性和丙二醛 (MDA) 浓度。
1.4 统计分析
2 结果
2.1 死亡率
饲料中添加纳米硒对低氧胁迫下中华绒螯蟹死亡率的影响见表2。未进行低氧胁迫时,纳米硒各添加水平组中华绒螯蟹死亡率均为0%,低氧胁迫12和24 h蟹死亡率分别上升至12.66% (P>0.05) 和62.45% (P<0.05)。在饲料中添加纳米硒,低氧胁迫12和24 h蟹死亡率均随着纳米硒添加水平的增加先下降后上升,添加0.1、0.2 mg·kg−1纳米硒组低氧胁迫下的死亡率显著低于未添加组 (P<0.05),其中0.2 mg·kg−1组效果更好,低氧胁迫12和24 h的免疫保护率分别可达80.25%和58.98%;添加0.8、1.6 mg·kg−1纳米硒会显著提高低氧胁迫下中华绒螯蟹的死亡率 (P<0.05)。
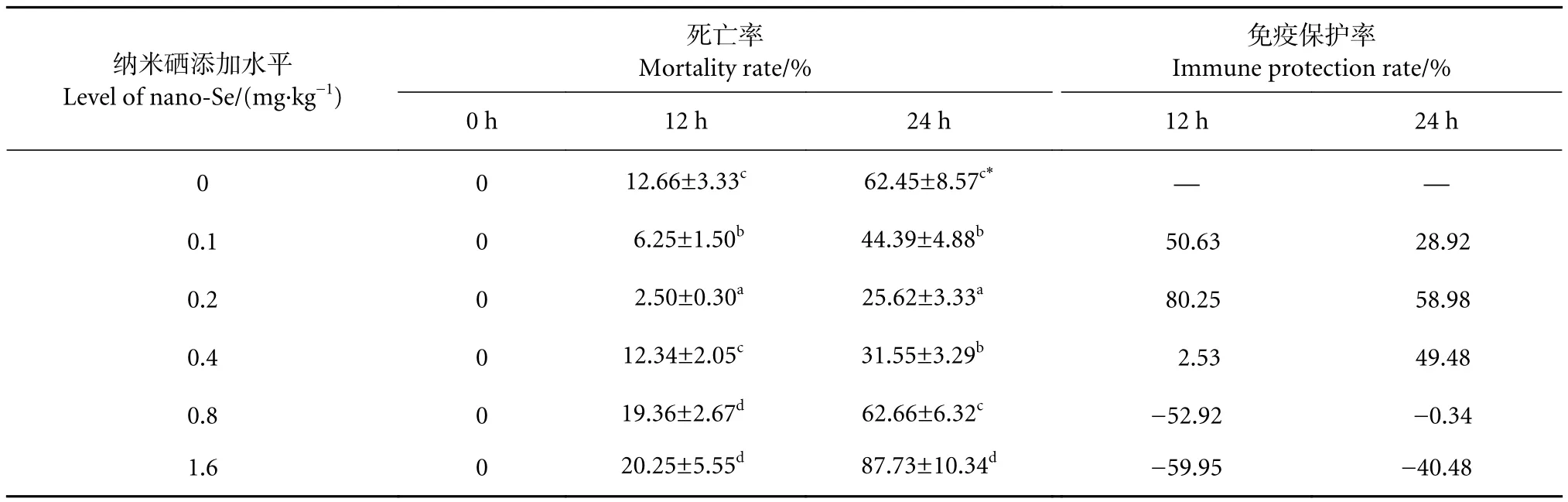
表2 纳米硒对低氧胁迫下中华绒螯蟹死亡率的影响 (N=10)Table 2 Effects of nano-Se on mortality rate of E. sinensis under hypoxia stress (N=10)
2.2 嗜水气单胞菌致蟹死亡率
饲料中添加纳米硒对低氧胁迫下嗜水气单胞菌致蟹死亡率的影响见表3。与单独低氧胁迫处理(表2) 相比,低氧胁迫下嗜水气单胞菌感染12和24 h的蟹死亡率分别由12.66%增至50.36%,62.45%增至100%。在饲料中添加适量纳米硒 (0.1~0.4 mg·kg−1),低氧胁迫下嗜水气单胞菌的致死率显著下降 (P<0.05),其中 0.2 mg·kg−1组中华绒螯蟹的死亡率显著低于其他添加水平组 (P<0.05),对低氧胁迫下12和24 h中华绒螯蟹的免疫保护率分别可达75.22%和43.18%。

表3 纳米硒对低氧胁迫下嗜水气单胞菌致死率的影响 (N=10)Table 3 Effects of nano-Se on lethality of A. hydrophila under hypoxia stress (N=10)
2.3 血淋巴耐低氧指标
饲料中添加纳米硒对低氧胁迫下中华绒螯蟹血淋巴中血蓝蛋白和LD浓度的影响见图1。与对照组比较,0 mg·kg−1组在低氧胁迫第12小时蟹血淋巴中血蓝蛋白浓度显著上升 (P<0.05),继续胁迫至第24小时回落。低氧胁迫12和24 h,血蓝蛋白浓度均随着纳米硒添加水平的增加呈现先上升后下降的趋势,且均以0.2 mg·kg−1组上升最为显著 (P<0.05),1.6 mg·kg−1组则显著下降 (P<0.05)。
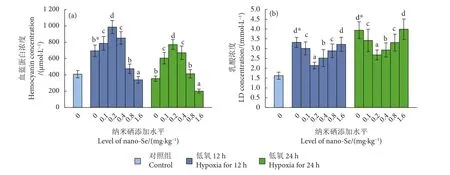
图1 纳米硒对低氧胁迫下中华绒螯蟹血淋巴耐低氧指标的影响 (N=6)注:柱上不同英文字母表示相同低氧胁迫时间下显著差异 (P<0.05);*. 与对照组差异显著 (P<0.05);后图同此。Fig. 1 Effects of nano-Se on hemolymph hypoxia tolerance indexes of E. sinensis under hypoxia stress (N=6)Note: Different lowercase letters on the bar indicate significant difference at the same hypoxia stress time (P<0.05); *. Significant difference compared with the control group (P<0.05); the same case in the following figures.
低氧胁迫下中华绒螯蟹血淋巴中LD和血蓝蛋白浓度具有基本相反的规律性。与对照组相比,低氧胁迫12和24 h显著增加0 mg·kg−1组蟹血淋巴中LD浓度 (P<0.05)。在饲料中添加纳米硒,低氧胁迫12和24 h,LD浓度均随着纳米硒添加水平的增加先下降后上升,均以0.2 mg·kg−1组LD浓度最低,且显著低于其他添加水平组 (P<0.05)。
2.4 血淋巴血细胞数量
饲料中添加纳米硒对低氧胁迫下中华绒螯蟹血淋巴中THC、LGC、SGC和HC的影响见图2。与对照组相比,0 mg·kg−1组蟹血淋巴中 THC、LGC、SGC和HC在低氧胁迫第12 h小时显著增加 (P<0.05),至第24小时下降。在饲料中添加纳米硒,低氧胁迫12和24 h,THC、LGC、SGC和HC均随纳米硒添加水平的增加先上升后下降,且均以0.2 mg·kg−1组显著高于其他添加水平组,低氧第24小时0.8和1.6 mg·kg−1组则显著低于其他添加水平组 (P<0.05)。
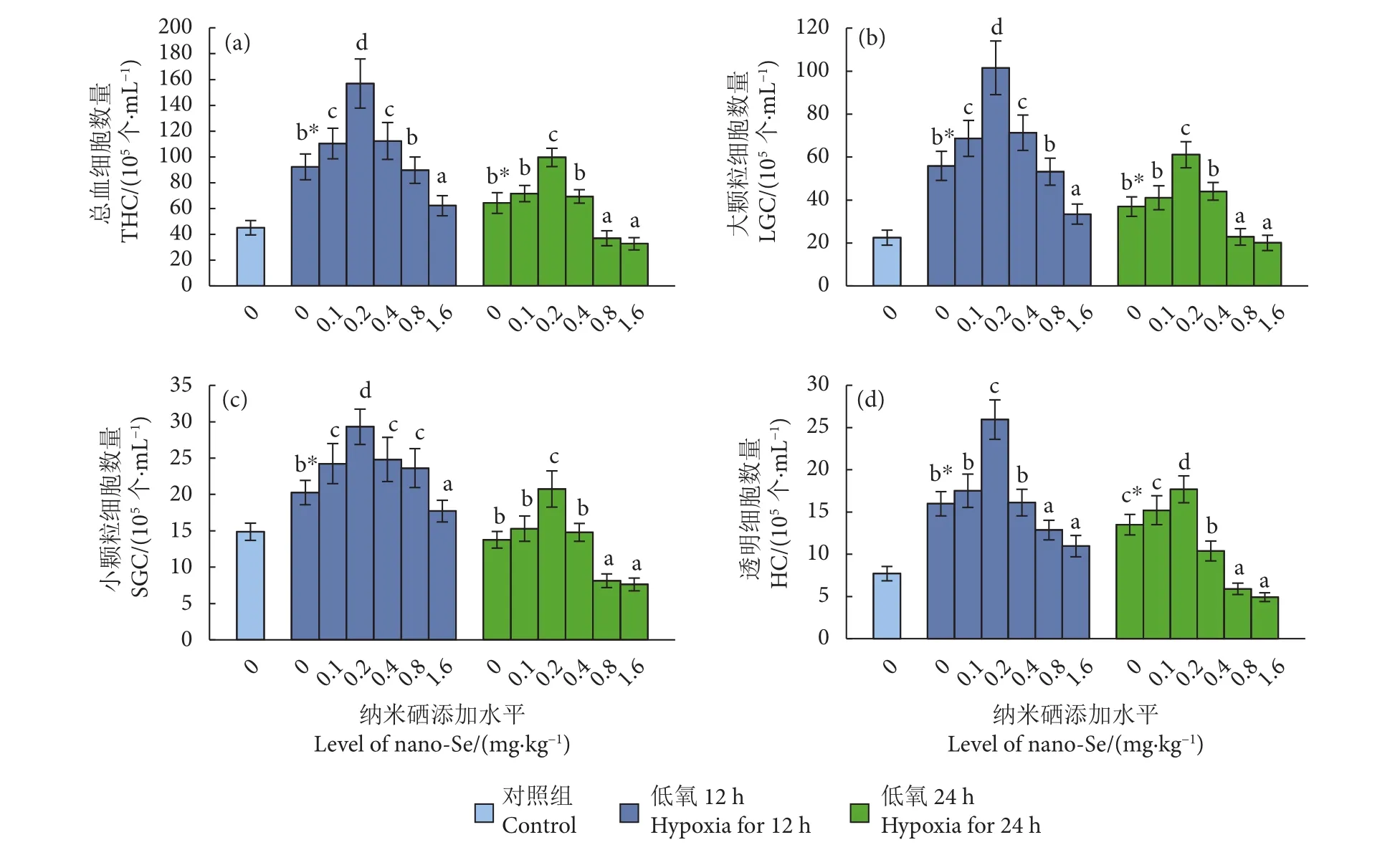
图2 纳米硒对低氧胁迫下中华绒螯蟹血淋巴血细胞数量的影响 (N=6)Fig. 2 Effects of nano-Se on hemolymph hemocyte count of E. sinensis under hypoxia stress (N=6)
2.5 抗氧化能力
低氧胁迫下中华绒螯蟹不同组织中SOD、CAT、GSH-Px活性和MDA浓度分别见图3、图4、图5和图6。

图3 纳米硒对低氧胁迫下中华绒螯蟹不同组织中超氧化物歧化酶活性的影响 (N=6)Fig. 3 Effects of nano-Se on SOD activity in different tissues of E. sinensis under hypoxia stress (N=6)

图4 纳米硒对低氧胁迫下中华绒螯蟹不同组织中过氧化氢酶活性的影响 (N=6)Fig. 4 Effects of nano-Se on CAT activity in different tissues of E. sinensis under hypoxia stress (N=6)

图5 纳米硒对低氧胁迫下中华绒螯蟹不同组织中谷胱甘肽过氧化物酶活性的影响 (N=6)Fig. 5 Effects of nano-Se on GSH-Px activity in different tissues of E. sinensis under hypoxia stress (N=6)
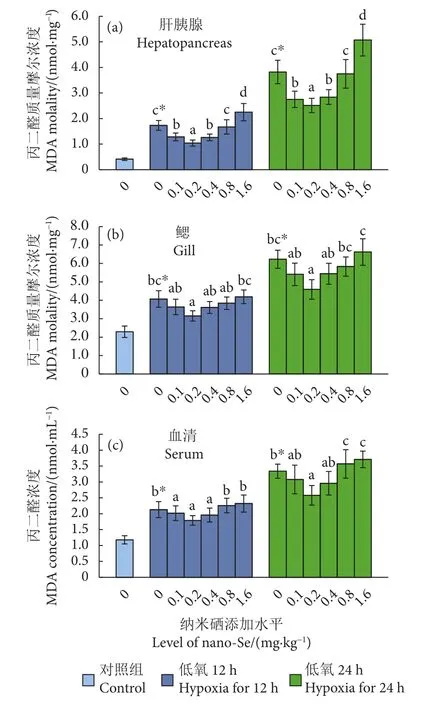
图6 纳米硒对低氧胁迫下中华绒螯蟹不同组织中丙二醛浓度的影响 (N=6)Fig. 6 Effects of nano-Se on MDA concentration in different tissues of E. sinensis under hypoxia stress (N=6)
与对照组比较,0 mg·kg−1组蟹肝胰腺、鳃和血清中的SOD、CAT、GSH-Px活性基本均呈现出在低氧胁迫第12小时显著上升 (P<0.05),第24小时又下降的趋势。在饲料中添加纳米硒,蟹3种组织中的SOD、CAT、GSH-Px活性均随纳米硒添加水平的增加先上升后下降;低氧胁迫第12小时,3种组织中0.2 mg·kg−1组SOD和CAT活性均最高,且与其他添加水平组有显著差异 (P<0.05);低氧胁迫第24小时,肝胰腺和鳃组织中SOD、CAT活性均以0.1、0.2和0.4 mg·kg−1组最高,且与其他添加水平组有显著差异 (P<0.05);低氧胁迫第12和第24 小时,肝胰腺和血清中GSH-Px活性均以0.2 mg·kg−1组最高,且与其他添加水平组有显著差异 (P<0.05),鳃组织中GSH-Px活性各添加水平组间无显著差异 (P>0.05)。
与对照组相比,蟹肝胰腺、鳃和血清中MDA浓度在低氧胁迫第12至第24小时持续显著上升 (P<0.05)。在饲料中添加纳米硒,蟹3种组织中MDA浓度随其添加水平的增加先下降后上升。低氧胁迫第12和第24 小时,0.1、0.2和0.4 mg·kg−1组蟹3种组织中MDA浓度均显著低于其他添加水平组 (P<0.05),1.6 mg·kg−1纳米硒组MDA浓度最高,且与其他添加水平组有显著差异(P<0.05)。
3 讨论
3.1 纳米硒对低氧胁迫下中华绒螯蟹免疫保护的影响
DO水平对水产养殖尤为重要,低氧胁迫易造成甲壳类动物氧化损伤,诱发水产疾病,对水产养殖造成巨大经济损失[14]。嗜水气单胞菌是引起水产养殖大规模传染疾病的主要病原菌[15],极易在不良胁迫尤其是低氧环境下感染水生动物,导致中华绒螯蟹颤抖病和水肿病等多种疾病的发生,是造成其养殖巨大经济损失的重要因素[16-17]。程超等[18]发现嗜水气单胞菌会破坏中华绒螯蟹鳃、肝胰腺等组织结构,并影响其免疫相关基因的表达。鉴于此,本研究选择嗜水气单胞菌研究低氧胁迫下中华绒螯蟹对致病菌的免疫能力。结果发现,注射嗜水气单胞菌使低氧胁迫12 h的蟹死亡率由12.66%增加到50.36%,低氧胁迫24 h的死亡率由62.45%增加到100%。而在饲料中添加0.2 mg·kg−1的纳米硒,低氧胁迫12和24 h嗜水气单胞菌的致蟹死亡率分别降至12.48%和56.82%,免疫保护率分别可达75.22%和43.18%,有效地缓解了低氧胁迫下中华绒螯蟹免疫力的降低,而以0.8、1.6 mg·kg−1水平添加纳米硒则会进一步提高低氧胁迫和低氧下嗜水气单胞菌攻毒的蟹死亡率。相似地,Kong等[19]发现在日本沼虾 (Macrobrachium nipponense) 的饲料中添加0.47和0.59 mg·kg−1酵母硒可以显著提高其成活率,而过量 (1.17 mg·kg−1)的酵母硒则会产生毒性,抑制其生长和免疫能力。
中华绒螯蟹免疫系统是非特异性的,主要通过血细胞和从细胞释放到血浆中的各种活性因子来清除病原体[20-21]。其中血细胞是中华绒螯蟹血液循环中的氧载体,通过吞噬作用、产生抗菌肽和活性氧等功能以抵御病原体[22],根据其形态和功能主要被分为大颗粒细胞、小颗粒细胞和透明细胞3类[23]。血蓝蛋白是甲壳类动物血淋巴中的主要蛋白质,在中华绒螯蟹中占血淋巴总蛋白的90%以上,除载氧功能外,还具有酚氧化酶的功能,通过酶促切割对病原产生免疫防御[24-25]。因此,血淋巴中血细胞数量和血蓝蛋白浓度是中华绒螯蟹免疫系统中关键的调节因子,也是评估其在低氧环境胁迫下免疫能力的重要指标。
le Moullac等[26]研究发现细角对虾 (Penaeus stylirostris) 暴露在严重低氧 (1 mg·L−1) 环境下24 h血淋巴中LGC、SGC、HC和THC显著降低,从而导致溶藻弧菌 (Vibrio alginolyticus) 的感染致死率显著增加。而本实验结果显示,低氧胁迫第12小时蟹血淋巴中各类型血细胞数量显著增加,继续胁迫至第24小时出现下降趋势,这可能与实验设置的DO水平不同有关。本实验中低氧胁迫第12小时蟹血蓝蛋白浓度显著上升 (P<0.05),继续胁迫至第24小时回落,LD浓度则继续增加。Song等[27]对中华绒螯蟹、Wang等[28]对青蟹(Scylla paramamosain) 的低氧胁迫研究均得到相似结论。在低氧胁迫下,中华绒螯蟹为适应低氧环境产生应激反应,通过增加血细胞数量和血蓝蛋白浓度以提高携氧能力,作为无氧呼吸产物——LD的增加可以有效消除波尔效应并提高血蓝蛋白结合氧的能力。低氧胁迫延长至第24小时,蟹血淋巴细胞数量和血蓝蛋白浓度降低,LD浓度增加,同时伴随蟹死亡率增加和嗜水气单胞菌致蟹死亡率加剧,表明低氧胁迫影响血蓝蛋白、LD浓度和血细胞数量而降低中华绒螯蟹的耐低氧及免疫能力。本研究在中华绒螯蟹饲料中添加纳米硒,0.2 mg·kg−1组血细胞数量和血蓝蛋白浓度显著高于其他添加水平组,LD浓度显著低于其他水平组,提示纳米硒可以提高低氧胁迫下中华绒螯蟹的免疫、载氧和耐低氧能力。李彦红等[29]研究发现,使用添加0.2、0.4和0.8 mg·kg−1纳米硒的饲料饲喂齐口裂腹鱼 (Schizothorax prenanti) 8周,血清总蛋白、球蛋白水平和免疫器官指数明显升高,说明纳米硒具有增强免疫的作用,且以0.2 mg·kg−1添加水平的效果最明显,这与本研究结果相似。另外本研究中,最佳添加水平对蟹LD浓度的抑制效果以及对各类型血细胞 (THC、LGC和HC,除SGC外) 的增加效果均在低氧第12小时最佳,说明0.2 mg·kg−1添加水平在短时间 (低氧 12 h) 内对蟹免疫功能的保护和调节作用更佳,胁迫时间延长,其保护效率下降。
3.2 纳米硒对低氧胁迫下中华绒螯蟹抗氧化能力的影响
低氧条件下,中华绒螯蟹的鳃、肝胰腺和血淋巴中产生大量活性氧 (ROS) 如过氧化物、超氧物、羟基自由基和单线态氧。ROS会导致DNA链断裂、碱基修饰,攻击膜蛋白造成细胞损伤,其最显著的细胞损伤是脂质过氧化[30-32]。MDA作为脂质过氧化的天然产物,反映了细胞的过氧化状态,通常用于监测内源性氧化损伤,其浓度升高通常与各种环境应激和动物病理状态有关[33-35]。抗氧化酶系统作为中华绒螯蟹非特异性细胞吞噬免疫和抗氧化防御体系的重要组成部分,可以消除生物体内过量的ROS。中华绒螯蟹体内的抗氧化酶包括SOD、GSH-Px和CAT等[36-37]。SOD和CAT可以清除超氧自由基 (·O2−) 和过氧化氢 (H2O2),GSH-Px 的作用是通过谷胱甘肽 (GSH) 转化为氧化型谷胱甘肽(GSSG) 的过程催化H2O2和过氧化脂类的还原[38-39]。
de Oliveira等[40]发现西南大西洋穴居蟹 (Chasmagnathus granulata) 在低氧胁迫8 h后鳃组织中的SOD活性降低,CAT和GSH-Px活性升高,MDA水平升高。管越强等[41]发现日本沼虾 (Macrobrachium nipponense) 在低氧 (2 mg·L−1) 环境 8 h 后SOD活性降低、CAT活性和总抗氧化能力升高。Nam等[42]和Bundgaard等[43]对皱纹盘鲍 (Haliotis discus hannai) 和鲫 (Carassius carassius) 的低氧胁迫研究均有相似结论。本实验中低氧胁迫12 h中华绒螯蟹肝胰腺、血清和鳃中SOD活性降低,CAT和GSH-Px活性升高,MDA水平升高,这与前人的研究结论一致;继续低氧胁迫至第24小时,3种抗氧化酶活性均降低,MDA水平继续增加。本研究结果说明低氧胁迫12 h会诱导氧化应激,中华绒螯蟹抗氧化酶CAT和GSH-Px活性升高以维持体内ROS平衡,SOD作为唯一以·O2−为底物的酶,随着摄入O2减少,产生·O2−的量减少而活性降低;随着低氧胁迫时间延长至24 h,中华绒螯蟹体内的抗氧化酶系统受到影响,使中华绒螯蟹的抗氧化能力下降进而损伤蟹免疫功能。
硒 (Se) 是甲壳类动物必需的营养元素,是抗氧化酶GSH-Px和其他硒蛋白的重要组成成分和活性中心,对防止氧化损伤和调节免疫功能起重要作用[44-45]。赵亚伟等[46]发现不同硒源的抗氧化能力具有显著差异,低毒高效的纳米单质硒作用最为显著。膳食补充纳米硒可以提高机体血清中硒水平,降低脂质和蛋白质氧化,上调GSH-Px、SOD和CAT等抗氧化酶水平,减轻氧化应激程度[47]。Kong等[19]发现在日本沼虾的饲料中添加0.31、0.47和0.59 mg·kg−1酵母硒可以显著提高 GSH-Px 和SOD活性,降低MDA水平,抗氧化能力显著提高。黄小红等[48]发现,饲料中添加0.25、0.5和0.75 mg·kg−1纳米硒可以显著提高草鱼 (Ctenopharyngodon idellus) 血清中的GSH-Px、SOD和总抗氧化能力 (T-AOC) 水平,降低MDA水平,其中0.5 mg·kg−1纳米硒作用更显著。本研究中,随着饲料中纳米硒添加水平的提高,SOD、CAT和GSHPx活性均呈现先上升后下降的趋势,其中0.2 mg·kg−1纳米硒组达到最高水平,1.6 mg·kg−1组达到最低水平,表明适量纳米硒可显著提高中华绒螯蟹的抗氧化能力,过量添加则会降低其抗氧化能力。低氧胁迫下0.2 mg·kg−1纳米硒组蟹各组织中的MDA水平均达最低值,这与该水平纳米硒可以有效提高低氧胁迫下中华绒螯蟹的抗氧化能力结论相一致。此外,不同胁迫时间下,最佳水平纳米硒在不同抗氧化指标以及相同抗氧化指标在不同组织中的效果不一致,但可以发现0.2 mg·kg−1纳米硒对3种组织中SOD活性的提升效果均在低氧第12小时更明显,胁迫时间延长至第24小时,纳米硒的保护效果降低;在低氧12 h下,0.2 mg·kg−1纳米硒对肝胰腺中CAT和GSH-Px活性的提升效果更好,相应地,此时0.2 mg·kg−1纳米硒对肝胰腺中MDA水平的抑制作用也优于低氧24 h。这些结果均表明0.2 mg·kg−1纳米硒在低氧第12小时对蟹抗氧化能力的保护效果更佳。
本研究发现在蟹饲料中添加0.2 mg·kg−1纳米硒可以显著改善其免疫能力,降低其在不良胁迫下的死亡率,综合笔者课题组前期研究[11],该剂量纳米硒也可提高中华绒螯蟹的生长性能,改善其营养组成,具有非常高的经济价值和发展前景。
4 结论
饲料中添加纳米硒可显著改善低氧胁迫下中华绒螯蟹的抗氧化能力和免疫机能,降低其在低氧胁迫下的死亡率和病菌致死率,且添加水平以0.2 mg·kg−1为宜。

