多囊卵巢综合征患者血清抗苗勒管激素与体质指数、胰岛素抵抗的相关性研究
霍丽静,王新玲,李新新,魏常梅,卢亚敏,任路平,帖彦清,于 芳
(河北省人民医院,河北 石家庄 050051)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS) 是一种育龄期妇女常见的内分泌代谢性疾病,近年来发病率逐年上升,在育龄期妇女中发病率为6%~15%[1]。PCOS 的发病机制和病因目前尚未完全阐明,肥胖是该病患者的常见临床表现,高雄激素血症、胰岛素抵抗和持续不排卵是该病的主要病理生理变化[2]。有研究表明,PCOS 患者血清中雄激素浓度与胰岛素水平密切相关,较高的胰岛素水平会促进雄激素合成增加,影响正常的卵泡发育过程,导致多毛、月经紊乱甚至不孕[3]。抗苗勒管激素(AMH)作为转化生长因子家族的成员,由颗粒细胞表达,被认为是人类卵巢储备的可靠标志物,与窦性卵泡的数量密切相关[4]。研究表明AMH浓度增高可导致其自身以及其他激素受体的下调,抑制卵巢皮质细胞增殖,影响卵泡发育[5]。本研究旨在探讨不同体质指数(BMI)PCOS患者血清中AMH、性激素的变化特点及与胰岛素抵抗的相关性,评估AMH的临床检测价值,为PCOS 患者的防治提供新的思路,为临床治疗干预提供参考。
1 资料与方法
1.1一般资料 选取2021年1—12月在河北省人民医院新诊断的育龄期PCOS患者142例作为PCOS组,患者诊断遵照2003年鹿特丹会议修订的PCOS诊断标准[6]。选取同期健康体检健康女性50例作为健康组,入选者月经规律,性激素水平及卵巢超声检查均正常,激素避孕者需要至少2个月的洗脱期。排除使用已知的影响骨代谢和类固醇合成的药物者。本研究入选者均对研究知情同意,签署知情同意书,且研究经河北省人民医院伦理委员会同意[(2019)科研伦审(249)号]。
1.2研究方法 记录所有受试者年龄、身高、体重、BMI、腰围、腰臀比,按照BMI将PCOS患者分为PCOS正常体重组59例(18.5 kg/m2≤BMI<24.0 kg/m2)、PCOS超重组48例(24.0 kg/ m2≤BMI<28.0 kg/m2)、PCOS肥胖组35例(BMI≥28.0 kg/m2)。于月经周期第3~5天(闭经者日期不限)清晨取静脉血5 mL,于美国罗氏公司cobas e601电化学发光分析仪检测AMH、卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、睾酮(T)、孕酮(P)、泌乳素(PRL)、空腹血糖(FPG)、空腹胰岛素(FINS)水平,同时检测餐后2 h血糖(2hPG)和餐后2 h胰岛素(2hINS)水平,计算胰岛素抵抗指数(HOMA-IR)。比较各组间年龄、BMI、腰围、腰臀比及血清各指标的差异,分析AMH与各指标的相关性。
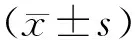
2 结 果
2.1PCOS组与健康组各指标比较 PCOS组患者BMI、腰围、腰臀比及血清AMH、LH、T、FPG、2hPG、FINS、2hINS、HOMA-IR均明显高于健康组(P均<0.05),血清PRL水平明显低于健康组(P<0.05),2组年龄及血清FSH、E2、P水平比较差异均无统计学意义(P均>0.05)。见表1。

表1 PCOS组与健康组各指标比较
2.2PCOS各组各指标比较 PCOS正常体重组、PCOS超重组和PCOS肥胖组BMI及血清AMH、FINS、HOMA-IR依次升高,血清LH、LH/ FSH依次降低,组间两两比较差异均有统计学意义(P均<0.05)。见表2。
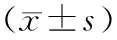
表2 PCOS各组各指标比较
2.3各组AMH与各指标的相关性 Pearson相关性分析显示, PCOS正常体重组、PCOS超重组和PCOS肥胖组血清AMH与BMI、LH、LH/ FSH、HOMA-IR均呈正相关关系(P均<0.05)。见表3。
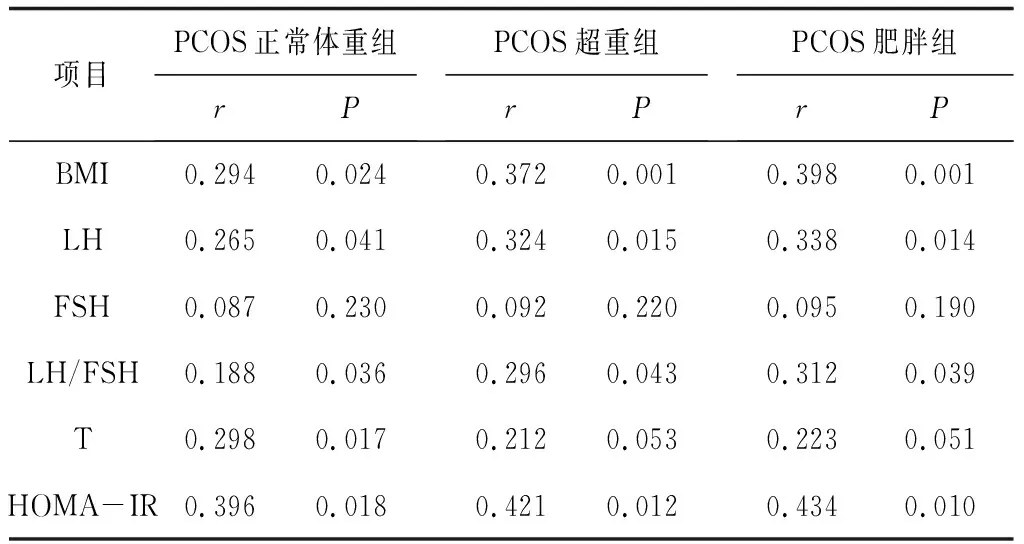
表3 血清AMH水平与PCOS各组各指标的Pearson相关性分析
3 讨 论
目前研究表明,PCOS患者血清AMH水平比正常者高2~3倍,AMH水平与PCOS发病具有潜在相关性[7],甚至可作为诊断PCOS的“金标准”。AMH在卵泡异常发育及排卵障碍中起着关键作用,血清AMH水平对窦卵泡计数(AFC)有显著影响,监测AMH水平可以预测排卵诱导和辅助生殖技术周期期间的卵巢过度刺激综合征 (OHSS)[8-9]。
PCOS患者存在性激素分泌紊乱现象,患者血清LH、T水平明显升高,血清E2、FSH水平明显降低,且血清T水平与胰岛素抵抗有关[10]。FSH和LH是卵泡发育和成熟过程的两种关键激素。在PCOS患者中,AMH通过抑制FSH受体mRNA的表达来影响卵泡对FSH的敏感性,从而抑制FSH刺激卵泡生长[11]。而FSH对小卵泡的调节受损,又使PCOS患者颗粒细胞持续产生高水平的AMH,形成一种不良循环。血清LH水平增高可刺激PCOS患者颗粒细胞中AMH mRNA表达,使得AMH产生增加[12],导致了PCOS患者正常排卵或无排卵的发生机制不同。张旭帆等[13]研究报道,PCOS患者血清AMH水平及LH/FSH明显增高,且血清AMH水平与LH/FSH呈显著正相关。本研究结果显示,PCOS组患者血清AMH、LH、T水平及LH/FSH明显高于健康组,FSH、E2、P水平无明显变化。提示PCOS患者血清高水平AMH可能造成了多囊卵巢卵泡生长和排卵异常,过高的LH对雄激素刺激颗粒细胞产生AMH起协同作用,高水平的AMH诱导了FSH、LH分泌紊乱。过高的LH和LH/FSH促进卵泡膜细胞和间质细胞生成过多的雄激素,排卵前循环中的睾酮过多又可促进非优势卵泡闭锁,使卵泡发育异常[14]。
某些病理情况下性激素水平发生变化会影响机体对胰岛素的敏感性,其中雄激素的活性增高可明显影响葡萄糖以及胰岛素的内环境稳定,降低对胰岛素的敏感性[15];应激状态下机体产生过量的胰岛素,刺激卵巢和肾上腺分泌雄激素,从而加重PCOS患者的高雄激素血症[16],卵泡内高雄激素环境使颗粒细胞产生更多的AMH,其可抑制雄激素向雌激素转化。雄激素可通过活化脂解级联,增加血清游离脂肪酸的释放,影响肌肉的组织结构,诱发胰岛素抵抗。PCOS患者尤其是肥胖者往往合并糖耐量异常或者糖尿病,因而胰岛素抵抗的发生率明显高于普通人群,可达50%~70%[17-18],且葡萄糖代谢受损程度与卵巢功能之间存在相关性[19]。本研究结果显示,PCOS组患者BMI、腰围、腰臀比及血清T、FPG、2hPG、FINS、2hINS、HOMA-IR均明显高于健康组,说明肥胖可造成严重胰岛素抵抗和胰岛β细胞功能受损,葡萄糖代谢受损程度与卵巢功能之间存在相关性。T水平高可能是PCOS患者发胖的直接或间接原因之一,高雄激素环境使颗粒细胞产生更多的AMH,导致脂代谢和糖代谢紊乱,加剧了胰岛素抵抗的发生。
肥胖和PCOS有共同的遗传基础,PCOS与成人BMI、儿童期BMI、腰臀比呈正相关,存在明显的遗传相关性[20]。研究显示,在不同表型肥胖PCOS患者中,血清AMH与BMI、HOMA-IR存在异质性,随着BMI的增加,表现出胰岛素抵抗加重和AMH的分泌紊乱[21]。在 BMI≥25 kg/m2的PCOS女性中,高AMH水平组的HOMA-IR显著高于正常AMH水平组[22]。AMH和高血糖可以上调促凋亡蛋白的表达,参与肥胖PCOS女性胰腺β细胞的病理过程,加速胰岛素抵抗。本研究结果显示,PCOS各组之中AMH与BMI、LH、LH/ FSH 、HOMA-IR均呈正相关关系,且随着BMI的增加相关性更密切,提示PCOS患者控制体重非常重要。
综上所述,AMH参与了PCOS的发生发展,AMH的过量产生导致了胰岛素抵抗,胰岛素抵抗又促进相关激素代谢紊乱产生更多的AMH,二者之间形成恶性循环,故PCOS患者血清中AMH水平可能是胰岛素抵抗的预测因子,AMH水平可作为预测PCOS严重程度的指标。
利益冲突:所有作者均声明不存在利益冲突。

