Caveolin-1调控VEGFR-2对肺癌细胞增殖及侵袭的影响
崔玉洁,杜梦颖,李 硕,李义帅,刘苗苗,张洪珍
(1. 河北省人民医院,河北 石家庄 050000;2. 河北省胸科医院,河北 石家庄 050000)
肺癌的发病率和病死率在全球范围内一直位居前位,其中非小细胞肺癌占肺癌总数的85%以上[1]。手术、放化疗、靶向、免疫等多手段联合治疗已成为提高恶性肿瘤疗效的重要手段,其中抗血管生成靶向治疗是目前的研究热点之一。血管内皮生长因子受体-2(VEGFR-2)与其配体血管内皮生长因子(VEGF)结合后导致酪氨酸激酶域激活,引起下游多条信号通路的活化,而血管内皮生长因子受体酪氨酸激酶抑制剂(VEGFR-TKIs)可竞争性抑制ATP与VEGFR-2激酶域结合,切断下游信号通路的传导,通过强效抑制肿瘤血管生成发挥抗肿瘤作用[2]。多中心的临床研究表明,VEGFR-TKIs如阿帕替尼、安罗替尼等可以改善晚期肺癌患者预后,使其生存显著获益,但临床疗效却不尽相同,且最终都会发生耐药,从而导致预后不良[3-4],这提示可能存在影响VEGFR-2表达及其与VEGFR-TKIs相互作用的因素。小凹蛋白(Caveolin-1,Cav-1)是细胞质膜表面特异性膜内陷囊泡的重要标志性结构,可以和许多蛋白分子结合调控下游的信号通路,进而影响细胞的增殖、黏附、迁移等。目前研究认为Cav-1与肿瘤的发生发展密切相关,与肿瘤细胞的多药耐药及药物敏感性有关[5]。本研究旨在探讨Cav-1通过调控VEGFR-2影响肺癌细胞增殖及侵袭的分子机制,为预测肺癌抗血管生成药物疗效提供新的生物标记物。
1 实验材料与方法
1.1材料与试剂 人肺腺癌H1299细胞,中国科学院上海细胞库;胎牛血清及RPMI 1640培养基,美国Gibco公司;Cav-1 shRNA及阴性对照质粒,美国Santa Cruz公司;转染试剂,美国Invitrogen公司;Transwell小室,美国Corning公司;Matrigel基质胶,美国BD公司;兔抗p-VEGFR2、VEGFR2、p-Akt、Akt、p-Erk、Erk和鼠抗β-actin一抗、抗鼠及抗兔的二抗,美国Cell Signaling公司;酶标仪及CO2培养箱,美国Thermo公司;倒置显微镜,日本Olympus公司;电泳槽,北京市六一仪器厂。
1.2细胞培养与质粒转染 人肺腺癌H1299细胞在含有10%胎牛血清、100 IU/mL青霉素和100 IU/mL链霉素的完全1 640培养基中复苏,置于无菌培养箱(37 ℃、5%CO2)培养。选取处于对数生长期的细胞,胰酶消化后接种于6孔板中,将所接种的细胞分别设置为H1299组(亲本株)、H1299/Ctrl组和H1299/Cav-1 shRNA组。分别将阴性对照质粒和Cav-1 shRNA质粒与转染试剂按比例混合,对H1299/Ctrl组和H1299/Cav-1 shRNA组细胞进行转染,梯度嘌呤霉素进行抗性筛选。H1299组细胞在第5天全部死亡,将H1299/Ctrl组和H1299/Cav-1 shRNA组筛选出的稳定转染细胞扩大培养,分别作为H1299/Ctrl细胞和H1299/Cav-1 shRNA细胞用于后续实验。
1.3稳转细胞系中Cav-1蛋白表达Western blot检测 收集并裂解处于对数生长期的H1299、H1299/Ctrl和H1299/Cav-1 shRNA细胞,提取蛋白并定量分析,制胶电泳并转膜,以β-actin为内参,分别用一抗Cav-1(1∶5 000)、β-actin(1∶2 000)4℃冰箱孵育过夜,相应二抗(1∶5000)室温孵育1h,暗室进行曝光,使用Image J软件扫描条带灰度值。
1.4细胞增殖MTS检测 实验设置H1299/Ctrl组和H1299/Cav-1 shRNA组。将处于对数生长期的H1299/Ctrl和H1299/Cav-1 shRNA细胞消化后离心计数,5 000个/孔接种于96孔板,无胎牛血清的1 640培养基饥饿4 h,每组再分为不加VEGF组和加VEGF组(加入VEGF 50 ng/mL),培养24 h后加入MTT(20 μL/孔),测定各孔吸光度(OD)值,检测细胞的增殖能力。
1.5细胞迁移平板划痕检测 实验设置H1299/Ctrl组和H1299/Cav-1 shRNA组。将处于对数生长期的H1299/Ctrl和H1299/Cav-1 shRNA细胞消化后铺于24孔板,待细胞融合度达70%,用10 μL 移液器吸头进行细胞划痕,PBS清洗漂浮细胞,显微镜下分别拍摄0 h、24 h划痕宽度,利用E尺分析:迁移率=(划痕初始宽度-划痕目前宽度)/2/划痕初始宽度×100%。
1.6细胞侵袭Transwell检测 实验设置H1299/Ctrl组和H1299/Cav-1 shRNA组。将1∶6配制的Matrigel基质胶轻铺入Transwell小室,置于4 ℃冰箱过夜。将对数生长期的H1299/Ctrl和H1299/Cav-1 shRNA细胞消化计数(1×106个/mL,200 μL/孔)铺于上室,分别加入VEGF(50 ng/mL),下室加入600 μL含高浓度血清的1 640培养基,24 h后用预冷的95%乙醇进行细胞固定,常规HE染色,显微镜(200×)下计数穿膜细胞数。
1.7相关通路蛋白表达Western blot检测 实验设置H1299/Ctrl组和H1299/Cav-1 shRNA组,收集细胞前10 min将每组再分为不加VEGF组和加VEGF组(加入VEGF 50 ng/mL)。收集并裂解处于对数生长期的H1299/Ctrl和H1299/Cav-1 shRNA细胞,提取总蛋白并定量分析,制胶电泳并转膜,以β-actin为内参,分别用一抗p-VEGFR2(1∶2 000)、p-Akt(1∶3 000)、p-Erk(1∶3 000)、VEGFR2(1∶2 000)、Akt(1∶4 000)、Erk:(1∶4 000)、Cav-1(1∶5 000)、β-actin(1∶2 000)4 ℃冰箱孵育过夜,相应二抗(1∶5 000)室温孵育1 h,暗室进行曝光,使用Image J软件扫描条带灰度值。
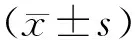
2 结 果
2.1肺癌H1299细胞中Cav-1蛋白表达情况H1299组、H1299/Ctrl组、H1299/Cav-1 shRNA组细胞中Cav-1蛋白相对表达量分别为1.08±0.10,1.16±0.03,0.25±0.02,H1299/Cav-1 shRNA组细胞中Cav-1蛋白相对表达量明显低于H1299组和H1299/Ctrl组(P均<0.05)。见图1。
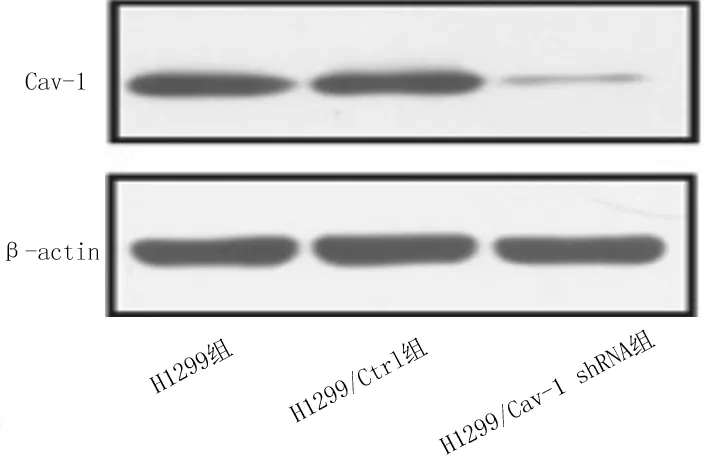
图1 各组肺癌H1299细胞系中Cav-1表达情况
2.2肺癌H1299细胞增殖情况 加或不加VEGF刺激,H1299/Cav-1 shRNA组细胞的OD值均明显低于H1299/Ctrl组(P均<0.05)。见图2。
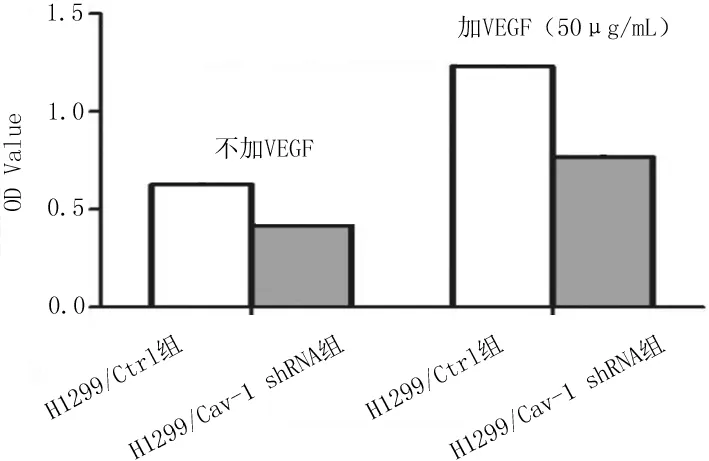
图2 稳定转染各组肺癌H1299细胞增殖能力
2.3肺癌H1299细胞迁移能力 H1299/Cav-1 shRNA组细胞的迁移率为(13.33±3.33)%,明显低于H1299/Ctrl组的(35.02±2.89)%,差异有统计学意义(P<0.05)。见图3。

图3 显微镜下稳定转染各组肺癌H1299细胞迁移情况
2.4肺癌H1299细胞侵袭能力 H1299/Cav-1shRNA组的穿膜细胞数为(56.67±6.19)个,明显少于H1299/Ctrl组的(157.67±14.73)个,差异有统计学意义(P<0.05)。见图4。
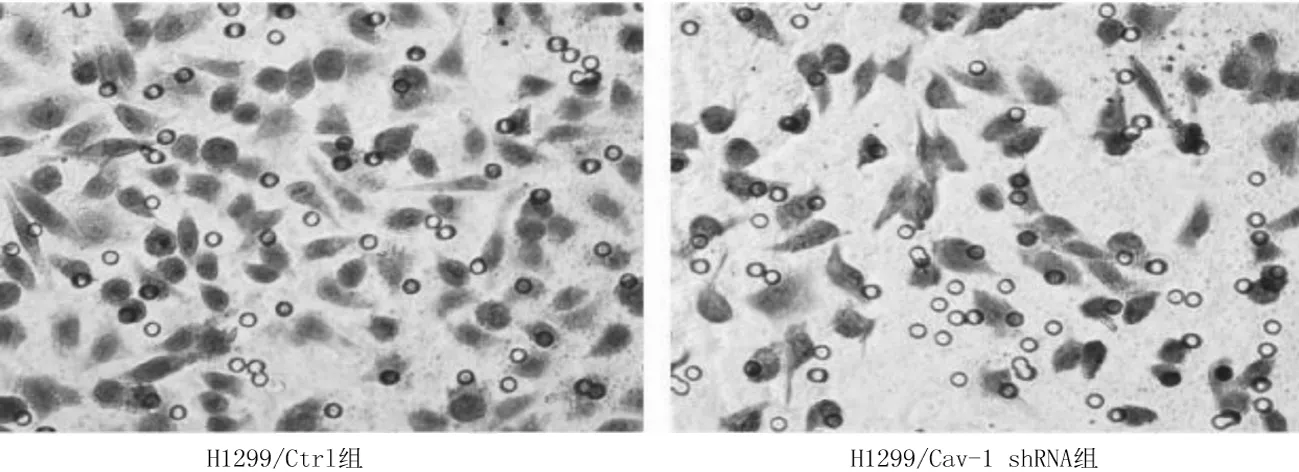
图4 稳定转染各组肺癌H1299细胞侵袭情况(HE染色,×200)
2.5肺癌细胞中相关通路蛋白表达情况 在VEGF刺激下,H1299/Cav-1 shRNA组细胞中p-VEGFR2、p-Akt、p-Erk蛋白相对表达量均明显低于H1299/Ctrl组(P均<0.05),2组细胞中VEGFR2、Akt、Erk蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见图5及表1。
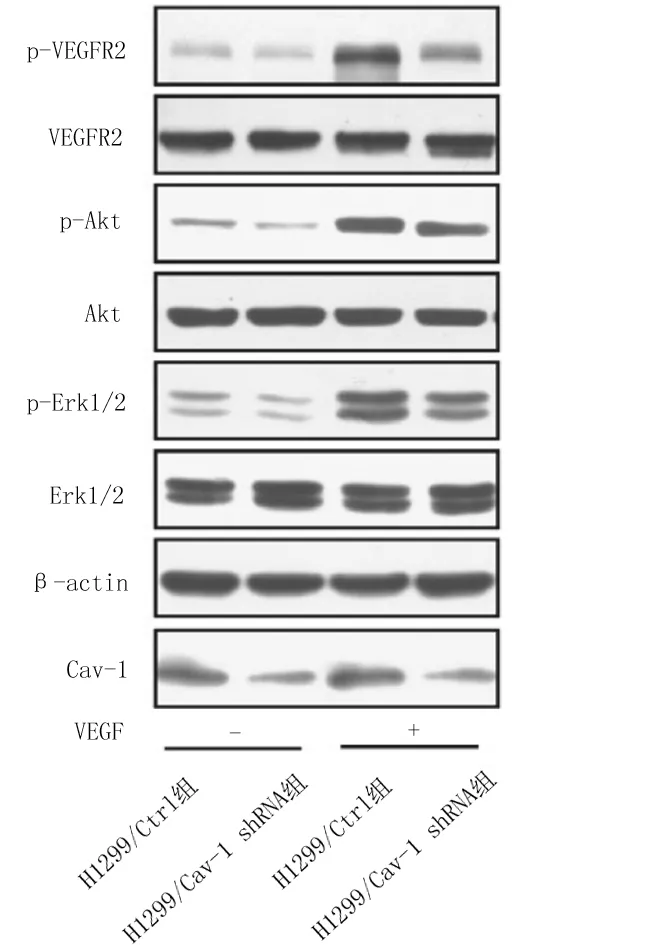
图5 稳定转染各组肺癌H1299细胞中各蛋白表达情况
表1 VEGF刺激时稳定转染各组肺癌H1299细胞中各蛋白相对表达量比较
3 讨 论
目前我国自主研发上市的VEGFR-TKIs药物阿帕替尼、安罗替尼等,无论其单药或与化疗、靶向或免疫药物联用均可使晚期肺癌患者获益[6-7]。但随着VEGFR-TKIs药物的广泛应用,相继出现了如下问题:①不同癌肿之间、相同癌肿不同个体之间的疗效存在差别,无可靠的生物标志物用于预测临床疗效;②部分患者在治疗后延长了无进展生存期,但随后出现耐药。因此发掘调控或逆转耐药的分子机制势在必行。
Cav-1与肿瘤的发生发展呈正相关,其可通过参与TGF-β1信号途径,增强头颈部鳞状细胞癌的侵袭转移能力[8]。在肝癌细胞中,Cav-1不仅可以通过Wnt/β-catenin途径促进肝癌细胞的进展和转移[9],还可通过上调核受体4A2/类维生素aX受体α介导的β-半乳糖苷α2,6-唾液酸转移酶I的表达来促进细胞迁移[10]。Cav-1还可激活PI3K/Akt/mTOR 信号通路促进乳腺癌的运动、侵袭和转移[11]。Caliceti等[12]证实Cav-1与VEGFR2经常共定位,这种相互作用在肿瘤细胞的存活和增殖中发挥着重要调控作用。本实验结果显示,H1299/Cav-1 shRNA组H1299肺腺癌细胞的增殖、迁移和侵袭能力均较H1299/Ctrl组减弱,说明沉默Cav-1的表达减弱了H1299肺腺癌细胞的生物学行为;蛋白表达检测结果显示,VEGF刺激下,H1299/Cav-1 shRNA组p-VEGFR2蛋白表达量明显低于H1299/Ctrl组,而2组VEGFR2蛋白表达量无明显差异,因此猜测其中的分子机制可能是Cav-1通过调控VEGFR2的磷酸化水平,进而影响下游MAPK/Erk及PI3K/Akt信号通路的活化,调控细胞的增殖、迁移、侵袭等一系列生物学行为。
Cav-1还参与调控肿瘤细胞的多药耐药以及药物敏感性环节,且在许多耐药的肿瘤细胞中发现Cav-1高表达[13-14]。在紫杉醇耐药的A549细胞中,沉默Cav-1可以通过增加Bax和减少Bcl-2来诱导细胞凋亡,从而使细胞对紫杉醇敏感[15]。笔者既往的研究也证实,在EGFR敏感突变的PC-9肺腺癌细胞中,敲低Cav-1的表达可以下调EGFR的活化水平,使细胞对吉非替尼和厄洛替尼更加敏感[16]。VEGFR-TKIs药物作用机制明确,但在临床应用过程中,一些患者对其不敏感或先敏感后耐药,说明有些特殊的蛋白影响了VEGFR-2的磷酸化和(或)VEGFR-TKIs与VEGFR-2相互结合。本实验结果提示,Cav-1可能通过调控VEGFR-2的磷酸化进而影响VEGFR-TKIs药物的敏感性,但具体的机制有待进一步研究证实。
综上所述,Cav-1可通过调控VEGFR-2的磷酸化水平影响肺癌细胞的增殖及侵袭,为预测肺癌抗血管生成药物疗效提供了新的生物标记物。后续需要进一步构建过表达Cav-1的细胞株进行正反论证以及药物干预和动物实验等整体研究,以为肺癌的治疗提供更有利的理论依据。
利益冲突:所有作者均声明不存在利益冲突。

