夜蛾黑卵蜂转录组及化学感受相关基因的分析
周 婉,徐 琢,杨文俊,毛 燕,盛龙玉,杜军利,武德功,王增霞*,黄保宏*
(1.安徽科技学院资源与环境学院,滁州 233100;2.安徽科技学院农学院,滁州 233100)
草地贪夜蛾Spodopterafrugiperda,是一种全球暴发性害虫,具有寄主广、迁飞快、繁殖能力强等特点[1-2]。该虫2019年入侵我国,目前已在我国完成定殖且周年常态化发生[3]。在2020年农业农村部公布的一类农作物病虫害名录中草地贪夜蛾位居首位,严重威胁我国玉米产业的发展。目前,其防治主要依赖化学农药,不仅可能使草地贪夜蛾产生抗性,还会对非靶标生物和环境造成危害。生物防治作为草地贪夜蛾长期可持续防控策略的有效手段之一,尤其是寄生蜂的应用,具有很好的应用前景。
夜蛾黑卵蜂TelenomusremusNixon属膜翅目Hymenoptera,广腹细蜂科Platygastridae,是草地贪夜蛾的优势卵寄生天敌[4-6]。南美、拉丁美洲国家利用夜蛾黑卵蜂防治草地贪夜蛾已经取得了较好的效果[7-8]。前期研究发现,夜蛾黑卵蜂在我国广东、海南、贵州等省均有分布[4,9-11]。国内实验室已成功实现该蜂的人工繁殖,利用夜蛾黑卵蜂等天敌昆虫对草地贪夜蛾进行长期防控将丰富重大农业害虫生物防治的手段。
化学感受系统是昆虫在复杂环境中准确识别挥发物、定位宿主和交配产卵的重要工具。在寄生蜂寄主选择、性信息素识别、交配和产卵寄生等行为中,都有化学感受系统参与[11-15]。开展寄生蜂化学感受蛋白相关基因的鉴定和表达规律研究,对提高寄生蜂寄主定位和寄生效率,提高生防效果至关重要。
随着全基因组测序和生物信息学的发展,转录组测序在生物防治领域的应用也越来越广泛。昆虫体内多种化学感受蛋白和受体基因被挖掘,主要包括气味结合蛋白(odorant binding proteins,OBPs)、化学感受蛋白(chemosensory proteins,CSPs)、味觉受体(gustatory receptors,GRs)、离子型受体(ionotropic receptors,IRs)和气味受体(odorant receptors,ORs)等。自2007年在管氏肿腿蜂Sclerodermaguani中发现OBP和CSP基因以来[16],有少数寄生蜂的化学感受基因被鉴定出来[16-20]。化学感受蛋白在寄生蜂寄主搜寻、性信息素识别和产卵寄生中的功能也陆续被报道[21-22]。关于夜蛾黑卵蜂生物学已开展了一些基础性研究,然而针对夜蛾黑卵蜂化学识别机制方面的研究未见报道。
本研究使用高通量测序技术对夜蛾黑卵蜂雌、雄成虫头部、腹部转录组进行测序,采用生物信息学对其基因进行鉴定和功能注释,挖掘化学感受相关基因进行系统发育分析,并利用实时荧光定量PCR对差异表达基因在雌、雄成虫头部和腹部的表达模式进行分析。研究结果旨在了解夜蛾黑卵蜂化学识别机制,进而研发夜蛾黑卵蜂的天敌引诱剂,提高其在田间的寄生效率,使其在生物防治中发挥更大作用。
1 材料与方法
1.1 供试昆虫
本试验所用的夜蛾黑卵蜂采集自安徽省凤阳县周边玉米田(117.56°E,32.86°N),饲养于安徽科技学院种植园养虫室内的人工气候箱内。饲养条件为:温度(24±1)℃、相对湿度(80±5)%、光周期L∥D=16 h∥8 h。将新鲜草地贪夜蛾卵块置于试管内供其产卵,并用10%蜂蜜水饲喂,待夜蛾黑卵蜂成虫羽化后1 d,取雌、雄成虫头部和腹部立即置于液氮中,并置于-80℃超低温冰箱保存。
1.2 总RNA的提取和检测
取夜蛾黑卵蜂雌、雄成虫头部(雌:FT1~FT3;雄:MT1~MT3)和腹部(雌:FF1~FF3;雄:MF1~MF3)共12个样品采用TRIzol法提取总RNA。用1%琼脂糖凝胶电泳检测RNA质量,Nanodrop检测RNA纯度,并用Agilent 2100 bioanalyzer检测RNA完整性。将各组织检测合格的3个RNA样品混合,合并为4个不同组织的RNA样品,送至北京诺禾致源科技股份有限公司进行转录组测序分析。
1.3 转录组数据的拼接和组装
测序得到的原始数据在去除序列接头、低质量reads和无法确定碱基信息的reads后,获得高质量的clean reads,并利用Trinity (Trinity-v 2.5.1)软件进行拼接。采用BUSCO软件对拼接得到的Trinity.fasta,unigene.fasta和cluster.fasta进行拼接质量的评估,根据GC比例和unigene序列的完整性来评价拼接结果的准确性和完整性。
1.4 转录组数据分析及化学感受相关基因分析
通过NR、NT、KO、KOG、Swiss-Prot、PFAM和GO等7个数据库构建参考蛋白序列库。使用Blastp对夜蛾黑卵蜂的蛋白序列进行同源性比对,最后进行结构域比对获得含有基因功能注释的转录本。
1.5 差异表达基因分析
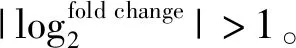
1.6 化学感受相关基因鉴定及进化树分析
根据寄生蜂化学感受基因的氨基酸序列构建系统进化树,从GenBank下载膜翅目昆虫管氏肿腿蜂、中红侧沟茧蜂Microplitismediator、斑痣悬茧蜂Meteoruspulchricornis、丽蝇蛹集金小蜂Nasoniavitripennis、意大利蜜蜂Apismellifera的化学感受相关基因的氨基酸序列。用MAFFT(https:∥www.ebi.ac.uk/Tools/msa/mafft/),FFT-NS-I迭代法和JT200评分矩阵对候选基因的氨基酸序列进行比对,通过MEGA邻接法构建系统发育树,并用Figtree进一步编辑修饰进化树。
1.7 实时荧光定量PCR分析
根据荧光定量PCR试剂盒的说明书对夜蛾黑卵蜂雌、雄成虫头部和腹部候选化学感受基因的表达情况进行分析,每个样品3个生物学重复。20 μL反应体系包含cDNA模板1 μL,10 mmol/L上、下游引物各1 μL,2×SYBR®Green Mix染料10 μL,ddH2O 7 μL。使用ViiA 7设备进行real time PCR检测,反应程序如下:95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min。以夜蛾黑卵蜂的18S rRNA和RPL12基因作为内参基因。使用Premier 5.0设计夜蛾黑卵蜂候选化学感受基因以及内参基因的特异性引物(表1)。采用 2-△△Ct相对定量法计算候选基因的相对表达量,并利用SPSS 21.0进行差异显著性分析。
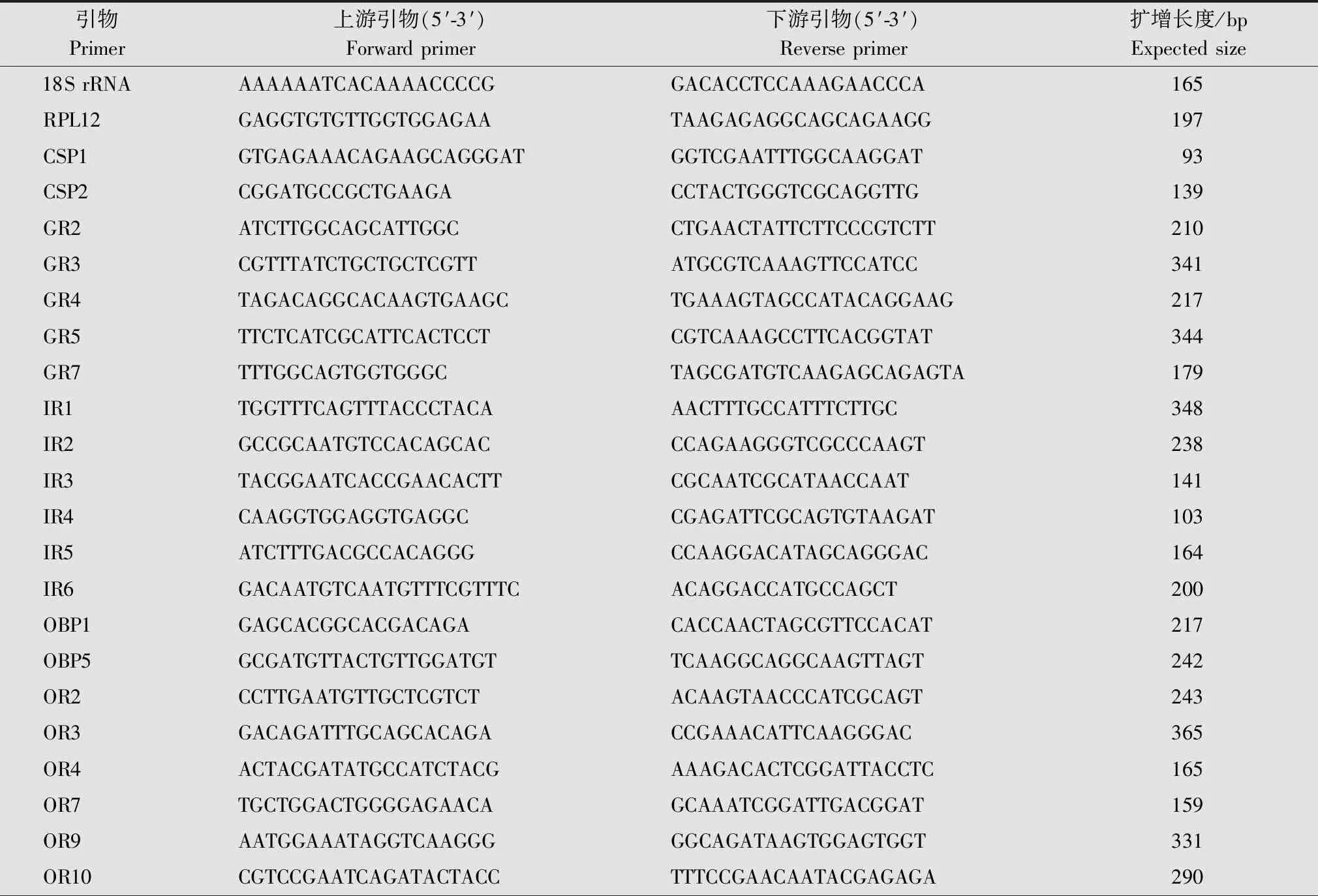
表1 夜蛾黑卵蜂化学感受基因的实时荧光定量PCR特异性引物Table 1 Specific primers for real time quantitative PCR of chemosensory-related genes of Telenomus remus

续表1 Table 1(Continued)
2 结果与分析
2.1 夜蛾黑卵蜂转录组测序和数据组装
对夜蛾黑卵蜂雌、雄成虫头部和腹部进行转录组测序,去除低质量和含有接头的reads后,得到88 178 564 条clean reads。数据显示,GC含量为38.95%~44.11%,Q30均不小于92.83%(表2)。利用Trinity软件对clean reads进行组装拼接、同源聚类分析后,共得到16 238条unigenes,总核苷酸长度为36 285 157 bp,N50长度为4 944 bp,平均长度为2 235 bp。
2.2 夜蛾黑卵蜂unigenes基因功能注释
对获得的unigenes序列进行BLAST序列比对,最终获得16 238条注释信息。其中NR数据库注释到8 944条,NT数据库注释到4 220条,KO数据库注释到4 936条,KOG数据库注释到4 753条,PFAM数据库注释到7 918条,GO数据库注释到7 917条,Swiss-Prot数据库注释到7 252条。
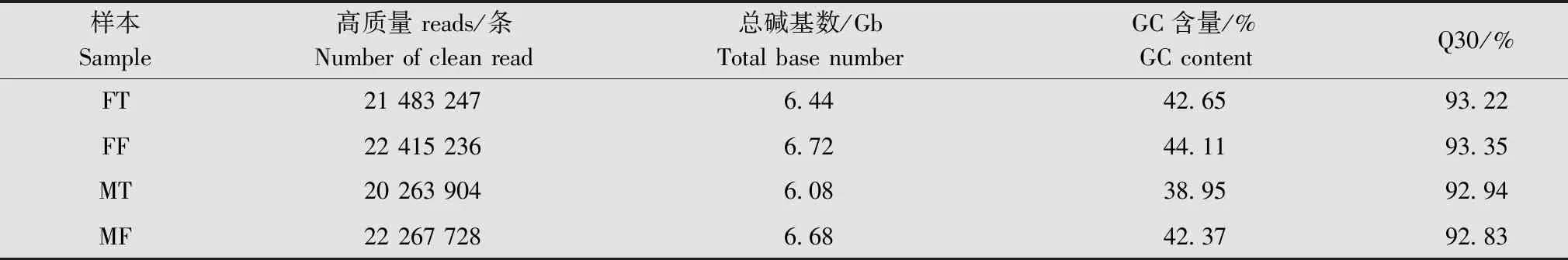
表2 夜蛾黑卵蜂4个样本的转录组序列输出数据1)Table 2 Sequence output data of four samples of Telenomus remus
2.3 夜蛾黑卵蜂unigenes基因功能分类
GO数据库中将夜蛾黑卵蜂基因功能归为3个类别:分子功能(molecular function)、细胞组分(cellular component)和生物进程(biological processes),其中参与生物进程的unigenes数量最多。在分子功能中,参与结合功能(4 925个)和催化活性(3 542个)的unigenes数量最多;在细胞组分中,参与最多的是细胞解剖实体(4 314个)的unigenes数量,其次是胞内组分(2 647个)和蛋白复合物(1 914个)的unigenes数量;在生物学进程中,最主要的是参与细胞内过程(5 124个)和代谢过程(4 479个)的unigenes(图1)。

图1 夜蛾黑卵蜂unigenes的GO分类Fig.1 Gene ontology classifications of the Telenomus remus unigenes
2.4 夜蛾黑卵蜂差异表达基因分析
通过对夜蛾黑卵蜂雌、雄虫不同组织差异表达基因(DEGs)进行分析,共获得5 862个差异基因。其中雄虫头部与雌虫头部相比,上调基因212个,下调基因1 116个;雄虫腹部与雌虫腹部相比,上调基因2 153个,下调基因2 740个。在各组织中筛选到具有显著差异表达的化学感受相关基因39个(表3)。大部分化学感受相关基因在雌、雄成虫头部高表达,说明头部是寄生蜂感受信息的主要器官,而IR2和OBP4表现出不同的表达模式,在雄虫腹部高表达,说明这2个基因可能在昆虫的交配行为中发挥作用;且大部分化学感受基因在雄虫头部的表达量比雌虫高,这与雌雄虫的特异性生理和行为有关,这些高表达的基因可能参与识别雌虫释放的性信息素等过程。

表3 夜蛾黑卵蜂化学感受相关基因的差异表达分析Table 3 DEG analysis of chemosensory-related genes in Telenomus remus

续表3 Table 3(Continued)
2.5 化学感受相关基因鉴定与进化分析
在NR数据库中对夜蛾黑卵蜂转录组数据进行分析,共筛选到62个化学感受相关基因。生物信息学分析结果表明,包含5个OBPs、2个CSPs、7个GRs、42个ORs和6个IRs。
2.5.1气味结合蛋白
从夜蛾黑卵蜂转录组数据中筛选到5个候选气味结合蛋白,其中3个是全长序列(OBP1、OBP4、OBP5),包含完整的开放阅读框(complete open reading frames,ORFs),尽管有2个TremOBPs(OBP2、OBP3)不具有完整的ORF,但具有跨膜结构。在所有候选TremOBPs中,氨基酸的编码范围为291~474 aa。进化分析结果表明,夜蛾黑卵蜂OBPs多与丽蝇蛹集金小蜂成簇聚集(图2)。
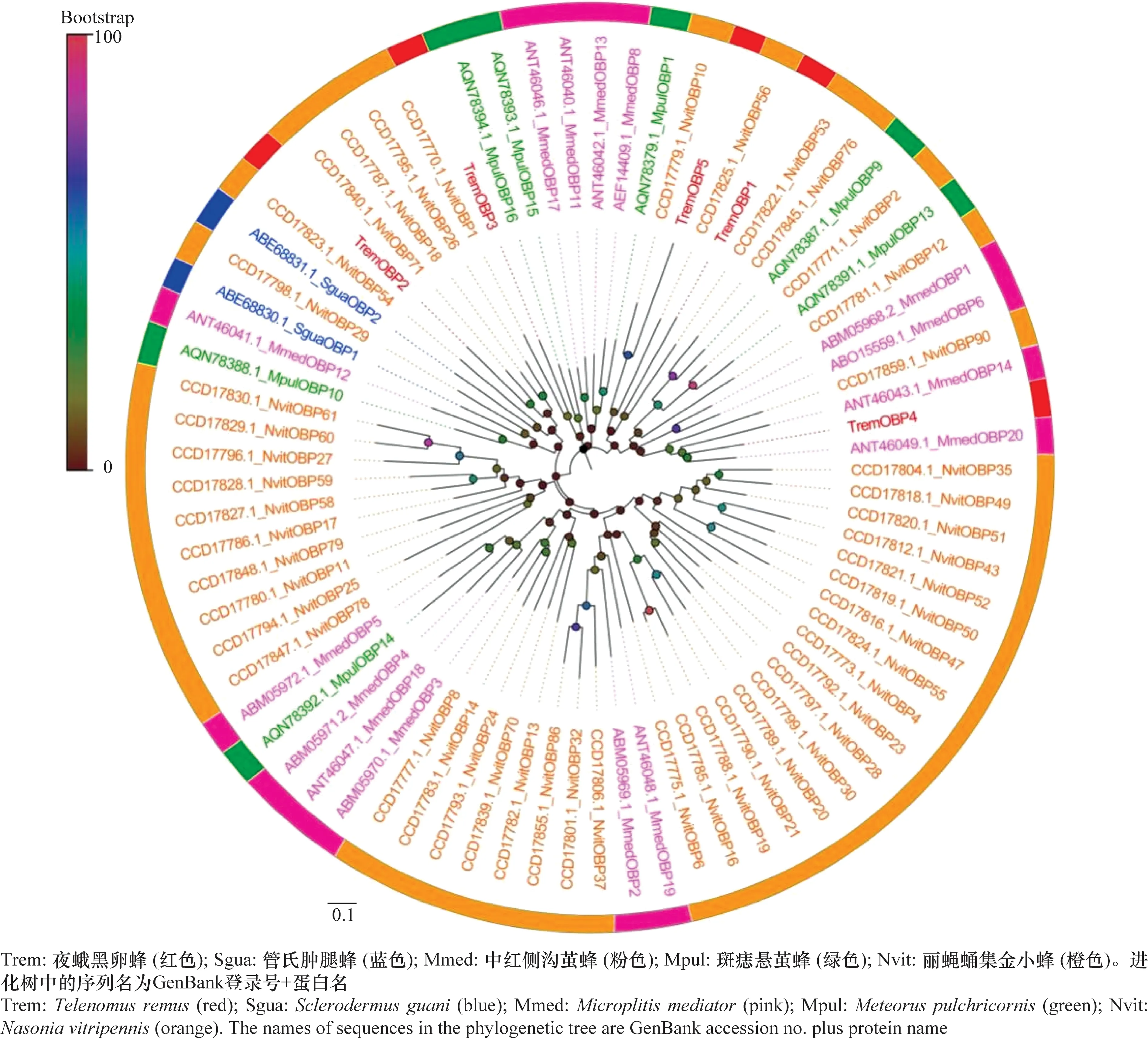
图2 夜蛾黑卵蜂候选气味结合蛋白的进化分析Fig.2 Phylogenetic analysis of candidate odorant binding proteins in Telenomus remus
2.5.2化学感受蛋白
从夜蛾黑卵蜂转录组数据中鉴定到2个候选CSPs,少于斑痣悬茧蜂中鉴定得到的6个CSPs。氨基酸编码范围为231~372 aa,其中CSP2具有1个跨膜结构。系统进化分析表明,TremCSP1与斑痣悬茧蜂聚成一簇,TremCSP2与意大利蜜蜂和斑痣悬茧蜂成簇聚集在一起(图3)。
2.5.3气味受体
从夜蛾黑卵蜂转录组数据中筛选到42个候选ORs,其氨基酸编码范围为315~1 464 aa,其中TremOR13、TremOR24、TremOR31、TremOR36和TremOR40具有信号肽。同源性比对显示,TremOR37与棉铃虫齿唇姬蜂CampoletischlorideaeCchlOr-co具有较高的相似性(81.84%)。系统进化分析表明,ORs在种间高度分化,并且同一物种的ORs形成单簇分支,TremORs在各个分支中均有出现,并在其中两个小分支出现成簇聚集,推测ORs在夜蛾黑卵蜂种间特异性较高(图4)。
2.5.4味觉受体
从夜蛾黑卵蜂转录组数据中筛选到7个候选GRs,其氨基酸编码范围为315~1 608 aa,其中1个GR(TremGR1)具有信号肽。同源性序列比对显示TremGR6与多胚跳小蜂Copidosomafloridanum的糖味受体有较高的相似性。系统进化分析显示,TremGRs趋向于成簇聚集,TremGR6与意大利蜜蜂AmelGR43a聚为一支(图5)。

图3 夜蛾黑卵蜂候选化学感受蛋白的进化分析Fig.3 Phylogenetic analysis of candidate chemosensory proteins in Telenomus remus
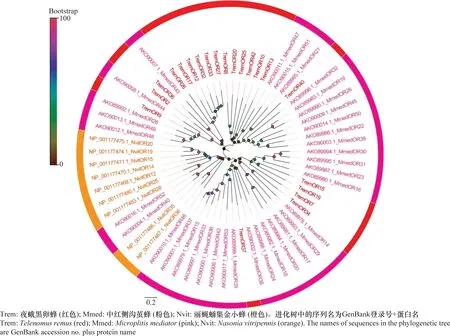
图4 夜蛾黑卵蜂候选气味受体的进化分析Fig.4 Phylogenetic analysis of candidate odorant receptors in Telenomus remus
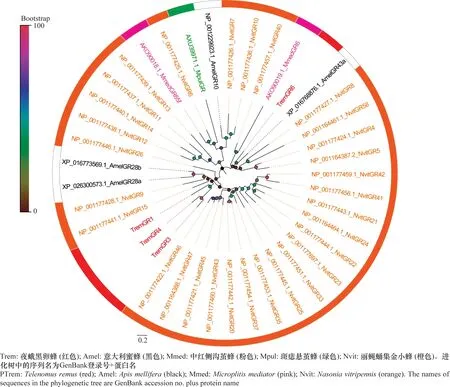
图5 夜蛾黑卵蜂候选味觉受体进化分析Fig.5 Phylogenetic analysis of candidate gustatory receptors in Telenomus remus
2.5.5离子型受体
从夜蛾黑卵蜂转录组数据中共鉴定到6个候选IRs,序列片段完整性差异大且均不具有信号肽,氨基酸编码范围为267~1 581 aa。另外,除TremIR1外,其他5个IRs与膜翅目昆虫有较高的相似性。在系统发育进化树中,TremIRs与中红侧沟茧蜂或斑痣悬茧蜂聚为一支,TremIR2与IR76b亚家族集群为一支(图6)。
2.6 化学感受相关基因表达谱分析
为进一步明确差异表达化学感受基因在雌、雄成虫头部和腹部的表达谱,采用实时荧光定量PCR分析化学感受相关基因在雌、雄成虫头部和腹部的相对表达量(图7)。结果表明,夜蛾黑卵蜂的化学感受相关基因主要在成虫头部高表达,而CSP1在成虫腹部表达量显著高于头部,IR1和OR12在雌虫腹部表达量显著高于头部。除组织特异性表达外,部分基因还表现出性别表达差异,例如GR3、GR7、IR3、IR4、OR2、OR3、OR9、OR11、OR12、OR13、OR16、OR17、OR25、OR26、OR27、OR31、OR32、OR35、OR41、OR42在雄虫头部的表达水平显著高于雌虫(P<0.05),而GR2、GR4、GR5、OBP5、OR4、OR10、OR33、OR37在雌虫头部的表达显著高于雄虫(P<0.05),这些结果与FPKM值分析趋势基本一致。
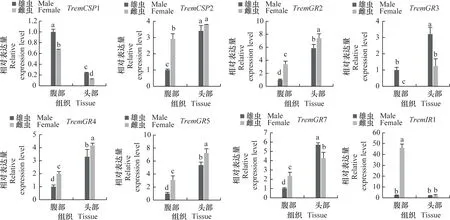
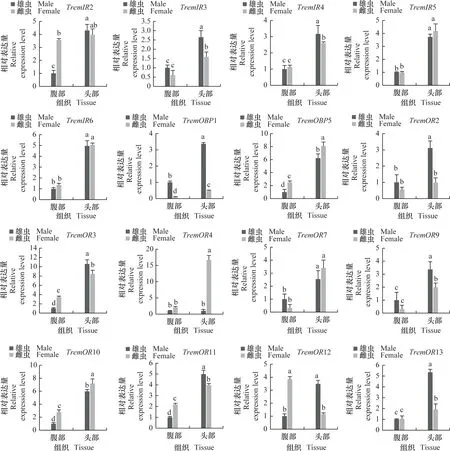

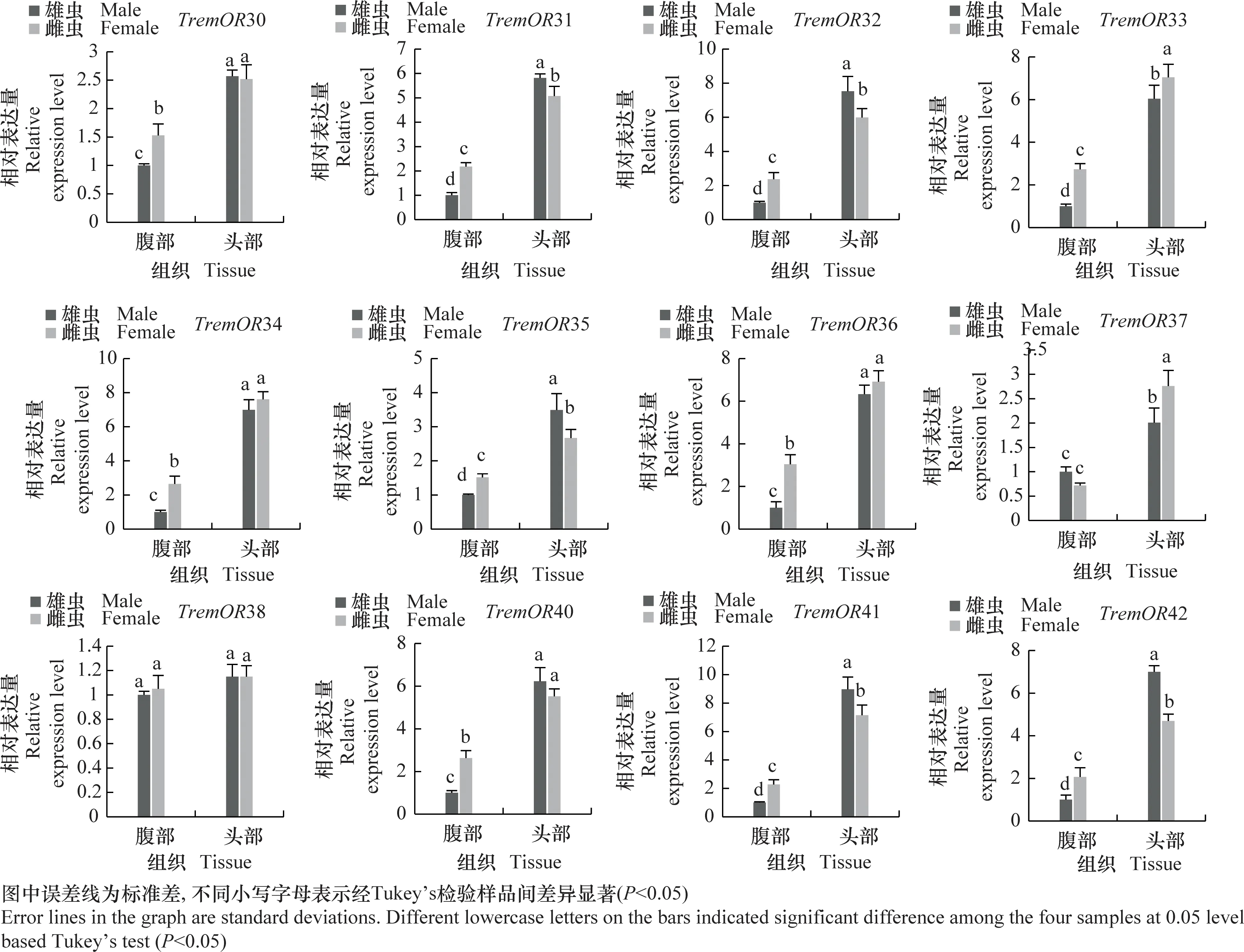
图7 夜蛾黑卵蜂化学感受相关基因的组织表达谱分析Fig.7 Tissue expression analysis of chemosensory-related genes in Telenomus remus
3 结论与讨论
化学感受系统在寄生蜂识别寄主、定位寄主、交配产卵和寄生等过程中发挥着重要作用。研究寄生蜂化学感受相关基因有助于深入了解其化学感受机制,进而为开发天敌引诱剂提供理论基础。随着基因组学、转录组学的快速发展,研究人员分别从丽蝇蛹集金小蜂、烟蚜茧蜂Aphidiusgifuensis、腰带长体茧蜂Macrocentruscingulum、蝶蛹金小蜂Pteromaluspuparum等寄生蜂触角转录组中鉴定到OBPs、CSPs、ORs、GRs和IRs等基因[16-26]。本研究通过Illumina Novaseq 6000高通量测序平台对夜蛾黑卵蜂的头部和腹部分别进行转录组测序分析。共获得16 238条unigenes,完整unigenes的占比为92.8%,说明本研究获得的测序数据和组装结果较好。将获得的unigenes序列进行功能注释和生物信息学分析,结果表明,夜蛾黑卵蜂unigenes序列与丽蝇蛹集金小蜂、斑痣悬茧蜂等其他膜翅目昆虫的序列相似性较高。从转录组数据中共挖掘到62个化学感受相关基因,包括42个ORs,5个OBPs,2个CSPs,7个GRs和6个IRs。与其他寄生蜂中鉴定的基因相比[27],数量偏少,但处于合理范围。由于夜蛾黑卵蜂体型较小,对触角、口针等特定组织解剖难度较大。因此本研究中夜蛾黑卵蜂转录组测序采用的是雌雄成虫头部和腹部组织,导致部分在触角、口针等组织低丰度表达的化学感受基因没有被鉴定到。
在膜翅目寄生蜂中大部分嗅觉基因呈现性别-组织的特异性表达谱。管氏肿腿蜂的OBP1和OBP2、中红侧沟茧蜂OBP1、菜蛾盘绒茧蜂Cotesiavestalis的OBP4和OBP7等在触角中高表达或特异性表达[28-30]。本研究中 DEGs分析表明,夜蛾黑卵蜂大部分嗅觉基因在雌、雄成虫头部高表达,说明头部组织中含有丰富的化学感受基因,在寄生蜂搜寻寄主、识别寄主等行为中发挥重要作用。除头部外,个别基因也在其他组织中高表达,如IR1和OR12在雌虫腹部的表达均高于头部。系统进化分析显示,TremIR2与中红侧沟茧蜂和斑痣悬茧蜂的IR76聚为一支。该类基因在不同寄生蜂间相对保守,主要参与胺类物质的识别,推测TremIR2基因可能具有类似功能[31]。CSP1在雄虫腹部的表达显著高于雌虫,该基因可能参与寄生蜂的交配及子代性别分配等过程。除组织特异性表达外,大部分化学感受基因呈现性别差异性表达。如白蛾周氏啮小蜂Chouioiacunea中8个OBPs,14个ORs,8个GRs等都在雌虫中高表达[32],这些在雌虫中高表达的基因可能在其寻找合适的寄主和产卵部位中发挥作用。本研究中,RNAseq和qPCR分析均表明,夜蛾黑卵蜂化学感受相关基因在雄虫不同组织中高表达的基因数量显著多于雌虫,仅部分OR基因在雌虫头部表达量较高。在雄虫头部高表达的基因,可能参与雌性性信息素的识别及交配等过程。
各种信息化合物在寄生蜂搜寻寄主、识别寄主和交配产卵的过程中发挥着重要的调节作用,因此,寄生蜂化学感受基因与寄生蜂在生防中的作用密切相关。夜蛾黑卵蜂作为多种鳞翅目夜蛾科害虫卵期重要的寄生性天敌,基于转录组筛选获得的候选基因为从分子水平上研究害虫-植物-寄生蜂相互作用提供宝贵的基因资源。研究结果表明,夜蛾黑卵蜂化学感受相关基因在雌、雄成虫不同组织表达存在着显著差异,推测这些基因在寄主识别、寄主定位、交配产卵和求偶觅食中发挥不同的作用。可以作为潜在的开发引诱剂的靶标基因,为后续夜蛾黑卵蜂化学生态学分子机制的深入研究,进而为利用其防控草地贪夜蛾等鳞翅目害虫提供参考。

