成熟期不同橄榄品种(系)果实代谢组及其差异
蔡净蓉,王 杰,赵俊跃,潘腾飞,郭志雄*,佘文琴*
成熟期不同橄榄品种(系)果实代谢组及其差异
蔡净蓉1,2,王 杰1,2,赵俊跃1,2,潘腾飞1,2,郭志雄1,2*,佘文琴1,2*
1. 福建农林大学园艺学院,福建福州 350002;2. 福建农林大学园艺产品贮藏保鲜研究所,福建福州 350002
橄榄果实风味独特,富含多酚、黄酮、氨基酸等多种生理活性物质,这些物质与其风味品质关系密切。目前对橄榄果实代谢物进行系统研究的报道较少,为解析橄榄果实的主要代谢成分并对3个品质类型存在差异的品种(系)(‘长营’‘檀香’‘灵峰’)进行比较,以期为橄榄果实品质形成、优良品种选育等研究提供理论基础。采用超高效液相色谱-串联质谱(UPLC-MS/MS)的广泛靶向代谢组技术,测定3个橄榄品种(系)成熟期果实代谢物,并结合多元统计分析方法及3个品种(系)果实总酚、总黄酮、木质素含量数据进行分析,结果表明:‘檀香’总酚、总黄酮含量最高;‘灵峰’总酚、总黄酮及木质素含量最低;‘长营’总木质素含量则很高,与其化渣差的特点相吻合。利用广泛靶向代谢组学技术共检测出黄酮、酚酸类、氨基酸及其衍生物、有机酸、脂质、核苷酸及其衍生物、鞣质、糖及醇类、木质素和香豆素等13类524种代谢物,其中黄酮类代谢物数量最多,主要为槲皮素类、木犀草素类和山奈酚类。各品种(系)代谢物差异显著,主要的差异代谢物为黄酮类、酚酸类和氨基酸及其衍生物。‘长营’相比‘檀香’存在161种差异代谢物(上调代谢物116种、下调代谢物45种),‘檀香’相比‘灵峰’存在164种差异代谢物(上调代谢物51种、下调代谢物113种);‘长营’相比‘灵峰’存在146种差异代谢物(上调代谢物51种、下调代谢物95种)。差异代谢物KEGG通路富集分析发现,3个品种(系)中,‘檀香’的黄酮代谢及氨基酸代谢最为活跃,积累更多的槲皮素类、木犀草素类、山奈酚类、丙氨酸、丝氨酸、组氨酸、苯丙氨酸、酪氨酸等黄酮及氨基酸类物质;‘灵峰’较‘长营’的黄酮代谢相对较弱,黄酮类物质积累相对较少,这可能是造成‘檀香’橄榄风味更为浓厚,而‘灵峰’橄榄风味较为清甜的原因之一。
橄榄;成熟期;代谢组学;差异代谢物;黄酮
橄榄[(Lour.) Raeusch.],又名青榄、青果等,属于橄榄科(Burseraceae)橄榄属常绿乔木,是我国南方特色经济果品[1],在福建、广东地区均有广泛栽培。橄榄风味独特,营养丰富,富含多酚、黄酮、多糖、氨基酸、膳食纤维等多种营养元素[2],是著名的药食两用果品,具有解酒护肝[3]、降脂[4]、消炎止痛[5]、抑菌[6]等多种功效。
橄榄品种资源丰富,可以分为加工型橄榄和鲜食型橄榄。‘长营’为传统的加工品种,果实质地粗糙且较硬,果肉纤维多,化渣差,味淡且涩;‘檀香’为传统鲜食品种,果实风味浓郁,味香质脆,纤维少,化渣好,食后回味极好[7];近年来,在福建省橄榄产区,选育出‘灵峰’‘清榄1号’和‘梅埔2号’等多个优良鲜食株系,其果实总体表现为质地细腻,化渣好,无涩,口味清甜等特性[8],橄榄的不同品种之间果实风味类型差异明显。
代谢组学利用高通量化学分析技术对植物特定组织中整体代谢水平进行检测,已在苹果[9]、柑橘[10]、葡萄[11]、猕猴桃[12]等园艺植物上开展了大量试验,可用于代谢物的积累模式,风味品质形成,遗传基础等研究提供参考依据。目前对于橄榄果实代谢物的研究包括糖酸[13]、多酚[14]、氨基酸[15]以及挥发性物质[16-17],但从代谢组学的角度系统研究不同橄榄品种果实代谢物的报道较少[18]。
本研究以‘长营’‘檀香’‘灵峰’为试材,采用广泛靶向代谢组学技术,测定其成熟期果实代谢物,识别差异代谢物,以期为探究不同品种(系)橄榄风味形成,品种改良以及资源利用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 试验材料‘长营’(CY)、‘檀香’(TX)、‘灵峰’(LF)果实样品均于果实成熟期(花后150 d,2019年10月下旬)取样,采自福建省福州市闽清县大溪石印山橄榄专业合作社甜橄榄基地(118°86′E,26°29′N)。每个品种(系)选择3株生长健壮、无病虫害,且其生境和栽培管理措施均一致的十年生树,沿每株树树冠的赤道面均匀摘取15个果实。采收当天运回实验室,将每个品种(系)果实均匀分成3份(即为3次生物重复);果实去核切片、混匀,用锡箔纸包裹,液氮冻存后放于–80℃超低温冰箱保存。甲醇、乙腈、乙醇(均为色谱纯)购自Merck公司;标准品(色谱纯)购自BioBioPha公司或Sigma-Aldrich公司。
1.1.2 仪器与设备 冻干机(Scientz-100F,宁波新芝),研磨仪(MM 400,德国Retsch),超高效液相色谱(UPLC,Shim-pack UFLC SHIMADZU CBM30A,日本岛津),串联质谱(MS/MS, Applied Biosystems 4500 QTRAP,美国Applied Biosystems)。
1.2 方法
1.2.1 总酚、总黄酮、木质素含量的测定 总酚、总黄酮、木质素提取与测定分别参照林玉芳[19]、谢晓琼[20]、鞠志国等[21]的方法,略有改动。
1.2.2 样品制备 将超低温保存的橄榄样品进行真空冷冻干燥,用研磨仪研磨(30 Hz,1.5 mim)至粉末状;精确称取100 mg的粉末,加入0.6 mL 70%甲醇进行提取;溶解后于4℃冰箱过夜,期间涡旋6次,以提高提取率;10 000 r/min离心,吸取上清液,用0.22 μm微孔滤膜过滤,并保存于进样瓶中,用于UPLC-MS/MS分析。
1.2.3 超高效液相色谱-串联质谱分析 色谱条件为色谱柱:Agilent SB-C18(1.8 µm,2.1 mm× 100 mm);流动相:A相为超纯水(含0.1%的甲酸),B相为乙腈;洗脱梯度:0~9.00 min 95%~ 5%A、5%~95%B,9.00~10.00 min 5%A、95%B,10.00~11.10 min 5%~95%A、95%~5%B,11.10~ 14.00 min 95%A、5%B;流速:0.35 mL/min;柱温40℃;进样量4 μL。
质谱条件主要包括:电喷雾离子源(ESI)温度为550℃,质谱电压5500 V,帘气(CUR)为30 psi,碰撞诱导电离(CAD)参数设置为高。
1.3 数据处理
基于迈维(武汉)生物技术有限公司自建MVDBV 2.0数据库及代谢物公共数据库,根据二级谱信息进行物质定性,通过三重四级杆质谱的多反应监测模式(MRM)对代谢物进行定量,得到不同样本的代谢物质谱并对其质谱峰峰面积积分,最后对不同样本中的同一代谢物的质谱出峰进行积分校正,利用Analyst 1.6.3软件处理质谱数据,Excel 2016软件进行数据整理。
对3个橄榄品种(系)果实代谢物进行两两比较,分别记为‘长营’vs‘檀香’、‘檀香’vs‘灵峰’、‘长营’vs‘灵峰’。通过多元统计分析方法进行主成分分析(PCA)、层次聚类分析(HCA)、正交偏最小乘判别分析(OPLS-DA)初步分析3个橄榄品种(系)果实间的代谢特征。根据OPLS-DA模型的变量重要性投影(variable importance in projection,VIP)≥1.0并结合差异倍数(fold change,FC)值≥2.0(上调)或≤0.5(下调)筛选出差异代谢物。利用TBtools(v1.098)软件进行热图绘制。根据KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对相应差异代谢物进行相关通路分析,最后采用SPSS 22.0软件以Duncan’s法评估主要代谢物含量的差异显著性。
2 结果与分析
2.1 不同橄榄品种(系)果实总酚、总黄酮及木质素含量的差异
3个橄榄品种(系)果实的风味及质地具有明显区别,通过测定其成熟期果实的总酚、总黄酮及总木质素含量,结果表明:‘檀香’的总酚和总黄酮含量显著高于‘长营’和‘灵峰’,‘灵峰’的总酚和总黄酮含量最低,仅为‘檀香’的67.96%和78.11%;‘长营’的木质素含量很高,分别为‘檀香’的2.34倍,‘灵峰’的4.18倍(表1)。

表1 3个橄榄品种(系)果实总酚、总黄酮及木质素含量
注:不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters indicate significant difference among treatments (<0.05).
2.2 不同橄榄品种(系)果实代谢组成分分析
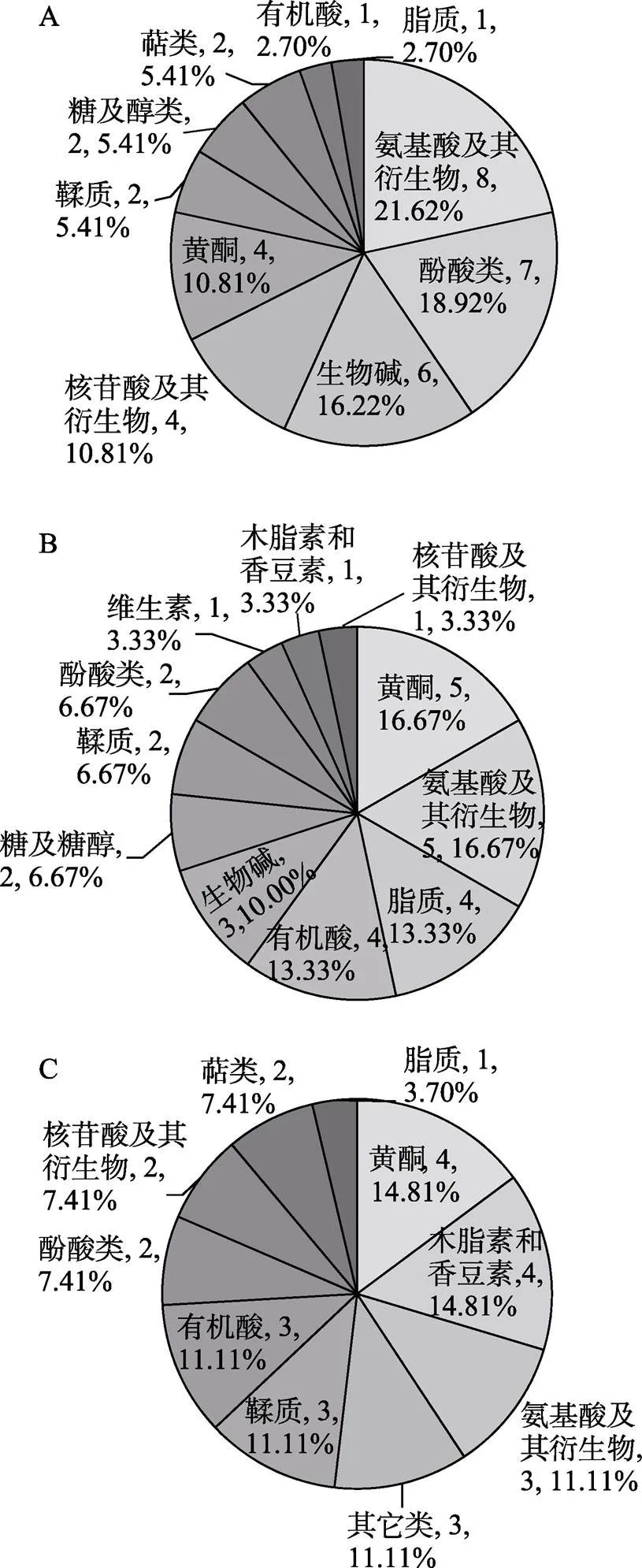
在3个橄榄品种(系)果实中共鉴定出524种代谢物,13个大类,其中包括101种黄酮、90种酚酸、73种氨基酸及其衍生物、48种有机酸、45种脂质、33种核苷酸及其衍生物、26种鞣质、25种糖及醇类、22种木脂素和香豆素、22种其他类代谢物、20种生物碱、12种维生素、7种萜类。其中,黄酮类物质数量最多,占19.27%;酚酸类次之,占17.18%;萜类物质数量最少,占1.34%(图1)。
2.3 不同橄榄品种(系)果实代谢组主成分分析(PCA)与层次聚类分析(HCA)
对3个橄榄品种(系)果实的总代谢物(524种)进行主成分分析,由图2A可见,各橄榄品种(系)样本内部聚集程度较好;品种(系)间表现出明显分离趋势。其中主成分1(36.89%)将‘檀香’和‘长营’‘灵峰’区分开;主成分2(29.43%)将‘长营’和‘檀香’‘灵峰’区分开。层次聚类结果如图2B所示,‘长营’和‘灵峰’的代谢物种类与含量较为接近,聚为一类;而‘檀香’与‘长营’‘灵峰’差异较大,单独聚为另一类。结合PCA和HCA共同结果表明,这3个橄榄品种(系)果实的代谢物之间存在明显差异。
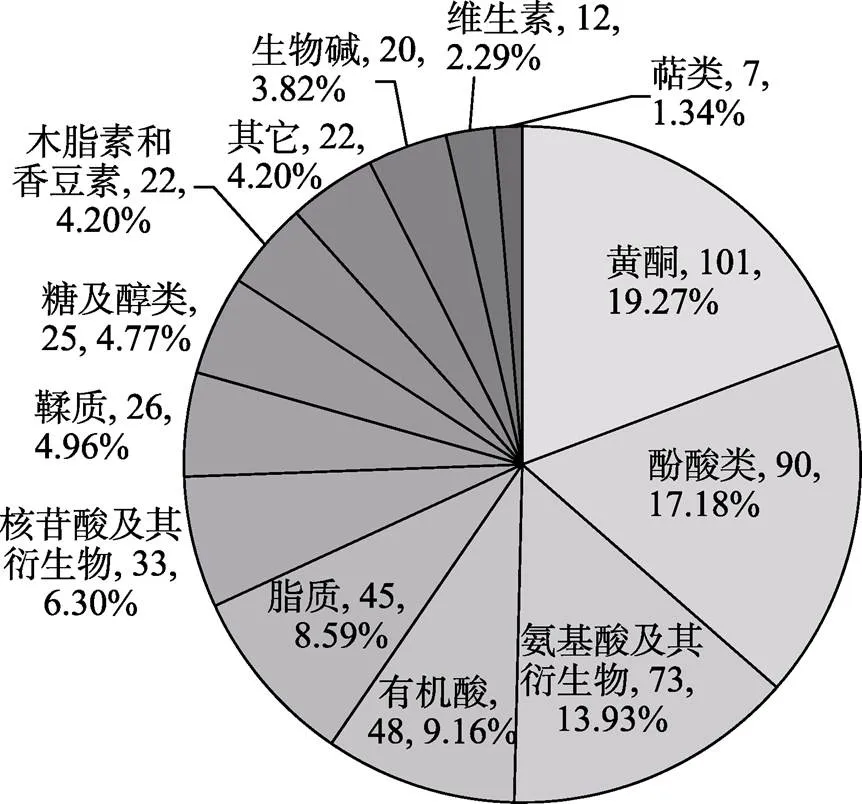
图1 橄榄果实代谢物种类
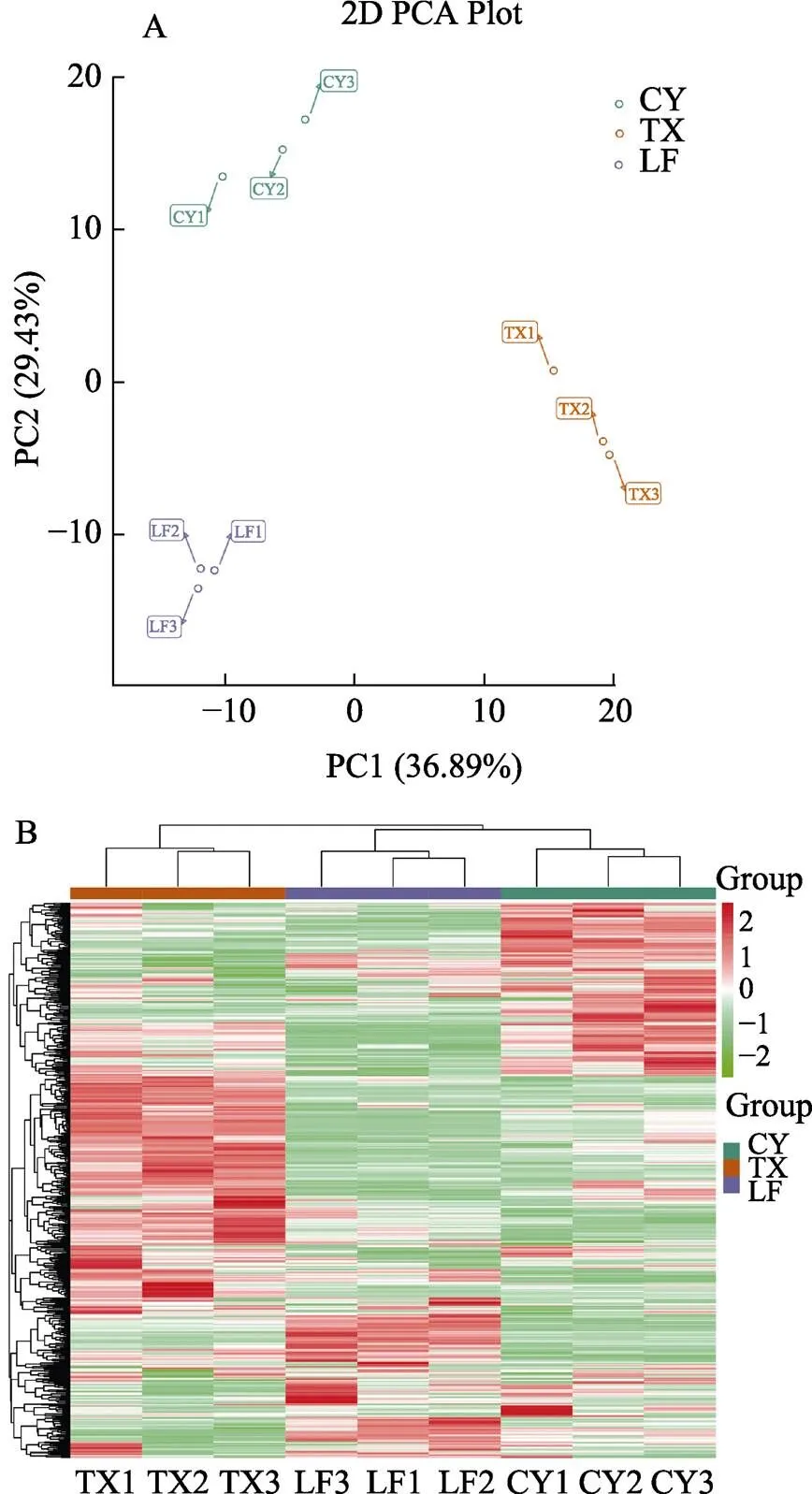
图2 橄榄果实代谢物主成分分析和层次聚类分析
2.4 不同橄榄品种(系)果实差异代谢物筛选
由图3、表2所示,‘长营’vs‘檀香’的161种差异代谢物(上调116种,下调45种),主要包括黄酮(52种)、酚酸类(29种)、氨基酸及其衍生物(26种)、鞣质(11种)、脂质(9种)等;‘檀香’vs‘灵峰’的164种差异代谢物(上调51种,下调113种),主要包括黄酮(57种)、酚酸类(22种)、氨基酸及其衍生物(21种)、脂质(15种)、鞣质(14种)等;‘长营’vs‘灵峰’的146种差异代谢物(上调51种,下调95种),主要包括黄酮(54种)、酚酸类(25种)、氨基酸及其衍生物(12种)、木脂素和香豆素(12种)、鞣质(10种)等。
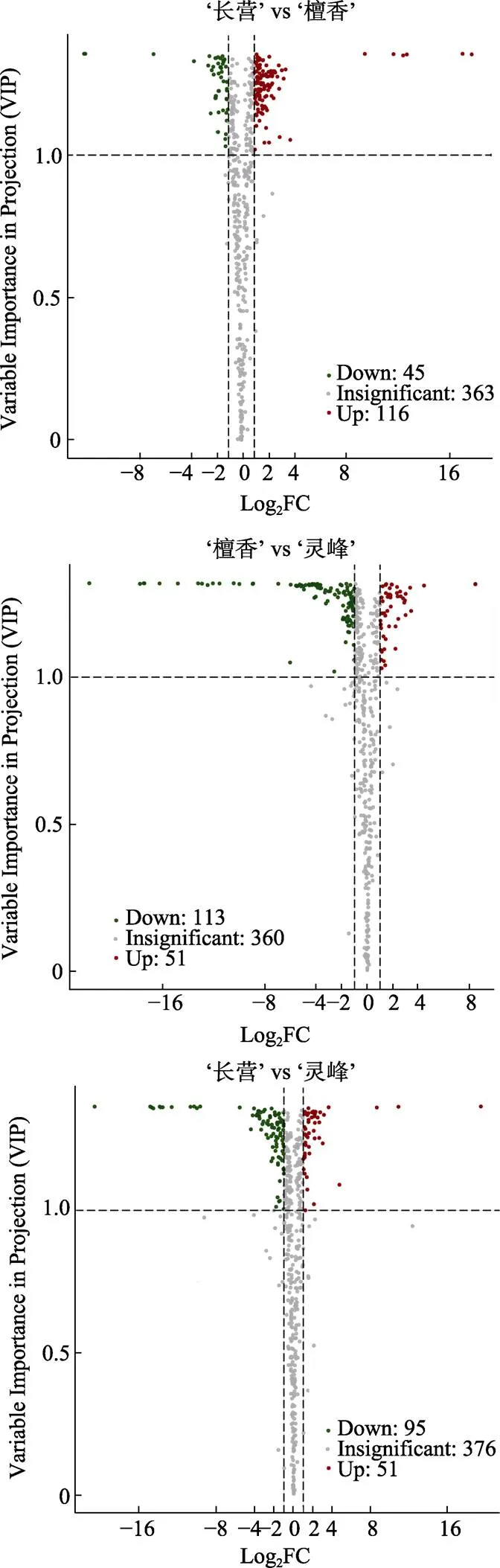
图3 橄榄品种(系)间差异代谢物火山图

表2 橄榄品种(系)间差异代谢物统计
2.5 不同橄榄品种(系)果实差异代谢物分析
2.5.1 不同橄榄品种(系)果实共有差异代谢物分析 根据韦恩图(图4)所示,‘长营’vs‘檀香’、‘檀香’vs‘灵峰’、‘长营’vs‘灵峰’间存在45种3组共有的差异代谢物,可分为黄酮(30种)、酚酸类(5种)、鞣质(4种)、氨基酸及其衍生物(3种)、木质素和香豆素(2种)、萜类(1种)。由图5所示,L-瓜氨酸等35种差异代谢物在‘檀香’中含量最高;酪胺等5种差异代谢物在‘长营’中含量最高;对香豆酰苹果酸等5种差异代谢物在‘灵峰’中含量最高。
2.5.2 不同橄榄品种(系)果实特有差异代谢物分析 由图4可知,‘长营’vs‘檀香’中特有差异代谢物最多(37种),‘檀香’vs‘灵峰’次之(30种),‘长营’vs‘灵峰’最少(27种)。由图6A可知,‘长营’vs‘檀香’的特有差异代谢物以氨基酸及其衍生物(8种)、酚酸类(7种)、生物碱(6种)、核苷酸及其衍生物(4种)、黄酮(4种)为主。由图6B可知,‘檀香’vs‘灵峰’的差异代谢物以黄酮(5种)、氨基酸及其衍生物(5种)、脂质(4种)、有机酸(4种)、生物碱(3种)为主。由图6C可知,‘长营’vs‘灵峰’的特有差异代谢物以黄酮(4种)、木脂素和香豆素(4种)、氨基酸及其衍生物(3种)、其他类(3种)、鞣质(3种)、有机酸(3种)为主。
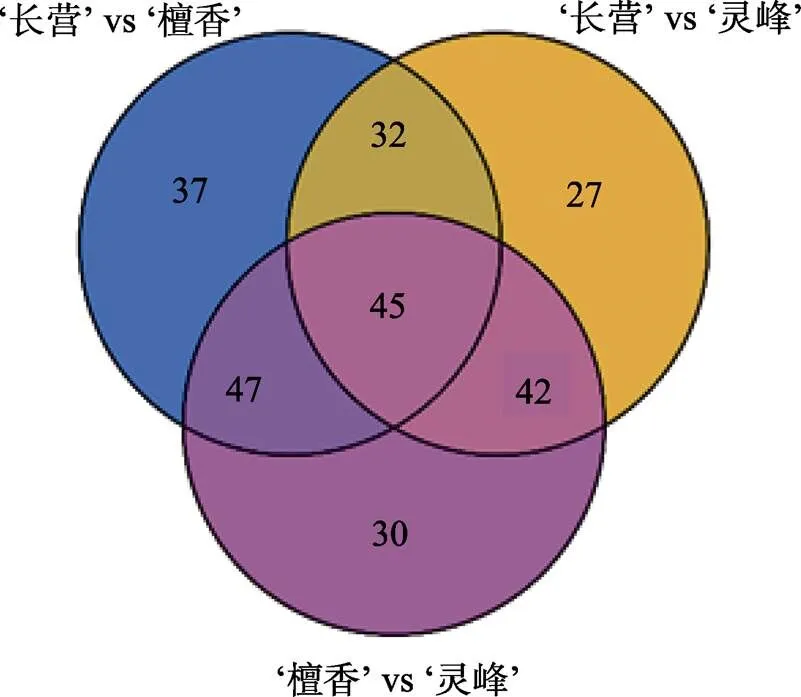
图4 橄榄组间差异代谢物韦恩图

图5 橄榄组间共有差异代谢物热图
A:‘长营’vs‘檀香’;B:‘檀香’vs‘灵峰’;C:‘长营’vs‘灵峰’。
2.6 不同橄榄品种(系)果实差异代谢物通路分析
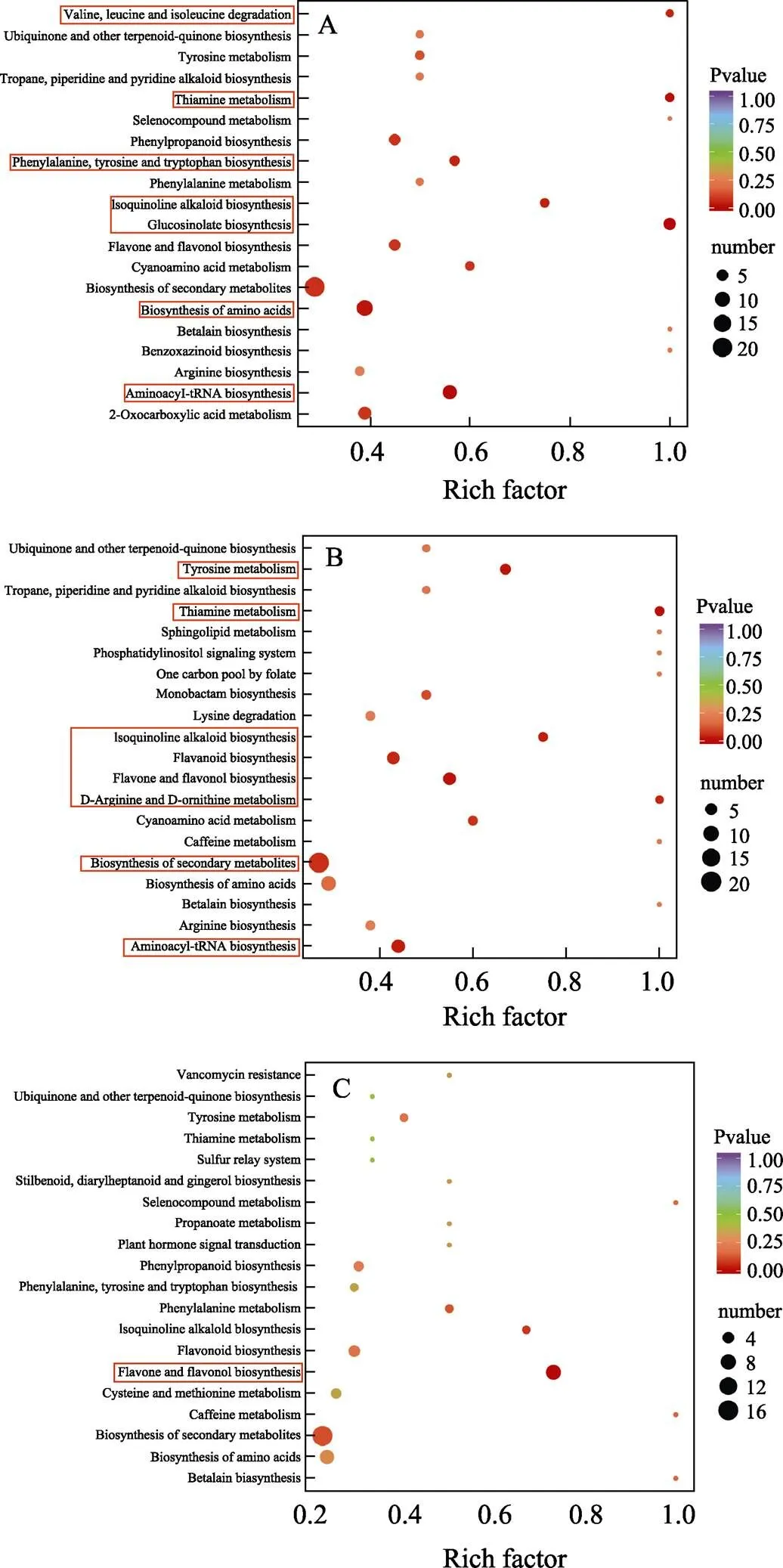
由差异代谢物KEGG富集分析结果可知,‘长营’vs‘檀香’中的差异代谢物共分布于55条代谢通路,显著的差异代谢通路7条(<0.05)(图7A),主要为氨基酸代谢途径(硫代葡萄糖苷生物合成、氨酰tRNA合成、硫胺代谢、氨基酸生物合成、异喹啉生物碱生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成、缬氨酸、亮氨酸和异亮氨酸降解)。氨基酸代谢共有17种差异代谢物参与,其中有16种在‘檀香’中的含量显著上调(FC≥2.0)。
A:‘长营’vs‘檀香’;B:‘檀香’vs‘灵峰’;C:‘长营’vs‘灵峰’。
‘檀香’vs‘灵峰’中的差异代谢物共分布于55条代谢通路,显著的差异代谢通路8条(< 0.05)(图7B),主要为氨基酸代谢(硫胺代谢、酪氨酸代谢、氨酰tRNA生物合成、异喹啉生物碱生物合成、D-精氨酸和D-鸟氨酸代谢)、黄酮代谢(黄酮和黄酮醇生物合成、类黄酮生物合成)、次级代谢产物生物合成途径。氨基酸代谢共有13种差异代谢物参与,其中12种在‘檀香’中积累较多。黄酮代谢共有11种差异代谢物参与,其中8种在‘檀香’中积累较多。次级代谢产物生物合成途径共有3种差异代谢物参与,且这3种差异代谢物在‘檀香’中积累较多。
‘长营’vs‘灵峰’中的差异代谢物共分布于55条代谢通路,显著的差异代谢通路1条(<0.05)(图7C),为黄酮和黄酮醇生物合成途径,共有8种差异代谢物参与,且这8种差异代谢物在‘长营’中代谢更为活跃,含量更高。
2.7 不同橄榄品种(系)间果实重要代谢物相对含量比较
黄酮类物质是橄榄果实中最主要的成分之一,可能是影响其果实风味的关键代谢物[22]。对代谢组中黄酮类物质进行比较分析,发现代谢组中含有大量槲皮素类(12种)、木犀草素类(15种)、山奈酚类(19种)黄酮代谢物,占黄酮类代谢物总数的45.54%,其中仅槲皮素、木犀草素-丙二酰基-O-己糖-O-戊糖在3个品种(系)中无显著差异。‘檀香’有9种槲皮素类、7种木犀草素类、13种山奈酚类代谢物显著高于‘长营’和‘灵峰’;‘长营’有3种木犀草素类、1种山奈酚类代谢物显著高于‘檀香’和‘灵峰’;‘灵峰’仅有1种木犀草素类代谢物显著高于‘长营’和‘檀香’(表3)。
氨基酸是橄榄果实重要的品质成分,其含量、种类都是衡量橄榄营养价值的重要指标之一[23],池毓斌[18]研究发现不同类型橄榄之间氨基酸的种类及含量差异显著,对橄榄风味形成起着关键作用。对3个品种(系)橄榄果实中主要差异的氨基酸及其衍生物进行比较分析,发现‘长营’中L-谷氨酸 O-己糖苷、酪胺、L-(-)-胱氨酸的含量显著高于‘檀香’和‘灵峰’;‘檀香’中L-丙氨酸、L-高丝氨酸、L-(-)-苏氨酸等25种氨基酸及其衍生物含量显著高于‘长营’和‘灵峰’;‘灵峰’中乙酰色氨酸、N-乙酰-DL-色氨酸显著高于‘长营’和‘檀香’(表4)。
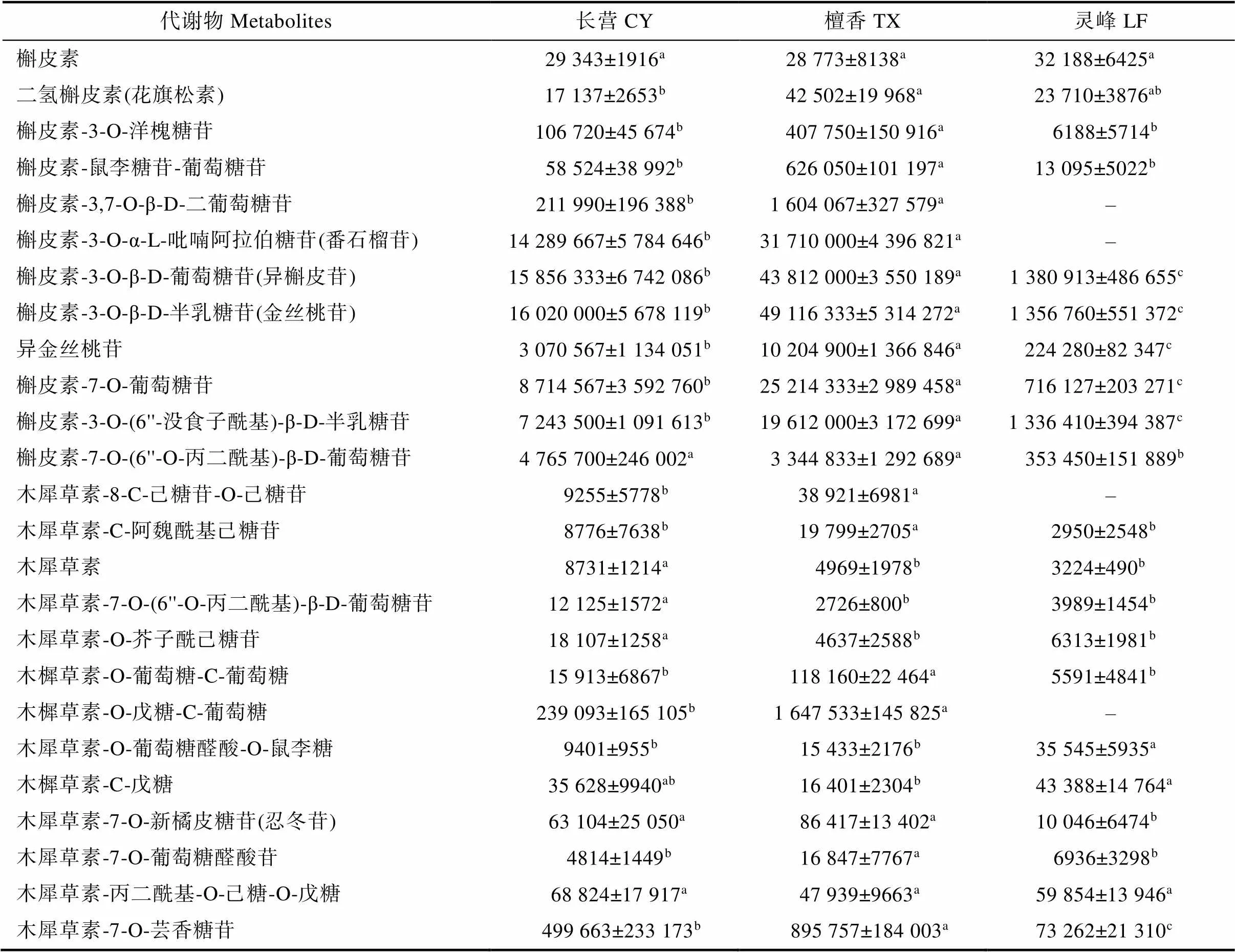
表3 3个橄榄品种(系)果实主要黄酮类物质相对峰面积
续表3 3个橄榄品种(系)果实主要黄酮类物质相对峰面积

Tab. 3 Relative peak areas of main of flavonoids in the varieties (lines) of Chinese olive fruits (continued)
注:不同小写字母表示处理间差异显著(<0.05);–表示未检出。
Note: Different lowercase letters indicate significant difference among treatments (<0.05); – indicates not detected.
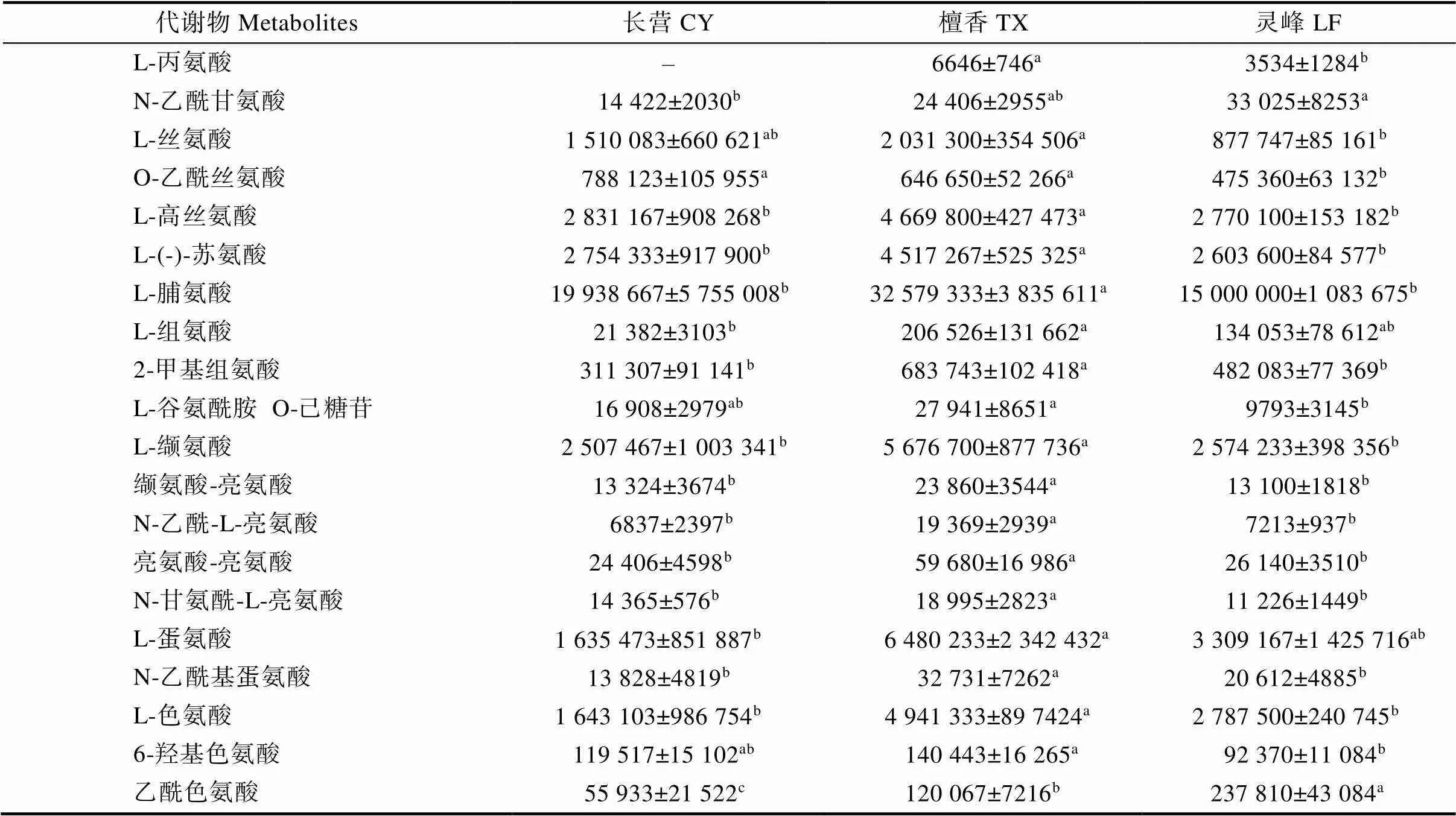
表4 3个橄榄品种(系)果实主要差异的氨基酸及其衍生物相对峰面积
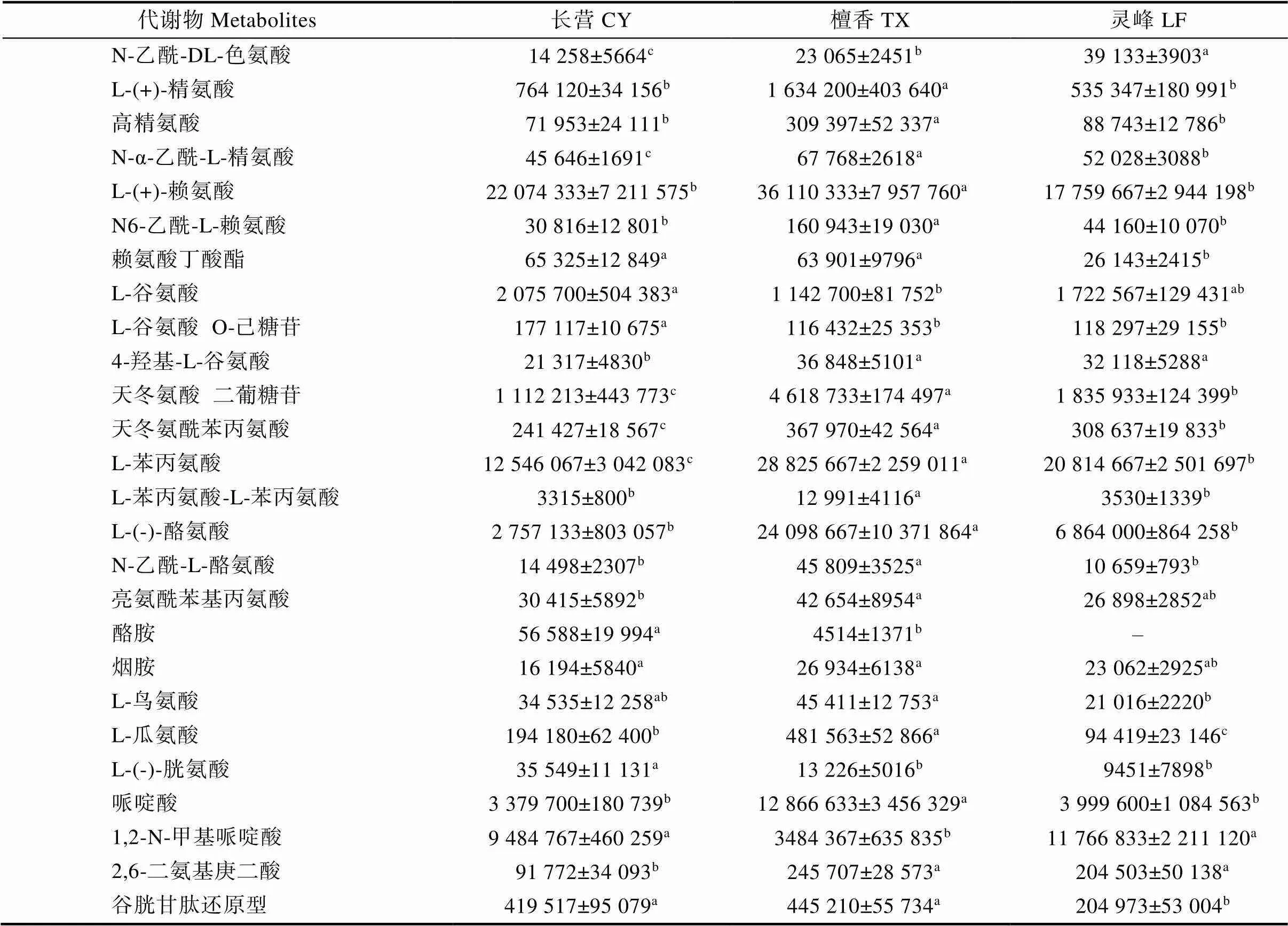
续表4 3个橄榄品种(系)果实主要差异的氨基酸及其衍生物相对峰面积
注:不同小写字母表示处理间差异显著(<0.05);–表示未检出。
Note: Different lowercase letters indicate significant difference among treatments (<0.05); – indicates not detected.
3 讨论
本研究利用广泛靶向代谢组学的技术,对3个橄榄品种(系)果实的差异代谢物进行比较分析,该技术具有非靶向代谢组学的“广泛性”和靶向代谢组学的“准确性”,能够更加精确、全面地获得橄榄果实中代谢物信息谱[24]。何志勇[13]通过高效液相色谱法在‘檀香’果实中检测到5种糖类、7种有机酸和18种氨基酸;常强[25]利用超高效液相色谱-串联质谱(UPLC-MS/MS)技术在‘长营’果实中共检测到12种酚类化合物;池毓斌[18]采用超高效液相色谱飞行时间质谱联用技术(UPLC-TOFMS)在‘长营’和‘清榄1号’果实中鉴定出16种酚类代谢物。本代谢组相比前人的研究所检测出的代谢物数量更为丰富,更利于对不同品种进行分析比较,为今后橄榄果实品质分析、代谢物积累模式等研究提供数据支撑。
目前,橄榄果实黄酮类代谢物的研究主要集中于宏观层面,其类型尚未明确[26]。本代谢组数据表明,橄榄果实中黄酮类代谢物数量最多,其中,槲皮素类、木犀草类和山奈酚类代谢物占黄酮类代谢物总数的45.54%,因此,可以将橄榄果实中的黄酮类代谢物分别归为这3类。这3类黄酮类化合物在植物体中多以糖苷的形式存在[27],具有抗炎[28]、抗癌[29]等药理活性作用。
多酚[30]和氨基酸[31]是近年来人们对于橄榄果实代谢物研究和关注的热点,是影响果实风味品质,区分橄榄类型的关键指标之一。利用OPLS-DA分析发现,黄酮类、酚酸类和氨基酸及其衍生物是3个橄榄品种(系)果实间主要的差异代谢物,由此可以推测,橄榄的不同品种果实之间的酚类物质和氨基酸存在差异,与林玉芳[19]的研究结果相吻合。
试验结果表明3个品种(系)中‘檀香’的总酚和总黄酮含量最高。代谢组数据也表明‘檀香’相对含量高的代谢物总数最多,以黄酮类物质为主,大多数槲皮素类、木犀草素类和山奈酚类代谢物显著高于‘长营’和‘灵峰’。与本课题组对这3个品种(系)果实的结合态酚类物质进行提取与测定,发现‘檀香’中槲皮素和山奈酚的含量最高,而‘灵峰’中木犀草素的含量相对较低的结果一致(待刊资料)。此外,‘檀香’中大多数差异氨基酸及其衍生物含量显著高于‘长营’和‘灵峰’,其中丙氨酸、丝氨酸、天冬氨酸等属于呈味氨基酸,对橄榄的风味形成具有一定作用[32];苯丙氨酸、酪氨酸属于芳香族氨基酸,参与植物的苯丙氨酸代谢,是酚酸、黄酮、木质素合成的前体物质,与果实生长发育和品质形成关系密切。由此可以推测‘檀香’独特的浓厚风味,与其果实中含有丰富的多酚、黄酮及氨基酸类物质有关。‘灵峰’的总酚、总黄酮和木质素含量最低,其相对含量高的代谢物总数最少,主要的差异代谢物为黄酮类物质。差异代谢物KEGG通路富集分析也证实,‘灵峰’与‘长营’相比其黄酮生物合成相对较弱,黄酮类物质积累相对较少,这可能是造成‘灵峰’涩味较淡的原因。而‘长营’果实木质素含量很高,与其果肉质地坚硬、化渣差的特点相符合。
综上所述,本研究采用广泛靶向代谢组学技术对3个橄榄品种(系)果实中的代谢物进行测定,明确了橄榄果实中黄酮类代谢物的类型主要为槲皮素类、木犀草素类和山奈酚类。3个橄榄品种(系)果实的代谢物间存在明显差异,其中‘檀香’的相对含量高的代谢物总数最多,尤其是黄酮和氨基酸及其衍生物类的代谢物;‘长营’较‘灵峰’的黄酮代谢更为活跃,且木质素含量最高;而‘灵峰’相对含量高的代谢物总数最少,黄酮类物质积累较少,这可能是造成‘檀香’果实风味更为浓郁,‘灵峰’果实风味较为清淡,而‘长营’果实肉质粗糙的原因之一,以期为橄榄果实风味形成等研究提供理论基础。
[1] 赵金星, 彭远琴, 邱志浩, 袁宏逸, 佘文琴. 橄榄发育过程中风味物质的变化规律[J]. 热带作物学报, 2017, 38(9): 1741-1751.
ZHAO J X, PENG Y Q, QIU Z H, YUAN H Y, SHE W Q. Flavor substances of Chinese olive fruit during development process[J]. Chinese Journal of Tropical Crops, 2017, 38(9): 1741-1751. (in Chinese)
[2] 常 强, 苏明华, 陈清西. 橄榄化学成分与药理活性研究进展[J]. 热带作物学报, 2013, 34(8): 1610-1616.
CHANG Q, SU M H, CHEN Q X. The advance on the research of chemical constituents and pharmacological activities of Chinese olive[J]. Chinese Journal of Tropical Crops, 2013, 34(8): 1610-1616. (in Chinese)
[3] 张 怡, 李玲望, 曾红亮, 曾绍校, 林雨菲, 郑宝东. 橄榄汁保肝作用及其功效成分的研究[J]. 营养学报, 2012, 34(4): 379-383.
ZHANG Y, LI L W, ZENG H L, ZENG S X, LIN Y F, ZHENG B D. Studies on the effect of olive juice on protection of liver and its functional components[J]. Acta Nutrimenta Sinica, 2012, 34(4): 379-383. (in Chinese)
[4] 彭 勃, 张金生, 崔 璨, 闫永斌. 橄榄降脂胶囊对高脂血症大鼠肝脏病理学及超微结构的影响[J]. 辽宁中医杂志, 2007, 34(4): 406-408.
PENG B, ZHANG J S, CUI C, YAN Y B. Effects of olive lipid lowering capsule on liver pathology and ultrastructure in hyperlipidemia rats[J]. Liaoning Journal of Traditional Chinese Medicine, 2007, 34(4): 406-408. (in Chinese)
[5] 朱焕容, 欧国灯, 罗燕玉, 黄晓丹. 中药材在清咽类保健食品中的应用及其功效成分研究进展[J]. 中国药房, 2013, 24(27): 2581-2583.
ZHU H R, OU G D, LUO Y Y, HUANG X D. Application of traditional Chinese medicine in throat-clearing health food and research progress of its functional components[J]. China Pharmacy, 2013, 24(27): 2581-2583. (in Chinese)
[6] 项昭保, 胡 波, 何从林. 橄榄抑菌活性部位研究[J]. 食品工业科技, 2013, 34(12): 149-152.
XIANG Z B, HU B, HE C L. Study on antibacterial activity of different fractions from[J]. Science and Technology of Food Industry, 2013, 34(12): 149-152. (in Chinese)
[7] 许长同,余德生,赖澄清. 橄榄栽培[M]. 北京:中国农业出版社, 1999.
XU C T, XU D S, LAI C Q. Chinese olive cultivation[M]. Beijing: China Agriculture Press, 1999. (in Chinese)
[8] 佘文琴. 橄榄丰产优质栽培技术[M]. 北京: 中国农业出版社, 2020.
SHE W Q. High yield and high quality cultivation techniques of Chinese olive [M]. Beijing: China Agriculture Press, 2020. (in Chinese)
[9] DAVID R, RUDELL, JAMES P, ERIC A. Prestorage ultraviolet-white light irradiation alters apple peel metabolome[J]. Journal of Agricultural and Food Chemistry, 2008, 56(3): 1138-1147.
[10] GLABASNIA A, DUNKEL A, FRANK O, HOFMANN T. Decoding the nonvolatile sensometabolome of orange juice ()[J]. Journal of Agricultural and Food Chemistry, 2018, 66(10): 2354-2369.
[11] BOHAN Y, SHUANG H, YUAN L, BUCHUN L, YANLUN J, DENGZHAO K, XIANGYU S, YULIN F. Transcriptomics integrated with metabolomics reveals the effect of regulated deficit irrigation on anthocyanin biosynthesis in Cabernet Sauvignon grape berries[J]. Food chemistry, 2020, 314: 126170.
[12] RUOCHEN W, PENG S, CHI Z,JUNLIN Z, YA C, YAOXING Z, KUI D, YUE X, MINGZHANG L, TAO M, YANG Z, ZHENGGUO L, DON G, JULIEN P, KUNSONG C, MONDHER B, BO Z, MINGCHUN L. Integrative analyses of metabolome and genome-wide transcriptome reveal the regulatory network governing flavor formation in kiwifruit ()[J]. The New Phytologist, 2021, 233(1): 373-389.
[13] 何志勇. 橄榄果肉营养成分的分析[J]. 食品工业科技, 2008(12): 224-226.
HE Z Y. Analysis of nutrient content in the fruit flesh of[J]. Science and Technology of Food Industry, 2008(12): 224-226. (in Chinese)
[14] 陈 岗. 橄榄中多酚类物质的分离纯化及功能性研究[D]. 重庆:西南大学, 2009.
CHEN G. Studies on separation, purification and functionalities of polyphenols from[D]. Chongqing: Southwest University, 2009. (in Chinese)
[15] 彭真汾. 清橄榄与普通橄榄果实差异氨基酸及其相关酶活性研究[D]. 福州: 福建农林大学, 2018.
PENG Z F. Study on the fruit differential amino acids and its related enzyme activity between sweet olive and common olive[D]. Fuzhou: Fujian Agriculture and Forestry University, 2018. (in Chinese)
[16] 钟 明, 陈玉芬, 甘廉生, 王 萍. 冬节圆橄榄果实挥发油化学成分分析[J]. 果树学报, 2004, 21(5): 494-495.
ZHONG M, CHEN Y F, GAN L S, WANG P. Studies on the volatile compounds in fruit of Chinese olive cultivar Dongjieyuan[J]. Journal of Fruit Science, 2004, 21(5): 494-495. (in Chinese)
[17] 张亚敏, 徐榕青, 林文津, 刘洪旭, 于虹敏. 橄榄肉超临界CO2萃取物GC/MS分析[J]. 福建医药杂志, 2011, 33(5): 65-67.
ZHANG Y M, XU R Q, LIN W J, LIU H X, YU H M. GC/MS analysis of supercritical CO2extract from olive fruit pulp[J]. Fujian Medical Journal, 2011, 33(5): 65-67. (in Chinese)
[18] 池毓斌. 橄榄果实品质特性及其代谢组学的初步研究[D]. 福州: 福建农林大学, 2017.
CHI Y B. A preliminary study on the fruit quality characteristics and metabolism of[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017. (in Chinese)
[19] 林玉芳. 福建橄榄((Lour.) Raeusch.)若干功能成分和品质相关指标的研究[D]. 福州: 福建农林大学, 2012.
LIN Y F. Studies on some functional components and quality indexes of Chinese olive [(Lour.) Raeusch] fruit in Fujian Province[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese)
[20] 谢晓琼. 橄榄[(Lour.) Raeusch]果实若干生理生化指标的研究[D]. 福州: 福建农林大学, 2007.
XIE X Q. Studies on the physiological and biochemical indexes of Chinese olive [(Lour.) Raeusch] fruit[D]. Fuzhou: Fujian Agriculture and Forestry University, 2007. (in Chinese)
[21] 鞠志国, 原永兵, 刘成连, 戴洪义, 刘润进. 低温对苹果贮藏过程H2O2水平的影响[J]. 果树科学, 1994, 11(1): 10-13.
JU Z G, YUAN Y B, LIU C L, DAI H Y, LIU R J. Effect of low temperature storage on H2O2level of apple[J]. Journal of Fruit Science, 1994, 11(1): 10-13. (in Chinese)
[22] XIANG Z B, LIU X Y, HE C L, HENG L S. Flavonoids from[J]. Asian Journal of Chemistry, 2014, 26(14): 4529-4530.
[23] 王 艳, 张 越, 陈姗姗, 张雪梅, 宋述尧. 食荚菜豆氨基酸组成与含量及其品质评价[J]. 西北农林科技大学学报(自然科学版), 2014, 42(8): 155-161.
WANG Y, ZHANG Y, CHEN S S, ZHANG X M, SONG S Y. Composition, content, and quality evaluation of amino acids in snap bean[J]. Journal of Northwest A & F University (Natural Science Edition) , 2014, 42(8): 155-161. (in Chinese)
[24] 田 菁, 王宇哲, 闫世雄, 孙 帅, 贾俊静, 胡晓湘. 代谢组学技术发展及其在农业动植物研究中的应用[J]. 遗传, 2020, 42(5): 452-465.
TIAN J, WANG Y Z, YAN S X, SUN S, JIA J J, HU X X. Metabolomics technology and its applications in agricultural animal and plant research[J]. Hereditas, 2020, 42(5): 452-465. (in Chinese)
[25] 常 强. 橄榄果实酚类物质及其抗氧化活性研究[D]. 福州: 福建农林大学, 2017.
CHANG Q. Investigation of polyphenol compounds and their antioxidant activity in the fruits of Chinese olive[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017. (in Chinese)
[26] 吴如健, 陈 瑾, 胡菡青, 万继锋, 韦晓霞. 橄榄黄酮类化合物研究进展[J]. 福建农业学报, 2015, 30(1): 106-110.
WU R J, CHEN J, HU H Q, WAN J F, WEI X X. Research advancement of flavonoids from Chinese olive[J]. Fujian Journal of Agricultural Sciences, 2015, 30(1): 106-110. (in Chinese)
[27] 沈晓静. 槲皮素、木犀草素和山奈酚的衍生化反应研究[D]. 昆明: 云南大学, 2013.
SHEN X J. Study on derivatization reaction of quercetin, luteolin and kaempferol[D]. Kunming: Yunnan University, 2013. (in Chinese)
[28] CHEN L J, WU X L, WANG W W, WANG X, MA J H. Quercetin with lycopene modulates enzymic antioxidant genes pathway in isoproterenol cardiotoxicity in rats[J]. The Libyan Journal of Medicine, 2021, 16(1): 1943924.
[29] IMRAN M, RAUF A, ABU-IZNEID T, NADEEM M, SHARIATI M A, KHAN I A, IMRAN A, ORHAN I E, RIZWAN M, ATIF M, GONDAL T A, MUBARAK M S. Luteolin, a flavonoid, as an anticancer agent: A review[J]. Biomedicine & Pharmacotherapy, 2019, 112: 108612.
[30] 赖瑞联, 陈 瑾, 冯 新, 程春振, 钟春水, 陈义挺, 吴如健. 橄榄多酚类物质研究进展[J]. 热带作物学报, 2018, 39(12): 2532-2541.
LAI R L, CHEN J, FENG X, CHEN C Z, ZHONG C S, CHEN Y T, WU R J. Research progress on polyphenol of(Lour.) Raeusch.[J]. Chinese Journal of Tropical Crops, 2018, 39(12): 2532-2541. (in Chinese)
[31] 彭真汾, 王 威, 叶清华, 陈清西. 高效液相色谱-串联质谱法定量分析橄榄果实氨基酸组分[J]. 食品科学, 2018, 39(24): 231-238.
PENG Z F, WANG W, YE Q H, CHEN Q X. Quantitative analysis of amino acids in Chinese olive using high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2018, 39(24): 231-238. (in Chinese)
[32] 彭真汾, 叶清华, 王 威, 谢 倩, 陈清西. 普通橄榄和清橄榄果实游离氨基酸差异成分与谷氨酰胺代谢[J]. 食品科学, 2019, 40(4): 229-236.
PENG Z F, YE Q H, WANG W, XIE Q, CHEN Q X. Differences in free amino acid composition of fruits of common olive and sweet olive and their glutamine metabolism characteristics[J]. Food Science, 2019, 40(4): 229-236. (in Chinese)
Metabolomics and Its Difference of Chinese Olive Fruit of Different Varieties (lines) During the Ripening Period
CAI Jingrong1,2, WANG Jie1,2, ZHAO Junyue1,2, PAN Tengfei1,2,GUO Zhixiong1,2*, SHE Wenqin1,2*
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2. Institute of Postharvest Science and Technology of Horticultural Products, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Chinese olive fruit has a unique flavor and polyphenols, flavonoids, amino acids and other physiologically active substances, which are closely related to its flavor quality. At present, there are few reports on the systematic study of Chinese olive fruit metabolites. The main metabolic components of the olive fruit of three varieties (lines) having different quality types (‘Changying’, ‘Tanxiang’, ‘Lingfeng’) were assayed to provide a theoretical basis for the study of Chinese olive fruit quality formation and select fine varieties. In the experiment, the widely targeted metabolome technology based on ultra performance liquid chromatography and tandem mass spectrometry (UPLC-MS/MS) was used to determine the fruit metabolites of the three varieties (lines) at maturity, and combined with the multivariate statistical analysis method and the data of total phenols, total flavonoids and lignin in the fruits of the three varieties (lines). ‘Tanxiang’ had the highest content of total phenols and flavonoids, and ‘Lingfeng’ had the lowest content of total phenols and flavonoids. The total lignin content of ‘Changying’ was very high, which was consistent with the characteristics of hard poor mastication. A total of 13 categories and 524 metabolites including flavonoids, phenolic acids, amino acids and derivatives, organic acids, lipids, nucleotides and derivatives, tannins, saccharides and alcohols, lignin and coumarins were detected by the extensive targeted metabolomics technology. Among them, the number of flavonoids metabolites was the largest, mainly quercetin derivatives, luteolin derivatives and kaempferol derivatives. The metabolites of the varieties (lines) were significantly different, and the main differential metabolites were flavonoids, phenolic acids and amino acids and derivatives. There were 161 different metabolites in ‘Changying’ compared with ‘Tanxiang’ (116 up-regulated metabolites and 45 down-regulated metabolites). There were 164 differential metabolites in ‘Tanxiang’ compared with ‘Lingfeng’ (51 up-regulated metabolites and 113 down-regulated metabolites). There were 146 differential metabolites (51 up-regulated metabolites and 95 down-regulated metabolites) in ‘Changying’ compared with ‘Lingfeng’. The KEGG pathway enrichment analysis of differential metabolites found that among the varieties (lines), ‘Tanxiang’ had the most active flavonoid metabolism and amino acid metabolism, accumulating more flavonoids and amino acids such as quercetin derivatives, luteolin derivatives, kaempferol derivatives, alanine, serine, histidine, phenylalanine, tyrosine and etc. The flavonoid metabolism of ‘Lingfeng’ was relatively weaker than that of ‘Changying’, and the accumulation of flavonoids was relatively less, while ‘Changying’ had high lignin content, which might be one of the reasons for the stronger flavor of ‘Tanxiang’, and the sweeter flavor of ‘Lingfeng’.
Chinese olive; maturity; metabolome; different metabolites;flavone
S667.5
A
10.3969/j.issn.1000-2561.2022.11.015
2022-03-09;
2022-04-01
中央财政林业科技推广项目(闽财指[2021]363号)。
蔡净蓉(1996—),女,硕士研究生,研究方向:果树生理生化与生态。*通信作者(Corresponding author):郭志雄(GUO Zhixiong),E-mail:gzhhs@163.com;佘文琴(SHE Wenqin),E-mail:wenqinshe@163.com。

