两种灰区标本处理方法对丙肝抗体检测干扰的消除效果评价
叶红玲 李娜 曾健 侯思南
1南京医科大学康达学院附属连云港第二人民医院连云港市第二人民医院检验科,连云港 222002;2连云港市中医院检验科,连云港 222004
丙型肝炎病毒(HCV)在我国某些地区呈低流行状态,蒋均等[1]建议加强对1957—1986年出生人群和血液透析科、感染科及肝病科就诊者HCV感染的血清学筛查。化学发光免疫分析法(CLIA)通过检测抗HCV抗体(Anti-HCV)成功地应用于HCV感染者的筛查,具有动态范围宽、高特异性、高灵敏度、周转时间短等优点[2-3]。Anti-HCV的检测通常是定性的,要么是阳性,要么是阴性。运用雅培i2000化学发光分析仪检测HCV抗体虽可检出阳性患者,但存在假阳性结果,临床应谨慎应用[4-5]。一些研究发现,吸光度和临界值比值(S/CO)的样品通常出现假阳性结果。在血液透析患者等免疫功能低下的人群中,出现抗-HCV抗体假阳性的结果在15%左右[6]。Dufour等[7]对S/CO的样本做了重组免疫印迹分析(recombinant immunoblot assay,RIBA)检测,发现86%的样本为HCV阴性,故建议对低阳性值的样本进行RIBA补充试验以避免报告假阳性结果[8]。Heinrichs等[9]研究发现,HCV血清学检查在有左心辅助设备(LVAD)的患者中存在假阳性,建议此类患者的CLIA反应阳性应通过HCV免疫印迹和HCV RNA检测确认,以排除HCV感染。陆银华等[10]建议对i2000SR检测Anti-HCV灰区(S/CO值为1.00~9.41)样本,应至少使用2种检测系统或使用高特异性的检测系统进行复检。对于低阳性值样本,实验室应充分考虑不同检测系统之间可能出现的结果不一致现象,制定合理灰区范围和确定最佳临界值[11-15]。
内源性干扰在临床免疫检测中较为常见。检验人员应采取措施,识别和排除内源性干扰物,保证检验结果的可靠性[16]。动物血清或动物源性免疫球蛋白通常用来封闭嗜异性抗体(HA),当其与待测样本共同孵育后,能结合样本中的HA或人抗动物抗体(HAAA),通过空间位阻阻遏HA/HAAA与检测或捕获抗体结合,从而封闭HA/HAAA的 干 扰 作 用[17]。Batteiger等[18]使 用 含 非 离 子 洗 涤 剂Tween20的PBS作为阻断剂,能有效阻断硝酸纤维素膜(NCM)上未被占据的蛋白结合位点,获得的条带背景明显低于使用大量牛血清白蛋白(BSA)或载体血清作为阻断剂。为了消除内源性干扰物对抗-HCV抗体的干扰,我们分别采用小鼠血清(MS)和磷酸盐吐温缓冲液(phosphate tween buffer,PBST)封闭患者标本可能存在的非特异性抗体,处理后以CLIA法复检,并评价干扰消除效果,现报道如下。
材料与方法
1、研究材料
1.1、研究对象研究病例是连云港市中医院检验科2017年2月至2019年11月间-20℃保存的雅培i2000SR化学发光仪检测的丙肝抗体结果即标本S/CO>1的血清样本151例、S/CO<1的血清样本40例(通过LIS系统查询初筛检验报告)。当S/CO比值>1.0时初筛试验判断为阳性反应。连云港市中医院伦理委员会根据《赫尔辛基原则宣言》审查通过了此研究方案。
1.2、设备与试剂雅培i2000SR全自动化学发光仪(厂家:美国雅培公司,配套丙肝抗体试剂,批号:03231BE00、03586BE00、03531BE00、04539BE00、94016LI00等);小鼠血清封闭液(厂家:北京鼎国昌盛生物技术公司,生产批号:80M00150);Tween20(厂家:欧蒙医学诊断中国有限公司,批号:F190403CA);PBS(厂家:欧蒙医学诊断中国有限公司,批号:F191010CB);丙肝抗体质控品(厂家:北京康彻斯坦公司,浓度:2 NCU/ml,批号:201811002)。丙肝抗体确证(RIBA)和HCV-RNA外送金域医学检验中心检验。
2、研究方法
本研究为病例对照研究。对所有受试标本以RIBA法检测,对结果为不确定的标本加做HCV RNA。以确证试验结果为标准,采用Kappa检验比较处理前后一致性,并绘制丙肝抗体受试者工作特征曲线(ROC),从而明确Anti-HCV的最佳诊断界值和灰区范围。灰区的标本用正常小鼠血清、PBST分别封闭处理后,以雅培i2000SR复检丙肝抗体。所有操作严格按实验室标准操作程序进行。
按厂家说明书配置0.1%(W/V)PBST。小鼠血清在使用前需经56℃水浴30 min灭活补体。处理步骤如下:(1)在2个EP管内各加入患者血清200 µl,其中1管加入小鼠血清200 µl,另1管加入0.1%(W/V)PBST 200 µl,充分混匀。(2)将小鼠血清管置于37℃水浴30 min,PBST管、小鼠血清管静置于室温1 h。(3)小鼠血清管以2 000 g/min瞬间离心,PBST管以3 500 g/min离心10 min。(4)两管均在雅培i2000SR上复测Anti-HCV,检验结果乘以稀释倍数2。
3、统计学处理
本研究的计量资料符合正态分布,使用SPSS 24.0软件对实验数据采用Kappa检验统计分析。P<0.05为差异有统计学意义。若Kappa<0.4,则表示一致性较差;若0.75>Kappa≥0.4,则表示一致性一般,若Kappa≥0.75,则表示一致性较好。以确认结果为标准,绘制标本处理前后丙型肝炎病毒抗体的ROC。
结 果
1、以雅培i2000SR检测Anti-HCV的最佳诊断界值的确立
见表1和图1。雅培i2000SR检测Anti-HCV项目时,不同的S/CO比值灵敏度、特异度、约登指数(灵敏度+特异度-1)分别如表1所示。因为约登指数越接近于1诊断效能最佳,从而可以看出当Anti-HCV的S/CO比值为5.02时,约登指数为最高值(0.919),所对应的灵敏度为97.4%,特异度为94.5%,将其确定为最佳S/CO比值。Anti-HCV的S/CO比值在0.89时,灵敏度为100.0%;Anti-HCV的S/CO比值5.97时,特异度为100.0%,因此Anti-HCV的灰区范围设置为0.89~5.97。

表1 雅培i2000SR检测Anti-HCV的不同临界值条件下的诊断效能
2、两种方法处理前后Anti-HCV与确认试验结果的一致性及诊断效能变化
RIBA检验结果为阴性75例,阳性109例,不确定7例,经加做HCV RNA补充试验最终确认阴性为76例,阳性为115例。通过整理对比被测者复检和确认试验结果,观察灰区标本在处理前后与确认试验结果的差异性,如表2所示。灰区标本未做处理、小鼠血清和PBST处理后,Anti-HCV与确证试验结果的一致性Kappa值分别为0.551、0.900、0.854;以i2000SR检测Anti-HCV的灵敏度分别为98.3%、100.0%、99.1%,特异度分别为52.6%、88.1%、84.2%,阳性预测值分别为75.8%、92.7%、90.5%,阴性预测值分别为95.2%、100.0%、98.5%。
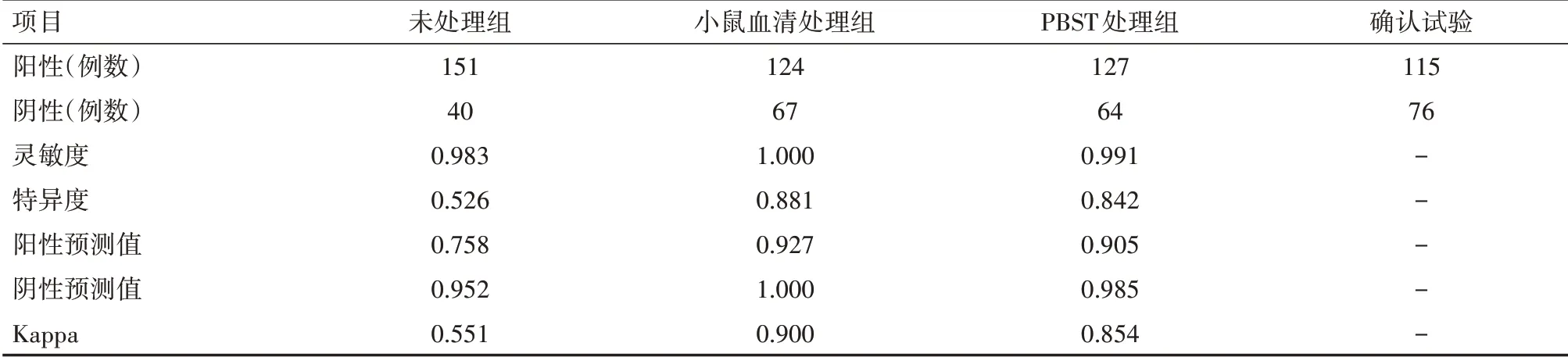
表2 两种方法处理前后Anti-HCV与确认试验结果的一致性及诊断效能变化
3、以确认试验结果为标准绘制的标本在处理前后检测Anti-HCV项目的ROC
雅培i2000SR检测Anti-HCV的曲线下面积(AUC)分别为0.980、0.996和0.987。灰区标本处理前、小鼠血清和PBST封闭后,i2000SR检 测Anti-HCV ROC分析 的AUC分别为0.980、0.996、0.987,以小鼠血清封闭法AUC最大(图1和表3)。

表3 基于151例灰区标本处理前后Anti-HCV检测数据绘制ROC曲线下面积

图1 以确认试验结果为标准绘制的标本处理前后Anti-HCV的ROC
讨 论
裘宇容等[19]研究发现,与临床不符的丙型肝炎抗体阳性(电化学发光法及ELISA法)标本应用绵羊血清封闭人血清中的HA以排除干扰,检测封闭后标本的Anti-HCV,结果为阴性。雅培i2000SR运用CLIA法定性测定人血清中的Anti-HCV。整个检测过程首先将待检血清、项目稀释液、HCV抗原包被的顺磁微粒子混合。待检血清Anti-HCV和HCV抗原包被的微粒子充分结合。经过冲洗后,加入吖啶酯标记的鼠抗人荧光抗体,再次冲洗,将预激发液和激发液加入到反应液中,通过测定发光值判断待测血清中的HCV抗体含量。由于结合物中的荧光标记的抗体是鼠抗人抗体,而我们研究所选择的是正常小鼠血清封闭待测血清,所以有可能存在非特异性抗体后要再次复检。
Arya等[20]报道了一种用于检测和估计乳腺癌的生物标志物-人表皮生长因子受体2(HER2)的电容式传感器研制。该研究包括用于制备电化学平台的插入叉指金电极,采用与HER2亲和的巯基末端DNA适体制备生物识别层通过在叉指金表面上的自组装,用0.05%吐温20(PBST-20)阻断剂阻止表面的可用空间,从而阻止了非特异结合。在复检灰区标本的ARCHITECT i2000SR Anti-HCV时,本研究用终浓度为0.05%的Tween20(PBST-20),阻断重组HCV抗原表面未被Anti-HCV占据的可用空间,封闭了标本中干扰物的非特异性结合,从而提高了雅培i2000SR检测Anti-HCV的准确性。
此次研究结果表明,雅培i2000SR检测灰区标本时标本处理前和在小鼠血清和PBST封闭后对比,Anti-HCV与确认试验结果的一致性均明显增高,以小鼠血清封闭最为明显;ARCHITECT i2000SR检测Anti-HCV的灵敏度、特异度、阳性预测值、阴性预测值还有AUC都提高显著,其中正常小鼠血清封闭检验效能最为显著。证实用正常小鼠血清消除免疫干扰的效果最理想。
在实践中很难确定消除患者样本中所有干扰的阻断剂的准确用量,因为对于干扰的免疫反应性抗体在个体之间变化很大,所加入的阻断剂的有效性取决于其种类和亚类[21]。此次研究结果虽然表明利用小鼠血清封闭或PBST处理后检验效能会有很大提高,但是还是有少数假阳性标本在处理之后还会出现假阳性现象,而此样标本仍然需要进行HCV确认试验。RIBA检测的是丙型肝炎病毒感染者血液中的抗HCV抗体,主要用于一线筛查时丙型肝炎病毒检测显示阳性或不确定结果的二次确认试验[22]。
Chiu等[21]认为,当怀疑实验室数据和临床不一致时,实验室检测干扰可能需要使用另一种方法。Huang等[23]分别使用Elecsys电化学发光(ECL)和雅培化学发光微粒免疫分析(CMIA),采用双检法测定抗-HCV的策略,以减少抗-HCV检测中的假阳性;或使用附加阻断剂,或用非免疫血清中和稀释样本。实验室应意识到所有免疫分析的潜在干扰,以及人工结果如何可能导致误解、随后的错误诊断和不合理的治疗。这些干扰虽然是相对不常见的,但是临床医生需要意识到它们有存在的可能性,并警惕临床和生物数据的不匹配。王菊英等[24]研究发现,由于HCV RNA存在间歇性复制特点,可能会导致RIBA检测阳性而RNA检测阴性的情况发生;而要明确丙肝是否为现症感染,则需要检测HCV抗体阳性者血中HCV RNA载量[25],因此对这种异常测试结果的识别需要实验室和临床医生的持续监控。加强临床医生与临床实验室就意外事件的沟通,可避免基于异常的免疫检测结果的不适当临床干预。利益冲突所有作者均声明不存在利益冲突

