灵芝乙醇提取物对宫颈癌细胞生物学行为和JAK1/STAT3信号通路的影响
任 璐, 曹芹雪, 杨少琴
(河南大学淮河医院妇产科, 河南 开封 475000)
宫颈癌是临床常见的妇科生殖道恶性肿瘤之一, 多发生于子宫阴道部和宫颈管中[1]。我国宫颈癌发病率仅次于乳腺癌, 约占全球宫颈癌的30%, 病死率也处于较高水平[2]。临床中常联合多项治疗手段提高疗效, 但治疗过程中仍存在较多不良反应[3]。考虑宫颈癌患者的发病年龄趋向年轻化, 亟需寻找新的更加安全有效的治疗药物。灵芝乙醇提取物(ganoderma lucidum ethanol extract, GLEE)是担子菌纲多孔菌科灵芝属灵芝的有效活性成分, 具有抗菌、抗病毒和广泛的抗肿瘤活性, 在鼻咽癌、胰腺癌和胃癌等疾病中均有抑瘤作用[4-5]。研究[6-7]显示:其抗肿瘤活性主要通过影响细胞增殖和诱导细胞凋亡等途径发挥作用, 但其对宫颈癌的抑瘤作用途径尚不清楚。本研究检测不同浓度GLEE对宫颈癌HeLa 细胞增殖、迁移和侵袭的影响, 探讨其可能作用机制, 为临床治疗宫颈癌提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人宫颈癌HeLa 细胞(中国科学院上海细胞生物学研究所)。GLEE(纯度70%, 成都荣保生物科技开发有限公司), 兔抗β-actin 多 克 隆 抗 体、 兔 抗Janus 激 酶1 (Janus kinase 1, JAK1)、 磷 酸 化JAK1 (phophorylated JAK1, p-JAK1) 信号传导及转录激活因子3(signal transduction and transcription activator 3, STAT3)、磷酸化STAT3(phophorylated STAT3, p-STAT3)、细胞因子信号传导抑制蛋白3(suppressor of cytokine signaling 3, SOCS3)、活化STAT 蛋 白 抑 制 因 子 1 (protein inhibitor of activated STAT1, PIAS1) 多克隆抗体和山羊抗兔二抗IgG (北京中杉金桥生物技术有限公司), RPMI-1640 细胞培养基、胎牛血清、胰蛋白酶(美国Hyclone 公司), 1% 青-链霉素混合液(货号:ZY90307, 上海泽叶生物科技有限公司)。Bio-Tek Elx800 型全自动酶标仪(美国Bio-Tek 公司), CFX Connect 型实时荧光定量PCR (real-time fluorescence quantitative PCR, RT-qPCR) 仪(美国Bio-Rad 公司)。
1.2 细胞培养和分组将人宫颈癌HeLa 细胞常规培养于含10% 胎牛血清和青-链霉素混合液的RPMI-1640 细胞培养基中, 置于37 ℃、含5%CO2培养箱中培养。次日于显微镜下观察细胞状态, 待细胞生长至指数生长阶段进行传代冻存, 选取对数生长期细胞进行后续实验。将细胞分为对照组和低、中及高剂量GLEE 组, 显微镜下确认细胞生长状态良好且密度适宜即可进行干预, 采用二甲基亚砜(dimethyl sulfoxide, DMSO) 将GLEE 配置成10 g·L-1储备液, 使用时将细胞稀释液稀释到实验所需浓度。低、中和高剂量GLEE 组细胞分别加入25、50 和100 mg·L-1GLEE[8-9], 对照组细胞给予等量完全培养液, 继续培养24 h。
1.3 MTT 法检测各组细胞增殖抑制率收集对数生长期的HeLa 细胞进行实验, 采用0.25%胰蛋白酶消化细胞, 调整细胞密度为1×105mL-1, 将细胞接种于96 孔细胞培养板, 每孔100 μL。不同剂量GLEE 组加入GLEE 后培养24 和48 h 后, 设置5 个复孔, 另设空白组(不含细胞, 仅含培养液), 每孔加 入5 g·L-1MTT 溶液20 μL, 置入37 ℃、5%CO2培养箱中培养4 h, 弃去上清, 加入150 μL DMSO。采用全自动酶标仪检测490 nm 处细胞吸光度(A)值, 计算细胞增殖抑制率。细胞增殖抑制率=[1-(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)]×100%。
1.4 平板克隆形成实验检测各组细胞克隆形成率取对数生长期宫颈癌HeLa 细胞进行实验, 胰蛋白酶消化后制备细胞悬液, 细胞密度调整为5×102mL-1, 将细胞接种于6 孔细胞培养板, 按照“1.2”步骤所述给药后继续培养2 周。肉眼观察到细胞集落后停止培养, 弃上清, PBS 缓冲液清洗, 加入多聚甲醛固定, 结晶紫避光染色20 min, 观察细胞克隆形成数, 并计算细胞克隆形成率。细胞克隆形成率=细胞克隆形成数/接种细胞数×100%。
1.5 Transwell 小室法检测各组细胞的迁移细胞数和侵袭细胞数侵袭实验:取对数生长期宫颈癌HeLa 细胞进行实验, 将细胞按照“1.2”步骤给药培养48 h 后, 采用胰蛋白酶消化宫颈癌HeLa 细胞后制备细胞悬液(细胞密度调整为1×105mL-1)加入Transwell 小室上室(含有基质胶与无血清培养基混合稀释液100 μL), 下室加入含血清的完全培养液500 μL, 置入37 ℃、5%CO2培养箱中孵育48 h。取出Transwell 小室, 多聚甲醛固定20 min, 结晶紫染液染色10 min, PBS 缓 冲 液 溶 液 清洗3 次, 光学显微镜下拍照观察并计数侵袭细胞数。迁移实验:检测细胞迁移能力时无需在上室添加Matrigel 基质胶, 其余方法与侵袭实验相同, 观察迁移细胞数。
1.6 RT-qPCR 法检测各组细胞中JAK1 和STAT3 mRNA 表达水平取各组细胞, 采用TRIzol 法提取总RNA, 反转录试剂盒逆转合成cDNA。采用RT-qPCR 法进行扩增, 反应体系:SYBR Premix Ex TaqTMⅡ10 μL, 上、下游引物各1 μL, cDNA 样 品2 μ L, RNase Free ddH2O 6 μL。反应条件:95 ℃预变性5 min, 95 ℃变性25 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共循环40次。目的基因mRNA 表达水平=目的基因mRNA 表达水平/内参基因mRNA 表达水平。JAK1 引物:F 5'-AGTGCAGTATCTCTCCTCTCTG-3', R 5'-GATTCGGTTCGGAGCGTACC-3'; STAT3 引 物:F 5'-CACCTTGGATTGAGAGTCAAGAC-3', R 5'-AGGAATCGGCTATATTGCTGGT-3'; β -actin 引物:F 5'-GGCTGTATTCCCCTCCATCG-3', R 5'-CCAGTTGGTAACAATGCCATGT-3'。
1.7 Western blotting 法检测各组细胞中JAK1、p-JAK1、STAT3、p-STAT3、SOCS3 和PIAS1 蛋白表达水平取处理后的各组细胞加入RIPA 裂解液提取总蛋白, 冰上孵育30 min, 4 ℃、12 000 r·min-1离心10 min, 取上清液。BCA 法检测蛋白浓度, 蛋白上样量40 μg, 加入分离胶与浓缩胶, 电泳至溴酚蓝到达底部。将蛋白转至PDVF 膜上, 加入脱脂奶粉摇床封闭2 h, TBST 缓冲液冲洗后加入1∶1 000 稀释一抗, 4 ℃孵育过夜, 再次采用TBST 缓冲液冲洗加入1∶3 000 稀释二抗摇床封闭2 h, TBST 缓冲液清洗, 滴加ECL 发光液显影成像。采用凝胶成像分析仪采集图像, 以目的蛋白条带灰度值与内参β-actin 蛋白条带灰度值的比值作为目的蛋白表达水平。
1.8 统计学分析采用SPSS 23.0 统计软件进行统计学分析。各组细胞增殖抑制率、细胞克隆形成率、迁移细胞数、侵袭细胞数、细胞中JAK1 与STAT3 mRNA 表 达 水 平 和 JAK1、 p-JAK1、STAT3、p-STAT3、SOCS3 和PIAS1 蛋白表达水平以±s表示, 多组间比较采用单因素方差分析, 组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组宫颈癌HeLa 细胞增殖抑制率不同浓度GLEE 作用于宫颈癌HeLa 细胞24 和48 h 后, 与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞增殖抑制率升高(P<0.05);与低剂量GLEE 组比较, 中和高剂量GLEE 组宫颈癌HeLa细胞增殖抑制率升高(P<0.05);与中剂量GLEE组比较, 高剂量GLEE 组宫颈癌HeLa 细胞增殖抑制率升高(P<0.05)。与24 h 比较, 作用48 h后低、中和高剂量GLEE 组宫颈癌HeLa 细胞增殖抑制率升高(P<0.05)。见表1。
表1 作用24 和48 h 各组宫颈癌HeLa 细胞增殖抑制率Tab. 1 Inhibitory rates of proliferation of cervical cancer HeLa cells in varilous groups after treated for 24 and 48 h(n=3,±s,η/%)
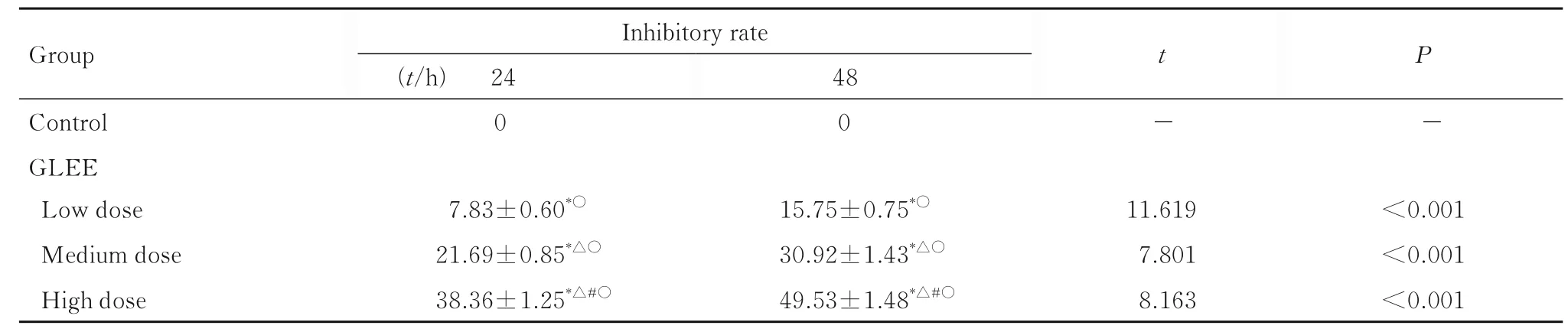
表1 作用24 和48 h 各组宫颈癌HeLa 细胞增殖抑制率Tab. 1 Inhibitory rates of proliferation of cervical cancer HeLa cells in varilous groups after treated for 24 and 48 h(n=3,±s,η/%)
*P<0.05 compared with control group;△P<0.05 compared with low dose of GLEE group;#P<0.05 compared with medium dose of GLEE group;○P<0.05 vs 24 h.“-”:No data.
Group Control GLEE Low dose Medium dose High dose Inhibitory rate(t/h) 24 0 48 0 t-P-7.83±0.60*○21.69±0.85*△○38.36±1.25*△#○15.75±0.75*○30.92±1.43*△○49.53±1.48*△#○<0.001<0.001<0.001 11.619 7.801 8.163
2.2 各组宫颈癌HeLa 细胞克隆形成率与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞克隆形成率降低(P<0.05);与低剂量GLEE组比较, 中和高剂量GLEE 组宫颈癌HeLa 细胞克隆形成率降低(P<0.05);与中剂量GLEE 组比较, 高剂量GLEE 组宫颈癌HeLa 细胞克隆形成率降低(P<0.05)。见表2。
表2 各组宫颈癌HeLa 细胞克隆形成率Tab. 2 Clone formation rates of cervical cancer HeLa cells in various groups (n=3,±s,η/%)

表2 各组宫颈癌HeLa 细胞克隆形成率Tab. 2 Clone formation rates of cervical cancer HeLa cells in various groups (n=3,±s,η/%)
*P<0.05 compared with control group;△P<0.05 compared with low dose of GLEE group;#P<0.05 compared with medium dose of GLEE group.
Group Control GLEE Low dose Medium dose High dose Clone formation rate 53.42±2.13 38.69±1.13*19.77±0.94*△6.04±0.58*△#
2.3 各组宫颈癌HeLa 细胞的迁移细胞数和侵袭细胞数与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞的迁移细胞数和侵袭细胞数减少(P<0.05);与低剂量GLEE 组比较, 中和高剂量GLEE 组宫颈癌HeLa 细胞的迁移细胞数和侵袭细胞数减少(P<0.05);与中剂量GLEE 组比较, 高剂量GLEE 组宫颈癌HeLa 细胞的迁移细胞数和侵袭细胞数减少(P<0.05)。见图1 和表3。
表3 各组宫颈癌HeLa 细胞迁移细胞数和侵袭细胞数Tab. 3 Numbers of migration and invasion cervical cancer HeLa cells in various groups (n=3, ±s)

表3 各组宫颈癌HeLa 细胞迁移细胞数和侵袭细胞数Tab. 3 Numbers of migration and invasion cervical cancer HeLa cells in various groups (n=3, ±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of GLEE group;#P<0.05 compared with medium dose of GLEE group.
Group Control GLEE Low dose Medium dose High dose Number of migration cells 112.61±6.31 Number of invasion cells 94.56±4.39 79.21±3.04*56.44±2.34*△37.91±1.22*△#93.29±5.28*66.38±2.57*△24.26±1.39*△#

图1 Transwell 小室实验检测各组宫颈癌细胞迁移(A-D)和侵袭(E-H)形态表现(结晶紫, ×200)Fig. 1 Migration(A-D) and invasion(E-H) morphology of of cervical cancer cells in various groups detected by Transwell chamber experiment(Crystal violet, ×200)
2.4 各组宫颈癌HeLa 细胞中JAK1 和STAT3 mRNA 表达水平与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞中JAK1 和STAT3 mRNA 表 达 水 平 降 低(P<0.05); 与 低 剂 量GLEE 组比较, 中和高剂量GLEE 组宫颈癌HeLa细胞中JAK1 和STAT3 mRNA 表达水平降低(P<0.05);与中剂量GLEE 组比较, 高剂量GLEE 组宫颈癌HeLa 细胞中JAK1 和STAT3 mRNA 表达水平降低(P<0.05)。见表4。
表4 各组宫颈癌中HeLa 细胞中JAK1 和STAT3 mRNA 表达水平Tab. 4 Expression levels of JAK1 and STAT3 mRNA in cervical cancer HeLa cells in various groups (n=3, ±s)

表4 各组宫颈癌中HeLa 细胞中JAK1 和STAT3 mRNA 表达水平Tab. 4 Expression levels of JAK1 and STAT3 mRNA in cervical cancer HeLa cells in various groups (n=3, ±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of GLEE group;#P<0.05 compared with medium dose of GLEE group.
Group Control GLEE Low dose Medium dose High dose JAK1 mRNA 1.04±0.08 STAT3 mRNA 0.95±0.07 0.64±0.04*0.49±0.03*△0.33±0.02*△#0.82±0.07*0.66±0.04*△0.41±0.02*△#
2.5 各组宫颈癌HeLa 细胞中JAK1、p-JAK1、STAT3、p-STAT3、SOCS3 和PIAS1 通路相关蛋白表达水平与对照组比较, 低、中和高剂量GLEE组宫颈癌HeLa 细胞中p-JAK1 和p-STAT3 蛋白表达水平降低(P<0.05), SOCS3 和PIAS1 蛋白表达水平升高(P<0.05);与低剂量GLEE 组比较, 中和高剂量GLEE 组宫颈癌HeLa 细胞中p-JAK1 和p-STAT3 蛋白表达水平降低(P<0.05), SOCS3和PIAS1 蛋白表达水平升高(P<0.05);与中剂量GLEE 组比较, 高剂量GLEE 组宫颈癌HeLa 细胞中p-JAK1 和p-STAT3 蛋白表达水平降低(P<0.05), SOCS3 和PIAS1 蛋白表达水平升高(P<0.05)。见图2 和表5。
表5 各组宫颈癌HeLa 细胞中JAK1/STAT3 信号通路相关蛋白表达水平Tab. 5 Expression levels of JAK1/STAT3 signaling pathway-related proteins in cervical cancer HeLa cells in various groups(n=3, ±s)

表5 各组宫颈癌HeLa 细胞中JAK1/STAT3 信号通路相关蛋白表达水平Tab. 5 Expression levels of JAK1/STAT3 signaling pathway-related proteins in cervical cancer HeLa cells in various groups(n=3, ±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of GLEE group;#P<0.05 compared with medium dose of GLEE group.
Group Control GLEE Low dose Medium dose High dose JAK1 0.79±0.05 p-JAK1 0.75±0.05 STAT3 0.84±0.07 p-STAT3 0.83±0.07 SOCS3 0.35±0.02 PIAS1 0.27±0.03 0.44±0.04*0.59±0.05*△0.76±0.06*△#0.72±0.05 0.74±0.04 0.76±0.03 0.61±0.05*0.43±0.04*△0.31±0.03*△#0.86±0.06 0.85±0.04 0.87±0.02 0.64±0.06*0.49±0.04*△0.27±0.02*△#0.48±0.04*0.64±0.04*△0.81±0.06*△#

图2 各组宫颈癌HeLa 细胞中JAK1/STAT3 信号通路相关蛋白表达电泳图Fig. 2 Electrophoregram of expressions of JAK1/STAT3 signaling pathway-related proteins in cervical cancer HeLa cells in various groups
3 讨 论
根据病理类型, 宫颈癌又分为鳞癌、腺癌和腺鳞癌[7]。治疗方式除早期的手术治疗、基因治疗和热疗外, 还包括中晚期常用的放化疗[8]。宫颈癌患者死亡常见原因是肿瘤细胞的侵袭和迁移, 致使宿主多器官功能衰竭走向死亡[9]。抑制肿瘤细胞活性, 延长治疗时间是提高患者生存率的关键, 但宫颈癌细胞恶性程度较高, 部分患者即使经过手术治疗, 仍会出现复发和远处转移[10]。宫颈癌已成为仅次于乳腺癌后第二大高发病率和高病死率的妇科恶性肿瘤[11], 严重威胁患者生命健康和生活质量, 不断开发新型癌症药物对宫颈癌临床治疗有重大意义。
灵芝含多种生物活性成分, 其药理作用主要包括抗炎、降血糖、增强机体免疫力和抗癌等[12]。其中, GLEE 因富含三萜类化合物是灵芝最主要的药效成分, 具有较强的抗癌作用[13]。本研究采用不同浓度GLEE 处理体外培养的宫颈癌HeLa 细胞, 从分子机制层面探讨GLEE 对宫颈癌HeLa 细胞增殖、迁移和侵袭的影响, 结果显示:在MTT 实验和平板克隆实验中, 低、中和高剂量GLEE 组较对照组宫颈癌HeLa 细胞增殖抑制率明显升高, 细胞克隆形成率降低, 且呈现浓度-时间依赖性, 相同处理时间下以高剂量GLEE 组(100 mg·L-1)对细胞增殖率的抑制作用更为明显, 相同浓度条件下处理时间越长, 抑制作用更佳, 表明不同浓度GLEE能够导致宫颈癌HeLa 细胞生长活性受到抑制, 降低其增殖能力, 使其生长受阻滞。徐凤姣等[14]研究显示:GLEE 对胰腺癌、胃癌、乳腺癌、肝癌和宫颈癌细胞的增殖均有抑制作用。本研究结果显示:与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞的迁移细胞数和侵袭细胞数均处于下降趋势, 提示给予不同浓度GLEE 处理后, 宫颈癌HeLa 细胞的迁移能力与侵袭能力均受到抑制, 且呈现浓度依赖性。
JAK1/STAT3 信号通路是许多细胞因子进行胞外胞内信息传导的主要通路, 广泛参与细胞增殖、分化、凋亡和炎症反应等多种生理过程[15]。研究[16]显示:JAK1/STAT3 通路具有增强或维持肿瘤细胞增殖和自我更新能力的作用, 过度活化是肿瘤形成与发展的重要原因之一。影响该通路的活性可以在一定程度上抑制肿瘤细胞的增殖与自我更新能力[17]。本研究结果显示:与对照组比较, 低、中和高剂量GLEE 组宫颈癌HeLa 细胞中JAK1 和STAT3 mRNA 及蛋白表达水平均呈下降趋势, 而SOCS3 和PIAS1 蛋白表达水平明显升高, 表明GLEE 可能通过上调SOCS3 和PIAS1 蛋白表达水平, 降低宫颈癌HeLa 细胞中JAK1 和STAT3 蛋白表达, 从而降低宫颈癌细胞的增殖活性。JAK1/STAT3 通路调节方式是通过多途径共同作用, 与负调节因子和SOCS 蛋白家族共同抑制蛋白的表达和其他信号通路的相互影响等密切相关[18-19]。SOCS3 是SOCSs 蛋白家族中相对表达水平较高的蛋白之一, 当SOCS3 与特异性细胞因子受体结合后, 可产生抑制细胞因子, 从而负反馈调节JAK1/STAT3 通路, 而PIAS1 蛋白与活化的STAT3 结合后, 会使STAT3 蛋白失去特异性结合的转录活性[20], 表明GLEE 可能是通过影响宫颈癌细胞中JAK1/STAT3 信号通路活性, 降低细胞的迁移和侵袭能力。
综上所述, GLEE 对宫颈癌HeLa 细胞增殖、克隆形成、迁移和侵袭有一定的抑制作用, 有可能是通过上调SOCS3 和PIAS1 表达水平, 进而影响JAK1/STAT3 通路发挥作用。

