基于跨理论模型的集束化护理对胃肠道肿瘤患者术后肠内营养耐受性的影响
张丽,黄晓璐,邱珊
作为一种高发的消化系统恶性肿瘤,胃肠道肿瘤在所有恶性肿瘤的发病率中居第3 位,且呈逐年增加的趋势,采取根治性切除术是目前治疗胃肠道肿瘤的有效手段[1]。但手术涉及胃肠等器官,影响胃肠功能,大部分患者术后伴有营养不良。因此,改善患者的营养状况是胃肠道肿瘤术后护理的重点和难点[2]。肠内营养支持自问世以来就得到了广泛的应用。良好的营养支持可以提高患者免疫力及生活质量,减少并发症,同时管饲易于管理,也易于护理[3]。常规护理针对性不强,效果不显著[4]。跨理论模型是Prochaska 在20 世纪80 年代初提出的行为改变模型,针对不同阶段的个体采取不同的行为转化策略,以促进其向不同阶段转化[5]。集束化护理是将循证医学支持的3~5 项干预措施应用于护理,以优化护理服务[6]。集束化护理在维持早期肠内营养患者肠道屏障功能方面有明显作用,能够减轻并发症,提高术后肠内营养的耐受性[7]。目前,胃肠道肿瘤患者肠内营养的干预方式多样,但并未体现不同阶段、不同心态下干预方式的差异[8]。鉴于此,本研究探讨基于跨理论模型的集束化护理对胃肠道肿瘤患者术后肠内营养耐受性的影响,旨在为临床胃肠道肿瘤患者术后护理提供一定的参考依据。
1 对象与方法
1.1 研究对象
选取2018 年1 月至2021 年1 月恩施土家族苗族自治州中心医院收治的96 例胃肠道肿瘤术后患者作为研究对象,,根据入院先后顺序将其分为对照组(56 例,2018 年1 月至2019 年7 月入院)和观察组(40 例,2019 年8 月至2021 年1 月入院)。对照组56 例中,男36 例,女20 例;年龄30~76 岁[(60.12±6.54)岁];直肠癌16 例,结肠癌24 例,胃癌16 例;受教育年限2~20 年[(12.18±4.27)年]。观察组40 例中,男24 例,女16 例;年龄30~75 岁[(59.12±7.03)岁];直肠癌14 例,结肠癌16 例,胃癌10 例;受教育年限2~20 年[(12.17 ± 4.39)年]。纳入标准:(1)均行胃肠道肿瘤根治术;(2)符合手术指征;(3)年龄≥18 岁;(4)无认知障碍,交流正常;(5)所有患者均知情同意签署知情同意书。排除标准:(1)伴有其他脏器严重损伤;(2)胃肠功能障碍;(3)精神、听力、语言障碍;(4)术后发生严重并发症;(5)甲状腺功能减退。2 组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究已通过恩施土家族苗族自治州中心医院伦理委员会审查。
1.2 方法
对照组术后给予常规护理,包括纠正酸碱平衡,及时肠内营养支持,协助患者改变体位,引导患者在床上活动四肢(第1 天,1 次/2 h,5~10 min/次),术后(第2~3 天)下床活动。观察组在对照组基础上,采取基于跨理论模型的集束化护理干预方式。
1.2.1 建立干预小组 以护士长为组长,5 名临床经验丰富的护士为组员,建立基于跨理论模型的集束化护理小组。统一进行基于跨理论模型的集束化护理知识培训,以“胃肠道肿瘤术后肠内营养耐受性”“营养支持”等为关键词,搜索知网等数据库,收集相关文献,结合临床护理经验,确定基于跨理论模型的集束化护理措施。
1.2.2 具体措施 (1)早期床上活动。术后6 h,每隔2 h引导患者翻身1 次,若患者生命体征稳定,可引导其在床上活动。①上肢活动。双臂伸直,同时握紧和松开拳头、屈腕回位,2~4 个8 拍;顺时针转动手腕,逆时针回位,3~4 个8 拍。②下肢活动。双腿伸直并拢后,屈膝伸直,顺时针转动脚踝,逆时针回位,3~4 个8 拍,动作应缓慢,节奏为3 s/拍。以上活动每天10 次,每次5 min,动作应标准规范,后期活动量可根据患者的身体状况缓慢增加。(2)肠内营养支持。①前意向阶段。教授患者肠内营养知识,有针对性地指导讲解胃肠道肿瘤疾病相关知识,让患者了解营养不良的危害,介绍胃肠道肿瘤患者肠内营养的治疗优势,并帮助患者增强维持肠内营养的意识。生动地向患者说明,不进行肠内营养治疗,营养状况就无法改善,使患者树立坚持肠内营养的信心。让患者了解营养不良的后果,营养不良不仅会影响正常生活,还会影响药物疗效。鼓励患者积极寻求医务人员的帮助,邀请肠内营养效果良好的胃肠道肿瘤患者分享成功置管和坚持肠内营养的经验,使患者认识到坚持肠内营养的重要性。②意向阶段。自我评估和环境评估,帮助患者权衡肠内营养治疗的优缺点,向患者推荐正确的自我管理方法。邀请患者将营养不良时与健康时的生活状态和心理活动进行比较,鼓励他们表达自己的担忧,并帮助其分析原因。请患者家属讲述患者病情恶化和再次入院的感受。③准备阶段(住院期间)。选择重要公共场所,与患者制定短期目标,并鼓励其亲属参与肠内营养计划。改变不遵守肠内营养的行为和习惯,将肠内营养计划变成承诺书,公开宣读,将承诺书放在醒目的位置,家人每天监督患者实施肠内营养。患者出院前接受肠内营养培训,包括营养输注技术、鼻胃管的护理、常见并发症的防治等。④行动阶段(出院后)。以健康行为取代不健康行为。提醒患者将肠内营养液放置在易接近的地方,养成定期肠内营养的习惯。针对不同的个体,制定个性化目标,充分利用家庭支持、电话或门诊咨询帮助患者改变行为和习惯。⑤维持阶段(出院后)。当行为好转时,给予精神奖励。消除不良行为暗示,增加有利暗示。出院后每天电话或上门随访,了解患者每天肠内营养的实施情况。当患者回到前意向和意向阶段时,帮助患者找出原因并给出适当的建议。指导患者设置小闹钟等,每天通过微信告知患者肠内营养的实施时间。分别在干预前、干预3 个月、干预半年3 个时间点由护理小组成员根据患者回答情况完成肠内营养依从性调查问卷,评价患者肠内营养的依从性。(3)行为护理。①腹部按摩。术后6 h,患者取仰卧位,以肚脐为中心,护士闭合4 个手指,围绕切口顺时针按摩腹部(15 min/次,3 次/d)。手法遵循轻-重-轻的原则,按摩时注意保暖。②肛门收缩训练。术后第1 天,指导患者进行肛门收缩训练(10~20 min/次,1 次/2 h)。③嚼口香糖。引导患者咀嚼口香糖(5~10 min/次,1 次/4 h),嚼口香糖为假饲,可以促进胃肠蠕动。
1.3 观察指标
1.3.1 肠内营养依从性 参考Morisky 服药依从性量表[9],结合鼻胃管肠内营养的护理要点,自行设计肠内营养依从性调查问卷,共15 题,前14 题为2 种计分方式,分别为1 或0 分,第15 题有5 个选项(0~4 分),总分0~18 分,分值越高说明肠内营养依从性越高。分别在干预前、干预3 个月、干预半年3 个时间点由护理小组成员根据患者回答情况完成肠内营养依从性调查问卷,并进行评分统计。
1.3.2 血清营养学指标 术前1 d、术后14 d,采集患者空腹静脉血4 ml,分别用溴代十六烷基三甲胺法、溴甲酚绿比色法、比浊法检测血清白蛋白、血红蛋白、前白蛋白含量。
1.3.3 胃肠功能 记录2 组患者术后首次排气、肠鸣音恢复、进食、胃管留置及住院时间等。
1.3.4 术后肠内营养耐受性 观察术后至出院时并发症发生情况。(1)腹痛[10]:采用视觉模拟评分(visual analogue scale,VAS)标准实施评价,0 分:无痛感;1~3 分:轻微痛感;4~6 分:中度痛感;7~9 分:重度痛感;10 分:极度痛感;(2)腹胀[11]:同时符合以下体征的2 项及以上即认为发生腹胀:①视诊腹部膨隆,以中上腹为主;②触诊中上腹部压力增大;③叩诊腹部鼓音范围增大;④听诊肠鸣音减弱或消失;(3)腹泻[12]:若患者每天≥3 次水样便(水分占总粪便比例85% 以上),且粪便总重量≥200 g/d 则为腹泻;(4)记录患者恶心呕吐情况。
1.3.5 生活质量 采用SF-36 量表[13]评估患者干预前及出院时的生活质量,包括生理功能、社会功能等8 个方面,分值越高说明生活质量越好。
1.4 统计学处理
采用SPSS 20.0 软件进行数据分析。计数资料以百分比(%)表示,采用χ2检验或Fisher 精确概率检验法;计量资料以±s表示,组间比较采用t检验,两两比较采用配对样本t检验,多组间比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 观察组和对照组患者肠内营养依从性比较
干预前、干预3 个月、干预半年后2 组患者的肠内营养依从性比较,差异有统计学意义(P<0.05);干预3 个月、干预半年后观察组患者的肠内营养依从性高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 观察组和对照组患者肠内营养依从性比较(分,± s)
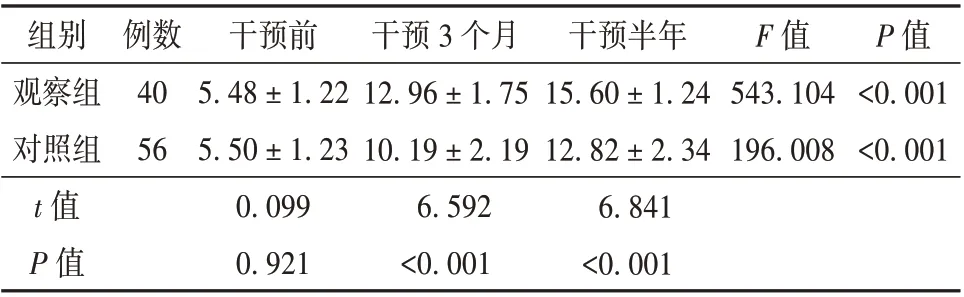
表1 观察组和对照组患者肠内营养依从性比较(分,± s)
组别观察组对照组t 值P 值例数40 56干预前5.48±1.22 5.50±1.23 0.099 0.921干预3 个月12.96±1.75 10.19±2.19 6.592<0.001干预半年15.60±1.24 12.82±2.34 6.841<0.001 F 值543.104 196.008 P 值<0.001<0.001
2.2 观察组和对照组患者血清营养学指标比较
术后14 d 2 组患者的血红蛋白、白蛋白、前白蛋白含量均高于术前1 d(P<0.05),且观察组高于对照组(P<0.05),差异有统计学意义。见表2。
表2 观察组和对照组患者血清营养学指标比较(g/L,± s)
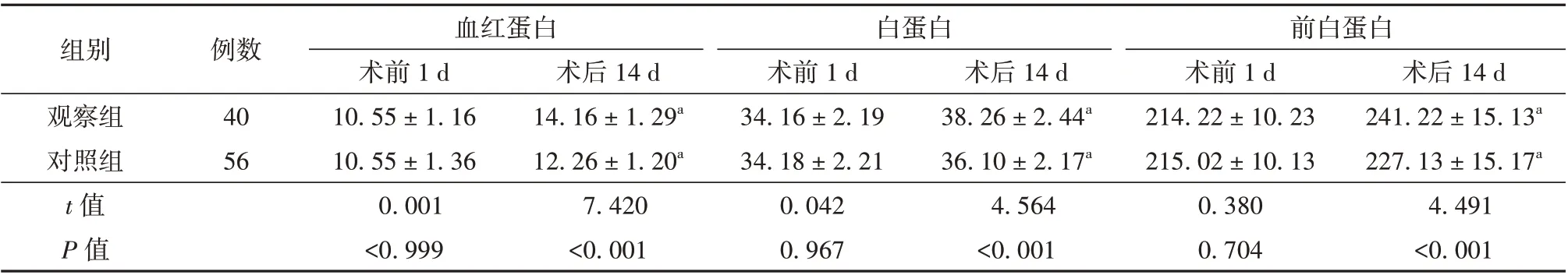
表2 观察组和对照组患者血清营养学指标比较(g/L,± s)
注:与术前1 d 比较aP<0.05
组别观察组对照组t 值P 值例数40 56血红蛋白术前1 d 10.55±1.16 10.55±1.36 0.001<0.999术后14 d 14.16±1.29a 12.26±1.20a 7.420<0.001白蛋白术前1 d 34.16±2.19 34.18±2.21 0.042 0.967术后14 d 38.26±2.44a 36.10±2.17a 4.564<0.001前白蛋白术前1 d 214.22±10.23 215.02±10.13 0.380 0.704术后14 d 241.22±15.13a 227.13±15.17a 4.491<0.001
2.3 观察组和对照组患者胃肠功能比较
观察组患者首次排气时间、肠鸣音恢复时间、进食时间、胃管留置时间、住院时间均短于对照组,差异有统计学意义(P<0.05)。见表3。
表3 观察组和对照组患者胃肠功能比较(± s)
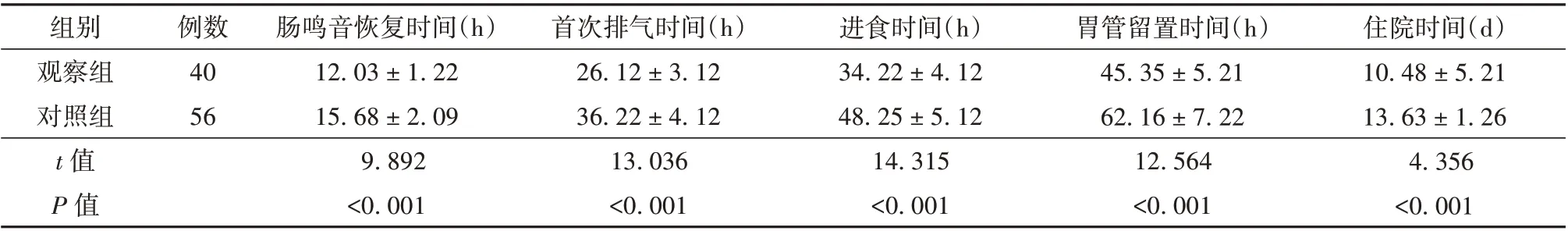
表3 观察组和对照组患者胃肠功能比较(± s)
组别观察组对照组t 值P 值例数40 56肠鸣音恢复时间(h)12.03±1.22 15.68±2.09 9.892<0.001首次排气时间(h)26.12±3.12 36.22±4.12 13.036<0.001进食时间(h)34.22±4.12 48.25±5.12 14.315<0.001胃管留置时间(h)45.35±5.21 62.16±7.22 12.564<0.001住院时间(d)10.48±5.21 13.63±1.26 4.356<0.001
2.4 观察组和对照组患者术后至出院时肠内营养耐受性比较
观察组患者腹痛评分、恶心呕吐、腹胀、腹泻发生率均低于对照组,差异有统计学意义(P<0.05)。见表4。
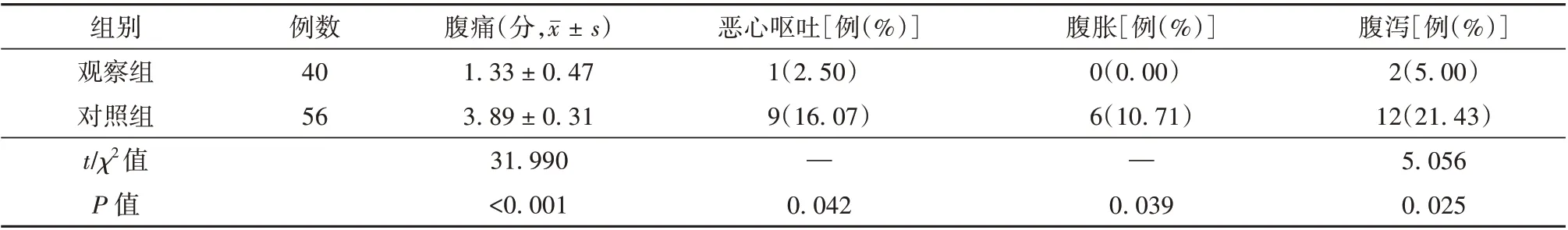
表4 观察组和对照组患者术后肠内营养耐受性比较
2.5 观察组和对照组患者生活质量评分比较
2 组患者出院时各项生活质量评分均高于干预前,且观察组高于对照组,差异有统计学意义(P<0.05)。见表5。
表5 观察组和对照组患者生活质量评分比较(分,± s)
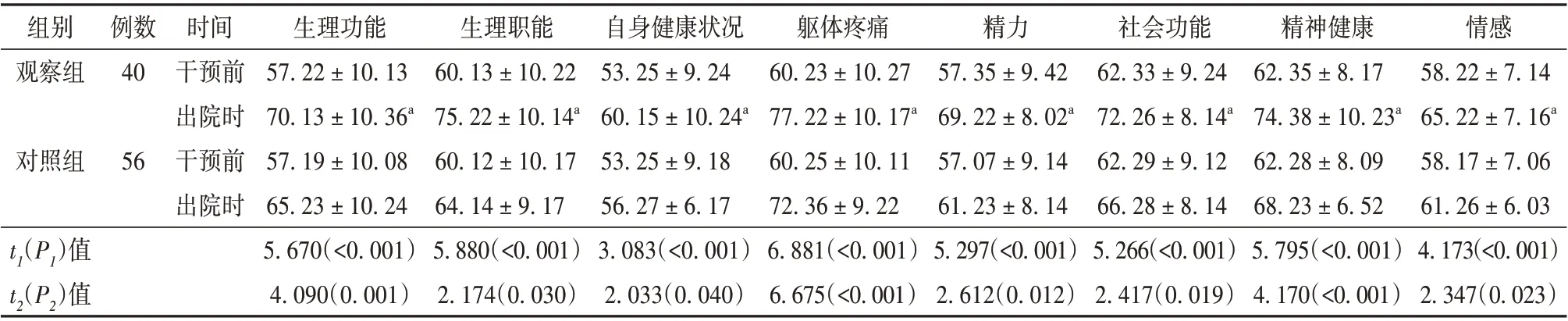
表5 观察组和对照组患者生活质量评分比较(分,± s)
注:与对照组出院时比较aP<0.05;t1(P1)值为观察组干预前后比较;t2(P2)值为对照组干预前后比较
组别观察组情感58.22±7.14 65.22±7.16a 58.17±7.06 61.26±6.03 4.173(<0.001)2.347(0.023)例数40对照组56时间干预前出院时干预前出院时t1(P1)值t2(P2)值生理功能57.22±10.13 70.13±10.36a 57.19±10.08 65.23±10.24 5.670(<0.001)4.090(0.001)生理职能60.13±10.22 75.22±10.14a 60.12±10.17 64.14±9.17 5.880(<0.001)2.174(0.030)自身健康状况53.25±9.24 60.15±10.24a 53.25±9.18 56.27±6.17 3.083(<0.001)2.033(0.040)躯体疼痛60.23±10.27 77.22±10.17a 60.25±10.11 72.36±9.22 6.881(<0.001)6.675(<0.001)精力57.35±9.42 69.22±8.02a 57.07±9.14 61.23±8.14 5.297(<0.001)2.612(0.012)社会功能62.33±9.24 72.26±8.14a 62.29±9.12 66.28±8.14 5.266(<0.001)2.417(0.019)精神健康62.35±8.17 74.38±10.23a 62.28±8.09 68.23±6.52 5.795(<0.001)4.170(<0.001)
3 讨论
目前,微创外科手术发展迅速。腹腔镜胃肠道肿瘤根治性切除术因能减少对腹部器官的损伤而被广泛应用[14]。研究发现,胃肠道肿瘤根治性切除术术后有约20% 的患者伴营养不良,这不但影响组织修复,还会增加手术并发症[15]。作为一种侵入性手术,根治性切除术会削弱胃肠功能调节作用,引起恶心、呕吐等并发症[16]。胃肠道肿瘤患者肠内营养的目的是促进热量和蛋白质摄入,减少术后并发症,纠正负氮平衡,保护患者的胃肠黏膜,减少术后感染[17]。通过精心护理,可有效减少肠内营养不耐受的发生[18]。
跨理论模型是近年来逐渐应用于患者健康行为变化的一种综合心理学研究方法[19]。基于跨理论模型的集束化护理策略,对于早期肠内营养支持更具标准化[20]。通过对营养状况的评价,控制营养液输注的浓度、速度和温度,加之全身肌肉运动以促进蛋白质合成,改善全身的营养状况,能够有效地提高其身体素质[21]。基于跨理论模型的集束化护理术后早期肠内营养可促进胃肠运动和术后早期排气[22]。
3.1 基于跨理论模型的集束化护理可提升胃肠道肿瘤患者术后的肠内营养依从性
本研究结果显示,观察组患者干预3 个月、干预半年的肠内营养依从性高于对照组,提示基于跨理论模型的集束化护理可提升胃肠道肿瘤患者术后的肠内营养依从性。对照组患者出院半年后依从性降低,主要原因是患者的营养状况好转,对继续肠内营养产生疑惑,或因经济压力过大自行停止。基于跨理论模型的集束化护理,根据不同阶段的个体制定相应的干预措施,将护理服务延伸至院外,医护工作者可随时掌握患者的肠内营养状况,有针对性地指导患者,使患者全面认识到肠内营养的必要性,继而提升其依从性[23]。
3.2 基于跨理论模型的集束化护理可改善胃肠道肿瘤患者术后的营养状态和胃肠功能
本研究结果显示,观察组患者术后14 d 白蛋白、血红蛋白、前白蛋白均高于对照组,观察组患者胃肠道功能恢复时间及住院时间均短于对照组,提示基于跨理论模型的集束化护理可改善胃肠道肿瘤患者术后的营养状态和胃肠功能。胃肠道肿瘤患者实施肠内营养时,应注意避免发生腹泻,可选择含膳食纤维的全营养配方,经厌氧发酵后产生短链脂肪酸,可有效预防腹泻;对患者实施肠内营养时,应严格遵守无菌操作,确保营养液温度适宜,避免发生腹泻;严密观察患者水、电解质和酸碱平衡,发现异常时及时采取纠正措施[24-25]。
3.3 基于跨理论模型的集束化护理可提高胃肠道肿瘤患者术后的肠内营养耐受性
本研究结果显示,观察组患者腹痛评分低于对照组,恶心呕吐、腹胀、腹泻发生率均低于对照组,提示基于跨理论模型的集束化护理可提高胃肠道肿瘤患者术后肠内营养耐受性。基于跨理论模型的集束化护理一方面可以根据患者早期肠内营养后的不同反应给予个体化的护理方案,进行正确有效的护理,提高耐受性;另一方面可使医护人员及时了解患者的心理状态,及早干预,增强患者信心[26]。
3.4 基于跨理论模型的集束化护理可改善胃肠道肿瘤患者术后的生活质量
本研究结果显示,观察组患者出院时各项生活质量评分均高于对照组,提示基于跨理论模型的集束化护理可改善胃肠道肿瘤患者术后的生活质量,与家属密切联系,全面发挥家庭的支持作用,使患者的幸福感提升,继而提高其生活质量[27-28]。
综上所述,基于跨理论模型的集束化护理可提升胃肠道肿瘤患者术后的肠内营养依从性,改善其术后营养状态和胃肠功能,提高其术后肠内营养耐受性,进而改善其生活质量。

