基于ICAM-5 mRNA表达探讨针刺治疗缺血性中风大鼠的作用机制研究
沈亚亭,谢西梅△,白 秀,白 桦,常小凡,唐园园,李秋宇
(1.西安市中医医院,陕西 西安 710014;2.陕西中医药大学,陕西 咸阳 712046)
脑卒中是全球范围内继癌症后导致成年人死亡的第二大病因,同时也是导致成年人伤残的主要原因,其中高达87%的全球卒中归因于缺血性卒中,严重危害人类健康[1-2]。缺血性中风的病理生理学极其复杂,涉及多个过程,其发生是由于脑部血液供应障碍,脑血流量降至临界水平以下,导致氧气和葡萄糖的输送不足,从而触发急性中风后的一系列病理生理事件,主要包括能量衰竭、兴奋性毒性、血脑屏障破坏、炎症和细胞凋亡等,最终导致不可逆的神经元死亡[3-5]。
研究表明[6-7],针刺是中医治疗缺血性中风的有效手段,有良好的抗氧化应激和脑保护作用,可挽救缺血半暗带周围将要坏死的神经元及促进损伤后神经功能恢复,其主要通过改善大脑缺血区域的血流、抑制炎症反应进程、促进中枢神经系统的神经形成和细胞增殖以及抗细胞凋亡等途径发挥疗效。研究已证实针刺对脑损伤的神经保护作用,同时ICAM-5也被发现广泛参与了脑卒中的病理生理过程[8-9]。因此,本研究以缺血性中风大鼠为研究载体,选用经典大脑中动脉闭塞再灌注损伤(Middle cerebral artery occlusion,MCAO)模型,观察针刺对缺血性中风后脑组织神经细胞形态和神经元凋亡及ICAM-5 mRNA表达的影响,探讨针刺治疗缺血性卒中的作用机制,为临床及研究工作者提供科学的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用SPF级成年雄性SD大鼠,体质量(250±30) g,实验前适应性喂养1周。实验动物由西安交通大学动物实验中心提供,许可证号:SCXK(陕)2018-001。饲养于陕西中医药大学实验动物科技中心动物房,保持温度23~25 ℃,湿度60%~65%,所有操作均严格按照中国伦理委员会有关动物研究指导原则进行。
1.1.2 主要试剂及仪器 HE染色液(珠海贝索BASO BA4025),TUNEL、DAPI染色液(AR1177)、Tunel细胞凋亡试剂盒-FITC(MK1018),TBS缓冲液(AR0031),抗荧光淬灭PVP封片液(AR0036),以上试剂均购于博士德生物;PCR,Trizol试剂(Invitrogen,美国,15596018);Loading buffer(上海威奥生物科技有限公司,WH1192);第一链cDNA合成试剂盒(Invitrogen,美国,K1622);qRT-PCR引物(QIAGEN,德国,208052);恒温箱(日本三洋,日本,MIR-262);荧光显微镜光镜(日本奥林巴斯,日本,BX51);全波长酶标仪购(ThermoFisher,美国,Mutiskan GO);梯度PCR仪(ThermoFisher,美国,Veriti DX);凝胶成像系统(上海天能科技有限公司,GIS-1600);荧光定量PCR仪(Roche,瑞士,Roche480Ⅱ Real Time PCR System)。
1.2 方法
1.2.1 缺血性脑卒中模型制备与评价 采用改良后大脑中动脉线栓法制备缺血性脑卒中模型[10],具体方法:用10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠,沿颈部前正中线切开皮肤,并钝性分离颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端,在靠近颈总动脉分叉处结扎颈外动脉,动脉夹夹闭颈内动脉远心端,随后在距离颈总动脉近分叉处剪一“V”形小口,将线栓从小口插入,松开动脉夹,缓慢向颈内动脉入颅方向推进,直至距离颈总动脉分叉处约(18.0±0.5)mm左右感到阻力时,停止进栓,缺血1 h后拔掉线栓,缝合颈部伤口。造模后的动物在自然苏醒后,参照 Zea-Longa[11]的5级4分评分标准对其神经障碍进行评分。0级(0分)无神经功能丧失;1级(1分)对侧前肢不能充分伸展;2级(2分)向对侧环行运动,轻度局灶神经功能丧失;3级(3分)向偏瘫侧倾倒,中度局灶神经功能丧失;4级(4分)不能自然行走,意识丧失。模型成功的标志为实验大鼠苏醒后Longa评分为1~3分并且无蛛网膜下腔出血。见图1。
图1 造模后大鼠图片
1.2.2 针刺治疗方法与分组 共募集92只大鼠,手术期间或之后死亡及造模不成功的大鼠共12只,余按照区组随机化法,分为正常组(A组n=10)、假手术组(B组n=24)、MCAO模型组(C组n=23)与MCAO模型+针刺组(D组n=23)。A组:正常饲养,不做干预;B组:仅将颈总动脉和颈外动脉、颈内动脉游离出来,不做结扎、插线处理,余操作同C组;C组:采用改良后大脑中动脉线栓法,制备缺血性脑卒中模型;D组:造模成功基础上,给予针刺治疗。选穴定位及操作参照华兴邦等[12]研制的大鼠穴位图谱,取“百会”“风池”“曲池”“合谷”“足三里”“阴陵泉”与“三阴交”穴,针刺操作均由经过统一培训的针灸医师完成,针灸针选用苏州医疗用品厂生产的一次性无菌华佗牌针灸针,规格:¢0.40 mm×13 mm,执行标准号:GB2024-1994;操作方法:穴位常规消毒后,百会穴,15 °角向后斜刺进针2 mm;双侧风池穴斜刺5 mm;余穴均直刺5~7 mm。均采用平补平泻针法,1次/d,每次留针30 min,15 min行针1次,造模成功后第2天开始治疗,5 d为1个疗程,1个疗程后休息2 d再进行下1个疗程,共进行2个疗程。非针刺组大鼠常规饲养,直至D组规定的针刺疗程结束。见图2。

图2 治疗中大鼠图片
1.2.3 检测指标 HE染色:将大鼠经心脏灌注4%多聚甲醛溶液,约100 mL,大鼠四肢肌肉抽搐、强直后取大脑皮层缺血半暗带组织,将其在4%多聚甲醛中固定过夜,常规石蜡包埋、切片(厚度8 μm)。采用石蜡切片,脱蜡至水:依次将切片放入二甲苯Ⅰ、Ⅱ,各20 min;无水乙醇Ⅰ、Ⅱ,75%的酒精,各5 min;自来水冲洗后烘干。苏木素浸染3 min,水洗后盐酸酒精分化液分化2 s,水洗后烘干。伊红染色浸染1 s,水洗3 s后100%酒精脱水2 s。最后用中性树胶封片。普通光学显微镜下,观察梗死灶情况并拍照。
TUNEL染色:取脑组织石蜡切片,常规脱蜡至水,标本片上滴加新鲜稀释的Proteinase K室温消化10 min,0.01 M TBS洗5 min×3次;标本片加标记缓冲液(Labeling Buffer)以保持切片湿润。置于样品湿盒中,37 ℃标记2 h,0.01 M TBS洗5 min×3次;滴加封闭液,37 ℃孵育30 min,甩掉封闭液,不洗;用抗体稀释液1∶100稀释生物素化抗地高辛抗体,混匀后加至标本片上。置于样品湿盒中,37 ℃标记2 h,0.01 M TBS洗5 min×3次;用抗体稀释液1∶100稀释SABC-FITC,混匀后加至切片上,37 ℃反应30 min,0.01 M TBS洗5 min×4次;DAPI染色液室温染色3 min,蒸馏水洗。抗荧光淬灭封片剂封片。由对分组不知情的研究人员使用400倍荧光显微镜在每个切片中随机观察2~3个不同视野。
实时定量PCR:按照TRIZOL试剂说明书提取总RNA,采用First Strand cDNA synthesis Kit(Invitrogen K1622)反转录试剂盒冰上加样。取上述逆转录产物PCR扩增ICAM-5,正义:5′-ctcatccgaactttccagcg-3′;反义:5′-caaggtcaatgtgaggctcg-3′,扩增产物长度135 bp。内参照β-actin引物序列,正义:5′-ctaaggccaaccgtgaaaag-3′;反义:5′-tacatggctggggtgttga-3′,扩增产物长度64 bp。PCR扩增使用了10 μL反应体系(包含1.5 μL H2O 、5 μL 2×SYBGEEN PCR mix、1 μL Primer和2.5 μL cDNA),反应条件为:变性95 ℃,2 min,退火95 ℃,5 s,延伸60 ℃,10 s,反应进行45个循环,PCR反应结束后,将PCR反应液从60 ℃缓慢升温到95 ℃,以获取溶解曲线。ICAM-5的转录水平通过循环阈值(Ct)方法定量,并通过与β-actin的比值将结果归一化。
2 结果
2.1 针刺对缺血性脑卒中大鼠神经细胞形态及神经元凋亡的影响
2.1.1 HE染色结果 高倍镜(200×)下A组和B组均可见大鼠脑组织结构清晰完整,神经细胞排列及形态正常,胞膜完整,胞质丰富,核仁清楚;与A组相比,C组脑组织可见明显的缺血及梗死灶,大鼠脑神经元结构发生显著改变,细胞间隙增大,胞体肿胀变形,排列紊乱,核仁变浅或缺失,呈明显的病理学改变;与C组比较,D组缺血区正常与坏死细胞相间存在,细胞轮廓较清晰,仅出现少量细胞排列紊乱,细胞形态有显著改善。见图3。

图3 各组大鼠脑组织神经元HE染色(200×)
2.1.2 TUNEL染色结果 A组和B组的大鼠大脑皮层几乎未发现凋亡细胞(P>0.05);与B组相比,C组大鼠脑组织神经细胞凋亡明显增多,与C组相比,D组大鼠脑组织神经细胞凋亡明显减少,差异具有统计学意义(P<0.05)。见图4。
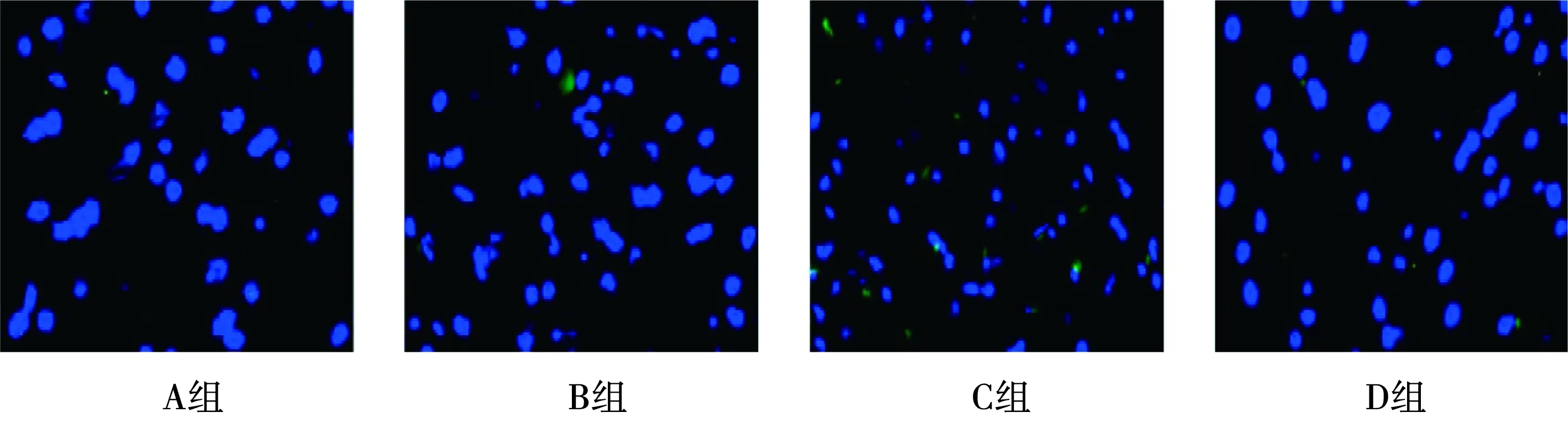
图4 TUNEL染色检测各组大鼠脑组织中的细胞凋亡(400×)
2.2 针刺对中风大鼠缺血脑组织ICAM-5基因转录水平的影响
RT-qPCR检测ICAM-5 mRNA的表达,结果显示:A组和B组大鼠脑组织中的ICAM-5 mRNA表达水平差异无统计学意义(P>0.05);C组、D组大鼠脑组织中的ICAM-5 mRNA表达水平较A组、B组均降低(P<0.01);但与C组相比,D组大鼠脑组织中的ICAM-5 mRNA表达水平明显升高,差异具有统计学意义(P<0.01)。见表1、图5。
表1 各组大鼠缺血脑组织ICAM-5 mRNA表达
图5 ICAM-5 Real-time溶解曲线
3 讨论
缺血性脑卒中的病理机制非常复杂,其中细胞凋亡在缺血性中风的发生发展中起着至关重要的作用。因此通过神经保护疗法来抑制细胞凋亡是当前治疗缺血性脑损伤的重要靶点。研究已证实针刺对缺血性脑损伤的神经保护作用,同时ICAM-5也被发现广泛参与了脑卒中的病理生理过程,具有促进神经元生长、营养神经和抗神经元凋亡等重要作用,可在缺血缺氧条件下对神经元起保护作用。本研究发现建立局灶性脑缺血再灌注模型能够明显降低ICAM-5的表达,说明大鼠脑缺血后会抑制ICAM-5的表达;给予模型组针刺治疗后,能够显著升高ICAM-5的表达,同时能明显降低脑缺血对神经功能的损伤,减少脑组织变形坏死范围,减轻神经细胞凋亡,说明针刺治疗脑缺血大鼠可上调ICAM-5的表达从而起到脑保护作用。
已有大量研究证实脑缺血损伤后针刺治疗可起到神经保护的作用[13]。朱氏等[14]制备脑缺血再灌注大鼠模型,并与针刺治疗后进行对比观察,发现针刺能减轻脑缺血导致的神经缺损行为异常,缩小梗塞面积;罗氏等[15]研究发现,针刺督脉可减少脑神经细胞凋亡,从而治疗脑缺血;林氏[16]等研究发现针刺可通过调控相关脑神经细胞凋亡基因表达水平,达到保护正常神经细胞,减少凋亡细胞数量的效果。本研究发现针刺可降低脑缺血对神经功能的损伤,减少脑组织变形坏死范围,减轻神经细胞凋亡。
细胞间黏附分子-5(ICAM-5)是黏附分子免疫球蛋白超家族成员之一,只在神经细胞表面表达,具有促进神经元生长、营养神经和抗神经元凋亡等重要作用,可在缺血缺氧条件下对神经元起保护作用[17-18]。Guo等研究发现,在局灶性脑缺血小鼠模型中,缺血区脑组织中ICAM-5水平下降[8]。杨氏等通过细胞实验表明,缺血缺氧环境可抑制ICAM-5的表达,而ICAM-5蛋白表达在缺血缺氧环境中具有神经保护作用,可以减轻缺血缺氧所致的细胞凋亡,促进细胞存活[9]。本研究发现模型组ICAM-5 mRNA表达水平较正常组和假手术组均下降;而给予针刺治疗后ICAM-5 mRNA表达水平明显高于MCAO模型组,且参照HE染色脑组织变性坏死范围及神经细胞凋亡数目,说明针刺的脑保护作用可能与上调了脑缺血大鼠ICAM-5的表达有关,本研究与先前学者研究结果一致[8-9,16]。
综上所述,针刺可改善大鼠脑缺血损伤,其机制可能与上调ICAM-5 mRNA表达,进而增强神经保护作用和减轻细胞凋亡有关。这些结果为ICAM-5参与脑卒中的生理病理过程提供了新的证据,并为针刺治疗脑卒中的疗效提供客观依据。

