清热活血汤改善大鼠心肌缺血再灌注损伤的药效成分及作用机制研究 Δ
李睿 ,纪树亮 ,章洁淳 ,孙治中 ,杨晓丹 ,刘煜德 ,邝枣园 ,卿立金 ,吴伟 (.广州中医药大学第一附属医院心血管科,广州 000;.广州中医药大学第一临床医学院,广州 000;.广州医科大学附属中医医院呼吸科,广州 000;.广州中医药大学基础医学院,广州 000)
随着再灌注治疗如经皮冠脉介入术(percutaneous coronary intervention,PCI)的普及,急性心肌梗死(acute myocardial infarction,AMI)的病死率显著降低。然而,随着冠心病患者数量逐年增加,AMI-PCI术后无复流现象、微循环障碍、心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)等并发症日益突出[1]。广东省名中医吴伟教授基于冠心病热毒血瘀病机所创制的清热活血汤(由毛冬青、黄芩、川芎、赤芍、降香、红花、丹参组成)是广州中医药大学第一附属医院治疗AMI-PCI术后的协定方剂,已广泛运用于临床20余年,疗效确切。为使更多患者获益,医院拟对其进行制剂开发及成果转化。本课题组前期研究表明,清热活血汤能改善AMI-PCI术后患者围术期临床症状、短期及远期预后,减少心血管终点事件的发生,且可通过调控自噬改善AMI模型大鼠的心肌组织损伤[2―4],但对MIRI的影响及具体机制尚未明确。超高效液相色谱质谱联用(ultraperformance liquid chromatography-tandem mass spec‐trometry,UPLC-MS)技术具有高通量、高分辨率、高灵敏度的特点,适用于分析包括难挥发或热稳定性差的代谢产物。本研究旨在探讨清热活血汤对MIRI模型大鼠的改善作用,并基于UPLC-MS技术分析其药效成分及相关机制,为后续制剂开发提供思路。
1 材料
1.1 主要仪器
本研究所用主要仪器有BL-420I型动物信号采集与处理系统(成都泰盟科技有限公司),Pannoramic MIDIⅡ型数字病理切片扫描仪(济南丹吉尔电子有限公司),TGL-16MS型台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司),LNG-T98型冷冻浓缩离心干燥器(太仓市华美生化仪器厂),QE型高分辨质谱仪[赛默飞世尔科技(中国)有限公司];Nexera UPLC型高效液相色谱仪(日本Shimadzu公司)。
1.2 主要药物与试剂
清热活血汤的中药配方颗粒由广东一方制药有限公司生产,其方剂组成为黄芩15 g、毛冬青30 g、丹参30 g、赤芍15 g、川芎15 g、降香6 g、红花10 g。戊巴比妥钠盐(货号57330)购自美国Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号A001-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(货号A005)、丙二醛(malondialdehyde,MDA)试剂盒(货号A003-1)均购自南京建成生物科技有限公司;多聚甲醛固定液(货号G1101-500ML)、苏木素-伊红(HE)染液试剂盒(货号G1003)、TUNEL试剂盒(货号G1501)均购自武汉赛维尔生物科技有限公司;L-2-氯苯丙氨酸(内标,批号C2001,纯度98%)购自上海恒创生物科技有限公司。
1.3 动物
本研究所用动物为SPF级雄性SD大鼠,5~7周龄,体质量180~220 g,共42只,购自南方医科大学实验动物中心,动物生产许可证号为SCXK(粤)2021-0041。大鼠饲养于广州中医药大学第一附属医院SPF级动物房,实验动物的使用遵循3R原则。所有实验操作均获得广州中医药大学第一附属医院实验动物伦理委员会的审批,批准号为TCMF1-2021044。
2 方法
2.1 动物分组、造模与给药
将SD大鼠适应性喂养1周后,随机分为假手术组,模型组,清热活血汤低、中、高剂量组(4.94、9.88、19.79 g/kg,参考文献[5]方法进行人鼠等效剂量换算,中剂量为等效剂量),清热活血汤含药血清组(19.79 g/kg),空白血清组,每组6只。各给药组大鼠灌胃相应药物,空白血清组、假手术组、模型组灌胃等量生理盐水,每天1次,连续2周。于末次给药12 h后,模型组和清热活血汤各剂量组复制MIRI大鼠模型,假手术组仅穿线不结扎,具体参考文献[6]进行造模:大鼠腹腔注射2%戊巴比妥钠(1.5 mL/kg)进行麻醉,行气管内插管并连接呼吸机辅助通气,钝性分离皮下各层肌肉后剪断第3肋骨以暴露心脏,在肺动脉圆锥与左心耳交界下2 mm处用带有5-0缝合线的圆针进针,对冠脉左前降支近中段行活结结扎(进针深度2 mm,宽度3~4 mm);缺血(左室前壁心肌发白、心电图ST段抬高0.1 mV以上为缺血标志)30 min后松开活结再灌注90 min,若再灌注时左室前壁缺血心肌部分恢复红润,且心电图ST段下降50%以上则造模成功。后续取上述5组大鼠全血及心脏组织进行实验。空白血清组和清热活血汤含药血清组大鼠不进行MIRI造模,于末次给药2 h后经腹主动脉取血,血样室温静置2 h后,以3 000 r/min离心15 min,取上清液,置于-80 ℃冰箱中保存备用。
2.2 大鼠心脏组织病理学形态观察
将“2.1”项下假手术组、模型组和清热活血汤各剂量组大鼠心脏组织使用预冷0.9%氯化钠溶液清洗后固定于4%多聚甲醛中24 h,然后进行梯度乙醇脱水、二甲苯透明、石蜡包埋及切片。根据试剂盒说明书方法操作,取上述部分切片(剩余部分进行细胞凋亡水平检测)以二甲苯脱蜡、梯度乙醇水化后,进行HE染色,采用数字病理切片扫描仪观察大鼠心脏组织的病理学形态变化。
2.3 大鼠心脏组织中细胞凋亡水平的检测
取“2.2”项下剩余切片按TUNEL试剂盒说明书方法操作后,采用数字病理切片扫描仪扫描观察,并随机选取6个视野使用Image J软件计算心脏组织细胞凋亡率,细胞凋亡率(%)=绿色荧光细胞数/蓝色荧光细胞数×100%。
2.4 大鼠清热活血汤含药血清和空白血清的UPLCMS分析
2.4.1 血清样本的预处理 将“2.1”项下空白血清组和清热活血汤含药血清组的血清样本取出解冻,移取样本100 μL,加入内标(0.06 mg/mL L-2-氯苯丙氨酸)20 μL,涡旋震荡10 s;加入蛋白沉淀剂300 μL涡旋震荡1 min,再于冰水浴中超声(功率360 W,频率40 kHz,下同)提取10 min后,于-20 ℃条件下静置30 min;静置后,将样本于4 ℃条件下以13 000 r/min离心10 min,取上清液200 μL装入UPLC-MS进样小瓶中挥干溶剂。样本残渣以300 μL甲醇复溶(涡旋30 s,超声3 min)后,离心10 min,吸取上清液150 μL,以0.22 μm微孔滤膜过滤后,进行UPLC-MS分析。每组平行6份样本。
2.4.2 UPLC-MS条件 (1)色谱条件:色谱柱为ACQUITYUPLC HSS T3(100 mm×2.1 mm,1.8 μm);柱温为45 ℃;流动相为0.1%甲酸(A)-乙腈(B,含0.1%甲酸),梯度洗脱(0~2 min,5%B;2~4 min,5%B→30%B;4~8 min,30%B→50%B;8~10 min,50%B→80%B;10~14 min,80%B→100%B;14~15 min,100%B;15~16 min,100%B→5%B);流速为0.35 mL/min;进样体积为2 μL。(2)质谱条件:离子源为ESI;质荷比扫描范围为100~1 200;一级全扫描分辨率为7×105;喷雾电压(V)为3 500(+)、-3 000(-);鞘气流速(Arb)为40(+)、35(-);辅气流速(Arb)为10(+)、8(-);毛细管温度为320 ℃;质谱信号采集分别采用正负离子扫描模式。
2.4.3 数据预处理 UPLC-MS原始数据采用Progenesis QI v2.3软件进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化。化合物的鉴定基于精确质量数、二级碎片及同位素分布,并使用HMDB(http://www.hmdb.ca/)、Lipidmapsv2.3(https://dev.lipidmaps.org/)和METLIN(http://enigma.lbl.gov/metlin/)数据库进行定性分析。笔者基于提取出的数据,将组内缺失值(即离子峰值为0)>50%的化合物的所有离子峰以极小值的1/2进行替换,并根据化合物定性结果打分进行筛选[筛选标准为≥36分(满分60分);<36分视为定性结果不准确,则排除[7]],最后将正负离子数据合并为一个数据矩阵表,后续研究则以此表为基础进行分析。
2.4.4 药效成分分析 基于“2.4.3”项下鉴定所得化合物,以P<0.05、差异倍数(fold change,FC)≥1.2为筛选条件,筛选清热活血汤含药血清相对于空白血清含量较高的化合物,然后与黄芩、毛冬青、川芎、赤芍、降香、红花、丹参在TCMSP(https://old.tcmsp-e.com/tcmsp.php)、SYMMAP(http://www.symmap.org/)、HERB(http://herb.ac.cn/)数据库中收录的化学成分进行交集,以确认清热活血汤含药血清中的主要药效成分。
2.4.5 差异代谢物及代谢通路分析 基于“2.4.3”项下鉴定所得化合物,采用主成分分析(principal component analysis,PCA)、偏最小二乘分析(partial least squares dis‐crimination analysis,PLS-DA)及正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)来区分清热活血汤含药血清组与空白血清组之间代谢轮廓的总体差异[7]。采用OPLS-DA中变量重要性投影(variable importance in projection,VIP)值及t检验筛选组间差异代谢物(筛选标准为VIP值>1,P<0.05)[8]。 采 用 HMDB、METLIN、KEGG(https://www.kegg.jp/)数据库对差异代谢物进行指认并基于KEGG数据库进行代谢通路富集分析。
2.5 大鼠血清中氧化应激指标水平的检测
取假手术组、模型组和清热活血汤低、中、高剂量组大鼠的全血样本适量,于4 ℃下以3 000 r/min离心15 min。取上清液,根据试剂盒说明书方法操作后,采用比色法检测大鼠血清中SOD、MDA、GSH-Px水平。
2.6 统计学方法
实验数据采用SPSS 24.0进行统计学分析,计量资料符合正态分布以±s表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验(方差齐时)或Dunnett’s T3检验(方差不齐时)。检验水准α=0.05。
3 结果
3.1 大鼠心脏组织病理形态学观察结果
假手术组大鼠心肌细胞纤维排列整齐、肌节清晰紧密。模型组大鼠大部分心肌细胞肿胀变形、肌丝断裂,组织间隙水肿、白细胞浸润较明显。清热活血汤各剂量组心肌细胞紊乱、心肌纤维断裂有所改善,且随着给药剂量的增加,改善越明显。结果见图1。

图1 各组大鼠心脏组织的病理形态学显微图(HE染色,×200)
3.2 大鼠心脏组织中细胞凋亡水平的检测结果
与假手术组[(1.25±0.34)%]比较,模型组大鼠心脏组织中细胞凋亡率[(38.62±5.75)%]显著升高(P<0.05)。与模型组比较,清热活血汤低、中、高剂量组大鼠心脏组织中细胞凋亡率[分别为(24.59±1.17)%、(21.41±3.03)%、(15.86±3.06)%]均显著降 低(P<0.05),且清热活血汤高剂量组细胞凋亡率显著低于中、低剂量组(P<0.05)。结果见图2。

图2 各组大鼠心脏组织中细胞凋亡的荧光图(TUNEL染色,×200)
3.3 清热活血汤含药血清的药效成分分析
清热活血汤含药血清中相对含量较高的化学成分共有1 137种,与黄芩、毛冬青、川芎、赤芍、降香、红花、丹参在相关数据库中所收录的1 402种化学成分进行交集后,得出清热活血汤含药血清中共有20种主要药效成分,包括黄芩苷、琥珀酸、黄芩素、隐丹参酮、异阿魏酸、原儿茶醛、丹酚酸G、3,4-二羟基肉桂酸、异红花素等,其中黄芩苷的相对含量较高。结果见图3、表1。

表1 清热活血汤含药血清中的主要药效成分
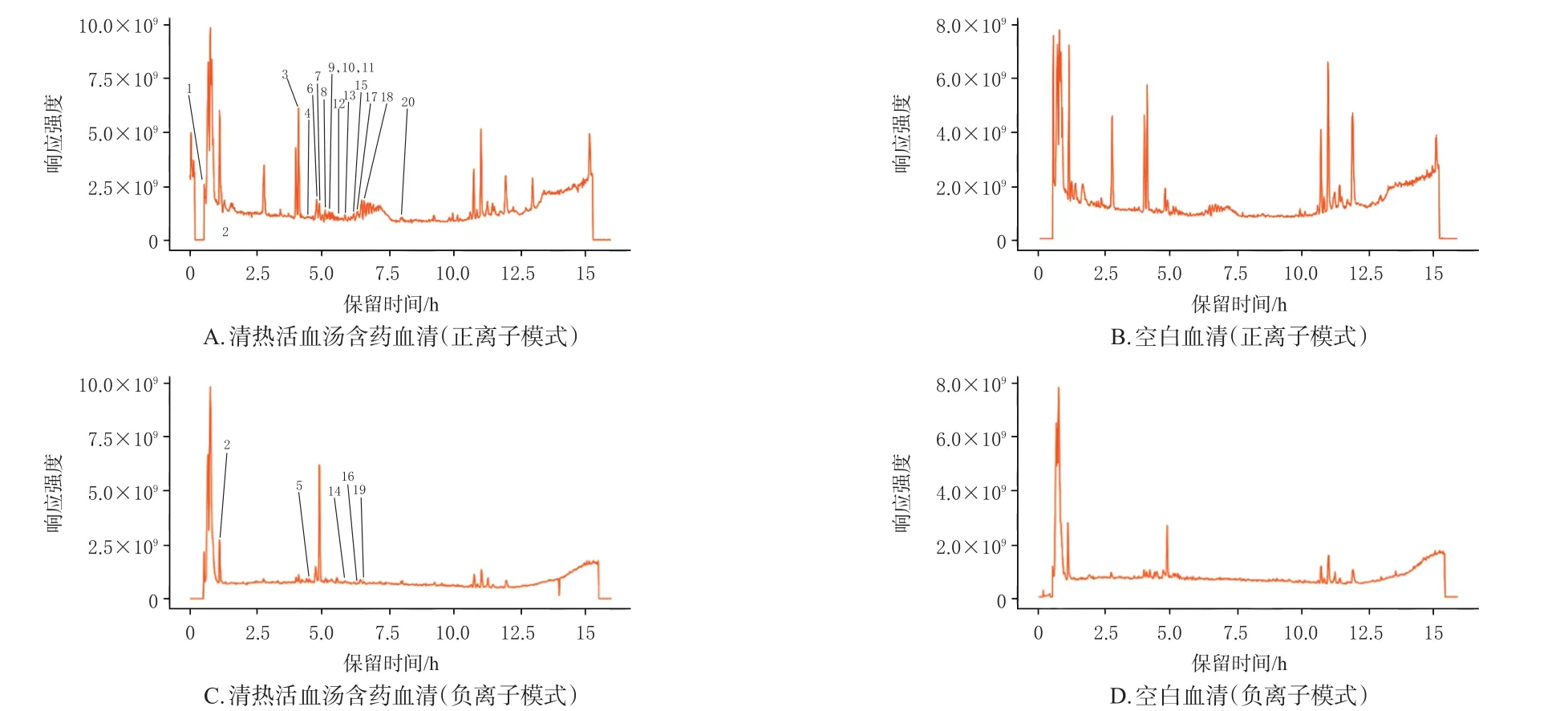
图3 正、负离子模式下清热活血汤含药血清代谢成分的总离子流图
3.4 差异代谢物的多元统计学分析结果
清热活血汤含药血清组和空白血清组的血清样本数据经无监督PCA模型(R2X=0.577)及PLS-DA模型(R2X=0.807,R2Y=0.997,Q2=0.97)预测后发现,模型可靠性较好,组间总体代谢成分存在差异。进一步经OPLS-DA 模型(R2X=0.731,R2Y=0.986,Q2=0.908)预测后发现,R2Y和Q2均接近于1,结合Splot-OPLS-DA图结果提示两组间血清总体代谢谱差异显著。结果见图4。
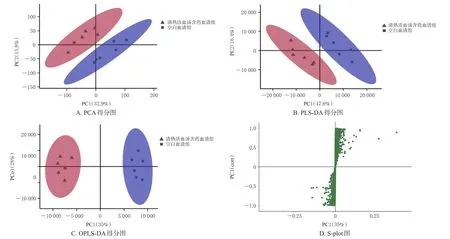
图4 清热活血汤含药血清组和空白血清组大鼠血清样本的多元统计学分析结果
3.5 差异代谢物的通路富集分析
本研究共筛选出29种差异代谢物,共参与35条代谢通路。其中,清热活血汤可上调L-异亮氨酸、左旋精氨酸、柠檬酸、谷胱甘肽、β-D-葡萄糖、左旋肉碱、瓜氨酸、异丙肾上腺素、D-核糖、D-葡萄糖醛酸等15种代谢物水平(P<0.05),可下调花生四烯酸、3-磷酸-d-甘油磷酸酯、亚油酸、二十二碳六烯酸、磷脂酰胆碱、溶血磷脂酰胆碱、棕榈酰肉碱、4-羟脯氨酸、葡萄糖苷酸、碘化酪氨酸等14种代谢物水平(P<0.05)。上述差异代谢物主要涉及精氨酸生物合成、亚油酸代谢、柠檬酸循环、糖酵解/糖异生途径、磷酸戊糖途径、脂质降解调节、血管平滑肌收缩、铁死亡、瞬时感受器电位(transient receptor potential,TRP)通道炎症介质调节,以及哺乳动物雷帕霉素靶蛋白(mamma‐lian target of rapamycin,mTOR)信号通路等代谢途径。
3.6 大鼠血清中氧化应激指标水平的检测结果
与假手术组比较,模型组大鼠血清中MDA水平显著升高(P<0.05),SOD、GSH-Px水平均显著降低(P<0.05);与模型组比较,清热活血汤各剂量组大鼠上述指标(低剂量组SOD除外)水平均显著逆转(P<0.05),且具有一定的剂量依赖趋势。结果见表2。
表2 各组大鼠血清中氧化应激指标水平的检测结果(±s,n=6)
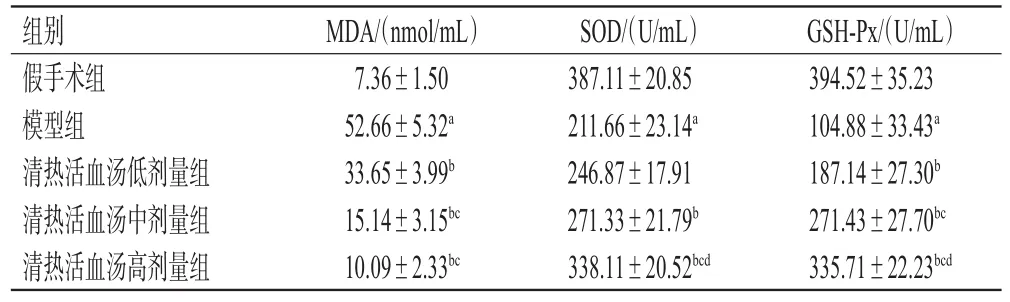
表2 各组大鼠血清中氧化应激指标水平的检测结果(±s,n=6)
a:与假手术组比较,P<0.05;b:与模型组比较,P<0.05;c:与清热活血汤低剂量组比较,P<0.05;d:与清热活血汤中剂量组比较,P<0.05
GSH-Px/(U/mL)394.52±35.23 104.88±33.43a 187.14±27.30b 271.43±27.70bc 335.71±22.23bcd组别假手术组模型组清热活血汤低剂量组清热活血汤中剂量组清热活血汤高剂量组MDA/(nmol/mL)7.36±1.50 52.66±5.32a 33.65±3.99b 15.14±3.15bc 10.09±2.33bc SOD/(U/mL)387.11±20.85 211.66±23.14a 246.87±17.91 271.33±21.79b 338.11±20.52bcd
4 讨论
心肌梗死面积是AMI患者预后的决定性因素,再灌注治疗可诱发心肌缺血期间并不存在的损伤或使已有损伤加重,其所造成的心肌损伤甚至可达50%心肌梗死面积[9]。因此,抑制MIRI,减少心肌梗死面积,从而减少介入术后心力衰竭及心室重构的发生,是心肌保护治疗策略的重要方向。清热活血汤方中黄芩清热燥湿、泻火解毒,毛冬青清热解毒、活血通脉,君臣配伍为主药;丹参、赤芍、川芎、红花力佐活血化瘀之功,降香理气助使活血止痛;几者并用共奏清热解毒、活血化瘀之效。基于此,本课题组探讨了清热活血汤改善模型大鼠MIRI的药效成分及相关作用机制。
4.1 清热活血汤对MIRI模型大鼠的影响及药效成分分析
本研究结果显示,模型组大鼠心肌组织损伤严重,而清热活血汤各剂量组大鼠心肌组织损伤减轻,细胞凋亡率显著降低。应用UPLC-MS确认了清热活血汤含药血清中20种主要药效成分,包括黄芩苷、琥珀酸、黄芩素、隐丹参酮、异阿魏酸、原儿茶醛、丹酚酸G、3,4-二羟基肉桂酸、异红花素等。相关研究发现,黄芩苷可通过抑制Janus激酶/转录激活因子信号通路促进MIRI模型大鼠心肌巨噬细胞M2型极化,并通过抗炎、抗氧化、抑制内质网应激等作用改善MIRI模型大鼠的心肌损伤及血管内皮功能[10―12]。原儿茶醛可通过调节核因子κB信号通路抑制炎症反应,从而改善MIRI模型大鼠的心肌损伤[13]。隐丹参酮可通过上调心肌细胞中内皮型一氧化氮合酶的磷酸化水平,发挥保护心肌组织的作用[14]。3,4-二羟基肉桂酸可通过诱导MIRI模型大鼠心肌组织胞外信号调节激酶磷酸化,降低B细胞淋巴瘤2相关X蛋白表达,抑制大鼠心肌细胞凋亡[15]。这提示,上述成分可能是清热活血汤改善MIRI模型大鼠心肌损伤的药效成分基础。
4.2 清热活血汤改善MIRI的差异代谢物及代谢通路分析
4.2.1 改善心肌能量代谢 MIRI造成的缺血缺氧心肌于再灌注期间进一步损伤、凋亡或坏死,其病理生理机制涉及能量代谢障碍、氧化应激损伤、钙超载、内质网应激、细胞坏死与凋亡等多种机制[16]。其中,心肌能量代谢障碍是始发因素,缺血期间心肌细胞脂肪酸有氧代谢受到抑制,无氧糖酵解供能增加,导致乳酸等代谢物堆积;而再灌注期间脂肪酸氧化代谢增多,但脂肪酸的低效供能可导致细胞氧耗增多,同时糖有氧酵解被抑制而导致糖代谢的酸性中间产物进一步增加,造成细胞内酸中毒[17]。本研究结果显示,清热活血汤含药血清中涉及氨基酸合成通路的异亮氨酸、左旋精氨酸、瓜氨酸等代谢物,以及涉及柠檬酸循环、糖酵解/糖异生途径、磷酸戊糖途径的柠檬酸、D-核糖、D-葡萄糖醛酸、β-D-葡萄糖等代谢物均显著上调;其中,异亮氨酸、精氨酸又为生糖氨基酸,D-核糖是机体重要的五碳糖,可加快心肌细胞ATP合成。另外,清热活血汤含药血清中3-磷酸-d-甘油磷酸酯、二十二碳六烯酸、亚油酸、磷脂酰胆碱等脂质代谢物均显著下调,而脂肪酸β-氧化必需的辅助因子——左旋肉碱释放增加。这提示,清热活血汤可调节机体能量代谢途径,减少脂质代谢,促进非必需氨基酸合成、糖异生及糖酵解,进而改善MIRI。
4.2.2 调节炎症损伤、氧化应激及自噬通路 再灌注期间细胞能量供应仍不足,Na+-K+-ATP酶活性下降,导致大量Ca2+内流引发钙超载[18―19]。钙超载可激活氧自由基底物,从而加速活性氧(reactive oxygen species,ROS)形成,ROS可对磷脂膜、蛋白和DNA功能结构造成直接破坏[20―21],并激活核因子κB信号通路活性,促进炎症因子及炎症细胞的释放,进而加重心肌损伤;同时可引发细胞内质网应激及线粒体损伤,诱导细胞凋亡[22]。本研究结果显示,清热活血汤含药血清中涉及磷酸戊糖途径的D-核糖、β-D-葡萄糖代谢物及谷胱甘肽水平显著上调。磷酸戊糖途径的激活有助于维持谷胱甘肽水平,而谷胱甘肽是体内ROS的强效清除剂,有助于拮抗MIRI所致的心肌组织氧化应激损伤[23]。这提示,清热活血汤可通过抗氧化作用改善MIRI。
花生四烯酸次级产物血栓烷素A2和白细胞三烯具有促血小板聚集及促炎症作用,其羟化酶代谢产物20-羟基二十碳四烯酸具有收缩血管及诱导ROS生成、血管内皮紊乱及心肌细胞凋亡等作用[24];溶血磷脂酰胆碱具有促进血管平滑肌收缩、血小板聚集及诱导心肌动作电位紊乱和心肌细胞钙循环障碍的作用[25]。本研究结果显示,清热活血汤含药血清可下调涉及TRP通道炎症介质、铁死亡及血管平滑肌收缩代谢途径的溶血磷脂酰胆碱、花生四烯酸、棕榈酰肉碱水平,上调谷胱甘肽水平。上述代谢途径均与MIRI预后密切相关[26―27]。这提示,清热活血汤有助于改善MIRI所致的心肌组织炎症浸润、微循环障碍及氧化应激相关性损伤。此外,清热活血汤含药血清可上调涉及mTOR信号通路的左旋精氨酸。mTOR是调控细胞自噬的关键靶点[28],这提示清热活血汤改善MIRI的作用可能与自噬机制有关。
MDA是脂类过氧化的最终代谢产物,是反映组织氧化损伤的客观指标,而SOD、GSH-Px作为抗氧化酶可有效清除超氧阴离子及脂类过氧化物自由基以维持细胞稳态[29]。基于此,通过对该类指标的检测可对上述氧化应激相关代谢物及代谢途径进行表型验证。本研究结果显示,清热活血汤可呈剂量依赖地改善MIRI模型大鼠血清中氧化应激相关指标水平。
综上所述,清热活血汤可改善MIRI模型大鼠心脏组织损伤,其药效成分包括黄芩苷、隐丹参酮、异阿魏酸、原儿茶醛等,其作用机制可能与改善心肌能量代谢、下调氧化应激水平、抑制炎症浸润有关。

