hsa_circ_0102049通过miR-96-5p/AK3轴促进结直肠癌细胞EMT介导的增殖和转移
刘胜楠 陈 卓
结直肠癌(colorectal cancer, CRC)在全球常见的癌症中排名第3,每年大约有9%的癌症相关死亡病例与CRC相关且CRC患者的5年总体生存率只有65%[1~3]。上皮-间质转化(epithelial-mesenchymal transformation, EMT)是一种在各种组织中普遍存在的保守的表观遗传程序,其中在癌症的发生、发展中EMT可以增强肿瘤细胞的转移能力,使其获得干细胞特性和细胞凋亡抗性[4,5]。目前已有多项研究表明EMT参与了CRC的进程,例如SPNS2通过上调PTEN和介导AKT通路的失活抑制EMT并降低CRC细胞的转移,高表达的ZEB2通过增强EMT相关转录程序上调ERCC1的表达以激活核苷酸切除修复(nucleotide excision repair, NER)通路,从而导致CRC的化疗耐药性和肝转移[6,7]。
circRNA是一类没有3′聚腺苷化尾巴和5′帽状结构的以共价闭合环为主要特征的非编码RNA[8]。circRNA起源于亲本基因的外显子或者内含子,其中外显子circRNA占主要部分且优先定位于细胞质中,在细胞质中它们可以作为miRNA的海绵影响基因的表达或者直接结合蛋白调控其功能[9]。circRNA的异常表达在几乎所有癌症中都有发现,circNDUFB2通过破坏IGF2BPs的稳定性激活抗肿瘤免疫来抑制非小细胞肺癌的进展,N6-甲基腺苷诱导的circ1662通过增强YAP1的核易位促进结直肠癌的转移[10,11]。
本研究筛选出在CRC中明显高表达的hsa_circ_0102049,hsa_circ_0102049通过增强EMT促进CRC细胞的增殖和转移。此外,同时分析出与hsa_circ_0102049结合的miR-96-5p以及其下游靶标AK3,证明hsa_circ_0102049通过miR-96-5p/AK3轴促进CRC细胞的EMT。
材料与方法
1.实验材料:HCT116和DLD-1细胞系购自中国科学院细胞库(上海)。McCoy′s 5A和RPMI 1640培养基购自美国Hyclone公司,青链霉素、脱脂奶粉和4%多聚甲醛购自江苏Vicmed公司,胎牛血清购自浙江天杭生物公司, RIPA细胞裂解液、PMSF、结晶紫染液和BCA蛋白浓度检测试剂购自上海碧云天公司,Silentfect Lipid转染试剂购自美国Bio-Rad公司,TRIzol试剂购自美国Invitrogen公司,反转录试剂、qPCR试剂和ECL化学发光显色试剂购自江苏诺唯赞公司,siRNA试剂购自上海吉玛公司, Matrigel基质胶购自美国Corning公司,PVDF膜和Millicell小室购自德国Merck公司,hsa_circ_0102049、miR-96-5p、AK3和GAPDH引物购自上海生工公司,E-cadherin、N-cadherin、Vimentin和GAPDH抗体购自美国Proteintech公司,HRP-山羊抗兔 IgG和HRP-山羊抗小鼠 IgG购自北京博奥龙公司。
2.GEO数据库分析:通过R中的GEOquery包下载GSE126094表达矩阵并将探针名注释为基因名,随后通过stringr、reshape2、ggplot2、ggfortify包对数据均一化处理和检查并使用limma包分析差异表达的circRNA。
3.细胞培养:HCT116和DLD-1细胞分别置于McCoy′s 5A和RPMI 1640培养基中并添加10%胎牛血清和100μg/ml青链霉素进行培养,两个细胞系均置于含有5%CO2的37℃培养箱中。
4.细胞转染:HCT116和DLD-1细胞生长至30%的比例时,将Silentfect Lipid和siRNA按照2∶1的比例使用无血清培养基进行转染,6h后更换为完全培养基,待细胞继续生长48h收取进行实验。本研究使用的siRNA及对照序列如下:si- hsa_circ_0102049#1: 5′- GGAAAATTGAAAGAGTCTGAT -3′;si- hsa_circ_0102049#2: 5′- GATGGAAAATTGAAAGAGTCT -3′;si-Ctrl: 5′-UUCUCCGAACG-UGUCACGUTT-3′。
5.CCK-8实验:细胞转染后48h使用胰酶消化收集,进行细胞计数后向96孔板的每个孔中分别加入含4000个细胞的完全培养基200μl,每组各加6个复孔,24、48、72、96h后加入CCK-8液孵育2h并测量测量吸光度(A450)。
6.迁移侵袭实验:实验前2h小室放入24孔板中,将Matrigel基质胶和无血清培养基按照1∶9的比例加入至小室上层并放入37℃培养箱备用,细胞转染后48h使用胰酶收集并计数,每个小室上层加入含10万细胞的无血清培养基200μl,小室下层则加入含20%血清的培养基800μl。在24和48h后分别收取添加和未添加基质胶的小室置于4%多聚甲醛固定20min并置于结晶紫染色液中染色10min,使用棉签擦去小室上层细胞并晾干后置于显微镜拍照。
7.RNA提取和实时定量PCR:细胞转染48h后使用TRIzol提取总RNA,使用相关的反转录试剂盒以及qPCR试剂置于Roche LC96仪器检测目标RNA表达水平,其中使用GAPDH作为内参并用2-△△cq进行数据计算。本研究使用的引物序列如下:hsa_circ_0102049-正向引物:5′-CCATTCCTGTTTCACCAACA -3′。hsa_circ_0102049-反向引物:5′-TGAGA-CCTTGAGGCGTTTTT-3′。miR-96-5p-正向引物: 5′-GCGTTTGGCACTAGCACATT-3′。miR-96-5p-反向引物: 5′-AGTGCAGGGTCCGAGGTATT-3′。AK3-正向引物: 5′-GGCAGAAGCCCTAGATAGAGC-3′。AK3-反向引物: 5′-GCAGTAAGGCGTTGTTTAATGAC-3′。GAPDH-正向引物: 5′-GGAGCGAGATCCCTCCAAAAT-3′。GAPDH-反向引物: 5′-GGCTGTTGTCATACTTCTCATGG-3′。
8.蛋白免疫印迹:细胞转染48h后消化收集,使用含1%PMSF的RIPA细胞裂解液提取总蛋白并使用BCA试剂盒进行蛋白浓度测定和配平,配置10%的SDS-page,按照每组蛋白20μg进行上样电泳及转移至PVDF膜上,转膜结束后置于5%的脱脂牛奶中室温封闭2h,将膜裁剪至合适大小置于一抗中4℃孵育过夜,随后在相应二抗中室温孵育1h并使用ECL发光试剂盒检测各蛋白表达量变化,使用GAPDH作为内参。

结 果
1.hsa_circ_0102049在结直肠癌组织和癌旁组织中表达量比较:通过对GEO数据库中GSE126094数据集的分析,以logFC>2或<-2以及P<0.05为条件共筛选出245个差异表达的circRNA,其中包括8个高表达的circRNA和237个低表达的circRNA,选取|logFC|>3的circRNA绘制表达热图,详见图1。由于hsa_circ_0102049是所有circRNA中表达最高且表达差异最大的(logFC=6.44344,P=1.07×10-10),因此后续研究选取了hsa_circ_0102049作为研究指标并探寻了hsa_circ_0102049对CRC细胞增殖和转移能力的影响。
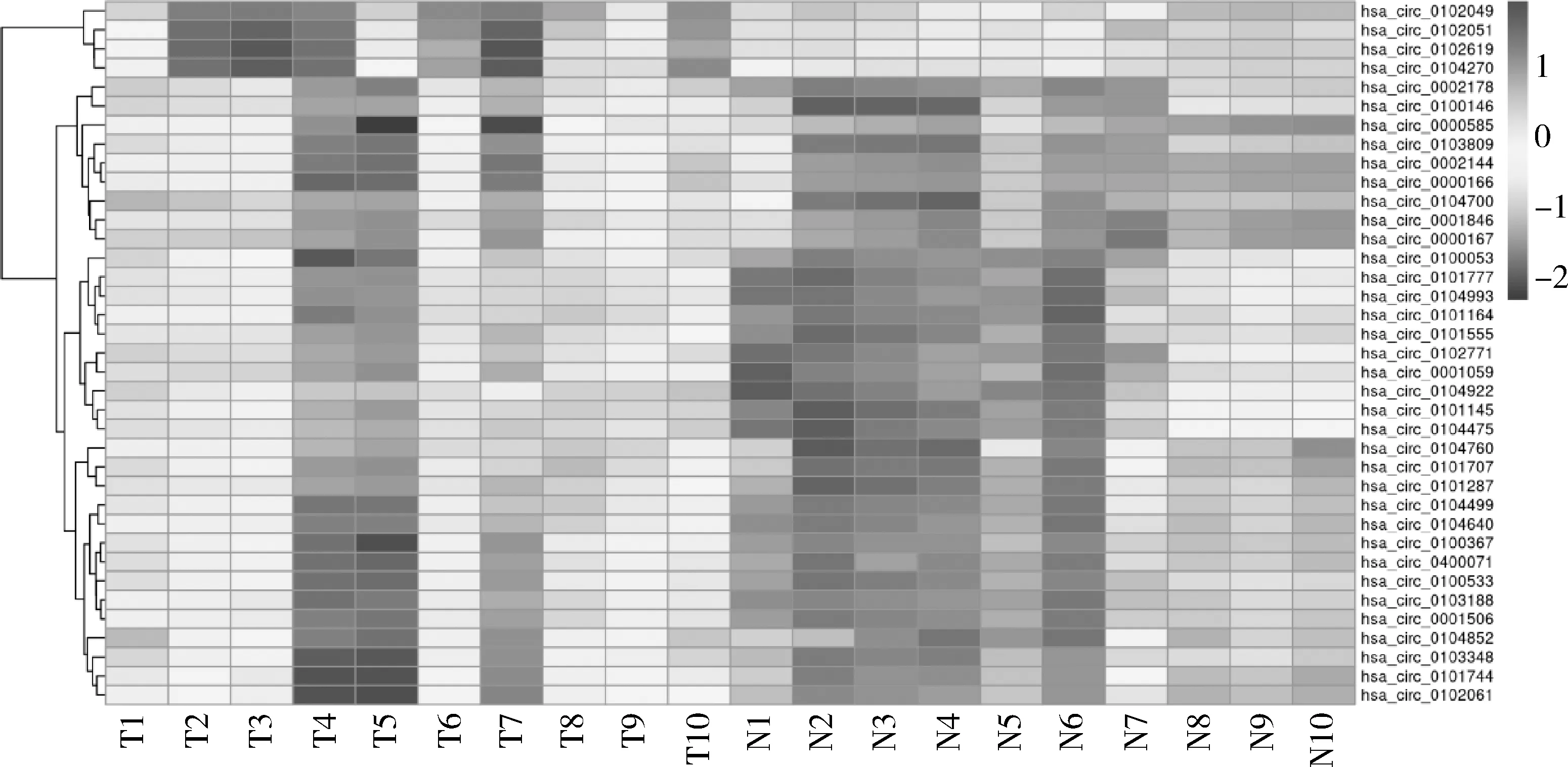
图1 hsa_circ_0102049在结直肠癌和癌旁组织中表达热图
2.敲低hsa_circ_0102049后CRC细胞增殖和转移能力比较:在HCT116和DLD-1细胞系中敲低hsa_circ_0102049后(P<0.05,图2A),两株细胞的增殖能力减弱(P<0.05,图2B)且迁移和侵袭能力降低(P<0.05,图3)。结果表明hsa_circ_0102049可以促进CRC细胞的增殖和转移。
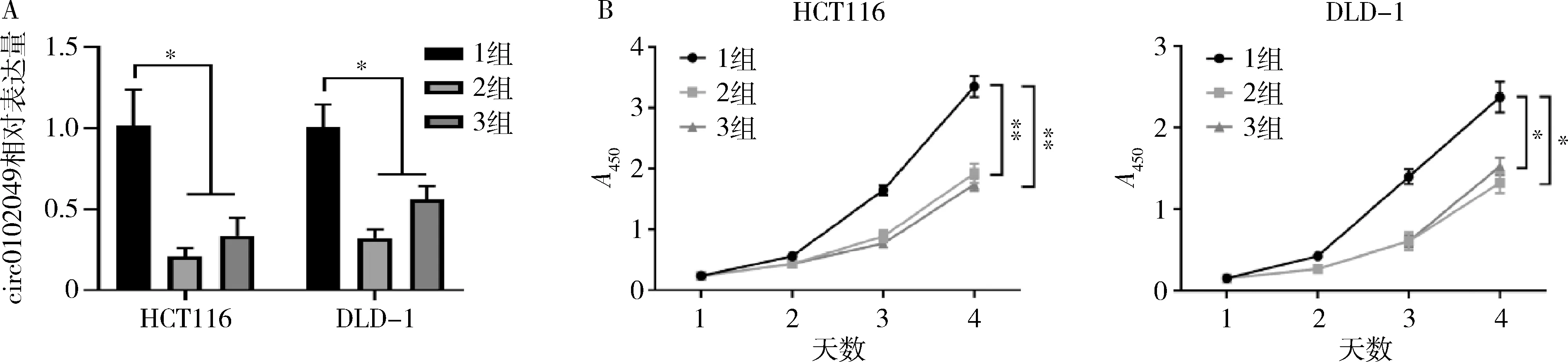
图2 敲低hsa_circ_0102049抑制结直肠癌细胞的增殖
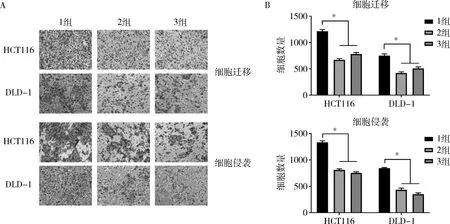
图3 敲低hsa_circ_0102049抑制结直肠癌细胞的迁移和侵袭
3.敲低hsa_circ_0102049后CRC细胞中EMT标志物表达量比较:在HCT116和DLD-1细胞系中敲低hsa_circ_0102049后,两株细胞中EMT相关标志物E-cadherin的表达量升高,而N-cadherin和Vimentin的表达量降低(P<0.05,图4)。结果表明hsa_circ_0102049通过增强EMT促进CRC细胞的增殖和转移。
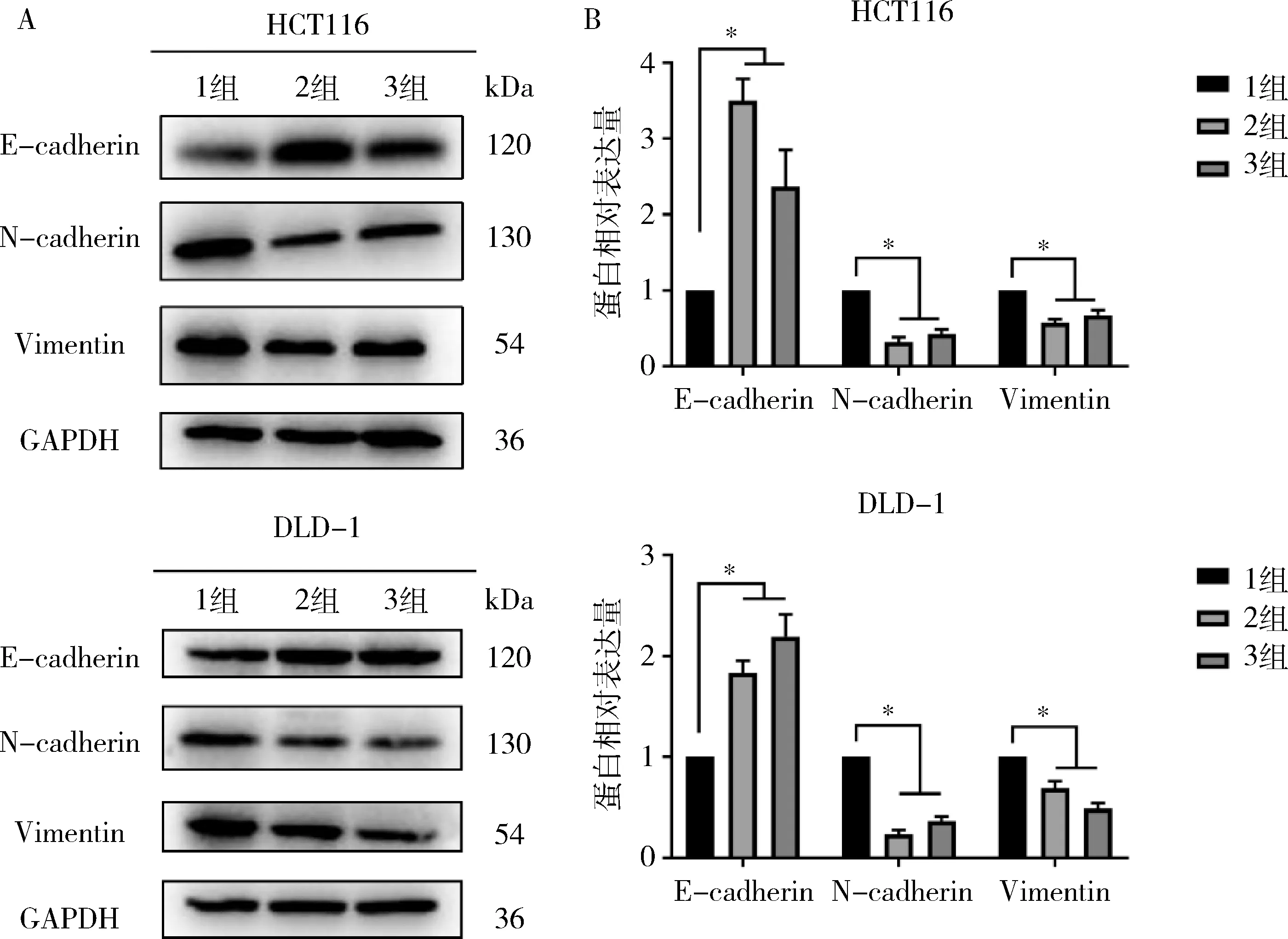
图4 敲低hsa_circ_0102049抑制结直肠癌细胞的EMT
4.hsa_circ_0102049的下游分子检测:通过miRanda和Targetscan数据库分析可以与hsa_circ_0102049结合的miRNA以探寻hsa_circ_0102049介导EMT变化的机制,筛选出评分较高的miR-96-5p(图5A),随后使用Targetscan预测miR-96-5p的mRNA靶标,其中AK3评分最高且AK3已被证实与CRC的发生有关(图5B)[12]。在HCT116和DLD-1细胞系中敲低hsa_circ_0102049后,miR-96-5p的表达量升高而AK3的表达量降低(P<0.05,图5C)。结果显示,hsa_circ_0102049通过miR-96-5p/AK3轴促进CRC细胞的EMT进展。
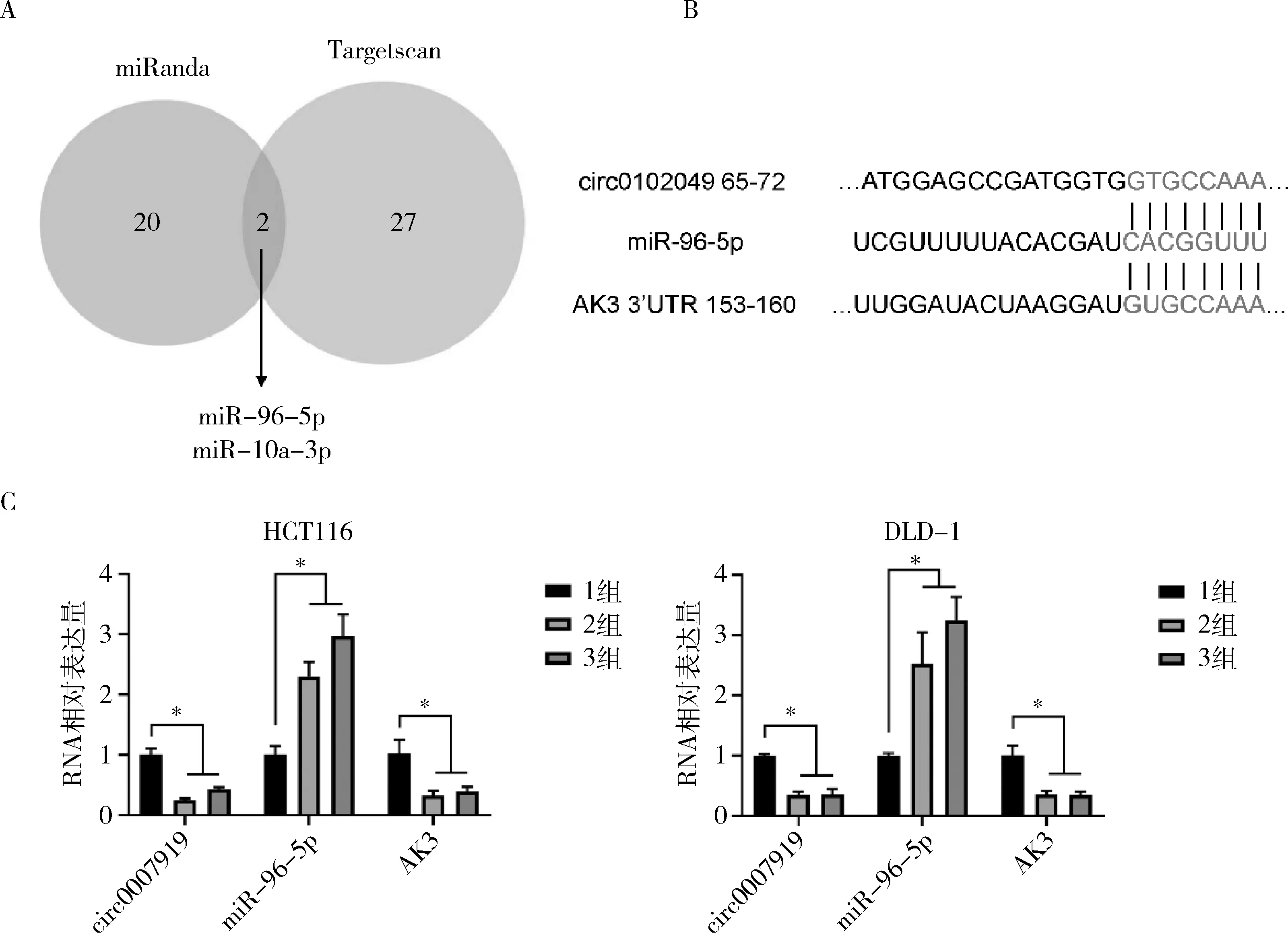
图5 hsa_circ_0102049下游分子检测
讨 论
近年来研究发现,circRNA由于具有对RNase高度抗性、以组织和发育阶段特异性的方式表达以及存在于各种组织和体液中等特征,使得circRNA 具有更长的半衰期和更强的稳定性从而可以作为多种癌症的诊断或预测生物学标志物。例如,血清中circ-FAF1和circ-ELP3的表达水平可以作为乳腺癌诊断的新型潜在生物学标志物,circ-PVT1和circ-001569的高表达预示结直肠癌的不良预后,在胃癌患者组织和血浆中低表达的hsa_circ_0001811预示着更好的预后[13~15]。除此以外,circRNA也被确定参与癌症的发生、发展过程,例如hsa_circ_0005273通过海绵化miR-200a-3p上调YAP1表达并抑制Hippo通路促进乳腺癌的肿瘤发生,circ-0007841通过抑制miR-151-3p活性促进MEX3C的表达加速卵巢癌的发展[16,17]。本研究发现,CRC中高表达的hsa_circ_0102049在功能上通过促进CRC细胞的EMT进程发挥增强CRC细胞的增殖和转移能力的作用。
circRNA作为癌症发生、发展的重要调控因子,主要通过吸附并降解miRNA以增加miRNA靶基因的表达、结合并调控蛋白的功能或表观遗传修饰、直接调节同源基因的表达等发挥作用。在结直肠癌中,hsa_circ_0001666通过miR-576-5p/PCDH10轴抑制结直肠癌的进展,circ-0006174通过调节miR-138-5p/MACC1轴加速结直肠癌的进展,circ-GALNT16通过增强hnRNPK的SUMO化来增加hnRNPK-P53复合物的形成以抑制结直肠癌的进展,circ-SIRT1通过招募和结合eIF4A3促进结直肠癌增殖和EMT,hsa_circ_0026628通过靶向同源基因SP1激活Wnt/β-catenin通路促进结直肠癌的发展[18~22]。
本研究通过miRanda和Targetscan数据库筛选出与hsa_circ_0102049结合的miR-96-5p及其下游靶基因AK3,发现敲低hsa_circ_0102049导致miR-96-5p的表达量升高和AK3表达量降低,表明hsa_circ_0102049通过miR-96-5p/AK3轴促进CRC细胞的EMT进程以增强细胞增殖和转移。AK3为腺苷酸激酶,主要定位于线粒体基质中参与腺嘌呤代谢[23]。然而对于AK3在肿瘤中的研究较少,目前已知AK3可以抑制肝癌和乳腺癌的进展和促进慢性淋巴细胞白血病的进程[24~26]。早发性结直肠癌患者显示出具有AK3的杂合性缺失,对于AK3与结直肠癌发生、发展之间的具体联系尚需进一步研究[12]。
综上所述,本研究发现hsa_circ_0102049可以通过海绵化miR-96-5p增加AK3的表达,从而促进CRC细胞的EMT进程以增强细胞增殖和转移。本研究较为详细地描述了hsa_circ_0102049的调控模式,并且提示hsa_circ_0102049可以作为结直肠癌潜在的诊断和治疗靶标。

