AAV9载体在小鼠体内分布的长期研究
化春晓 孙英杰 郭依琳 杨宇霞 孔祥东
杜氏肌营养不良(Duchenne muscular dystrophy,DMD)是一种是由DMD基因突变引起的致命性的X连锁隐性遗传病,全球发生率约为(10.7~27.8)/10万活产婴儿[1]。DMD通过常规治疗治愈非常困难,但因其致病基因非常明确,故该病特别适合于基因治疗。腺相关病毒(adeno-associated virus,AAV)是DMD基因治疗中最热门的的载体之一,腺相关病毒9型(adeno-associated virus serotype 9,AAV9)是从非人灵长动物中分离出来的,免疫原性和毒性极低,可介导外源基因长期有效表达,在心肌、骨骼肌、脑、肝脏和胰腺等组织脏器中均具有较高的转导效率[1,3]。Hakim等[4]观察AAV9micro-dystrophin基因治疗mdx小鼠的疗效时发现,mdx小鼠全身骨骼肌功能显著改善,并有剂量依赖效应。有研究证明,使用AAV9micro-dystrophin基因治疗成年Duchenne型肌营养不良症模型犬疗效持久且安全,可广泛表达于全身肌肉组织,显著提高肌力、促进运动功能的恢复[5]。虽然AAV9载体应用于DMD基因治疗的有效性已得到了证实,但病毒载体能否长期安全地发挥作用仍不清楚。因此,本研究通过观察经肌内注射AAV9-Luc病毒小鼠体内的荧光表达情况,进而分析AAV9载体在小鼠体内的长期分布结果,并对小鼠主要肌肉组织内分布的病毒载体进行荧光定量分析。
材料与方法
1.材料:(1)实验动物:于广东省实验动物监测所购入50只周龄为5周左右的雄性Balb/c nude小鼠,饲养于广东省医学实验动物中心SPF级设施内[实验动物许可证:SCXK(粤)2018-0044)]。小鼠体质量约17~20g,健康,无任何疾病。所有动物均符合实验动物伦理要求,每日喂小鼠适量饲料,随意饮水,光照及夜暗时间均为12h。饲养环境平均温度、平均湿度均达到实验动物饲养标准。(2)试剂:ssAAV-CMV--Luciferase-WPRE(AAV-Luc)病毒载体由笔者所在实验室构建,由山东维真生物科技有限公司合成包装。Luciferin溶液由笔者所在实验室配制。(3)仪器:Xenogen IVIS 50动物活体成像系统由广州市锐博生物科技有限公司提供。
2.实验方法:(1)分组方法:50只Balb/c小鼠随机分为A、B两组,每组25只,A、B两组又随机各分为5个亚组,每组5只。(2)注射方式:A组为实验组,每只给予4×1011vg 的AAV-Luc病毒50μl。B组为空白对照组,每组给予0.9% NaCl注射液50μl。A、B两组注射方式相同,均为经右后肢肌内进行4点注射,单次给药,且保证每只小鼠注射的量一致。(3)动物观察指标:每天观察A、B两组小鼠并记录其一般行为学表现,主要观察的指标有:小鼠体质量变化、体温、四肢运动情况、进食情况、排便情况、精神、神经、毛发颜色、分泌物,有无死亡、濒死前反应等。具体观察项与指征详见表1。(4)小鼠活体荧光分布观察及主要肌肉组织荧光定量:根据AAV9的药效学和药代动力学特性、受试动物及临床研究方案等因素,分别于AAV9-Luc病毒注射后的第1、3、7、14、30天,从A、B两组中各挑1个亚组,小鼠吸入麻醉后,向腹腔注射200μl底物荧光素,在IVIS 50活体成像系统下连续拍照,观察小鼠全身的荧光表达情况。随之快速处死小鼠,按照以下顺序分离各组织器官(睾丸、脑、膈肌、肋间肌、心脏、肝脏、脾脏、肾脏、肺脏、胰腺、左前肢、右前肢、左后肢、右后肢),在分离后的组织器官上均匀滴加配置好的Luciferin溶液,在显色时间10min后置于IVIS 50活体成像系统下观察荧光表达情况,并用仪器累计记录小鼠右后肢肌、右前肢肌、肋间肌、心肌、膈肌组织平均Luc发光量,进行荧光定量分析。

表1 小鼠一般体征观察项与指标
结 果
1.小鼠一般情况观察:在注射AAV9-Luc病毒或0.9% NaCl注射液后至被处死之前的这段时间内,各小鼠生长状况良好,体质量较前稍增加,体温、大小便正常,食量无明显变化,毛发有光泽,运动频率正常且无异常运动,神经、精神良好,无嗜睡、惊厥等,无异常分泌物,无死亡、濒死前反应。
2.小鼠全身荧光表达情况:30天内,对照组小鼠体内始终无荧光表达。实验组小鼠经右后肢肌内注射AAV9-Luc病毒3天后,在体内各部分均可检测到荧光表达(图1)。随着时间的延长,荧光表达量逐渐增大,表达部位先局限于右后肢注射处,后逐渐扩大(图2)。
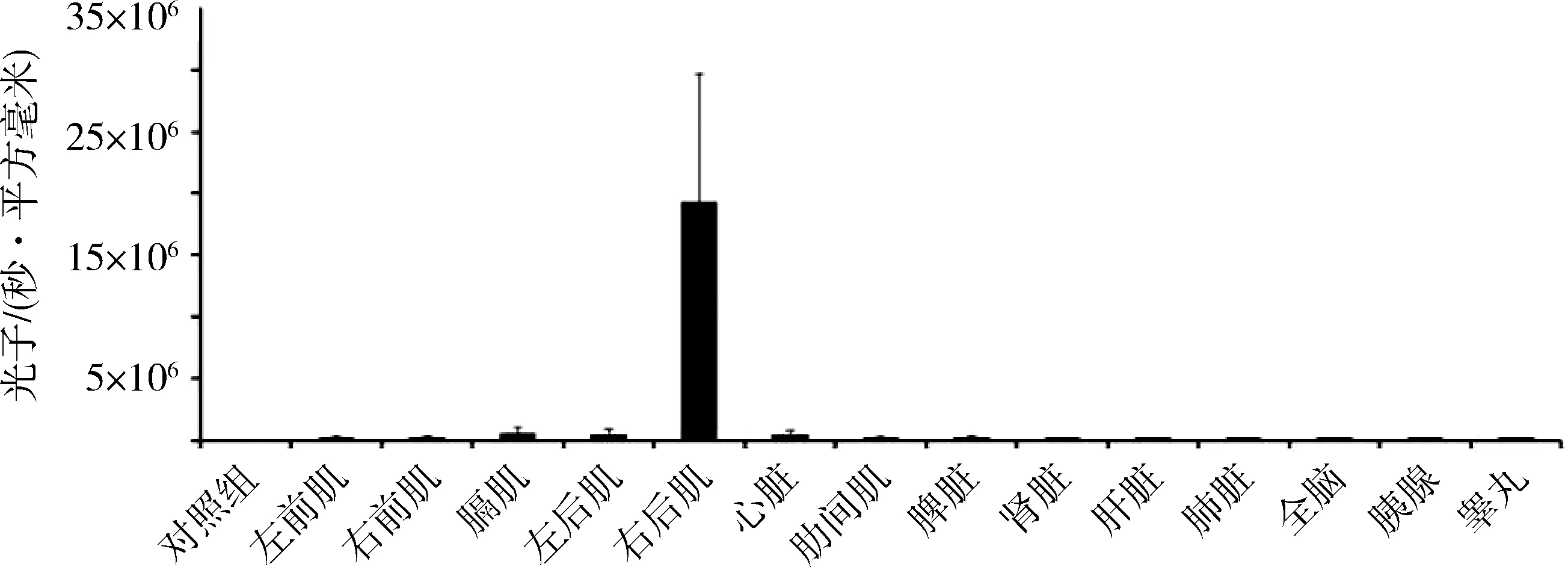
图1 肌内注射AAV9-Luc 3天后小鼠各组织器官中荧光表达分布情况
随时间的延长,观察各组织器官中的荧光分布发现,第1天时仅在注射部位有荧光表达。第3天时可在右后肢、右前肢、左后肢、左前肢及膈肌等肌肉组织中表达。第7天时肌肉中荧光表达更为强烈,双侧肾脏有少量荧光表达。第14天时右后肢的荧光表达最为强烈,且未见除肌肉外其他器官有明显荧光表达。第30天右后肢的荧光表达略低于第14天,但仍未见除肌肉外其他器官有明显荧光表达(图2、图3)。
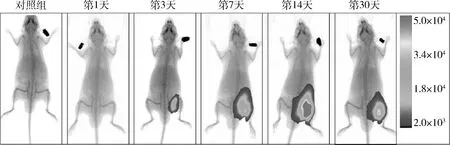
图2 肌内注射AAV9-Luc后小鼠体内荧光表达分布随时间的变化情况
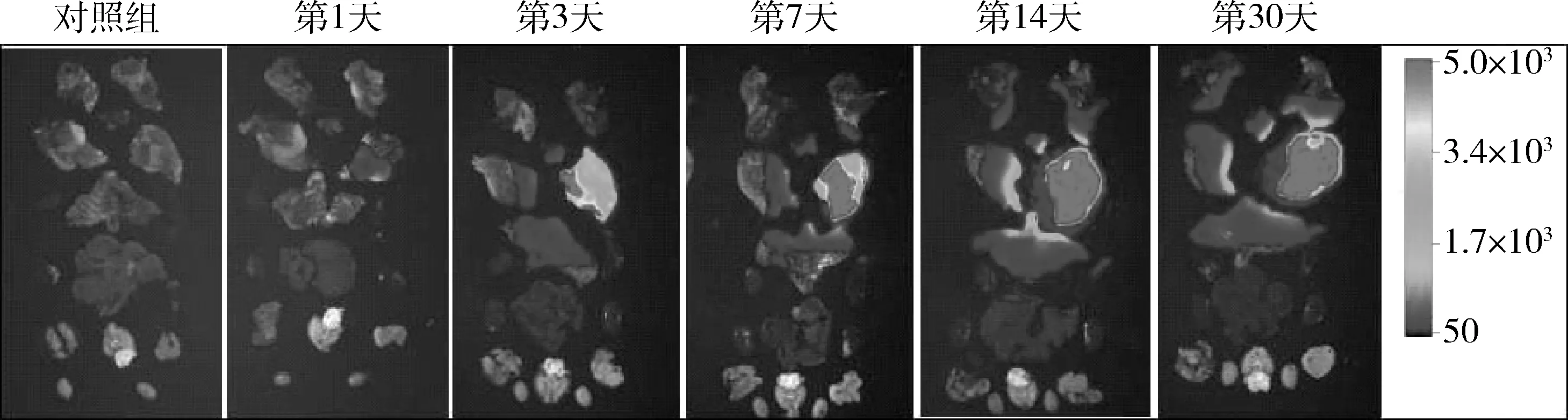
图3 肌内注射AAV9-Luc后小鼠各组织器官内荧光表达分布随时间的变化情况
3.小鼠部分组织荧光定量分析:在注射后的第1、3、7、14、30天,对小鼠右后肢肌、右前肢肌、肋间肌、心肌、膈肌中的荧光表达量进行定量分析,小鼠右后肢肌的光子数分别为0.8×105、1.7×106、10.0×106、18.9×106、23.7×106;小鼠右前肢肌的光子数分别为0.1×103、2.5×104、6.0×104、16.2×104、25.3×104;小鼠肋间肌的光子数分别为0.1×103、0.3×104、1.8×104、5.0×104、4.0×104;小鼠心肌的光子数分别为0.1×103、0.3×103、2.8×104、5.0×104、4.0×104;小鼠膈肌的光子数分别为0.2×102、0.2×105、1.2×105、6.1×105、6.1×105,经分析可知右前肢肌、右后肢肌中的荧光表达量随着时间的延长逐渐增大(图4中A、E)。肋间肌、心肌、膈肌在注射后1~14天的荧光表达量逐渐增加,而在第14~30天时肋间肌和心肌的荧光表达量略下降(图4中B、C),膈肌的荧光表达量无明显变化(图4D)。
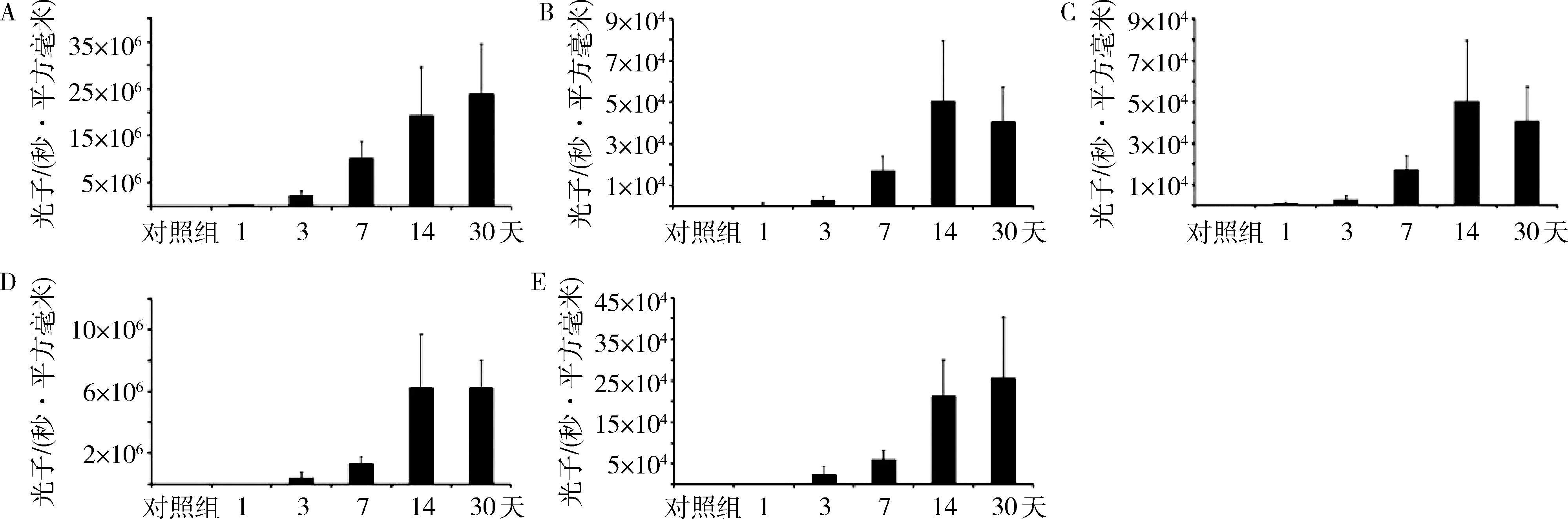
图4 肌内注射AAV9-Luc后小鼠主要肌肉中病毒表达量随时间的变化情况
讨 论
DMD是最常见的X连锁隐性遗传性肌病,发生率约为1/5000的活产男婴,有症状的女性携带者约为1/100000~1/45000,且无明显的种族或地理差异[6]。典型的临床特征是进行性肌萎缩、肌无力伴小腿腓肠肌假性肥大,随着病情的加重可逐渐累及心肌和呼吸肌。患者血清肌酸激酶明显升高,也可能会出现不同程度的语言延迟、学习障碍和认知障碍。多数患儿在7~13岁时丧失行走能力,多于20岁左右因心脏、肺脏衰竭而死亡[7]。临床上可使用糖皮质激素来进行治疗,长期使用可延长患者独立行走的时间并改善患者的心肺功能[8]。但也会产生不良反应,包括肥胖、多毛、痤疮、行为异常、免疫抑制、骨折和骨质疏松等[9,10]。临床上还有一些物理疗法,例如牵伸治疗、应用矫形器、肌力训练、有氧运动训练以及物理因子治疗等[11]。但这些方法只能缓解患者的症状,无法改变疾病的最终结局。
目前临床上尚无根治DMD的方法,CRISPR/Cas基因编辑技术的出现有望彻底治愈DMD。目前基因治疗的载体主要包括病毒和非病毒两大类。非病毒载体,如脂质体和蛋白质多肽等,虽然较为安全但转导效率低下,因此病毒载体的应用更为广泛[12]。在过去几年中,AAV作为CRISPR/Cas基因编辑系统的载体迅速推进了神经肌肉疾病基因治疗的发展。AAV具有极低的免疫原性和细胞毒性,基本不产生免疫反应,宿主范围广泛,既能感染分裂细胞,又能感染非分裂细胞,可稳定地整合到人体细胞染色体上,介导外源基因在细胞内长期稳定表达,且不易被灭活[13,14]。
目前已经从人和动物组织中分离出了多种AAV血清型,包括至少12种自然存在的血清型和100多种变体,不同的血清型对不同的组织和细胞有不同的感染效率,但是尚未发现与任何已知疾病相关的AAV血清型[15,16]。有研究以AAV作为基因治疗载体来转运相应的凝血基因治疗血友病,其治疗效果可维持1年以上而且无毒性[17~19]。有研究以AAV作为载体携带含有特异乙型肝炎病毒的干扰RNA片段,可使乙型肝炎病毒的mRNA水平降低,从而减少体内的乙肝病毒而治疗乙型肝炎,效果可长达数月[20]。Biferi等[21]用包含RPE65互补DNA片段的AAV载体对先天性黑蒙症患者进行视网膜下注射,可改善部分患者的视功能。
在癌症治疗中,AAV可以向肿瘤细胞或肿瘤基质细胞内转导癌症治疗基因,并使其稳定表达,从而有效抑制癌症的进展[22,23]。AAV9特别适合作为DMD基因治疗的载体,因其全身给药后可高效地转染各种器官的细胞,包括心肌、肝脏、骨骼肌、脑和脊髓等[2,3]。但AAV载体可能因体内潜在的免疫反应而不能长期表达,因此本研究通过肌肉向雄性Balb/c小鼠体内注射50μl剂量为4×1011vg/只的AAV9-Luc病毒,研究AAV9在小鼠体内的长期分布情况从而进一步评价AAV载体介导CRISPR/Cas9基因编辑系统临床应用的安全性。
在本研究的30天内,对照组始终未检测出任何荧光表达。实验组小鼠活体观察可见荧光一直局限于右下肢肌,虽然随着时间的延长荧光表达范围逐渐扩大,但可见荧光主要位于右下肢肌。为了观察荧光在小鼠体内各器官组织的分布情况,在活体观察荧光的大体分布后对小鼠进行了处死解剖,并分离出各个组织器官按照顺序放好。在第3天时荧光主要集中在注射部位右下肢肌中表达,左下肢肌、心肌、膈肌有微量表达。随后,笔者对各个器官中的表达量与时间关系进行了研究,结果显示右后肢肌、右前肢肌中的荧光表达量随着时间的增加逐渐增大。肋间肌、心肌、膈肌在注射后1~14天的荧光表达量逐渐增加,而在第14~30天时肋间肌和心肌的荧光表达量略微下降,膈肌的表达量无明显变化。证明AAV9载体介导CRISPR/Cas9基因编辑系统临床应用的安全性较高。
本实验存在一些不足之处,本实验中考虑DMD患者多为免疫功能正常的男性,采用了Balb/c雄鼠进行实验,未来会进一步扩大样本,采用雌性Balb/c或mdx小鼠进行实验。本实验中使用了Balb/c雄鼠,小鼠皮毛可能对观察全身荧光表达存在一些影响,未来可采用Balb/c无皮毛的雌性裸鼠进行实验。实验在小鼠的注射后进行了持续30天的观察,但有研究证明AAV9可以在小鼠体内存留数月,所以未来需进一步延长时间继续观察。
综上所述,肌内注射AAV9,剂量为4×1011vg/只时,病毒在小鼠体内30天表达情况下局限分布于肌肉(右后肢肌、左后肢肌、膈肌、心肌、肋间肌),而在非肌肉器官中几乎没有分布,具有很高的肌肉组织特异性,初步证明AAV9作为DMD基因治疗的载体较为安全有效。

