低温胁迫高山杜鹃对外源氯化钙和脱落酸的响应
李小玲, 华智锐, 杨文怡, 张 飞
(1.商洛学院 生物医药与食品工程学院, 陕西 商洛 726000; 2.陕西天士力植物药业有限责任公司, 陕西 商洛 726000)
0 引言
【研究意义】高山杜鹃〔Rhododendronlapponicum(L.)Wahl.〕属杜鹃花科常绿灌木,是我国传统十大名花之一,与报春、龙胆属植物合称为世界三大高山花卉[1]。高山杜鹃因其花序巨大、色彩艳丽和花姿优美等特点有着较高的观赏价值,同时枝叶可入药,药用开发利用价值高[2],市场开发前景广阔。高山杜鹃多生长于海拔高、山地阴坡、杂林和林缘草坡上,使得植株形成了喜冷凉、对周边环境因子要求高的特点,为其产业化、园艺化和规模化种植带来了难题。在自然界中存在各种非生物因子的胁迫,其对植物的生长发育可造成不同程度的伤害。温度作为植株生理代谢过程中的主要生态因子[3],植物体在低温逆境中自身的形态、生理和超微结构均受到不同程度的影响,如其细胞膜结构受到破坏,导致相关的生理指标发生变化,生长发育受阻甚至损伤[4]等。因此,探索减轻低温胁迫对高山杜鹃造成伤害的措施对实现其产业化、园艺化和规模化种植具有重要意义。【前人研究进展】钙离子(Ca2+)作为细胞信号转导过程中主要的第二信使,在生物膜膜完整性和膜结构稳定性方面有着重要作用[5]。在参与低温信息传导过程中,钙离子作为低温信号传递分子可参与和调节冷害基因的正常表达以应对低温胁迫[6]。外源氯化钙(CaCl2)可作为诱导剂用于增强植物抗寒性[7-9]的抗寒性。脱落酸(Abscisic acid,ABA)作为一类脂溶性的小分子植物激素,可抑制种子萌发,促进种子休眠和叶片衰老脱落等;同时也是植物响应逆境胁迫的重要信号因子,其作用机制在于可通过保护膜结构,维持膜功能和诱导抗冷基因表达以增强植物抗冷性。因此,向处于逆境中的植物体喷施外源ABA能有效缓解逆境对植物体造成的伤害[10]。王兴等[11]研究表明,在低温胁迫过程中,随着植物体内ABA的积累,植物的抗寒性随之升高且ABA的含量在抗寒性强的植物体内明显高于抗寒性相对弱的。对植物体喷施外源ABA后,植物体内源ABA含量进一步上升且抗寒性强的品种增幅更为显著,研究表明,对植物体喷施外源ABA可以缓解逆境中植物体内丙二醛含量和相对电导率的上升,提高可溶性蛋白的含量,减轻低温胁迫对植株造成的伤害[12]。目前国内关于外源物质对低温胁迫下植物生理特性影响研究多集中在对低温较敏感的作物上[13-14],高山杜鹃作为一种适应高海拨地区冷凉气候的野生花卉,有关外源物质对其生理特性方面的研究多集中于耐热性方面[15-17]。王浩琪等[15]研究发现,高山杜鹃低山引种时喷施外源抗热剂可有效缓解高温对其造成的损伤,其中,均以喷施1 500 mg/L氯化钙、100 mg/L对氨基水杨酸+600 mg/L海藻酸+800 mg/L氯化钙对不同规格的马缨杜鹃和露珠杜鹃均具有较好缓解效果;喷施100 mg/L对氨基水杨酸+600 mg/L海藻酸+800 mg/L氯化钙对云锦杜鹃效果最佳;喷施1 500 mg/L氯化钙对大白杜鹃效果最佳。李小玲等[16-17]研究发现,温度对高山杜鹃的影响较大,不同高山杜鹃品种的耐热性存在差异,但其热伤害指数均随温度和胁迫时间的增加而增加;高山杜鹃在遭受高温逆境后其生理生化指标会发生显著的变化,且变化趋势与其耐热性密切相关。【研究切入点】已有的研究主要集中于高山杜鹃耐热性方面,而对低温胁迫下高山杜鹃的生理特性研究鲜见报道。【拟解决的关键问题】以秦岭高山杜鹃幼苗为材料,采用单因素试验研究低温胁迫下喷施不同浓度外源CaCl2和ABA对高山杜鹃受冷害程度和生理特性的影响,以期为减轻低温胁迫对高山杜鹃造成的伤害和抗性育种研究提供借鉴和参考依据。
1 材料与方法
1.1 材料
1.1.1 样品 2021年4月采摘于商洛市镇安县木王国家森林公园海拔1 500 m左右的茨沟杜鹃花景区。
1.1.2 试剂 ABA购自上海蓝季生物有限公司,含量≥98%(AR级),分析纯;无水氯化钙(CaCl2)为购自廊坊乾耀科技有限公司,含量≥96%,分析纯。
1.2 方法
1.2.1 预处理 选取株高25~30 cm的高山杜鹃幼苗移栽至盆中,单盆单株栽于腐叶土与松针土体积比为1∶2的盆栽基质中。每天下午取0.2%硫酸亚铁溶液100 mL喷洒幼苗,7 d后选取生长基本一致的幼苗开展试验。
1.2.2 试验设计
1) 外源CaCl2和ABA喷施对低温胁迫高山杜鹃幼苗受冷害程度的影响。2种外源物各设5个处理,分别喷施CaCl20 mg/L(T0,CK)、600 mg/L(T1)、800 mg/L(T2)、1 000 mg/L(T3)、1 200 mg/L(T4);ABA 0 mg/L(N0,CK)、5 mg/L(N1)、10 mg/L(N2)、15 mg/L(N3)、20 mg/L(N4),CK均为喷洒蒸馏水。具体操作参照石如意等[10]的方法进行,即采用不同浓度的CaCl2和ABA分别连续喷施3 d后,将各处理杜鹃幼苗置于人工气候箱中,光照强度2 000 lx,光照时间12 h,0℃低温胁迫处理2 d,然后对高山杜鹃幼苗冷害程度进行分级统计,筛选2种外源物的最佳喷施浓度。后续试验将采用筛选出的CaCl2和ABA最佳浓度进行。杜鹃幼苗的冷害程度分为1~5级:1级,无冷害症状;2级,1~2片叶边有轻度萎蔫;3级,1/2以下的叶片萎蔫死亡;4级,1/2以上叶片萎蔫死亡;5级,整株幼苗死亡。
2) 外源CaCl2和ABA喷施对低温胁迫高山杜鹃幼苗生理机制的影响。共设4个处理,即以幼苗受冷害程度试验筛选出的CaCl2和ABA最适浓度作为处理条件分别对高山杜鹃幼苗进行喷施,在经过常温培养3 d后对高山杜鹃幼苗进行0℃低温连续胁迫,对照为喷洒蒸馏水+常温25℃(CK1)和蒸馏水+0℃低温胁迫(CK2)。处理后5 d内每天采摘称取高山杜鹃植株健康叶片0.5 g去主脉,进行剪碎、研磨、离心,将提取酶液保存以测定高山杜鹃相关的生理指标,连续测5 d,3次重复,取平均值。
1.2.3 指标测定 采用茚三酮法[18]测定脯氨酸含量,硫代巴比妥酸法[19]测定MDA含量,氮蓝四唑(NBT)光还原法[20]和愈创木酚显色法[21]分别测定超氧化物歧化酶(SOD)活性及过氧化物酶(POD)活性,电导仪法[22]测定相对电导率,考马斯亮蓝G-250法[18]测定可溶性蛋白含量。
1.3 数据处理
采用Excel 2010和SPSS 22.0对数据进行统计分析与绘图。
2 结果与分析
2.1 喷施外源CaCl2和ABA高山杜鹃幼苗受冷害程度
由表1可知,喷施外源CaCl2和ABA后高山杜鹃幼苗受冷害的程度存在差异。
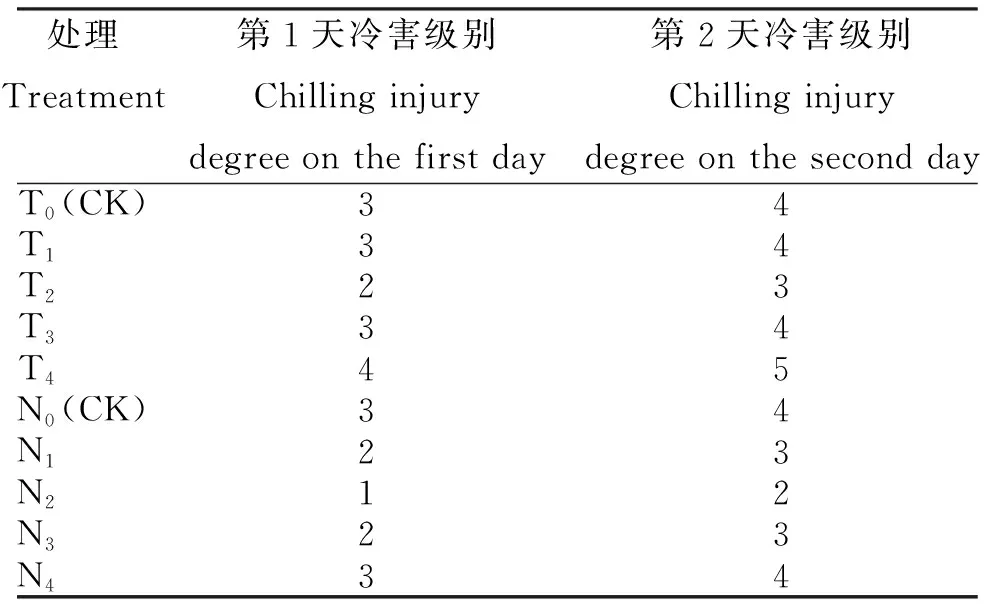
表1 喷施不同浓度外源ABA(N)和CaCl2(T)高山杜鹃幼苗受冷害程度
2.1.1 喷施CaCl2喷施外源CaCl2后,第1天时各处理高山杜鹃幼苗的受冷害程度为2~4级,第2天时为3~5级,均随CaCl2浓度升高呈先降后升趋势。其中,T2(800 mg/L CaCl2)第1天和第2天的冷害级别分别为2级和3级,较CK(3级和4级)的冷害级别低;T1和T3冷害级数与CK一致,T4(4级和5级)的冷害级数最高,且均较CK高。
2.1.2 喷施ABA 喷施外源ABA后,第1天时各处理高山杜鹃幼苗的受冷害程度为1~3级,第2天时为2~4级,均随ABA浓度升高呈先降后升趋势。其中,N2(10 mg/L ABA)第1天和第2天的冷害级别分别为1级和2级,低于CK及其余处理;N1和N3冷害级别均为2级和3级,均低于CK;T4(4级和5级)的冷害级别最高,与CK一致。
综上看,喷施外源800 mg/L CaCl2和10 mg/L ABA 处理效果最佳,可明显降低高山杜鹃幼苗冷害程度及减少低温对高山杜鹃幼苗造成的威胁,且ABA处理稍优于CaCl2处理;同时,受冷害程度与外源物质的浓度有关,在一定浓度下能缓解冷害级别,促进高山杜鹃幼苗生长;但随着外源物质浓度升高,缓解效应会受到抑制。
2.2 喷施外源CaCl2和ABA高山杜鹃生理指标的变化
2.2.1 相对电导率及丙二醛(MDA)含量 由图1可知,随处理时间延长,除CaCl2的MDA含量呈先增后减再升趋势外,各处理高山杜鹃的相对电导率和MDA含量均呈逐渐增加趋势。
1) 相对电导率。CaCl2处理为29.78%~50.11%,ABA处理为31.13%~53.99%,CK127.72%~39.11%,CK234.33%~60.12%;不同时段各处理的相对电导率均呈CK2>ABA>CaCl2>CK1。其中,第2~3天时CK2相对电导率的升幅较其余处理高;处理第5天时,各处理的相对电导率分别第1天增加41.09%、75.12%、68.27%和73.43%,CK2的增加幅度较其他处理最为显著。各时段CK2的相对电导率上升趋势高于CK1;而低温胁迫下ABA和 CaCl2处理的高山杜鹃幼苗体内相对电导率上升较慢,说明高山杜鹃喷施外源ABA和CaCl2可有效缓解低温胁迫对其造成的伤害。
2) 丙二醛(MDA)含量。CaCl2处理为6.8~11.9 μmol/g,ABA处理为7~13.2 μmol/g,CK16.1~8.2 μmol/g,CK29.3~17.9 μmol/g;不同时段各处理的MDA含量均呈CK2>ABA>CaCl2>CK1。其中,第2~3天时CK2的MDA含量上升幅度较其余处理高;处理第5天时,各处理的MDA含量分别较第1天增加34.43%、92.47%、75.00%和88.57%,CK2增加幅度较其他处理最为显著。各时段CK2的MDA含量上升趋势显著高于CK1;而低温胁迫下ABA和 CaCl2处理的高山杜鹃幼苗体内MDA含量上升较慢,说明喷施外源ABA和CaCl2对低温胁迫下高山杜鹃所受的冷害有缓解作用。
2.2.2 SOD及POD活性 由图2可知,随处理时间延长,除CK1外其余处理高山杜鹃的SOD及POD活性均呈先增后减趋势,而CK1的SOD活性和POD活性变化总体呈缓慢上升趋势。
1) SOD活性。CaCl2处理为 36.11~45.98 U/g,ABA处理为34.89~47.31 U/g,CK126.92~35.11 U/g,CK232.14~36.92 U/g;第2天各处理的SOD活性呈CaCl2>ABA>CK2>CK1,之后均呈ABA>CaCl2>CK2>CK1。其中,第4天时CK2、ABA和CaCl2处理的SOD活性均达最高值,分别较第1天增加35.53%、51.82%和37.97%;CaCl2和ABA处理较CK2和CK1分别提高14.37%和45.54%,21.60%和54.75%;CK1在处理第5天时达最高值,较第1天增加30.42%。说明,喷施外源ABA和CaCl2可提高低温胁迫下高山杜鹃的SOD活性,增强其抗寒性。
2) POD活性。CaCl2处理为T 23.15~33.97 U/g,ABA处理为21.66~34.54 U/g,CK120.23~24.96 U/g,CK220.44~26.31 U/g;不同时段各处理的POD活性均呈CaCl2>ABA>CK2>CK1。其中,ABA和 CaCl2的POD活性在处理第4天时达最高值,分别较第1天增加75.21%和51.71%;CK2和CK1分别在处理第3天和第5天时达最高值,分别较第1天增加43.88%和23.38%;CaCl2和ABA处理较CK2和CK1分别提高25.03%和50.92%,35.10%和63.09%。表明,喷施适宜浓度的外源ABA和CaCl2可提高低温胁迫下高山杜鹃的POD活性,增强其抗寒性。
2.2.3 可溶性蛋白和游离脯氨酸含量 从图3看出,随处理时间延长各处理高山杜鹃的可溶性蛋白含量呈逐渐升高趋势,游离脯氨酸含量除CK1呈逐渐上升趋势外,其余处理均呈先增后减趋势。
1) 可溶性蛋白含量。CaCl2处理为11.57~22.98 mg/g,ABA处理为12.12~25.79 mg/g,CK110.49~15.12 mg/g,CK212.12~21.319 mg/g;不同时段各处理的可溶性蛋白含量均呈ABA>CaCl2>CK2>CK1;随着胁迫时间延长,可溶性蛋白含量均在处理第5天时达最大值。其中,CK2高山杜鹃幼苗可溶性蛋白含量的升幅显著高于CK1,CaCl2和ABA处理高山杜鹃幼苗的可溶性蛋白含量也呈上升趋势且显著高于CK2。说明,施加外源ABA和CaCl2可明显提高低温胁迫下高山杜鹃幼苗体内蛋白质的合成能力,从而增强其耐寒性。
2) 游离脯氨酸含量。CaCl2处理为145.9~176.5 μg/g,ABA处理为139.5~197.6 μg/g,CK196.5~126.9 μg/g,CK2121.1~151.3 μg/g;第2天时各处理的游离脯氨酸含量呈CaCl2>ABA>CK2>CK1,之后均呈ABA>CaCl2>CK2>CK1;随着胁迫时间延长,CK2、ABA和CaCl2处理的游离脯氨酸含量均在第4天时达最大值;CK1的游离脯氨酸含量最大值则出现在第5天。由此可知,高山杜鹃幼苗在低温下施加外源CaCl2和ABA能使得游离脯氨酸的含量在植株体内得以积累,从而增强抗寒性。
3 讨论
研究结果表明,喷施外源800 mg/L CaCl2和10 mg/L ABA可明显缓解低温逆境对高山杜鹃幼苗造成的损伤,且ABA稍优于CaCl2,同时在一定程度上也能促进高山杜鹃幼苗生长;逆境胁迫下的高山杜鹃幼苗受冷害程度与外源物质的浓度有关,但随着外源物质浓度升高,缓解效应会受到抑制。
低温对植物造成冷害的原因可能是细胞膜膜系统的损伤。细胞膜透性的变化可引起植株相对电导率的改变,膜脂过氧化后丙二醛的含量明显升高,所以用相对电导率和丙二醛含量的变化可以直观地反映出植物细胞生物膜系统的损伤程度[23]。研究表明,低温(0℃)条件下高山杜鹃幼苗的相对电导率与丙二醛含量较常温(对照)显著上升,而喷施外源CaCl2和ABA后对比低温未喷施外源物质的高山杜鹃幼苗,其相对电导率和丙二醛含量均有不同程度的下降,与李淑顺等[24]的研究结果类似,说明低温胁迫下喷施外源CaCl2和ABA对植物膜系统有积极作用,能够缓解冷害,提高高山杜鹃幼苗的抗寒性。
低温逆境中,细胞内活性氧自由基大量积累,当活性氧含量超过防御系统的清除能力即会破坏细胞膜结构。植物体细胞内特有能清除由膜损伤产生活性氧自由基的相应保护酶,此特性可以减轻低温对幼苗造成的伤害,主要包括SOD和POD,SOD是通过消除活性氧维持细胞膜的完整性;POD能消除对植物自身有毒害的过氧化物[25]。研究表明,低温胁迫下,喷施外源CaCl2和ABA对高山杜鹃幼苗SOD和POD活性缓解趋势相似,均呈先升再降趋势,随着植物受损程度增强,细胞内活性氧产生和清除的平衡关系被打破,SOD和POD活性随之升高。且喷施外源ABA和CaCl2的高山杜鹃幼苗体内SOD和POD活性相较对照显著增强,说明,ABA和CaCl2具有提高高山杜鹃幼苗SOD与POD活性的作用,从而提高高山杜鹃幼苗代谢强度,缓解逆境对幼苗造成的氧化损伤。
可溶性蛋白含量可说明植物体的代谢状况,其可维持细胞膜稳定和保护植株自身活力。因此,其含量越高植物的抗逆性越强。可溶性蛋白是细胞内重要的调节物质,其含量升高可降低低温对细胞膜造成的损伤,增强植株抵御不良环境的能力。研究结果表明,外源喷施ABA和CaCl2可以使高山杜鹃的可溶性蛋白含量升高,与黄杏等[25-27]的研究结果一致。
脯氨酸作为细胞质的渗透调节物质,能调节和维持结冻前冻融后原生质与环境的渗透平衡,在低温逆境中,植株体内脯氨酸的含量积累增多,脯氨酸对于保持细胞组织含水量,保护质膜完整性发挥重要的作用[26]。在逆境胁迫条件下,抗冷性植物体内积累的脯氨酸含量明显较高,调节植物细胞水分的变化从而增强植物对低温胁迫的抗性。研究发现,在低温胁迫下,喷施一定浓度的外源ABA溶液和CaCl2溶液明显提高高山杜鹃幼苗的脯氨酸含量,与伍宝朵等[27]的研究结果一致,说明对低温胁迫下植株喷施外源氯化钙和脱落酸能提高游离脯氨酸的含量,提高高山杜鹃幼苗的抗寒性。但在低温条件下使用浓度设置、外源物种类及大田栽培方面还有待进一步研究。
4 结论
低温胁迫下高山杜鹃幼苗喷施10 mg/L ABA和800 mg/L CaCl2可明显降低其受冷害程度,其中,喷施10 mg/L ABA缓解冷害的(1级和2级)效果优于800 mg/L CaCl2(2级和3级)。喷施ABA和CaCl2后,低温胁迫下高山杜鹃的SOD和POD活性随喷施浓度增加呈先升后降趋势,且均在第4天时达最高,SOD活性分别为52.97 U/g和49.82 U/g,POD活性分别为37.95 U/g和35.12 U/g,相较于低温(0℃)胁迫喷施蒸馏水(CK2),喷施ABA和CaCl2的POD活性分别升高35.10%和25.03%,SOD活性分别升高21.60%和14.37%,可溶性蛋白在达最高值时分别提升20.97%和7.79%,相对电导率达最高值时分别降低10.20%和16.65%,丙二醛达最高值时分别降低26.26%和33.52%。喷施10 mg/L ABA和800 mg/L CaCl2能明显缓解低温(0℃)对高山杜鹃造成的冷害。

