刺梨乙醇提取物对黄嘌呤氧化酶的抑制作用及分子作用机制
董师宇,赵帅,易俊洁,蔡圣宝
昆明理工大学 食品科学与工程学院,云南 昆明 650500
0 引言
随着国民生活水平的提高和饮食结构的变化,由嘌呤代谢紊乱引起的高尿酸血症人群的数量正逐年增加[1]。我国高尿酸血症人数已超过1.7亿,且以9.7%的年增长率迅速增加[2]。高尿酸血症的典型表现是尿酸(UA)含量升高,这会导致痛风、慢性肾脏疾病、高血压、糖尿病、溶血性疾病、动脉粥样硬化等[3]。UA是由关键酶黄嘌呤氧化酶(XOD)催化次黄嘌呤和黄嘌呤生成的[4],因此,抑制XOD活性是缓解高尿酸血症的主要方法之一。目前临床使用的XOD抑制剂(如:别嘌呤醇和非布索坦)虽能有效抑制体内XOD活性,降低体内UA含量,但长期服用会出现腹泻、皮疹、头晕等副作用[5]。所以,研发新型、安全的XOD抑制剂势在必行。植物中的多酚和黄酮类化合物具有抑制XOD活性、降低体内UA含量的作用,有研究[6-7]表明,鞣花酸和洋葱总多酚对XOD活性具有较强的抑制作用,其半抑制浓度(IC50)分别为165.6 μmol/L和17.36 μg/mL。因此,从植物中提取多酚、黄酮类等天然成分作为XOD的潜在抑制剂备受业界关注。
刺梨(RosaroxburghiiTratt)是蔷薇科野生药食两用植物,主要分布在我国西南地区,富含黄酮类、维生素C、刺梨多糖等活性成分。研究[8-9]表明,刺梨多酚和黄酮类化合物对α-葡萄糖苷酶和酪氨酸酶均具有明显的抑制作用,且表现出良好的抗氧化活性。但关于刺梨多酚和黄酮类化合物对XOD的抑制作用鲜见报道。基于此,本研究拟以刺梨果实为原料,用体积分数为80%的乙醇提取其活性成分,利用超高效液相色谱串联质谱(UHPLC-ESI-HRMS/MS)分析刺梨乙醇提取物的主要成分,研究刺梨乙醇提取物对XOD的抑制作用,采用分子对接、分子动力学模拟筛选具有较好XOD抑制活性的成分并阐述其可能的分子作用机制,以期为刺梨的开发利用及天然XOD抑制剂的研发提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
新鲜刺梨果实,采自贵州省毕节市。XOD(5 U/770 μL),北京索莱宝科技有限公司产;黄嘌呤(纯度≥98%),上海瑞永生物科技有限公司产;别嘌呤醇(纯度≥98%),上海阿拉丁生化科技股份有限公司产;(-)儿茶素、没食子酸、鞣花酸、槲皮素、槲皮素-3-O-鼠李糖苷、竹节参皂苷标准品(纯度≥98%),成都曼斯特生物科技有限公司产。其他常规试剂均为分析纯,天津致远化学试剂有限公司产。
1.2 主要仪器与设备
UHPLC-ESI-HRMS仪,美国赛默飞世尔科技公司产;ALPHA 1-2 LD plus型冷冻干燥机,德国Christ公司产;Hei-VAP型旋转蒸发仪,德国Heidolph公司产;SpecyraMax型酶标仪,美国Sunnyvale公司产。
1.3 实验方法
1.3.1 刺梨乙醇提取物的制备参考孙红艳等[10]的方法,并稍作修改。将新鲜刺梨果实清洗干净后,经冻干、粉碎、过筛获得刺梨粉,于4 ℃保存备用。以1∶5的料液比(mg/mL)在刺梨粉中加入80%(若无特指,文中百分数均指体积分数)的乙醇,于30 ℃、200 W的条件下超声30 min,离心(8000 r/min,15 min)后收集上清液,残渣重复提取2次,合并上清液,旋转蒸发浓缩上清液,冻干后得到刺梨乙醇提取物,于-20 ℃保存备用。
1.3.2 刺梨乙醇提取物主要成分测定采用UHPLC-ESI-HRMS仪测定刺梨乙醇提取物的主要成分,参考Q.Ma等[11]的方法,并稍作修改。使用Agilent Poroshell 120 SB-C18色谱柱(100 mm×2.1 mm×2.7 μm),柱温为室温;流动相A为0.1%的甲酸水溶液,流动相B为乙腈;梯度洗脱程序为0~2 min,5%B;2~20 min,5%~50%B;20~30 min,50%~70% B;30~32 min,70%B;32~33 min,5%B;33~38 min,5%B;流速为0.5 mL/min;进样量为2.0 μL。记录负离子模式下的质谱数据。使用全MS扫描,相关参数如下:质谱扫描范围(m/z)为100~1 500 amu,喷雾电压3.3 kV,毛细管温度320 ℃,加热器温度350 ℃,辅助气体流量8.0 L/min,鞘气体流量32.0 L/min,扫描气体流量4.0 L/min。
1.3.3XOD抑制率测定参考A.Mehmood等[12]的方法,并稍作修改。用PBS缓冲液(0.2 mol/L,pH值为7.5)配制质量浓度为1 mg/mL的样品母液,将样品母液稀释至不同质量浓度即得实验待测样品。对照组加入200 μL PBS缓冲液 、100 μL待测样品;样品处理组加入100 μL PBS缓冲液、100 μL XOD溶液、100 μL待测样品。37 ℃孵育5 min后,各组均加入100 μL黄嘌呤溶液(pH值为8.0),于37 ℃再孵育30 min后,各组均加入100 μL HCl溶液(1 mol/L)终止反应,于295 nm处测吸光度。两组均设有空白对照,并使用别嘌呤醇作为阳性对照。每个待测样品重复3次实验,待测样品对XOD的抑制率计算公式如下:
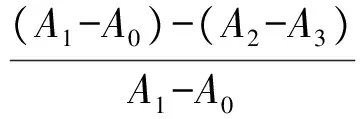
式中:A0为PBS缓冲液和黄嘌呤混合后的吸光度;A1为PBS缓冲液、XOD和黄嘌呤混合后的吸光度;A2为待测样品、PBS缓冲液、XOD和黄嘌呤混合后的吸光度;A3为待测样品、PBS缓冲液和黄嘌呤混合后的吸光度。
参考文献[13]计算样品半抑制浓度(IC50)。
1.3.4 分子对接方法从RCSB PDB数据库(https:∥www.rcsb.org/)中获取XOD的晶体结构(PDB:1fiq),从PubChem数据库 (https:∥pubchem.ncbi.nlm.nih.gov/)中获取小分子物质。使用PyMol软件除去XOD中的水和配体[14],并使用AutoDock Tools1.5.6软件[15]在XOD和配体中添加非极性氢和高斯电荷。在Autodock Vina软件[16]中进行分子对接,使用GetBox plugin (https:∥github.com/MengwuXiao/GetBox-PyMOL-plugin)进行分子对接盒子建立,其中心坐标为:X=25.4 Å,Y=23.7 Å,Z=21.7 Å。根据评分函数计算对接亲和能,筛选出对接亲和能绝对值较高的构象模型,并使用Discovery Studio 2016 Client和PyMol[17]进行分子对接结果的可视化分析。
1.3.5 分子动力学模拟方法使用GROMACS 19.5软件包(https:∥manual.gromacs.org/)进行动力学模拟,在amber FF99SB-ILDN力场中进行分子动力学模拟:1)将体系模拟在TIP3P水模型和0.15 mol/L NaCl溶液中;2)采用最速下降法进行能量最小化,将能量优化到小于1 000.0 kJ/(mol·nm);3)执行正则系综(NVT,2 ns)后,进行等温、等压模拟(NPT,1 ns),确保在恒定温度和压力(310.15 K,100 000 Pa)下进行下一步操作;4)对复合物进行100 ns的分子动力学模拟,并使用GPU处理器加速模拟。模拟结束后,使用均方根偏差(RMSD)、蛋白回旋半径(Rg)、溶剂可及表面积(SASA)、氢键数量评估XOD与配体间结合的变化情况。
1.4 数据处理
所有实验均平行3次,结果以(平均值±标准差)表示,使用SPSS 20.0软件进行数据分析和差异显著性分析(P<0.05),采用Origin 2019b对分析数据作图。
2 结果与分析
2.1 刺梨乙醇提取物主要成分分析
图1为刺梨乙醇提取物总离子流图,初步鉴定刺梨乙醇提取物中含有18种化合物,这些化合物的主要信息见表1。由表1可知,刺梨乙醇提取物中含有2种有机酸类化合物(抗坏血酸和抗坏血酸衍生物),10种多酚和黄酮类化合物(没食子酰己糖、原花青素B1、(-)儿茶素,香豆酰葡萄糖、长春花苷、没食子酰儿茶素-(4α->8)-儿茶素、鞣花酸-鼠李糖苷、鞣花酸、槲皮素-3-O-[6″-O-(3-羟基-3-甲基戊二酰)-β-D-半乳糖苷和槲皮素),6种萜类化合物(刺梨苷1、刺梨苷2、刺梨苷3,1-羟基蔷薇酸、苦楝二醇和美洲茶酸)。刺梨乙醇提取物中物质丰富,其中,刺梨苷2是含量最多的成分,占干物质总质量的19.64%;(-)儿茶素是含量最多的多酚类化合物,占干物质总质量的8.83%。
2.2 刺梨乙醇提取物对XOD抑制作用分析
不同质量浓度刺梨乙醇提取物对XOD的抑制率如图2所示,其中不同的小写字母表示具有显著性差异(P<0.05)。由图2可知,对XOD的抑制率随刺梨乙醇提取物质量浓度的升高而增加。刺梨乙醇提取物对XOD的IC50为(8.17±0.19)μg/mL,而别嘌呤醇对XOD的IC50为(11.69±0.30)μg/mL。这可能是因为刺梨乙醇提取物中含有多种酚类和黄酮类化合物,使其对XOD的抑制作用强于别嘌呤醇。对比其他研究[21-22]报道,香水莲花花蕊乙醇提取物对XOD的IC50为38.54 μg/mL,桑黄乙醇提取物对XOD的IC50为 0.85 μg/mL,即刺梨乙醇提取物对XOD的抑制作用较好。
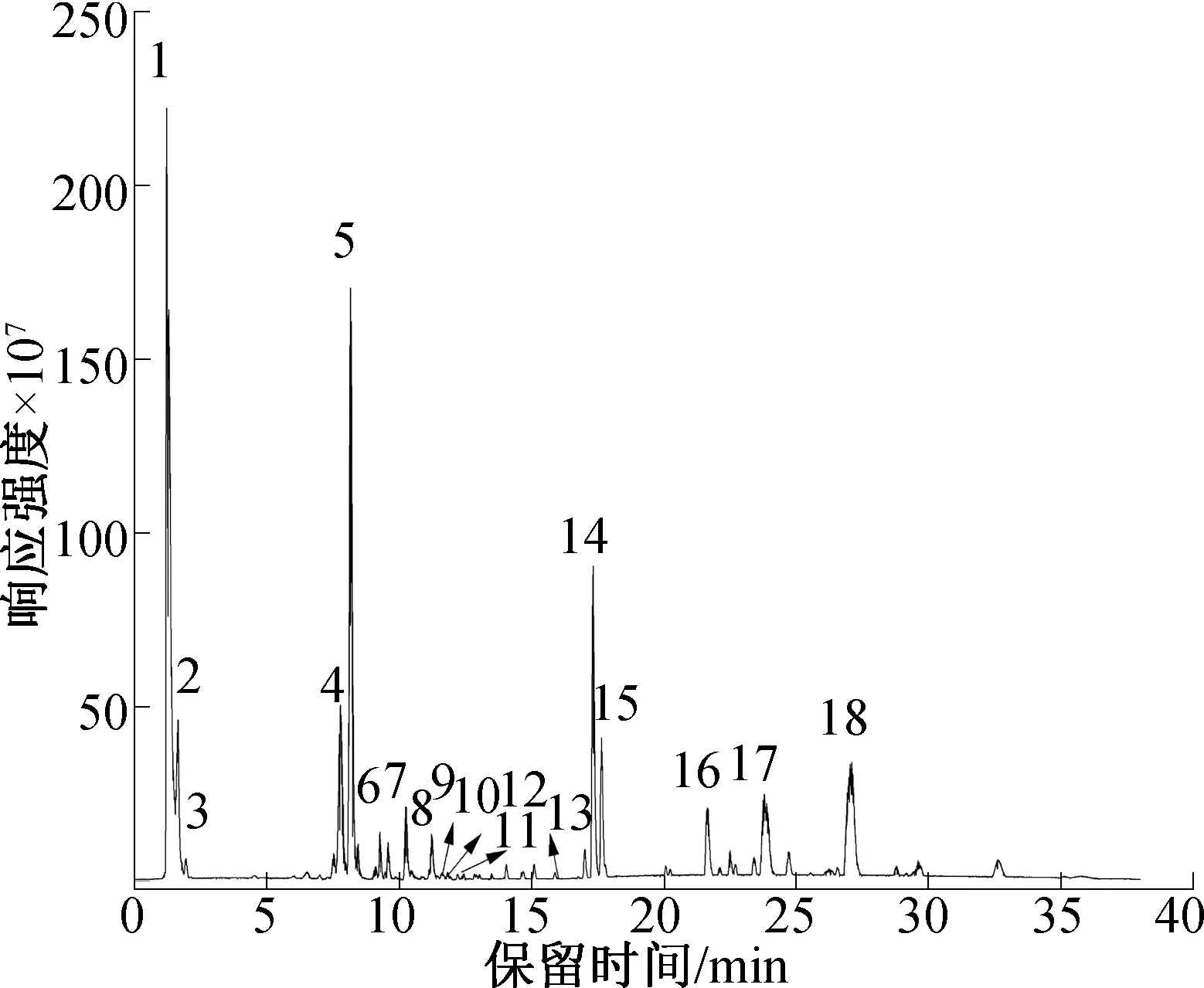
图1 刺梨乙醇提取物总离子流图Fig.1 The negative ion current chromatograms of the ethanol extracts from Rosa roxburghii Tratt
2.3 分子对接结果分析
将刺梨乙醇提取物中鉴定出的化合物进行分子对接,结果见表2。由表2可知,槲皮素和(-)儿茶素的对接亲和能绝对值相对较高,其中槲皮素与XOD的对接亲和能为-9.1 kcal/mol,与张静等[21]报道的-9.6 kcal/mol接近,说明本研究的分子对接数据可靠。且有文献[24]报道,槲皮素能通过氢键与大分子物质结合产生相互作用,故选择槲皮素作为阳性对照。图3为(-)儿茶素与XOD相互作用的2D和3D模式图。由图3可知,(-)儿茶素可与大量氨基酸残基(SER876、VAL1011、PRO1076、GLU802、PHE649、LYS771、ASN768、THR803)形成范德华力,与某些氨基酸残基(GLU1261、THR1010、ARG880)形成氢键。其中,PHE649、GLU802等氨基酸残基被证明在黄嘌呤的羟基化中发挥关键作用[25],(-)儿茶素可能与黄嘌呤竞争结合XOD的活性位点,阻碍黄嘌呤的进入,从而降低XOD活性。鉴于(-)儿茶素在刺梨乙醇提取物中的含量较高,且未见有文献通过分子动力学模拟探究其潜在分子作用机制,故选取(-)儿茶素作为主要活性成分与XOD进行后续分子动力学模拟,研究(-)儿茶素与XOD在模拟过程中的结合稳定性。
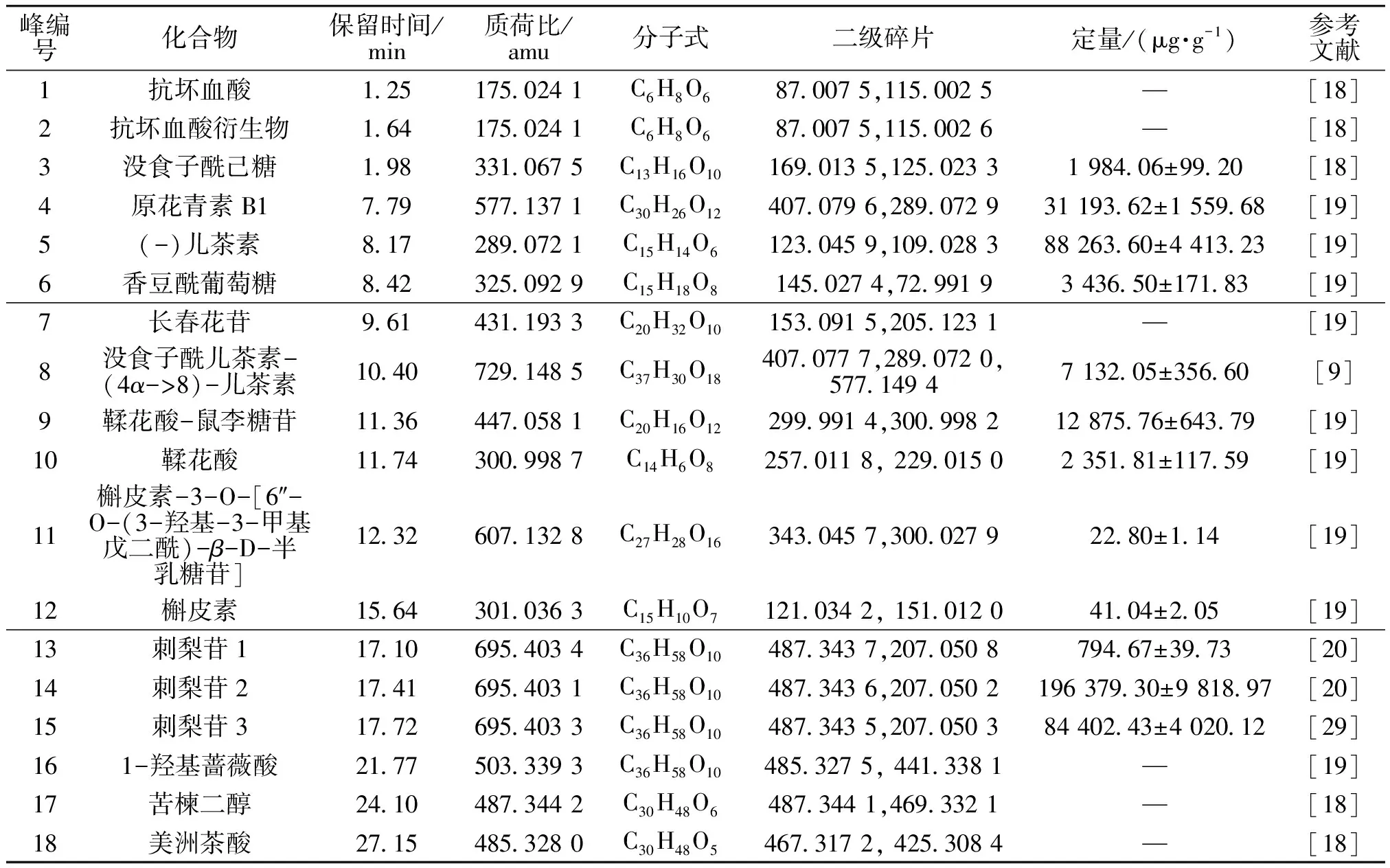
表1 刺梨乙醇提取物中的化合物及其定量或半定量信息Table 1 Compounds and their quantitative or semi-quantitative information of the alcohol extracts from Rosa roxburghii Tratt
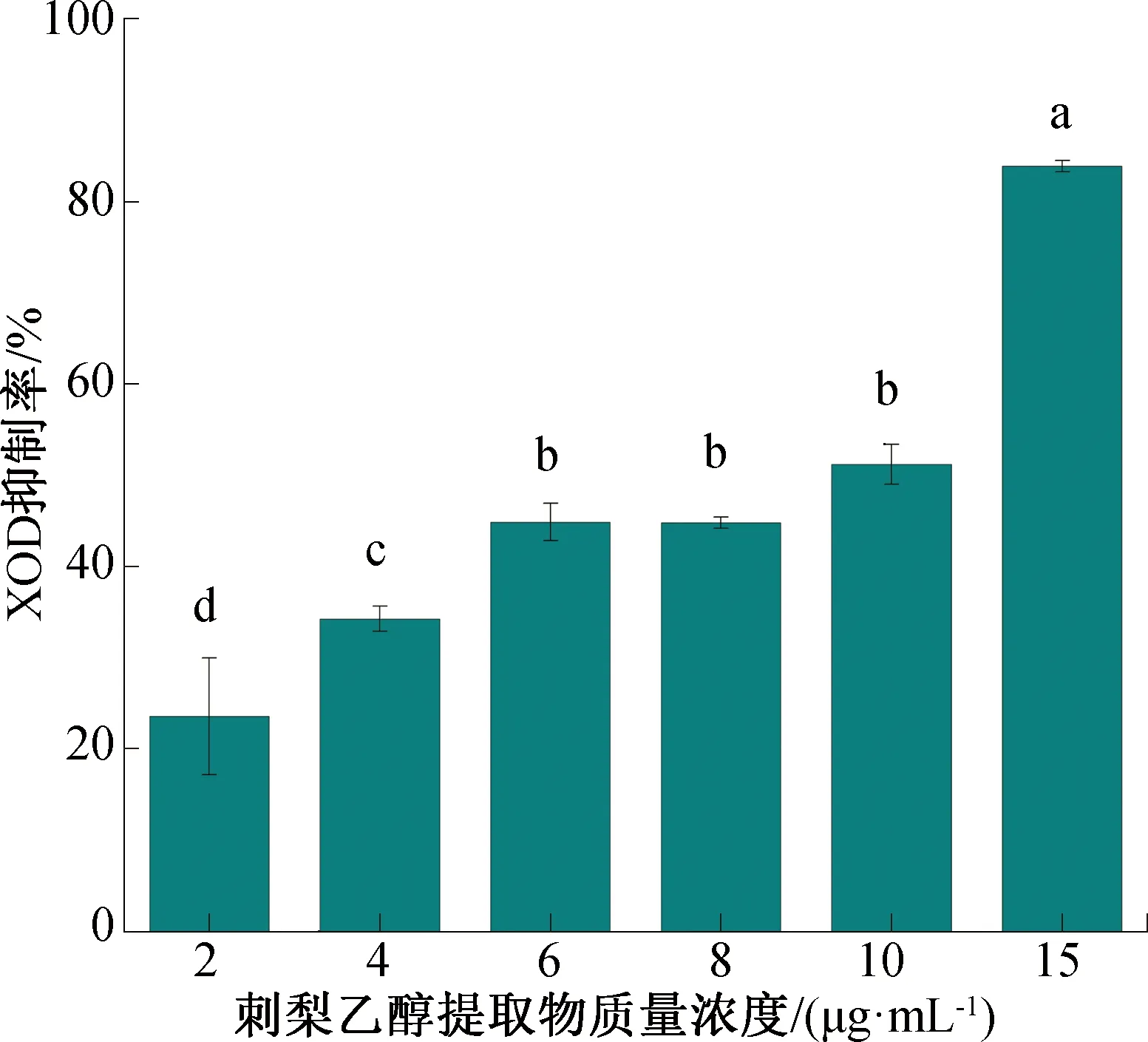
图2 不同质量浓度刺梨乙醇提取物对XOD的抑制率Fig.2 Inhibition rate of XOD by different mass concentration of alcohol extracts from Rosaroxburghii Tratt
2.4 分子动力学模拟结果分析
分子动力学可用原子尺度动态分析微观相互作用。经一系列动态模拟后,体系通常会达到平衡状态,对平衡后的轨迹进行分析即可根据动力学数据预测物质的宏观性质。RMSD用以衡量特定时间蛋白结构与原始构象的平均偏差,是判断模拟系统是否处于平衡状态的关键指标,可用于查看模拟的收敛性和复合物的稳定性。在整个分子动力学模拟过程中,XOD和XOD-(-)儿茶素复合物RMSD的变化如图4所示。由图4可知,XOD和XOD-(-)儿茶素复合物分别在45 ns和20 ns达到平衡,XOD-(-)儿茶素复合物的RMSD先于XOD达到平衡,其RMSD
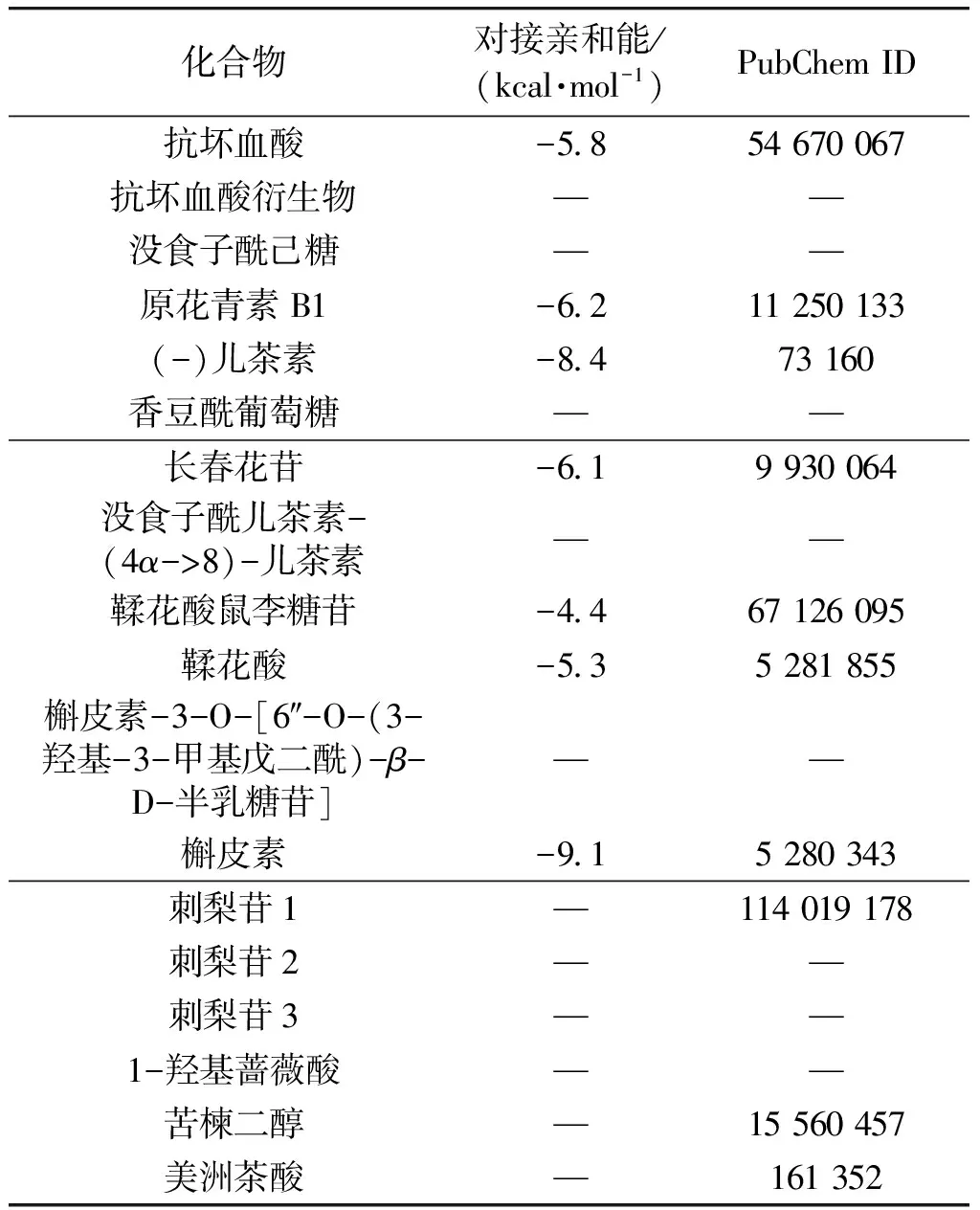
表2 分子对接结果Table 2 Results of molecular docking
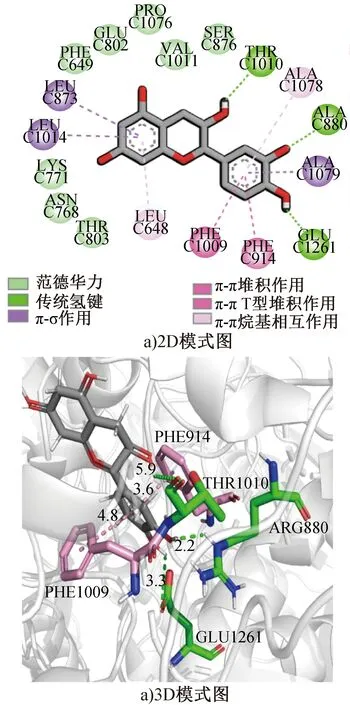
图3 (-)儿茶素与XOD相互作用2D和3D模式图Fig.3 2D and 3D docking modes of interaction between (-) catechin and XOD
在不同时间段围绕平均值波动并稳定在0.16 nm附近,说明XOD-(-)儿茶素复合物更稳定。100 ns分子动力学模拟中(-)儿茶素结构的变化如图5所示。由图5可知,20 ns和100 ns时的(-)儿茶素在XOD中的构象发生了转动,但相较于0 ns和20 ns时,100 ns时的(-)儿茶素转动幅度较小。
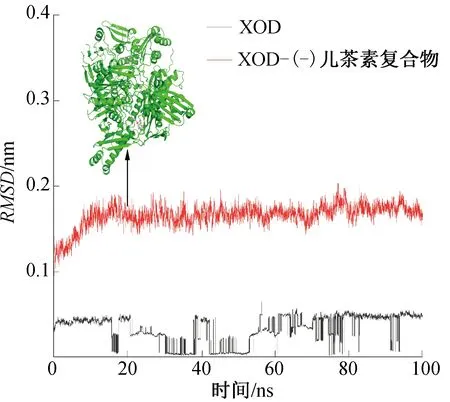
图4 XOD和XOD-(-)儿茶素复合物RMSD的变化Fig.4 RMSD changes of the XOD and XOD-(-) catechin complexes
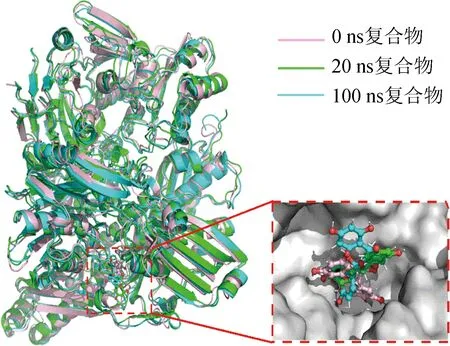
图5 100 ns分子动力学模拟中(-)儿茶素结构的变化Fig.5 Structural changes of (-)catechin in 100 ns molecular dynamics simulations
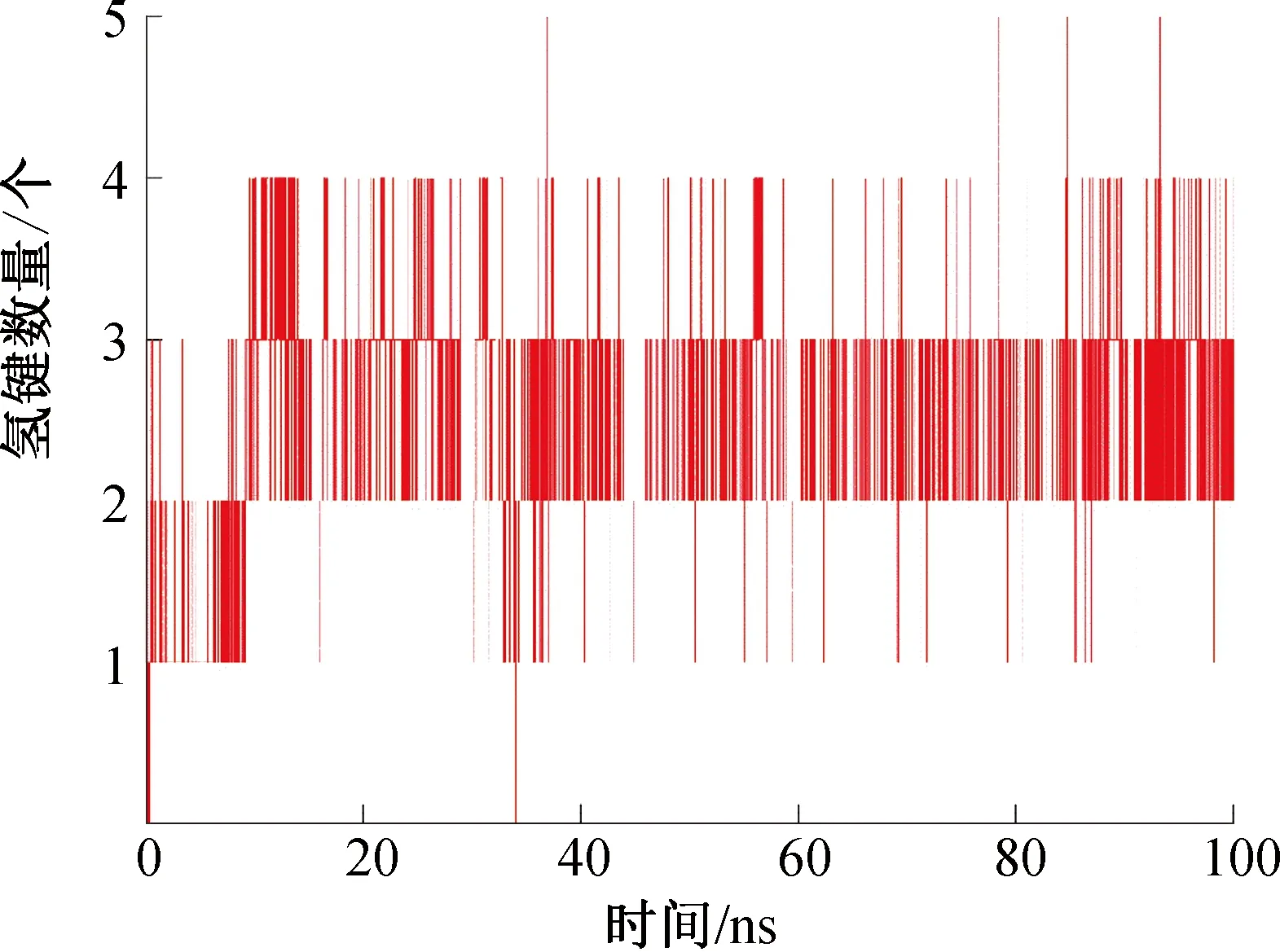
图6 XOD-(-)儿茶素复合物氢键数量的变化Fig.6 H-bond number changes of the XOD-(-) catethin complexes
氢键是一种重要的非共价结构力,能够反映(-)儿茶素与XOD结合的稳定性。XOD-(-)儿茶素复合物体系氢键数量的变化如图6所示。由图6可知,在整个100 ns 分子动力学模拟中,(-)儿茶素与XOD间发生了氢键相互作用,且(-)儿茶素与XOD间的氢键数量在2~5个范围内波动;XOD-(-)儿茶素复合物一直伴随着氢键的断裂和新氢键的形成,导致氢键数量不断变化。在20 ns后依然保持相对稳定的氢键数量(3个),说明20 ns后,XOD-(-)儿茶素形成了稳定的结构。
Rg通常是评估蛋白质结构变化的表征参数,可描述蛋白质的紧密度,Rg越小则紧密度越好,即蛋白质结构越稳定。XOD和XOD-(-)儿茶素复合物体系Rg的变化如图7所示。由图7可知,XOD-(-)儿茶素复合物的Rg趋势较平稳,稳定在3.1 nm左右,这表明(-)儿茶素与XOD结合后,复合物体系结构紧密。
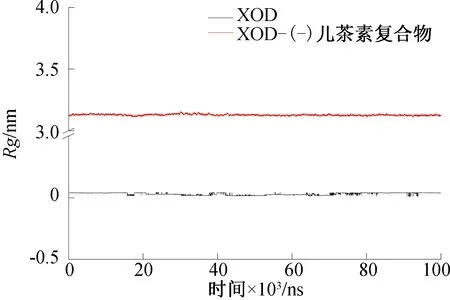
图7 XOD和XOD-(-)儿茶素复合物Rg的变化Fig.7 Rg changes of the XOD and XOD-(-) catechin complexes
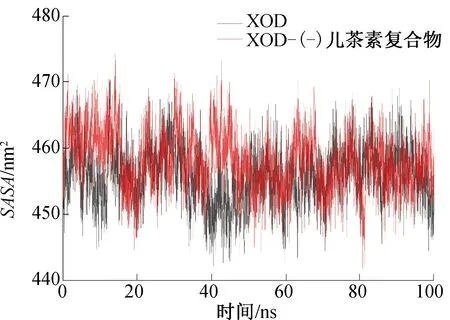
图8 XOD和XOD-(-)儿茶素复合物SASA的变化Fig.8 SASA changes of the XOD and XOD-(-) catechin complexes
SASA用于描述蛋白质的疏水性,氨基酸残基的疏水性可影响蛋白质的折叠。XOD和XOD-(-)儿茶素复合物SASA的变化如图8所示。由图8可知,在40 ns前,XOD 和XOD-(-)儿茶素复合物的SASA波动基本一致,40 ns时,XOD的SASA降低,而XOD-(-)儿茶素复合物的SASA升高,变化趋势与Rg一致,这可能是XOD-(-)儿茶素复合物在模拟过程中形成的氢键数量在此时增加所致。
经过100 ns 分子动力学模拟发现,(-)儿茶素与XOD结合并形成稳定的复合物,相较于XOD,两者的结合导致XOD更加紧密,且影响了(-)儿茶素结合XOD周围的氨基酸残基。通过氢键分析可知,(-)儿茶素与XOD的结合过程一直伴随着氢键的产生和断裂。因此,通过分子对接和分子动力学模拟可知,(-)儿茶素可与XOD长时间稳定结合,并抑制XOD的活性位点。
3 结论
本文鉴定了刺梨乙醇提取物中的主要成分,研究了刺梨乙醇提取物对XOD的抑制作用,筛选了刺梨乙醇提取物中具有较好XOD抑制活性的成分并探究了其可能的分子作用机制。结果表明,刺梨乙醇提取物中共鉴定出18种化合物,包括2种有机酸化合物、10种多酚和黄酮类化合物、6种萜类化合物,其中刺梨苷2和(-)儿茶素是主要成分,分别占干物质总质量的19.64%和8.83%。刺梨乙醇提取物具有较好的XOD抑制活性,IC50为8.17 μg/mL。(-)儿茶素与XOD的对接亲和能的绝对值较高,其能与XOD多个氨基酸残基通过范德华力、氢键等方式紧密结合,形成构象稳定的复杂体系,从而降低XOD活性。但刺梨乙醇提取物对XOD的抑制活性尚需进一步通过体内实验进行验证,以更好地为开发具有XOD抑制作用的刺梨功能性食品提供理论依据和参考。

