高致病性猪繁殖与呼吸综合征病毒与副猪嗜血杆菌共感染的综合鉴定
宫萌菲,兰吉灵,王一丹,任玉鹏
(西南民族大学畜牧兽医学院,四川 成都 610041)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS)是国内外生猪养殖过程中极为常见且危害较大的疫病之一,主要由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染所致,引起母猪繁殖障碍、仔猪呼吸道症状和免疫抑制等[1]。全球流行的PRRSV主要分为以LV株为代表的欧洲型(Ⅰ型)和以VR-2332株为代表的北美型(Ⅱ型)。我国猪群体感染的PRRSV以北美型为主,其又分成3种亚型,包括以CH-1a、S1和BJ-4株为代表的经典PRRSV(Ⅱ型);以JXA1、HuN4和TJ株等为代表的高致病性PRRSV(HP-PRRSV);以JL580、CHsx1401和HNjz15株为代表的NADC30-like PRRSV[2]。由于PRRSV基因突变和重组的频率较高,往往导致新毒株的出现和适应性的不断增强。同时,研究表明,PRRSV感染导致胸腺前体细胞减少和CD4+、CD8+胸腺细胞凋亡,使胸腺内成熟T淋巴细胞数量改变,进而引起外周T淋巴细胞对抗原识别及相关细胞因子分泌异常。此外,PRRSV感染还可推迟PRRSV感染猪中和抗体的产生[3]。因此,兽医临床中,PRRSV感染猪往往还与其他病毒或细菌混合感染,如猪瘟[4]、猪伪狂犬病[5]、猪圆环病毒病[6]、链球菌病[7]、大肠杆菌病[8]和副猪嗜血杆菌病[9]等,增加了猪群发病率和死亡率,也给猪病预防带来了很大困难[10]。
副猪嗜血杆菌(Haemophilus parasuis, HPS)是巴斯德菌科嗜血杆菌属细菌,是一种革兰氏阴性菌,以多发性纤维素性浆膜炎、脑膜炎和关节炎为主要症状。近些年来,HPS作为继发性病原菌与其他细菌或病毒病一起暴发,使得混合感染病例变得非常普遍,成为威胁养殖业的重要细菌性病原[11]。HPS有众多血清型,目前已知的血清型有15种[12],在我国以血清4型(24.2%)和5型(19.2%)最为流行,其次为13型(12.5%)、14型(7.1%)和12型(6.8%),还有12.1%的分离菌株不能进行血清学分型[13],另外,HPS相同的血清型根据地方差异其毒力也会有很大差异。因此进行本地特异毒株的实验室药敏试验以确定有效的抗生素就显得尤为重要。
本研究对肥育猪场病猪进行临床诊断、病理剖检和实验室检测。无菌采集病变组织样本,用PCR检测法进行病毒检测,进行细菌分离鉴定,参考Howell等[14-15]报道的血清学鉴定方法对病变组织上分离到的HPS分离菌株进行血清型鉴定,采用K-B纸片法对分离得到菌株进行药物敏感性试验。本研究的目的和意义在于综合诊断分析该养殖场病猪发病病因,并进一步对分离菌株进行血清型鉴定和药敏分析,为养殖场疫病防治提供依据。
1 材料与方法
1.1 病料来源
2022年5月,于四川地区某肥育猪场无菌采集病猪血液、肺脏及淋巴结样本。
1.2 主要试剂
病毒基因组DNA/RNA提取试剂盒,购于Magen公司;反转录试剂购于TakaRa公司;胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)购于杭州微生物试剂有限公司,琼脂糖购于US EVERBRIGHT,DL 2 000 DNA Marker购于北京博奥森生物技术有限公司;核酸染料购于中晖赫彩生物医药科技有限公司,抗菌药物药敏片购于杭州微生物试剂有限公司。
1.3 猪场病猪临床症状观察及病理剖检
了解猪场病猪发病情况,观察病猪整体状态、精神状态和采食情况等,挑取濒死肥育猪进行剖检,观察各组织和器官的病理变化特征。
1.4 病毒的RT-PCR检测
将采集到的病料肺脏组织样品切碎充分研磨,放入-80 ℃冰箱中反复冻融3次后,4 ℃,1 000 r/min,离心10 min,取200 μL上清液按照病毒基因组DNA/RNA提取试剂盒说明书步骤提取样品中病毒核酸。用于DNA病毒检测的核酸直接进行PCR扩增。用于RNA病毒检测的核酸可进行反转录,体系如下:5×Buffer 4 μL,Supreme Enzyme Mix 3 μL,DEPC水8 μL,RNA模板5 μL。反应程序为:25 ℃,10 min;55 ℃,15 min;85 ℃,5 min。产物储存在-20 ℃冰箱中,用作模板DNA。
PRRSV Nsp2基因检测特异性引物根据其保守区域,用Primer 5.0设计;ASF[16]、PRV[17]和CFSV[18]的检测引物序列均根据参考文献合成(表1),其检测靶基分别为PRRSV Nsp2基因、ASFV VP72基因、PRV gE基因、CSFV E2基因;所有引物由生物工程(上海)股份有限公司合成。检测过程中按照各引物最优反应体系及条件设置。扩增产物送北京擎科生物科技有限公司(成都)测序。

表1 几种病毒的引物序列信息
1.5 PRRSV Nsp2基因同源性及遗传进化分析
将测序产物的序列与NCBI上已登录的参考毒株[包含NADC30-like(谱系1)、QYYZ-like(谱系3)、VR-2332-like(谱系5)和HUN4-like(谱系8)等4个主要谱系的代表毒株]进行比对分析,通过BLAST对PRRSV Nsp2基因序列进行同源性比较,用Mega 7.0构建进化树分析各毒株的遗传进化关系。
1.6 细菌分离纯化及形态学检查
以接种环无菌采集病变肺脏组织液,接种于TSA固体培养基(含20%小牛血清和1% NAD)上,置于恒温培养箱,37 ℃培养24~48 h,观察细菌生长状况和形态。将TSA平板上生长的疑似HPS菌株进一步纯化后,制备细菌抹片,并进行革兰氏染色。用100×油浸镜头观察菌体形态特征及染色特性。
1.7 细菌的16S rRNA鉴定及遗传进化分析
细菌的16S rRNA检测引物序列根据参考文献[19]合成。引物序列信息见表2。

表2 细菌16S rRNA基因扩增引物序列
PCR反应体系如下:2×Taq酶mixture 10 μL、上下游引物各0.5 μL、DNA模板2 μL、ddH2O 7 μL。阴性对照组使用ddH2O代替cDNA。扩增反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸90 s,循环30次;72 ℃终延伸10 min,电泳观察结果,4 ℃保存。送产物到公司测序,将所得细菌16S rRNA序列(命名为HK-YP)将测序结果经BLAST比对分析,找到相近序列从而确定菌株种属。
已知目前副猪嗜血杆菌在我国国内主要流行的血清型有4型、14型、13型、5/12型[20]。结合目前我国国内流行的HPS血清型,把16S rRNA基因测序结果与GenBank中登录的副猪嗜血杆菌参考序列构建系统发育进化树。
1.8 细菌分型鉴定
参考文献[14-15,21-22]报道的HPS血清型多重PCR鉴定方法结合目前我国国内流行的HPS血清型,选择合成4种HPS特异性的血清型基因鉴定引物,血清4型、14型、13型、5/12型PCR鉴定引物(5型和12型共用同一对引物[23]),引物由北京擎科生物科技有限公司(成都)合成(表3)。

表3 HPS血清分型的引物序列
PCR反应体系为:2×Taq酶mixture 10 μL、上下游引物各0.5 μL、DNA模板2 μL、ddH2O 7 μL。空白对照组使用ddH2O代替cDNA。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火35 s,72 ℃延伸50 s,循环30次;72 ℃终延伸10 min。凝胶电泳后,用紫外凝胶成像仪观察结果,4 ℃保存。PCR产物进行测序,将测序结果经BLAST进行比对分析。
1.9 细菌药敏试验
药敏试验基于美国临床标准委员会(NCCLS)推荐的K-B琼脂法进行。选择挑取单菌落接种于TSB液体培养基(含20%小牛血清和1% NAD)中,在37 ℃恒温摇床中培养24~48 h,用纸片扩散法进行药敏试验,选取常用抗生素:新霉素、恩诺沙星、庆大霉素、林可霉素、卡那霉素、头孢拉定、头孢克洛、头孢氨苄、多西环素为试验药物。用移液枪取100 μL HPS分离菌的TSB液体培养基,用无菌涂布棒均匀涂布接种于含1% NAD及20%新生小牛血清的TSA平板上。然后用无菌镊子将各种药敏纸片分别平贴于培养基表面,在恒温37 ℃条件下培养24~48 h观察、测定抑菌圈直径。药敏试验结果参考杭州微生物有限公司的《药敏试验纸片法的抑菌范围解释标准》的标准判断耐药(R)、敏感(S)或中介(I)。
2 结果与分析
2.1 猪场病猪临床症状观察及病理剖检结果
2022年该肥育猪场购买有200头断奶仔猪有100多头猪出现发病症状,发病率高达50%,死亡率在30%~40%之间。发病猪的主要临床症状为体温升高、体表有大面积的淤血斑、耳朵及四肢明显发绀,详见图1A。精神沉郁、食欲不振、不愿站立和行走或行走缓慢、呼吸困难、气喘并伴有咳嗽、流鼻涕、腹泻症状。病理剖检可见全身淋巴结肿大,胸腔、心包和腹腔内有大量的淡红色液体,肺脏、肝脏肿大实变,详见图1B、图1C。

图1 病猪临床症状观察及病死猪剖检病变
2.2 病毒基因测序及遗传进化分析
病毒结果显示,PCR扩增出现大小约926 bp的特异性条带,将测序结果经BLAST比对分析显示,本次分离的PRRSV SCLZ202201株与GenBank中登录的PRRSV广西分离株HUN4-like毒株GXBH1404(登录号:MG604959.1)基因序列同源性最高,为99.17%。与PRRSV代表毒株JXA1、HUN4同源性分别为97.5%、97.52%,与经典PRRSV CH1a同源性为89%,与QYYZ-like同源性67.6%,与VR-2332-like同源性为77.5%,与NADC30-like同源性为52.9%。此外,SCLZ202201株与近年报道的四川流行的HP-PRRSV谱系8毒株SCCD16和SC2012相比,同源性仅分别为94%和93.6%。进一步分析显示,与谱系8中的代表毒株JXA1和HUN4、GXBH1404及四川流行毒株SCCD16、SC2012等5个毒株相比,SCLZ202201株Nsp2基因共存在9个独有的碱基突变,与四川流行毒株相比共存在21个碱基突变。表明当前HP-PRRSV仍在四川地区持续流行,其基因多样性也在不断增加。
根据Nsp2基因序列构建进化树,结果显示,所有PRRSV毒株主要分为2个大支(以LV为代表的欧洲型分支,以VR-2332为代表的美洲型);目前国内的美洲型PRRSV基因型Nsp2基因进化树分为NADC 30-like(谱系1)、QYYZ-like(谱系3)、VR-2332-like(谱系5)和HUN4-like(谱系8)(图2)。遗传进化树结果显示,本次检测的PRRSV SCLZ202201属于Lineage8谱系PRRSV,与JAX1、HUN4等聚为一大支,与GXBH1404单独聚成一个小分支。

图2 PRRSV Nsp2基因遗传进化分析
2.3 细菌的分离培养及镜检结果
在添加1% NAD和20%小牛血清的TSA固体培养基上培24~48 h后,长出肉眼可见的圆形、微凸、透明或半透明的白色圆形小菌落,直径约0.5 mm(图3A)。革兰染色镜检结果显示,该菌株为革兰氏阴性菌,在显微镜下呈现多种形态,多见短杆状和长杆状,与其他文献报道HPS染色结果相似(图3B)。

图3 细菌的形态学鉴定
2.4 样品16S rRNA基因的PCR扩增以及测序结果分析
PCR扩增出现长度约1 500 bp的特异性条带,表明已成功扩增目标16S rDNA序列。将测序结果与NCBI中已有序列进行BLAST比对,发现其与副猪嗜血杆菌的同源性最高。参考国内流行HPS血清型,将该序列(命名为HK-YP)与NCBI网站上14株国内外参考菌株相应序列进行比对分析,运用Neighbor-Joining方法构建的系统发育进化树。结果表示,分离菌株HK-YP与血清5型HPS参考菌株SH0165(登录号:CP001321.1)处于同一分支(图4),确定分离菌株为副猪嗜血杆菌。
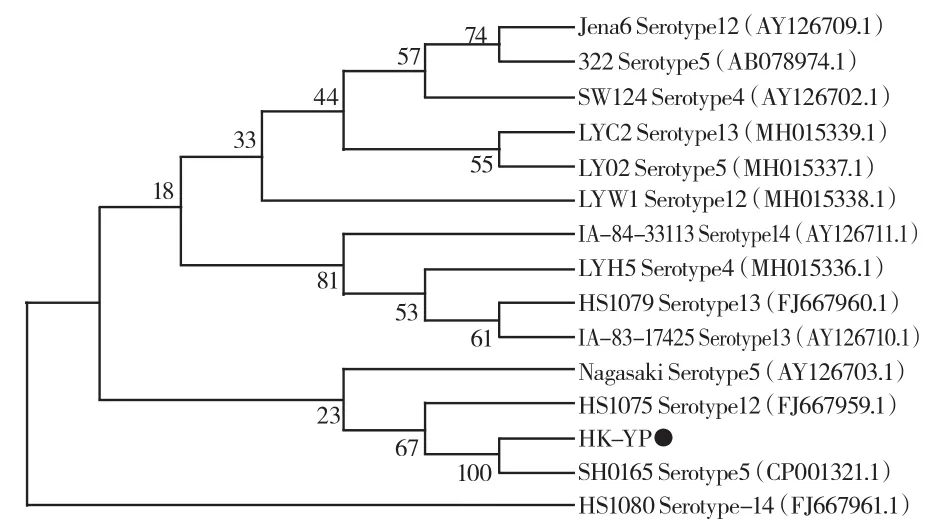
图4 细菌16S rRNA基因扩增及遗传进化分析
2.5 分离株的血清型鉴定结果分析
使用HPS血清4型、14型、13型、5/12型分型PCR引物,对试验2.1分离纯化的HPS菌株,进行PCR扩增。琼脂糖凝胶电泳结果显示,经5/12型引物扩增后,出现与预期大小相符的条带,大小约450 bp(图5),表明本次分离的HPS菌株可能为血清5型或12型菌株。
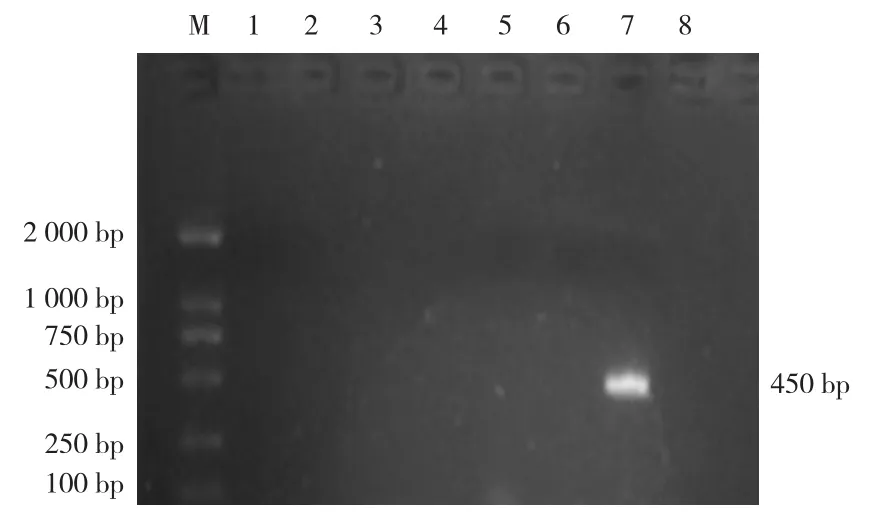
图5 HPS分离株血清型PCR鉴定结果
2.6 分离株PCR产物测序结果分析
将获得的HPS分离株PCR反应产物送公司测序,将测序结果经BLAST比对分析,结果显示,本次分离的HPS HK-YP株序列信息与NCBI上已知HPS血清5型分型毒力基因wcwK5同源性最高,达到99.05%;与已知血清5型HPS 29755株(登录号:CP021644.1)、SH0165株(登录号:CP001321.1)、SCW0912株(登录号:CP046114.1)、Nagasaki株(登录号:CP018034.1)基因序列同源性均大于99%。进一步表明,本次分离菌株为血清5型HPS。
2.7 药敏试验结果
用(K-B)纸片法对分离出的HPS菌株分别进行了药敏试验,测量得到抑菌环直径,药敏结果参考杭州微生物有限公司的《药敏试验纸片法的抑菌范围解释标准》的标准判定耐药(R)、敏感(S)或中介(I)。结果表明,分离菌对新霉素、恩诺沙星、庆大霉素、头孢克洛、头孢氨苄敏感;林可霉素、卡那霉素、多西环素中介;头孢拉定耐药(表4)。

表4 药敏试验结果
3 讨论
本研究根据四川某肥育猪场的发病情况、病猪临床症状、病理变化,结合实验室检测结果,确诊引起该猪场疫病的主要病原为PRRSV HUN4-like毒株和HPS 5型菌株混合感染。目前在我国主要流行的PRRSV主要包括美洲型NADC 30-like、QYYZ-like、VR-2332-like和HUN4-like型等,且不同类型毒株毒力及抗原性有所差异[24]。在PRRSV全基因序列中,Nsp2是最大的非结构蛋白,不同类型毒株间Nsp2基因核苷酸同源性较低,变异系数大,易发生重组,存在插入缺失和突变,且缺失的片段对毒株的毒力有很大影响,常被作为PRRSV遗传进化分析的靶基因[25]。本研究将此次分离的SCLZ202201株分别与GenBank中登录的经典PRRSV、HP PRRSV和NADC30-like的不同代表毒株相应序列进行BLAST比对,用SCLZ202201和参考的毒株建立了基于Nsp2基因的进化树,结果发现,该分离的毒株属于Lineage8谱系的HP-PRRSV毒株;与PRRSV代表毒株JXA1、HUN4同源性分别为97.5%、97.52%与VR-2332-like毒株和NADC30-like毒株同源性都低于80%。研究表明,近年在四川地区流行的PRRSV基因型复杂多样,特别是NADC30-Like株与疫苗病毒重组频繁,使病毒更易引起免疫逃逸和继发感染[26]。周泷等[27]对2016—2018年四川地区来源样本检测发现,7株PRRSV分离株全基因组遗传演化分析表明,其中谱系8(JXA1-Like株)的PRRSV占比42.86%(3/7),谱系1(NADC30-like株)的PRRSV占比57.14%(4/7),未发现谱系5(VR-2332-like株)和谱系3毒株(QYYZ-Like株)。表明四川地区近年流行的PRRSV优势基因型为:谱系8和谱系1,这与本研究检出结果相似。但用本次检出的SCLZ202201株与上述研究中发现的四川地区流行的谱系8毒株SCCD16和SC2012相比,同源性仅分别为94%和93.6%,共有21个碱基突变。表明当前在四川地区流行的HP-PRRSV在持续变异,遗传多样性不断增加。此外根据从进化树上看,SCLZ202201株与广西分离株GXBH1404 Nsp2基因位于同一分支,同源性达99.17%;而SCLZ202201株与其他四川地区的流行毒株均不在同一个分支,提示这两个毒株具有较近的亲缘关系,可能存在演化关联;推测该毒株可能是在跨省际生猪贸易或引种过程中进行传播的。因此,在猪只引种过程中还需进一步加强对PRRSV的检疫和防控。
同时,由于PRRSV的持续感染常导致猪只免疫抑制,使多病原混合感染或继发感染的情况加剧。HPS则是与PRRSV出现共感染的主要病原之一,不同地区流行的HPS菌株,血清型和致病力都存在较大差异,其中以1型、5型、10型、12型、13型和15型菌株毒力最强,国内流行的血清型主要是4型、5型、13型和14型,Howell等[14-15]报道的血清学鉴定方法能确定分离菌株的血清型,准确的血清型鉴定对于HPS感染的流行病学调查研究至关重要。本研究通过已报道的HPS血清分型PCR[14-15,21-22]对本次分离的HPS进行了分型鉴定,该PCR分别针对HPS 4型、14型、13型、5/12型分别特有的wciP、funAB、gltP和wcwK等靶基因进行特异性检测以达到快速分型的目的。经检测和测序分析结果表明,本次分离的HPS菌株为血清5型强毒菌株。研究显示,HPS 5型感染猪常表现出严重的呼吸困难、发热、关节肿大和跛行等,剖检可见严重的纤维素性渗出和败血症等病理变化[28]。为进一步给临床用药提供指导,本研究对HK-YP株进行了药敏试验,结果表明,该菌株对新霉素、恩诺沙星、庆大霉素、头孢克洛、头孢氨苄敏感,对林可霉素、卡那霉素、多西环素中介,对头孢拉定耐药。当前对HPS的治疗主要采用抗生素,通过药敏试验筛选出敏感药物进行针对性的治疗,可以取得良好的效果和减少细菌耐药性的产生。
4 结论
本研究对四川省某肥育猪场发生疫病的病原进行了系统的实验室诊断,通过PCR扩增和测序分析确定了主要病原为HP-PRRSV HUN4-like毒株(谱系8),该毒株与GXBH1404株同源性最高,与川内以往流行毒株相比存在多个核苷酸突变。进一步对继发感染的细菌进行了分离纯化,经16S rRNA鉴定和分型PCR检测,确定病猪继发感染细菌为血清5型HPS,该菌株对新霉素、恩诺沙星、庆大霉素、头孢克洛和头孢氨苄敏感,对林可霉素、卡那霉素和多西环素中介,对头孢拉定耐药。本研究为该猪场疫情防控和治疗提供理论指导,也为同类疫病的综合诊断与防控提供参考。