抗禽腺病毒4型纤突蛋白-2的卵黄抗体的治疗效果评估
李国攀,谢明,艾笑扬,李少斌,荣俊
(长江大学生命科学学院,湖北 荆州 434025)
禽腺病毒根据群抗原差异可分为Ⅰ、Ⅱ和Ⅲ群[1],其中I群最为常见。I群FADV又根据交叉中和抗体的差异分为12种血清型[2]。目前我国流行的血清型主要为FADV-4、FADV-11、FADV-8a/8b[2]。FADV-4是一种传染性和致病性均很强的血清型,可引发包涵体肝炎和心包积液综合征,各日龄的肉鸡以及产蛋鸡均易感和易发病,致死率在30%以上[3],给家禽养殖业造成重大的经济损失。
疫苗免疫是预防FADV-4的重要手段之一。然而,没有免疫疫苗的鸡场一旦爆发FADV-4疫情,疫病将快速传播,鸡群会在3 d ~ 10 d内陆续发病甚至死亡,此时免疫疫苗将不能及时有效对鸡群产生保护作用。在这种紧急情况下,有效的卵黄抗体的使用是治疗和预防FADV-4的重要措施。目前,已有多篇关于FADV-4卵黄抗体的研究,均表现出良好的针对同源毒株的预防和治疗效果[4-7];然而,制备这些卵黄抗体的免疫原大多采用的是灭活的FADV-4,fiber-2亚单位蛋白作为免疫原还未见相关报道。
笔者实验室成功利用原核表达系统可溶性地表达了fiber-2蛋白,该蛋白的N端裁剪了274个氨基酸残基,并保留了抗原的重要结构域;基于该重组fiber-2蛋白,开发了一种FADV-4亚单位疫苗,该疫苗能够诱导产生高滴度抗体,并对鸡产生完全保护[8]。本研究利用该亚单位疫苗免疫蛋鸡,制备和纯化抗FADV-4 fiber-2的卵黄抗体,并评估该在抗体在治疗FADV-4感染中的效果,为将来FADV-4卵黄抗体新兽药申报奠定基础。
1 材料与方法
1.1 主要试剂
Ni Sepharose 6 FF亲和层析介质,购自GE公司;ISA 71VG油佐剂,购自SEPPIC公司;高结合力酶标板,购自NEST公司;HRP标记的兔抗鸡IgY抗体,购自Sigma公司;单组分TMB显色液,购自索莱宝公司;Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix荧光定量试剂盒,购自Yesean公司。
1.2 疫苗、病毒及实验动物
禽腺病毒4型fiber-2亚单位疫苗按照文献[8]进行制备和效检,该批次疫苗的抗原含量为0.1 mg·mL-1;禽腺病毒4型病毒株FADV-4 HB1505为长江大学生命科学学院生物医药实验室分离和保存,GenBank登录号为MZ054256;150日龄产蛋母鸡由长江大学动物实验中心提供;30日龄的SPF鸡由SPF鸡蛋孵化并放置隔离器中饲养,其中SPF鸡蛋购自南京竹顺生物有限公司。
1.3 fiber-2的结构预测
利用SWISS-Model在线工具对疫苗中的fiber-2抗原进行蛋白结构的预测和分析,并通过PyMol软件对其空间结构进行展示。
1.4 蛋鸡免疫
对150日龄产蛋母鸡进行3次免疫:首次皮下免疫1 mL的fiber-2亚单位疫苗;首次免疫14 d后和28 d后进行两次加强免疫,免疫剂量为2 mL。三免30 d后,收集免疫鸡所产鸡蛋,表面酒精消毒后,置于15 ℃保存。
1.5 卵黄抗体的纯化
无菌取50 mL的卵黄,加入8倍体积的蒸馏水,调节pH至5.2,震荡混匀;冻存-80 ℃冰箱2 h后转移至室温解冻,如此反复冻融3次。10 000 g离心10 min,分离收集上清。上清溶液中加入3.5% (m·v-1)的PEG-4000,4 ℃沉淀2 h后,10 000 g离心10 min,分离收集上清;再加入12%(m·v-1)的PEG-4000,4 ℃沉淀过夜,10 000 g离心10 min,分离收集沉淀。沉淀用10 mL无菌PBS重悬,除菌过滤后备用。利用BCA试剂盒对卵黄抗体的蛋白含量进行测定。
1.6 卵黄抗体效价的测定
将纯化后的卵黄抗体用2%的BSA溶液按照2倍比进行梯度稀释(起始稀释比例为1∶500),利用间接ELISA方法对卵黄抗体效价进行测定。
用包被缓冲液(0.05 mol·L-1碳酸缓冲液,pH9.5)将纯化的fiber-2蛋白稀释至1 μg·mL-1,加至高结合力酶标板中,100 μL·well-1,37 ℃包被4 h。然后加入2%的BSA溶液,150 μL·well-1,37 ℃封闭2 h。用2%的BSA溶液将样本进行梯度稀释,加入到包被有fiber-2的酶标板中,100 μL·well-1,37 ℃孵育30 min;每孔加入260 μL的PBST缓冲液,洗板5次,每次间隔1 min,最后一次在吸水纸上完全拍干。加入HRP标记的兔抗鸡IgY二抗(稀释20 000倍),100 μL·well-1,37 ℃孵育30 min;每孔加入260 μL的PBST缓冲液,洗板5次,每次间隔1 min,最后一次在吸水纸上完全拍干。每孔加入单组分TMB显色液,100 μL·well-1,37 ℃避光显色10 min。加入2 mol·L-1H2SO4终止显色,并利用酶标仪读取OD450数值。同时设置SPF鸡血清为阴性对照。
以抗体稀释倍数的对数值(Log10)为横坐标,以卵黄抗体与SPF鸡血清的OD450之比为纵坐标,利用GraphPad软件进行非线性曲线拟合(四参数模型);卵黄抗体效价定义为卵黄抗体与SPF鸡血清的OD450之比等于2.1所对应的卵黄抗体稀释倍数。
1.7 动物实验
将60只30日龄的SPF鸡随机分为六组(G1~G6),每组10只。G1和G2组在攻毒1 d后分别给予0.5 mL·只-1(2 mg·只-1)、1 mL·只-1(4 mg·只-1)的抗体剂量进行治疗;G3组在攻毒后2 d给予1 mL·只-1(4 mg·只-1)的抗体剂量进行治疗;G4组为抗体治疗对照组,在攻毒前一天肌肉注射1 mL·只-1(4 mg·只-1)的抗体剂量;G5组为攻毒对照,只攻毒不注射抗体;G6组为空白对照,既不攻毒也不注射抗体。攻毒株为FADV-4 HB1505,攻毒剂量为5×106TCID50。攻毒以及抗体治疗方案如表1所示。
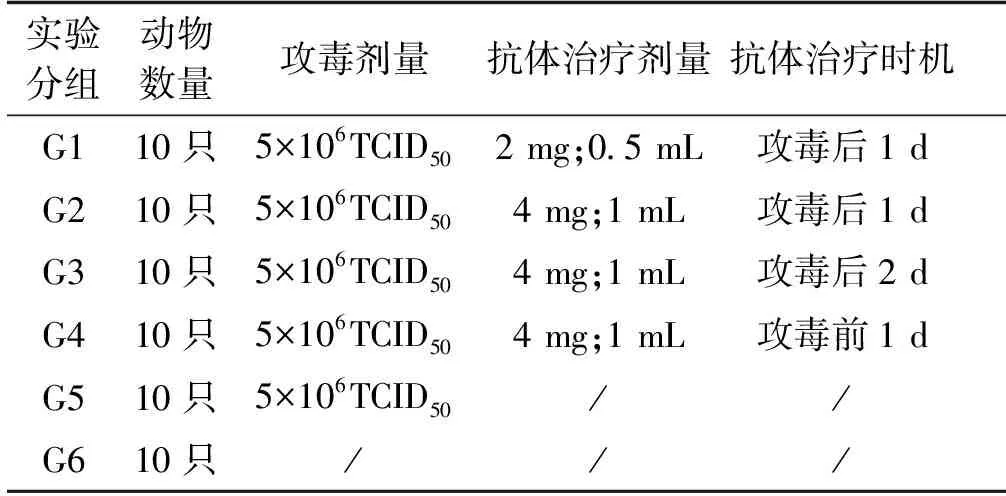
表1 卵黄抗体治疗FADV-4感染方案
1.8 临床症状的检测和评估
攻毒后,监测每日鸡的肛温、体重、采食、精神状态等,统计攻毒后鸡的死亡数量和死亡时间,并根据表2对试验动物进行临床症状评分。攻毒10 d后,所有试验动物处死并进行剖检,采集肝组织后进行HE染色分析。
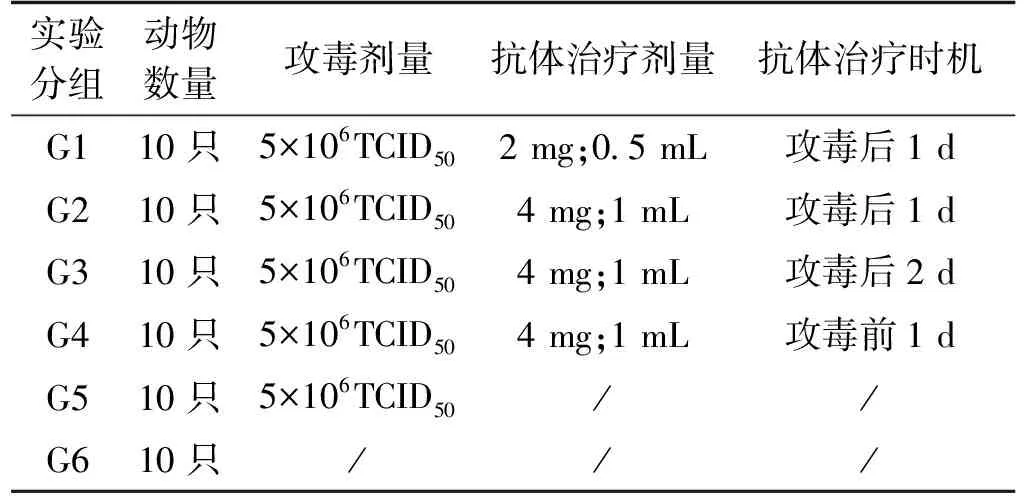
表2 临床症状评分及标准
1.9 病毒载量的测定
取鸡肝组织和肛拭子进行总DNA的提取。使用Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix试剂盒,以FAdV-4 FP (5′-TCTCCACACCCATCGCTACT-3′)和 FAdV-4 RP (5′-CTGACCGTTCCCGCTTGAAT-3′)为特异性引物进行荧光定量试验。并构建标准模板质粒pTOPO-Hexon283(包含一个283bp的FADV-4 Hexon基因片段),用来绘制标准曲线和计算FADV-4病毒在肝组织和肛拭子中的载量。每个样本做3个生物学重复。
1.10 统计与分析
2 结果与分析
2.1 fiber-2的结构预测
利用SWISS-Model对FADV-4 fiber-2亚单位的中的fiber-2蛋白进行了同源建模和分析,结果表明该fiber-2蛋白可以形成同源三聚体,保留了正确的空间结构(图1)。
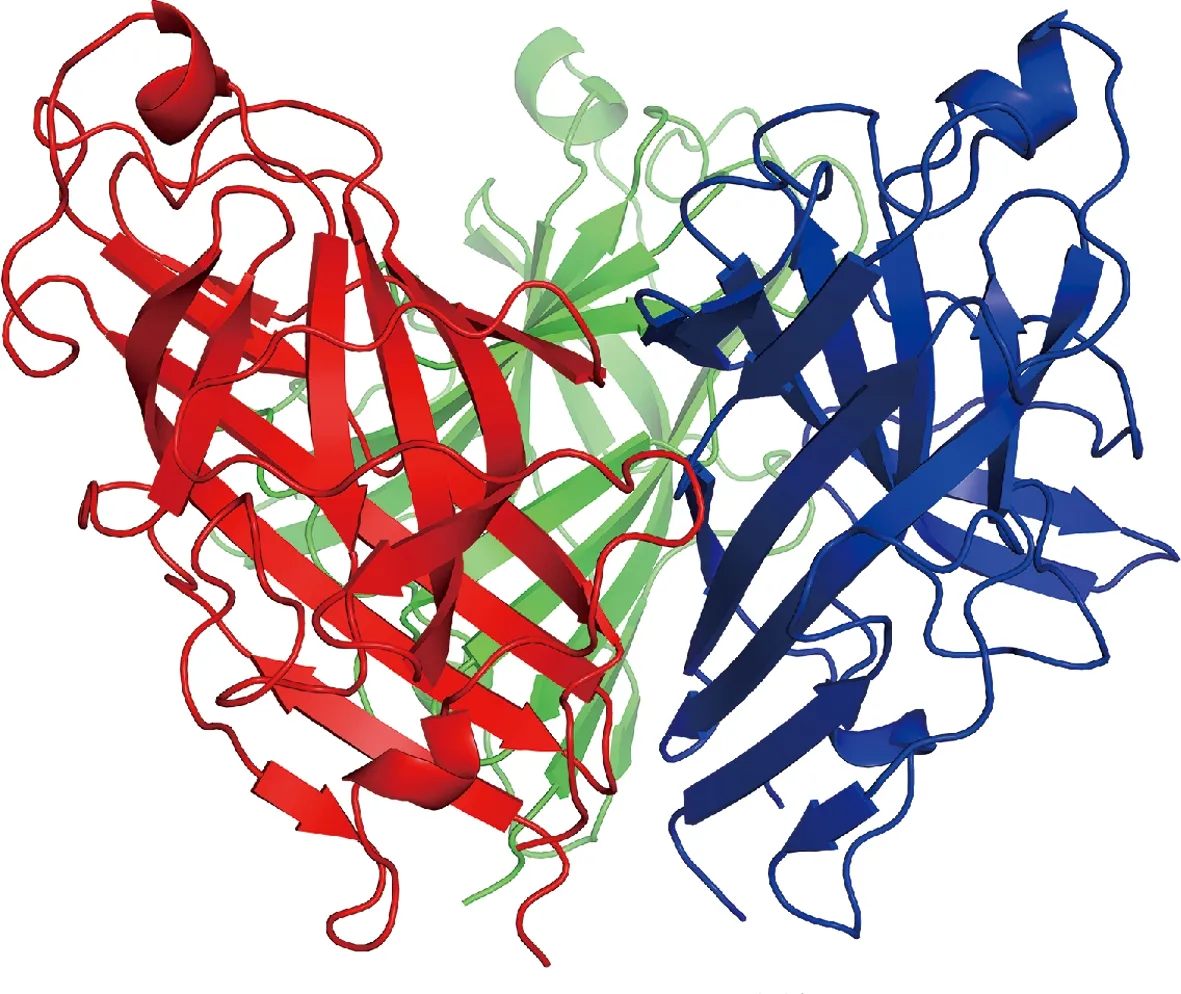
红色、蓝色和绿色部分表示3个亚基。图1 fiber-2的空间结构预测
2.2 卵黄抗体的纯化和效价的测定
采用水稀释法和PEG-4000沉淀法,对卵黄抗体进行了提纯。该组合方法操作简单,能够有效去除卵黄抗体中的脂肪和部分杂蛋白,并保留重链和轻链的完整性,经初步提纯,卵黄抗体的蛋白含量为4 mg·mL-1。并通过基于FADV-4 fiber-2蛋白的间接ELISA方法对纯化浓缩后的卵黄抗体进行了效力测定,结果表明该抗体的效价为105.597,效价较高,见图2。
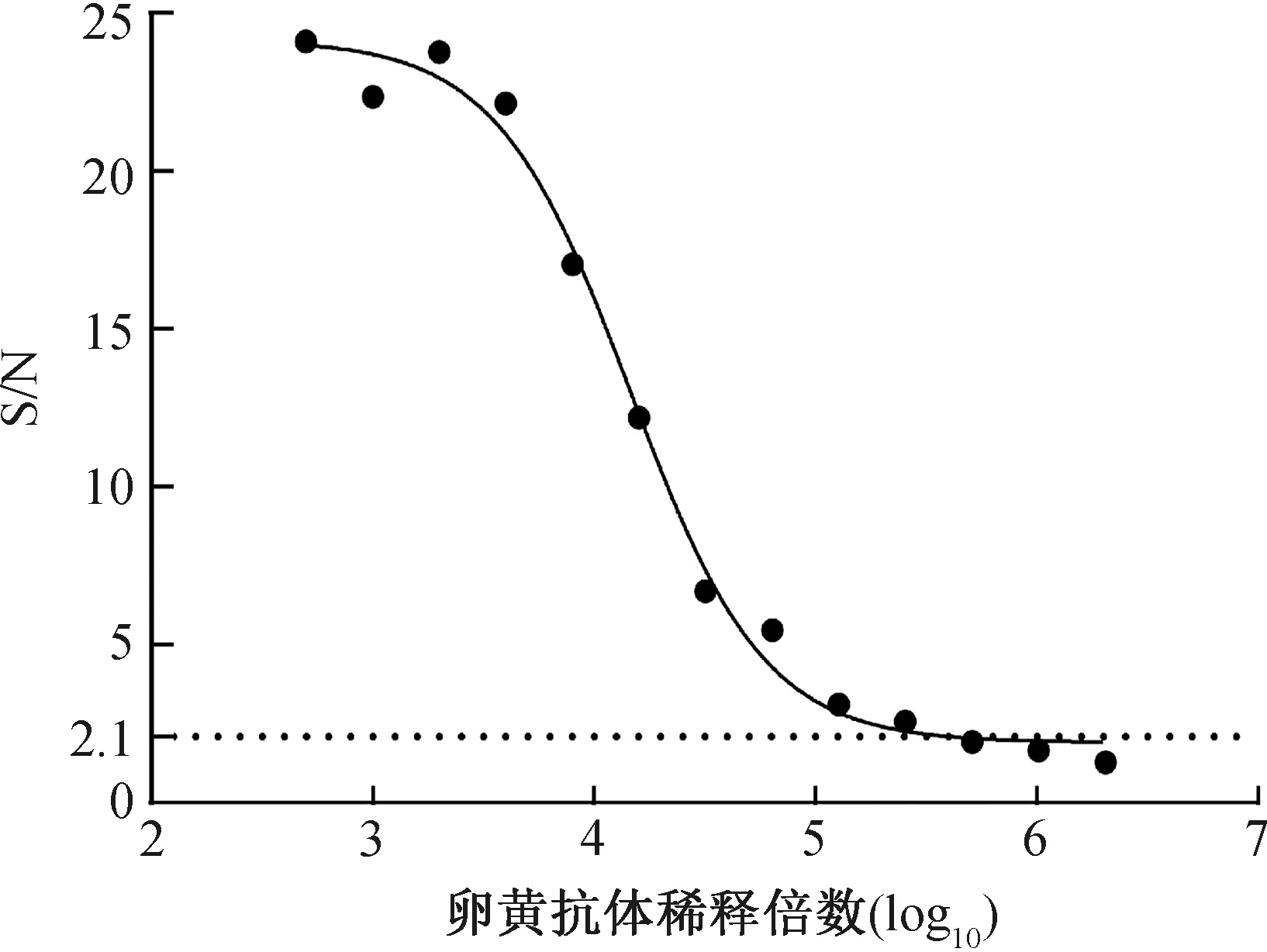
图2 卵黄抗体的纯化和效价的测定
2.3 试验鸡剖检和肝脏HE染色分析
试验结束后,对所有鸡进行了剖检,观察了鸡的肝脏病理变化,各组的典型剖检结果见图3。结果表明,F组(空白对照)鸡肝颜色红润、质地柔软;D组(抗体治疗阳性对照)鸡肝的形态同F组,颜色、形态以及质地均正常;而E组(攻毒对照)鸡肝严重充血、肿大,质地易脆,呈现典型的肝炎症状;而A组、B组和C组(抗体治疗组)鸡肝颜色偏黄,除C组表面有部分出血点之外,其他形态与F组类似。
将鸡肝组织甲醛固定和石蜡包埋后,进行了HE染色,其结果如图3所示。HE染色结果表明,E组鸡肝中央静脉、肝窦扩张,广泛性的红细胞出现,肝细胞索排列紊乱,可见碎裂的肝细胞核碎片,肝细胞核增大;C组肝脏局部出现红细胞,中央静脉、肝窦轻微扩张;其余各组鸡肝肝窦结构完整,肝细胞索排列正常,的细胞核和细胞质染色良好。
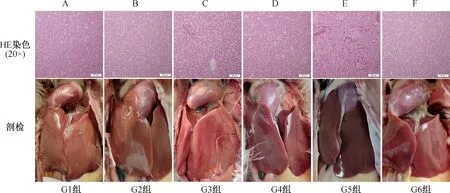
图3 剖检鸡的肝脏形态和HE分析
2.4 卵黄抗体治疗FADV-4感染效果评价
从攻毒后各实验组鸡的存活率、肛温变化、粪便排毒情况、肝中的病毒载量、肝重体重比以及临床症状评分维度上对卵黄抗体治疗FADV-4感染效果评价。鸡的生存曲线见图4A,G5组(攻毒对照)在5×106TCID50攻毒剂量条件下,攻毒后2 d出现死鸡,至第5天所有鸡均死亡,鸡的发病和死亡进程很迅速,鸡的中位存活时间为3.5 d;G3组有3/10的鸡死亡,这3只死亡鸡的存活时间分别为4、6和7 d,中位存活时间为5.7 d,其余鸡无死亡;其余组的实验鸡全部存活。
实验鸡每天的肛温变化表明(图4B),攻毒后,仅有G4组(抗体治疗阳性对照)没有出现明显的肛温升高的问题,其余各组(G1、G2、G3、G5)则在攻毒2 d后出现了不同程度的肛温升高的现象。其中,G1组有轻微的肛温变化,但肛温变化在正常范围内;G2组在攻毒后第2天至第5天肛温升高,并在第6天之后回归正常水平;G3组则在攻毒后第2天至第6天肛温升高,共持续了5 d;G5组在攻毒后的第二天开始肛温急剧升高和持续升高。
肛拭子中病毒载量测定结果表明(图4C),G5组鸡在攻毒后2 d开始排毒,且排毒载量逐日增加,最高可达104拷贝;而其余抗体治疗组则在攻毒3天后不同程度向外排毒,表明抗体治疗能够在一定程度上缓解病毒的增殖。
剖检后取鸡肝进行了病毒载量的测定,结果见图4 D。结果表明,G5组的病毒载量最高;G3组不同个体之间病毒载量差异较大,其中3/10死亡鸡的肝中病毒拷贝数较高,其余7/10存活鸡中未检测到明显病毒;统计结果表明G3组病毒载量显著低于G5组,表明G3组抗体治疗有效;而其余抗体治疗组(G1、G2和G4)中病毒载量显著低于G5组,而与G6组无明显差异,也表明这3组的抗体治疗能够阻止病毒在肝中的增殖。肝重体重比结果与鸡肝中病毒载量结果类似图4E。仅G1组1/10的鸡出现肝脏轻微肿大。
根据表2对攻毒后动物的临床症状进行了评分,结果见图4F。G1~G6组的评分分别为2.7、2.5、3.5、1.6、5.0、0.3;所有攻毒的鸡均出现不同程度的症状,其中G4组相对症状较轻,G5组最严重,而G1和G2组略好于G3组;G1组的出现1/10鸡临床症状评分为4,而G3组则有5/10鸡评分大于、等于4。
结合上述卵黄抗体治疗FADV-4感染效果评价,我们统计并评估了制备的卵黄抗体的不同治疗方案对FADV-4感染的治疗效果,其中将临床症状得分≥4鸡认定为感染FADV-4后发病,而抗体治疗成功的标志为攻毒后鸡不发病。
结果表明(表3)G5组(攻毒对照)的卵黄抗体治愈率为0/10;G4组(抗体治疗阳性对照)的治愈率为10/10;而攻毒后1 d进行卵黄抗体治疗,高剂量抗体的治疗效果(G2,4 mg,10/10)要好于低剂量(G1,2 mg,9/10);而即使高剂量抗体治疗,早期的抗体治疗效果(G2,攻毒后1 d治疗,10/10)要明显好于晚期的治疗效果(G3,攻毒后2 d治疗,5/10)。
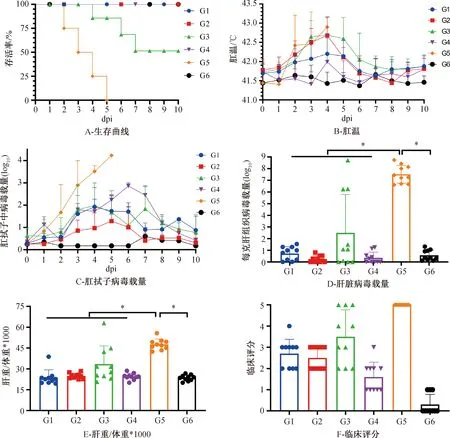
*表示差异显著(P<0.05)。图4 卵黄抗体治疗FADV-4感染效果评价结果

表3 卵黄抗体对FADV-4感染的治疗效果
3 讨论
抗原免疫产蛋鸡后,诱导在血清中产生的特异抗体通过受体介导的方式,转移和富集到卵黄中,这种免疫球蛋白被称为卵黄抗体。卵黄抗体作为疫苗的补充,在疫病防控中发挥重要作用。与疫苗相比,注射卵黄抗体能够在短时间内通过毛细血管和血液循环等途径,使抗体在动物体内迅速分布,能够快速识别、结合和清除病原体[9-11];而注射疫苗后,需要抗原提呈、免疫细胞或抗体的识别、活化和效应等阶段,该过程的建立一般至少需要7天以上。因此,卵黄抗体比疫苗更适用于疫情爆发的初期[12]。
目前已经公开报道了多种FADV-4疫苗,主要包括全病毒灭活疫苗[13]以及基因工程亚单位疫苗。FADV-4表面的结构蛋白hexon[14]、penton[14]、fiber-1[14-15]、fiber-2[8,14,16-17]是开发亚单位疫苗的抗原优势蛋白,能够给动物提供一定的保护效率,其中fiber-2的保护效率最高,可达到96%以上[14]。Fiber-2能够形成同源三聚体[18-19],在FADV的感染过程中发挥关键作用。基于Fiber-2开发的亚单位疫苗能够有效诱导CD4+T细胞的增殖[16],也能在单次5 μg的剂量下诱导高滴度的抗体,给鸡提供完全保护[8]。因此,本研究选择fiber-2亚单位疫苗作为免疫原来免疫蛋鸡,结果也表明,制备的卵黄抗体可以有效地治疗FADV-4的感染。
FADV-4是造成鸡死亡率最高FADV亚型,其死亡程度一般与FADV-4毒株强弱、攻毒途径、攻毒剂量、鸡的日龄、鸡的品种以及鸡的免疫状态相关[20-21]。在我们的这项研究中,通过肌肉注射的方式攻毒5×106TCID50剂量的FADV-4 HB1505,在攻毒后2 d陆续有鸡的死亡,攻毒组鸡的平均存活时间为3.5 d。而在注射卵黄抗体进行治疗后,该情况有极大的改善,仅G3组(攻毒后2 d抗体治疗)出现3/10鸡的死亡,但这些死亡的鸡的平均存活时间提升到了5.7 d。临床上,可以通过该窗口时间开展进一步的防控措施以减少损失,这在实际临床应用中也具有重要的意义。有研究表明,对21日龄的SPF鸡注射100 TCID50剂量的FADV-4病毒,攻毒24 h后注射中和抗体效价为1∶1 024的卵黄抗体(FADV-4病毒灭活苗免疫后制备)进行抗体治疗,0.5 mL剂量组的死亡率为20%,治愈率为30%;1 mL剂量组的治愈率死亡率降为10%,治愈率提升到为90%[6]。在本研究中,采用的FADV-4毒株毒力强、攻毒剂量较大,对鸡的致死率高达100%,攻毒后鸡的平均存活时间仅为3.5 d;攻毒后1 d进行抗体治疗,鸡的死亡率为0,卵黄抗体治愈率在90%(0.5 mL剂量组)和100%(1 mL剂量组);卵黄抗体治疗效果要更好。然而,与另外一篇文献报到的采用灭活FADV-4作为免疫原制备的卵黄抗体的治疗效果相比[5],fiber-2的治疗效果似乎相对较弱,然而这需要考虑到毒株强弱、攻毒剂量以及治愈率的评估方法等因素的影响。同时,也需要认识到fiber-2亚单位相对于灭活的FADV-4在抗原表位的丰富性上也存在差异,诱导的抗体种类、强度以及中和抗体的滴度也存在不同,这也是造成两者治疗效果存在差异的重要因素。
总的来说,在鸡感染FADV-4感染1 d前,2 mg及以上的卵黄抗体剂量,可以实现超过9/10的治愈率;而在感染FADV-4 2 d时,该抗体的治疗效率下降至5/10,但显著缓解了临床症状,延迟了鸡的死亡时间。因此,该卵黄抗体的规范使用和及时使用,可以有效治疗FADV-4的感染,可作为早期感染的重要的治疗和预防措施。

