发酵温度对高山被孢霉合成ω3/ω6多不饱和脂肪酸的影响
夏继蓉,金 娜,苏荣镇,杨建华,温燕龙,李凌飞
(云南农业大学食品科学技术学院, 昆明 650201)
【研究意义】多不饱和脂肪酸(Polyunsaturated fatty acids, PUFAs)是细胞正常生长和发育必需的脂质,是生物膜的关键结构成分,对激素代谢和许多酶的活性起调控作用[1]。根据第一个不饱和双键位置的不同,PUFAs主要分成4类:ω-3、ω-6、ω-7、ω-9类,其中ω-3类和ω-6类较为常见[2]。ω-3 PUFAs包含二十碳五烯酸(EPA)、α-亚麻酸(ALA)、十二碳六烯酸(DHA)等;ω-6 PUFAs包含花生四烯酸(ARA)、γ-亚油酸(GLA)、亚油酸(LA)等。ω-3和ω-6 PUFAs在包括人类在内的高等生物体中具有重要的结构和功能作用[3],例如ω-6 PUFAs中的ARA是前列腺素、白三烯、血栓烷等二十烷类激素的前体,由于其独特的生理功能,它被广泛应用于食品工业、化妆品、医药等许多领域[4]。在膳食中摄入ω-3 PUFAs对预防炎症性疾病和维持正常脑功能具有重要作用[5-6]。二十碳五烯酸(EPA)是一种具有代表性的ω-3 PUFAs[7],可用于治疗心血管疾病,降低血小板聚集和血压[8]。相对于ω-6 PUFAs的丰富来源,自然界中ω-3 PUFAs的来源仅仅是深海鱼类[9]。然而,海洋鱼类资源的减少、开采的复杂性和海洋污染的增加已经成为生产ω-3 PUFAs的限制因素[10]。研究表明,含有一些外源去饱和酶基因的转基因植物可以产生ω-3和ω-6 PUFAs[11],但基于对转基因生物安全性的考虑,这些转基因来源并不适合实际用途。因此,许多研究优先开发微生物作为生产PUFAs的新来源[12]。【前人研究进展】高山被孢霉(Mortierellaalpina)是目前产PUFAs真菌中具有正式安全性评估的菌种,其菌体中含有丰富的PUFAs,总脂肪酸含量可达菌体生物量的50%,其中ω-3达到总脂肪酸含量的3%,而ω-6可达总脂肪酸含量的近30%,是名副其实的油脂细胞工厂[13]。M.alpina菌体中PUFAs合成路径复杂,M.alpina主要通过ω-6途径积累以ARA为主的PUFAs[14],十八烷酸(Stearic C18∶0)依次在Δ9脱饱和酶、Δ12脱饱和酶和Δ6脱饱和酶的催化下生成GLA,而后在Δ6延长酶的作用下生成DGLA,在通过Δ5脱饱和生成ARA。Δ12脱饱和酶和Δ15脱饱和酶分别催化ω-6和ω-3 PUFAs的生物合成,其活性差异可能是M.alpina高产ARA而低产EPA的原因[15]。研究人员采用过表达ω-3脂肪酸去饱和酶基因,如oPaFADS17和oPpFADS17来提高EPA的产量[16-17]。【本研究切入点】酶的催化效率易受温度的影响,而目前温度对M.alpina合成PUFAs的影响知之甚少。在本研究中,采用改变培养温度的策略,测定不同发酵温度下M.alpina的生物量以及ω3、ω6 PUFAs组成及各组分含量和产量。【拟解决的关键问题】分析发酵温度对M.alpina合成ω3、ω6 PUFAs的影响,为M.alpina工业化生产ω3/ω6营养平衡膳食油脂奠定研究基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 高子被孢霉(M.alpinaD36)菌株为云南农业大学食品微生物资源与利用重点实验室分离获得并经过形态学和分子生物学鉴定的菌株。
1.1.2 试剂 马铃薯葡萄糖琼脂含氯霉素(PDA)、葡萄糖、硝酸钠、硫酸镁、磷酸二氢钾、甲苯、甲醇、正己烷、碳酸氢钾、2, 6-二叔丁基-4-甲基苯酚(BHT)、十七烷酸标品(Heptadecanoic acid)、酵母提取物等。
1.1.3 仪器 TS-211CF往复回旋式摇床、YXQ-LS-70A立式压力蒸汽灭菌锅、SW-CJ-1C双人单面净化工作台、BS11OS分析天平、DN-12A干式氮吹仪、LGJ-12冷冻干燥机、气相色谱-质谱联用仪(安捷伦5975C-7890A)等。
1.2 试验方法
1.2.1 培养基的配制 种子培养基:葡萄糖30 g/L,酵母提取物6 g/L,NaNO33 g/L,KH2PO43 g/L,MgSO4·7H2O 0.5 g/L,121 ℃灭菌15 min。发酵培养基:葡萄糖80 g/L,酵母提取物11 g/L,NaNO33.4 g/L,KH2PO43.8 g/L,MgSO4·7H2O 0.5 g/L,121 ℃灭菌15 min。
1.2.2M.alpina发酵培养 无菌挑取少量M.alpina菌丝体,转接于种子培养基中,置于摇床培养。培养条件为20 ℃,175 r/min震荡培养3 d。然后将培养结束后的菌丝混匀后按10%接种量接种于发酵培养基中,分别置于6个不同发酵温度(10、15、25、30、35 ℃)下,175 r/min震荡培养7 d。
1.2.3 生物量(DCW)的测定 发酵结束后收集M.alpina菌丝体,用无菌蒸馏水反复多次洗涤菌体,经真空冷冻干燥并称重。
生物量=菌体干重/发酵液体积
1.2.4 脂肪酸的提取及甲酯化 参考顾晓颖等[18-19]的方法,称取干菌体粉末50 mg,依次加入甲苯、硫酸甲醇、十七烷酸标准品,充分混匀后置于50 ℃水浴过夜。加入5% NaCl水溶液,混匀后加入正己烷萃取2次,合并上清液,加入2% KHCO3水溶液清洗,收集上层清液并用氮气吹干,获得的脂质复溶于1 mL含0.05% BHT的正己烷溶液中,过滤膜后待测。
1.2.5 脂肪酸组成测定及定量分析 通过气相色谱-质谱联用仪(GC-MS)对甲酯化的脂肪酸进行定性和定量分析。GC-MS具体条件参见顾晓颖等[19]的方法。参照标准谱库对菌体中脂肪酸进行定性分析,以C17∶0为参照内标,根据峰面积对各类脂肪酸进行定量分析。
1.3 数据统计与分析
运用软件Excel 2016、Graphpad prism 8.0、SPSS 25.0进行试验数据统计分析与作图。对6个不同发酵温度下ω-3 PUFAs和ω-6 PUFAs的含量和产量进行单因素方差分析(One-way ANOVA),再采用SNK法进行均值的两两比较。
2 结果与分析
2.1 发酵温度对M. alpina菌体生物量的影响
如图1所示,M.alpina菌体生物量随温度的升高呈现先上升后下降的趋势。25 ℃时,M.alpina菌体生物量达到最高(16.07 g/L);当温度达到30 ℃及以上时,菌体几乎不生长;35 ℃时,菌体生物量仅为0.33 g/L。由此可见,25 ℃最适合M.alpina生长,而30 ℃及以上则会抑制M.alpina菌体生长。
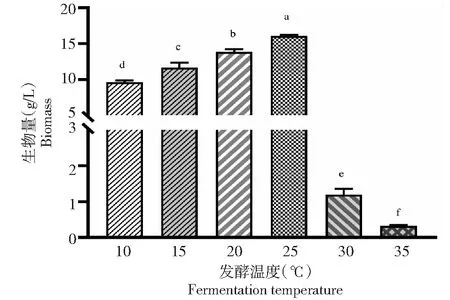
不同字母表示差异显著,即P<0.05,下同Different letters in the graph indicate significant differences, P<0.05,the same as below图1 发酵温度对M. alpina菌体生物量的影响Fig.1 Effect of fermentation temperatures on biomass of M. alpina
2.2 发酵温度对M. alpina菌体中脂肪酸组分的影响
发酵温度为10、15、20、25、30和35 ℃时,M.alpina菌体中的脂肪酸种类分别为11、12、10、10、12和7种。其中,15和30 ℃时菌体中脂肪酸种类最多,由于35 ℃不利于菌体生长,其脂肪酸种类和含量也随之急剧减少。参考武迎春[20]对M.alpinaPUFAs的分类,本研究在所有温度条件下共检测到的ω-3类PUFAs有2种,分别是十八碳三烯酸(α-亚麻酸,ALA)和二十碳五烯酸(EPA);ω-6类PUFAs有4种,分别是十八碳二烯酸(亚油酸,LA)、十八碳三烯酸(γ-亚麻酸,GLA)、二十碳三烯酸(DGLA)和二十碳四烯酸(花生四烯酸,ARA)(表1)。
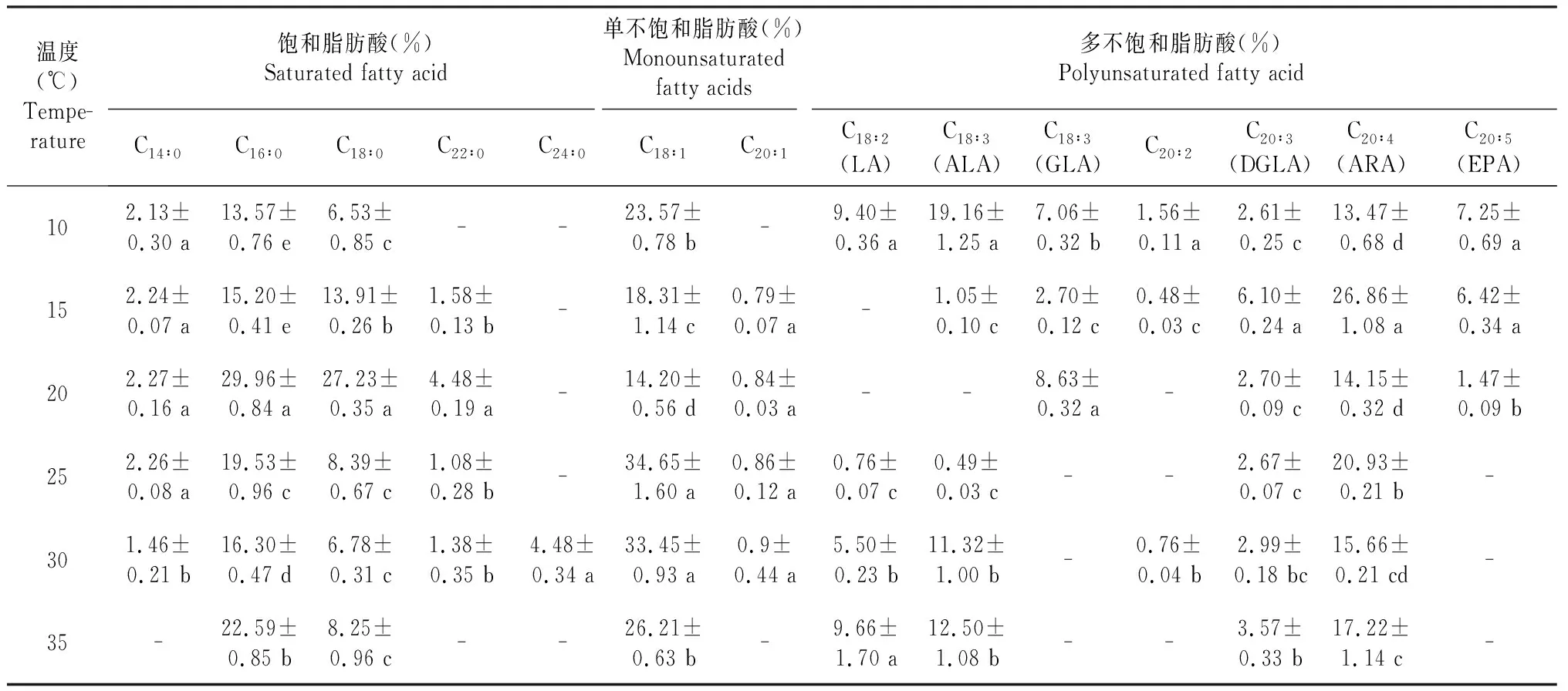
表1 不同温度条件下M. alpina脂肪酸组分及含量
2.3 发酵温度对M. alpina菌体中总脂肪酸(TFA)和PUFAs含量的影响
如图2所示,20 ℃时TFA含量最高,为62.32 mg/g,15~30 ℃含量无显著差异;PUFAs含量在15 ℃时最高,为28.23 mg/g,与其它温度下的含量存在统计学差异。
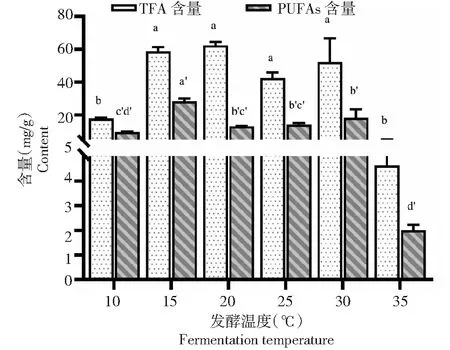
图2 不同发酵温度条件下M. alpina 菌体中TFA和PUFAs的含量Fig.2 Contents of TFA and PUFAs in M. alpina at different fermentation temperatures
2.4 发酵温度对M. alpina菌体中ω-3 PUFAs的影响
2.4.1 发酵温度对M.alpina菌体中ω-3 PUFAs含量的影响 就ALA而言,30 ℃时菌体中ALA含量最高(表2),为5.39 mg/g;25 ℃时其含量最低,为0.2 mg/g;20 ℃时未检测到ALA。就EPA而言,15 ℃时含量最高,为3.79 mg/g;20 ℃时含量最低,为0.91 mg/g;25、30、35 ℃时未检测到ALA。且15、25、35 ℃条件下ALA含量无统计学差异;10和20 ℃条件下EPA含量也无统计学差异。
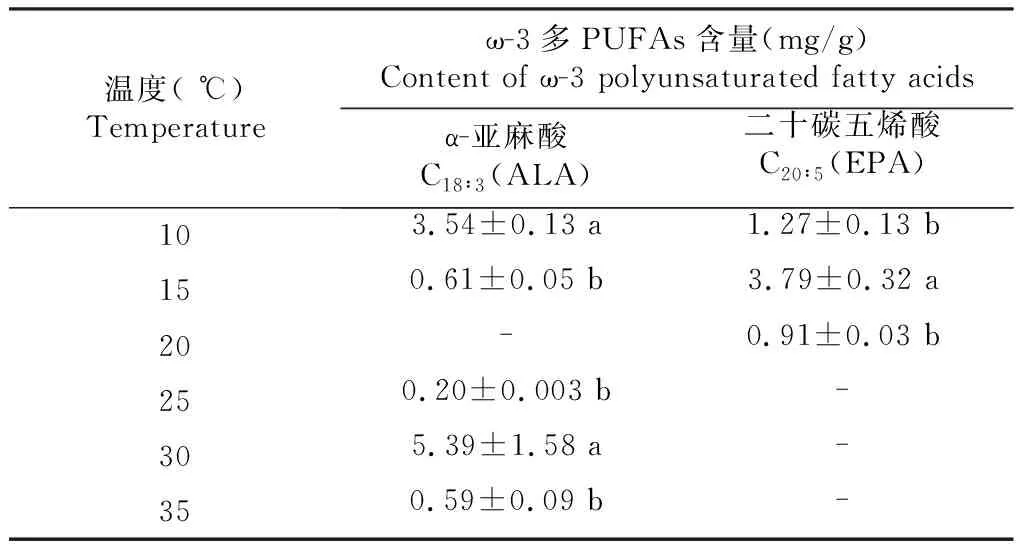
表2 不同发酵温度条件下M. alpina菌体中ω-3 PUFAs含量
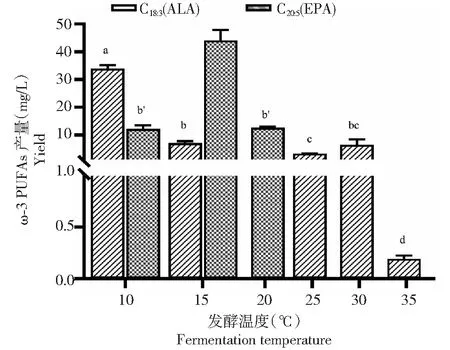
图3 不同发酵温度条件下M. alpina 菌体中ω-3 PUFAs的产量Fig.3 The yields of ω-3 PUFAs in M. alpina at different temperatures
2.4.2 发酵温度对M.alpina菌体中ω-3 PUFAs产量的影响 从图3可知,10 ℃时ALA产量最高(33.94 mg/L),显著高于15和25 ℃的。15 ℃时EPA产量最高,为44.10 mg/L,10 ℃和20 ℃时EPA产量无统计学差异,且当温度高于20 ℃时不再合成EPA。
2.5 发酵温度对M. alpina菌体中ω-6 PUFAs的影响
2.5.1 发酵温度对M.alpina菌体中ω-6 PUFAs含量的影响 就亚油酸(LA)而言,30 ℃时其含量最高(表3),为2.82 mg/g;25 ℃时含量最低,仅为0.32 mg/g;15和20 ℃时未检测到LA。就GLA而言,15 ℃时其含量最高,为4.13 mg/g;20 ℃时含量最低,为1.68 mg/g;10、30、35 ℃时未检测到GLA。就二十碳三烯酸(DGLA)而言,15 ℃时其含量最高,为3.60 mg/g;35 ℃时含量最低,为0.16 mg/g。就花生四烯酸(ARA)而言,所有发酵条件下均能合成ARA,其中15 ℃时ARA含量最高,为15.84 mg/g;35 ℃时ARA的含量最低,为0.81 mg/g。表明发酵温度对M.alpina菌体中ω-6 PUFAs含量具有显著影响。
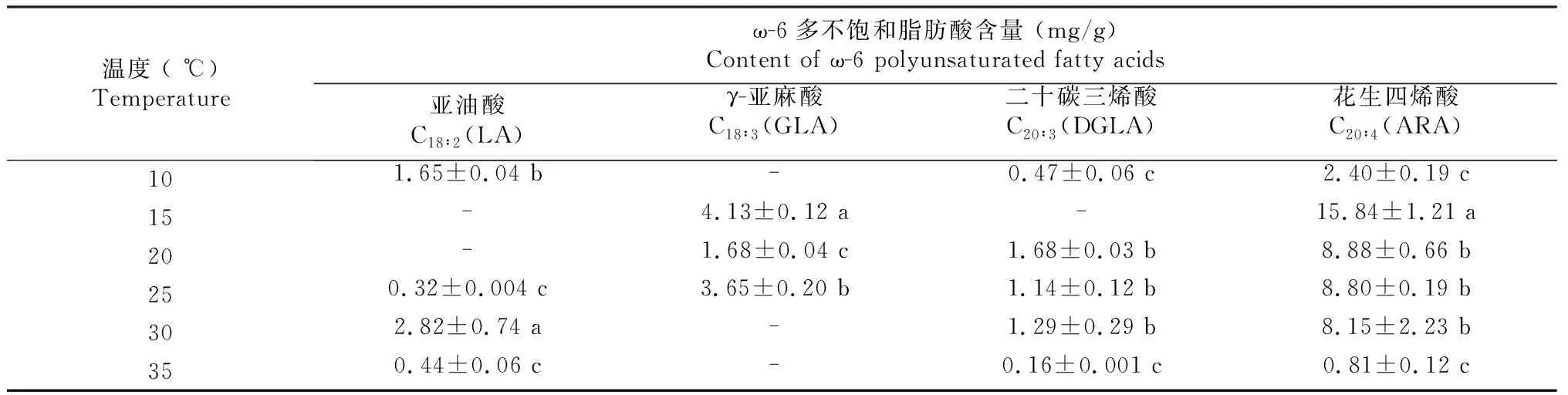
表3 不同温度下M. alpina ω-6 PUFAs含量
2.5.2 发酵温度对M.alpina菌体中ω-6 PUFAs产量的影响 如图4所示,LA在10 ℃条件下产量最高,为15.86 mg/L;GLA产量在25 ℃时最高,为58.72 mg/L;DGLA产量在15 ℃时最高,为40.65 mg/L;ARA产量在15 ℃时最高,为184.41 mg/L,且在各个温度条件下,ARA均是ω-6 PUFAs中产量最高的PUFAs。
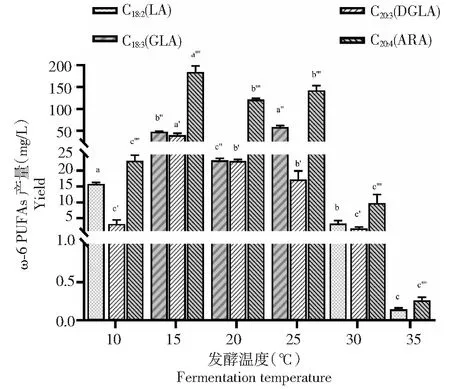
图4 不同温度条件下M. alpina ω-6 PUFAs的产量Fig.4 The yields of ω-6 PUFAs in M. alpina at different temperatures
2.6 发酵温度对M. alpina菌体中ω-3和ω-6 PUFAs合成代谢的影响
如图5所示,本研究中所有温度条件下M.alpina菌体中ω-3和ω-6 PUFAs合成代谢同时进行,但15 ℃时ω-3和ω-6 PUFAs的产量均为最高,分别是51.20和273.13 mg/L;当温度为30 ℃及以上时,由于菌体几乎不生长,ω-3和ω-6 PUFAs的合成代谢几乎都停止。故15 ℃最有利于M.alpina合成ω3/ω6营养平衡膳食油脂。
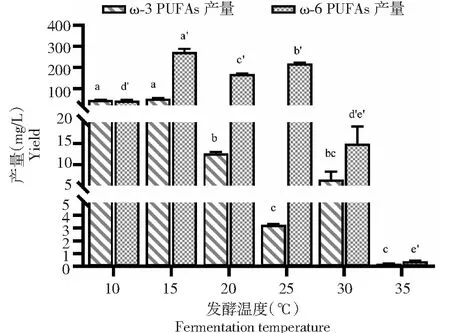
图5 不同温度条件下M. alpina菌体中ω-3和ω-6 PUFAs的产量Fig.5 The yields of ω-3 and ω-6 PUFAs in M. alpina at different temperatures
3 讨 论
如何平衡饮食中的膳食油脂是近几年的研究热点。国内外研究表明,膳食中ω-6与ω-3 PUFAs比值与心血管疾病具有相关性,通过调节含有ω-6与ω-3 PUFAs食物的膳食摄入量来降低该比值具有防治心血管疾病的效果[21-22]。由于可获取ω-6与ω-3 PUFAs的资源匮乏,目前许多研究以微生物作为生产各类PUFAs的新能源。为提高微生物工业化生产PUFAs的可能性和了解更多的合成机制,对微生物合成PUFAs的影响因素进行研究显得尤为重要。
温度是影响微生物生长代谢的重要因素之一。在本研究中,25 ℃最适合M.alpina生长,30 ℃及以上则会抑制M.alpina生长,导致这一现象的原因可能是当温度高于30 ℃时M.alpina菌体中一些重要的酶失去活性[23]。而当温度低于20 ℃时,M.alpina的生物量也显著降低,其原因可能是低温抑制了菌丝的生长。M.alpina合成PUFAs的过程中,10 ℃时菌体中ω-3和ω-6 PUFAs合成代谢同时进行;10与15 ℃时ω-3 PUFAs产量无显著差异,当温度超过20 ℃时不再合成EPA,仅在20 ℃以下的温度才能合成EPA,表明参与EPA合成的酶具低温依赖性的[23]。在ω-6 PUFAs的合成过程中,ARA在各个温度下均能合成,且产量相对较高,Wynn等[24]在培养基中添加含有亚油酸的菜籽油作为底物提高了ARA的产量,因此ARA在各温度下都能合成,可能是由于在整个脂肪酸合成过程中有特定的并具有较高活性的酶可使C18类PUFAs脱饱和生成ARA。
本研究结果表明,发酵温度对ω-3 PUFAs与ω-6 PUFAs的合成均具有较大影响,且在各个温度下ω-6 PUFAs的产量均高于ω-3 PUFAs。这可能是由于M.alpina自身ω-3脂肪酸脱饱和酶MAW3偏好C18链PUFAs,而对C20链底物的偏好性较差,且在高于20 ℃时活性太低,不能有效地将积累的ω-6 PUFAs转化为对应的ω-3 PUFAs[25-26]。本研究仅考虑了不同发酵温度对菌体中ω-3/ω-6 PUFAs合成的影响,关于其影响机制还有待进一步研究。
4 结 论
本研究中M.alpina在固定发酵转速和发酵培养基成分的条件下,通过改变发酵温度,比较分析发酵温度对菌体的生物量、ω-3和ω-6 PUFAs组分及其含量和产量的影响。研究结果表明,发酵温度对M.alpina菌体代谢合成ω-3、ω-6 PUFAs组分、含量和产量均具有显著影响,其中15 ℃最利于M.alpina菌体同时累积ω-3和ω-6 PUFAs。M.alpina代谢积累的ω-3 PUFAs主要是EPA,ω-6 PUFAs主要是ARA,且在M.alpina脂肪酸合成代谢过程中合成ω-6 PUFAs的能力显著高于合成ω-3 PUFAs的能力。本研究结果为M.alpina工业化生产ω-3/ω-6营养平衡膳食油脂奠定了研究基础。

