复合推进剂铝粉燃烧反应动力学计算研究
文 瞻,王 芳,敖 文,刘 露,刘佩进
(1. 西北工业大学燃烧、流动与热结构重点实验室,西安,710072; 2. 航天化学动力技术重点实验室,襄阳,441003)
0 引 言
铝含量丰富、成本低廉、密度较高、耗氧量低、氧化放热高[1],现代固体火箭发动机普遍采用铝(微米级铝粉)添加到固体复合推进剂配方中,来提高固体复合推进剂的能量密度。
然而,铝颗粒在燃烧过程中,会有团聚现象发生在推进剂燃面附近,会降低铝在推进剂中的燃烧效率[2];铝颗粒在燃烧过程中的团聚会形成多相流,多相流中大颗粒粒子造成的冲刷效应会导致燃烧室绝热层和喷管烧蚀的加剧,影响到固体发动机的正常安全工作[3]。研究降低铝的团聚,降低两相流损失的方法,提升固体推进剂能量转化效率,一直是固体复合推进剂研究人员研究的热点。
采用纳米铝粉可减小团聚和两相流损失,但是使用了纳米铝粉的推进剂机械性能较差,容易燃烧不稳定[4],用铝热剂来代替单纯的铝,能较好地抑制团聚,不仅可以提高发动机的比冲,还可以提高推进剂的燃烧效率。超级铝热剂可以降低化学反应时的熔点和熔化焓[5,6],可以降低化学反应时的反应活化能[7,8]。
尽管目前固体复合推进剂研究人员已经提出了“离子扩散机理”[9]、“熔融-扩散机理”[10]、“预点火-熔结机理”[11]等预反应的理论与模型,但这些理论模型都有各自的局限性,还无法解释超级铝热剂的复杂的预反应点火过程。Henz等[12]用经典分子动力学方法模拟了小芯径(10 nm)氧化物包裹的铝纳米颗粒的机械化学行为。Jacob等[13]对3种亚稳态分子间反应复合材料的燃烧产物进行了研究,发现纳米铝热剂中的能量释放途径遵循凝聚态。Brotman等[14]建立了一个独特的基于凝聚相反应和热方程耦合的模型来研究Al/CuO纳米铝热剂氧化还原反应的起始和早期阶段。Tang等[15]在不同温度(800~1800 K)和不同氧气浓度(0.5~5.5 mol/m3)条件下,研究了4~20 μm纳米铝团聚体的燃烧特性。
目前在物理模型、数值模拟及分子动力学模拟上虽然取得了一定的进展,但是燃烧模型中必须综合考虑燃烧反应基本过程的复杂性,关键体现在多气固、气液、气气多相化学反应,界面间组分扩散,相变反应以及传热、传质、化学反应之间的相互耦合及随温度的动态变化等,故燃烧机理应该被进行更多的探究。
1 铝燃烧反应动力学计算
1.1 Al/O2体系的CHEMKIN计算
采用CHEMKIN中的闭式均相反应器进行反应的模拟。反应所需要的热力学数据均从 JANNAF[16]和Burcat[17]热力学数据库中查找并输入。Al/O2反应中,假设空气中O2与N2的体积比为1:3.76,铝与氧气的总包反应可描述为 2Al+1.5O2→ Al2O3。所选择的环境参数为温度为2300 K,环境压力为1个标准大气压。
从图1中可以得到,在时间达到1×10-7s之后反应温度和各主要物质摩尔分数基本稳定,可以认为反应在此时已经完成,已经达到平衡状态[18]。此时,环境温度约为3800 K。
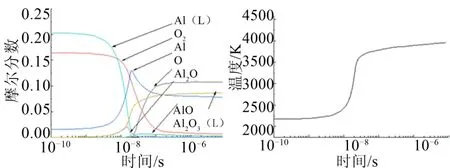
图1 主要物质摩尔分数与环境温度随时间变化 Fig.1 Curve of Molar Fraction of Main Substances and Ambient Temperature with Time
1.1.1 环境压力对Al/O2反应的影响
在压力保持为7 MPa(发动机标准压强)不变的情况下,计算了初始温度分别为1700 K,1900 K, 2100 K,2300 K和2500 K下的Al/CO2反应。
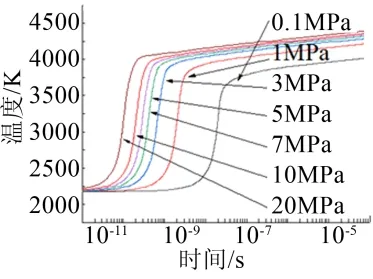
图2 不同环境压力下反应过程的温度变化 Fig.2 Temperature Curves of Reaction Processes Under Different Ambient Pressures
Al/O2反应所需要的延迟时间反而变得越来越短,这可能是由于压力的升高,导致了Al与O2的氧化反应速度的提高,从而使Al/O2反应所需要的延迟时间变短;Al/O2反应在结束时达到平衡的温度变得越来越高,平衡温度从3800 K逐渐增长到4400 K;而反应达到平衡时所需要的时间变得越来越短;也就表明,环境压力的升高有助于Al/O2反应的进行。
1.1.2 初始温度对Al/O2反应的影响
在压力保持为7 MPa(发动机标准压强)不变的情况下,计算了初始温度分别为1500 K,1700 K, 1900 K,2100 K和2300 K下的Al/O2反应。
图3是不同初始温度下的反应过程的温度变化曲线,在初始温度从1500 K增长到2300 K时,反应所需要的延迟时间变短了,这可能是由于温度的升高,提高了Al与O2的氧化反应速度,从而使Al/O2反应所需要的延迟时间变短;而反应结束时达到平衡时的温度几乎不变,这说明反应达到平衡时的温度与初始温度的关系不是很大。
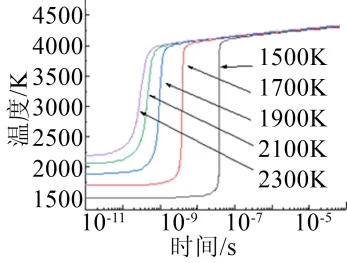
图3 不同初始温度下反应过程的温度变化 Fig.3 Temperature Curves of Reaction Processes at Different Initial Temperatures
1.2 Al/CO2体系的CHEMKIN计算
采用CHEMKIN中的闭式均相反应器进行反应的模拟。Al/CO2反应中,铝与二氧化碳的总包反应可以描述为 2Al + 3CO2→ Al2O3+ 3CO ,假设反应物的比例为Al:CO2:N2=0.12:0.18:0.7。所选择的环境参数为温度为2100 K,环境压力为1个标准大气压。
从图4中可以得到,在时间达到1×10-5s之后反应温度和各主要物质摩尔分数基本稳定,可以认为反应在此时已经完成,已经达到平衡状态[19]。此时,环境温度约为3100 K。AlO最先产生并达到峰值后开始下降,然后是Al2O2产生并达到峰值后开始下降,Al2O2的产生时间晚于AlO,而Al2O的产生时间更晚,并且也是会在生成达到峰值后开始下降,反应末期又会有少量O生成。
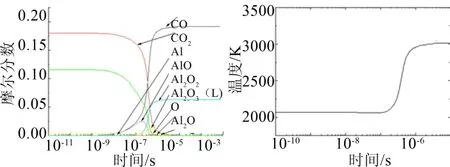
图4 主要物质摩尔分数、温度数随时间变化曲线 Fig.4 The Curve of Molar Fraction of Main Substance, Temperature T and Some Components with Time
1.2.1 环境压力对Al/CO2反应的影响
在初始温度为2300 K不变的情况下,对不同环境压力下的Al/CO2反应进行了对比计算。
从图5中可以看出,在反应开始时,环境温度有一个小幅下降,这是反应时Al(L)气化时吸热造成的,而且下降的温度幅度都相近;在环境压力从0.1 MPa逐渐升高到20 MPa的情况下,Al/CO2反应所需要的延迟时间变得越来越短,这可能是由于压力的升高,导致了Al与CO2的氧化反应速度的提高,从而使Al/CO2反应所需要的延迟时间变短;Al/CO2反应在结束时达到平衡的温度几乎没有增长,平衡温度几乎保持3100 K不再变化,这可能是由于Al/CO2反应对压强的不敏感造成的;反应达到平衡时的时间也变得越来越短;表明环境压力的升高有助于Al/CO2反应进行。
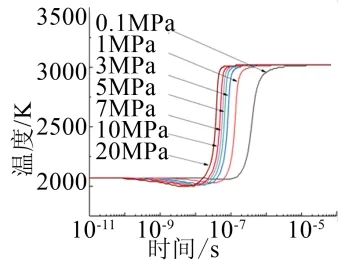
图5 不同环境压力下反应过程的温度变化 Fig.5 Temperature Curves of Reaction Processes Under Different Ambient Pressures
1.2.2 初始温度对Al/CO2反应的影响
在压力保持为7 MPa(发动机标准压强)不变的情况下,计算了初始温度分别为1700 K,1900 K,2100 K,2300 K和2500 K下的Al/CO2反应。
图6是不同初始温度下的反应过程的温度变化曲线,在温度从1700 K增长到2500 K时,反应所需要的延迟时间和达到平衡的时间都变短了,这可能是由于温度的升高,提高了Al与CO2的氧化反应速度,从而使Al/CO2反应的延迟时间变短;而反应结束时的温度有一个明显的提高,这说明反应达到平衡时的温度与初始温度的关系很大,这是由于Al与CO2的反应对温度的敏感性较高,不同的初始温度会产生不同的中间反应过程,从而影响到最终反应平衡时的温度[18]。

图6 不同初始温度下反应过程的温度变化 Fig.6 Temperature Curves of Reaction Processes at Different Initial Temperatures
1.3 Al/H2O体系的CHEMKIN计算
采用CHEMKIN中的闭式均相反应器进行反应的模拟。假设Al与H2O的摩尔比为0.4∶0.6,铝与水的总包反应可描述为 2Al+3H2O →Al2O3+3H2。所选择的环境参数为温度为2300 K,环境压力为1个标准大气压。
从图7中可以得到,在时间达到1×10-6s之后反应温度和各主要物质摩尔分数基本稳定,可以认为反应在此时已经完成,已经达到平衡状态。此时,环境温度约为3450 K。从图7中可以看出,Al(L)和H2O在1×10-8s开始下降,然后是Al产生并达到峰值后开始下降,OH的产生时间晚于Al,而生成物Al2O3(L)、H、H2逐渐产生时间并达到平衡。
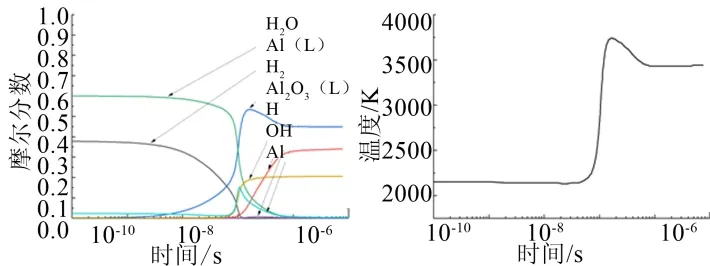
图7 主要物质摩尔分数与环境温度随时间变化 Fig.7 Curve of Molar fraction of Main Substances and Ambient Temperature with Time
1.3.1 环境压力对Al/H2O反应的影响
在初始温度为2300 K不变的情况下,对不同环境压力下的Al/H2O反应进行了对比计算。
从图8中可以得到,Al/H2O反应所需要的延迟时间反而变得越来越短,这可能是由于压力的升高,导致了Al与H2O的氧化反应速度的提高,从而使Al/H2O反应所需要的延迟时间变短;而从图中也可以看出,在环境压力从0.1 MPa逐渐升高到20 MPa时,Al/H2O反应在结束时达到平衡的温度变得越来越高,平衡温度从3450 K逐渐增长到4200 K;而反应达到平衡时所需要的时间也随着环境压力从0.1 MPa逐渐升高到 20 MPa而变得越来越短;而由于液态铝气化需要吸热,所以在反应过程中,温度曲线会先下降后上升,压力越大,降温越早则表明高压促进了液态铝的气化进程;这表明,环境压力的升高有助于Al/H2O反应的进行。
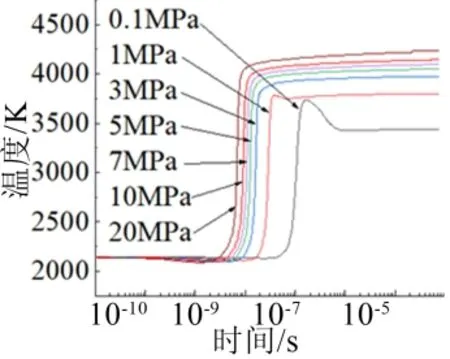
图8 不同环境压力下反应过程的温度变化 Fig.8 Temperature Curves of Reaction Processes under Different Ambient Pressures
1.3.2 初始温度对Al/H2O反应的影响
在压力保持为7 MPa(发动机标准压强)不变的情况下,计算了初始温度分别为1700 K,1900 K, 2100 K,2300 K和2500 K下的Al/H2O反应。
图9是不同初始温度下的反应过程的温度变化曲线,从中可以看出,反应所需要的延迟时间变短了,这可能是由于温度的升高,提高了Al与H2O的氧化反应速度,从而使Al/H2O反应所需要的延迟时间变短;而反应结束时达到平衡时的温度几乎不变,这说明反应达到平衡时的温度与初始温度的关系不是很大。
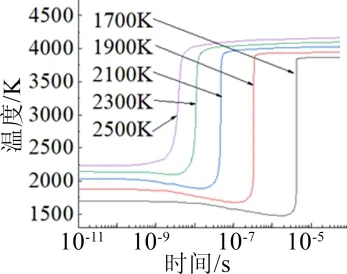
图9 不同初始温度下反应过程的温度变化 Fig.9 Temperature Curves of Reaction Processes at Different Initial Temperatures
1.4 Al/AP/HTPB/RDX推进剂
采用CHEMKIN中的闭式均相反应器进行反应的模拟。选择的推进剂配方为RDX 10%,Al 17.5%,AP 60.5%和HTPB 12%,假设铝的主要反应是在HTPB等组分反应之后,利用CEA计算得到实际推进剂反应中的 A∶l H2O∶ C O2∶ N2的比例大概为1∶1.2∶0.3∶3.5。计算时环境参数为温度为3300 K,环境压力为7 MPa。
从图10中可以得到,在时间达到1×10-7s之后反应温度和各主要物质摩尔分数基本稳定,可以认为反应在此时已经完成,已经达到平衡状态。此时,环境温度约为4000 K。环境温度会先有一个下降的趋势然后在上升,这和铝颗粒先汽化吸热然后反应放热的趋势相同,组分和温度的相关联变化情况也说明了这一点。反应的主要的几种中间产物(AlO、Al2O2和Al2O)的变化趋势与之前的计算基本一致。系统达到平衡后Al/H2O/CO2反应的主要产物为Al2O3(L)、H2、H和CO,这也与之前分步计算的结果相似。
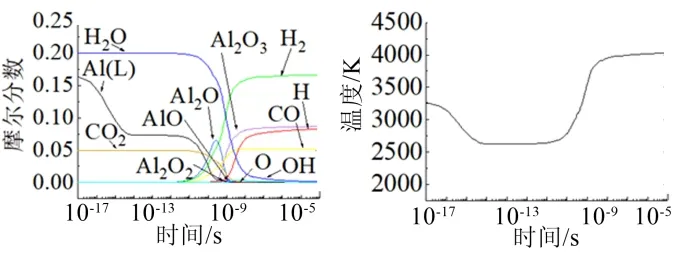
图10 主要物质摩尔分数与环境温度随时间变化 Fig.10 Curve of Molar Fraction of Main Substances and Ambient Temperature with Time
从以上的计算和分析中可以得到Al/H2O/CO2体系直接消耗Al的主要机制是:
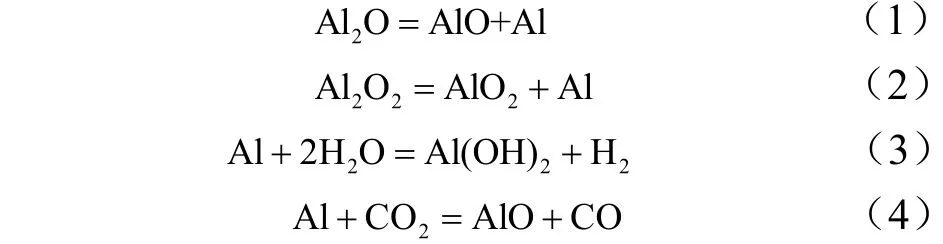
有助于形成Al2O2的反应是:
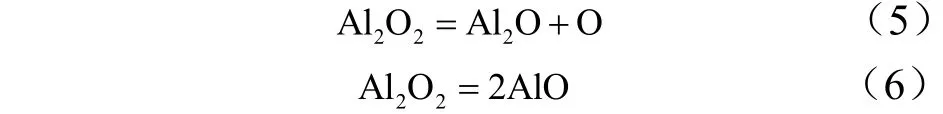
Al2O3的主要生成机理是:
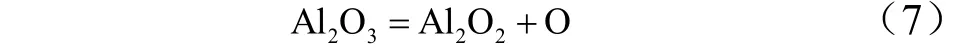
可以看出,O原子在当前的反应体系中起着重要的作用。O是形成Al2O3所必需的,在中间物种Al2O2的生成过程中也非常活跃。AlO2和AlO在反应中也非常活跃,AlO2、AlO和Al2O2这些中间产物的产率与整体反应速率直接相关。从之前的分析,反应(7)是形成Al2O3的关键的反应步骤,Al2O2是形成Al2O3(L)的关键中间产物。而O原子主要由反应(5)分解形成,而Al2O2既要参与 Al2O3的形成,又要分解产生O原子,导致 Al2O3(L)产量较少。因此,如果体系中存在较多的O原子或者加入含有O原子的助燃剂,有可能增大Al2O3(L)的产量,使反应放热量增加。
2 结 论
开展含铝推进剂燃烧机理研究,建立含铝推进剂燃烧模型具有重大现实意义。
a)研究并建立了Al/O2、Al/CO2和Al/H2O的零维均质气相反应模型。通过环境压力的变化对反应延迟时间的计算分析,发现环境压力的提高有助于反应的进行,不仅能提高反应进行的速率,且能提高反应达到平衡时的环境温度。通过针对初始环境温度对反应延迟时间的计算分析,发现环境初始温度的升高显著缩短了反应的延迟时间,但不利于总包反应是放热反应的生成物的生成。
b)研究并建立了Al/AP/HTPB/RDX推进剂的零维均质气相反应模型。基于Al/AP/HTPB/RDX推进剂的反应机理进行了计算,得到了Al/AP/HTPB/RDX推进剂燃烧时参与反应的主要物质摩尔分数与环境温度T随时间变化曲线,重点硏究了密闭环境下反应过程中参与反应的物质组分变化,初步得到了AP/HTPB和Al/AP/HTPB/RDX推进剂燃烧模型。

