不同运动干预下老年肌少症患者的CT影像特征变化
魏渼淇,杨 光*,魏茂泉,孟德宇,何诗纯,李 妍
(1 东北师范大学 体育学院,吉林 长春 130000;2 白山市中心医院 放射科,吉林 白山 134300)
肌少症是一种与机体老化密切相关的虚弱综合征(asthenia syndrome,AS)[1],核心症状是骨骼肌量流失和肌肉力量下降,由其引发的体能下降与活动障碍会造成老年人失能,增加老年人跌倒、残疾和死亡的风险[2]。适度增加身体活动、定期参与体育运动已被世界卫生组织认定是改善老年人肌少症、预防老年人虚弱综合征的唯一有效措施[3]。一方面,骨骼肌质量是判断肌少症的主要指标,但仅有少数运动可增加肌肉质量[4],抗阻力运动可改善骨骼肌蛋白质积累,是预防肌少症的最佳运动方式[5];另一方面,长期低强度有氧运动可以缓解胰岛素抵抗,进而缓解肌萎缩[6]。由此可见,有关不同运动方式如何影响肌少症发生、延缓肌少症发展仍存在争论。
最近研究发现,骨骼肌脂肪浸润(muscle fat infiltration, MFI)会导致单位骨骼肌质量下降,可能是引发肌肉萎缩、影响肌少症发生发展的关键因素[7]。计算机断层扫描(computer tomography,CT)可排除测试环境和患者水合状态的影响[8],对骨骼肌质量进行准确测量,是国际公认评估肌肉质量的金标准。在此基础上,定量CT(quantitative CT,QCT)可排除CT值不稳定造成的测量误差,更精确地评估骨骼肌形态和结构,并显示肌肉水肿和脂肪化的程度。
本研究选取60岁以上肌少症患者为研究对象,以不同类型运动作为干预手段,采用QCT在干预前后对研究对象L3 椎体水平骨骼肌面积(L3 skeletal muscle area,L3 SMA,cm2)、骨骼肌密度(L3 skeletal muscle density,L3 SMD,HU)、骨骼肌间隙脂肪面积(cm2)以及骨骼肌间隙脂肪密度(HU)进行测量,分析不同类型运动干预前后老年肌少症患者L3 椎体水平骨骼肌和肌间脂肪形态的CT影像学特征变化。根据测量结果推算MFI程度,讨论不同运动对老年肌少症患者骨骼肌质量和骨骼肌脂肪浸润程度的影响,为预防和治疗肌少症提供指导。
1 研究对象和方法
1.1 研究对象
2019年1—6月在白山市中心医院健康体检中心和白山市慈铭体检中心招募研究对象。排除标准:(1)呼吸衰竭或严重躯体疾病患者;(2)合并有神经-肌肉系统疾病者,如帕金森等;(3)伴有影响日常活动或者中低强度运动的肌肉骨骼疾病,或者正在服用对肌肉骨骼功能影响较大的药物;(4)精神障碍或神经系统疾病患者。纳入标准:(1)符合AWGS2016年制定的亚洲肌少症筛查标准[9];(2)年龄60~75岁;(3)具有自主活动能力;(4)知情同意、自愿参加、能配合随访的患者。最终纳入92例老年肌少症患者为研究对象,其中男性44例、女性48例;年龄(66.28±3.976)岁。根据随机数字表法随机分为有氧训练(aerobic training,AT)组31例、抗阻训练(resistance training,RT)组30例和空白对照组(control group,CG)31例。由于伤病原因AT组退出1例。本研究经医院伦理委员会审查通过,并与所有纳入者签署知情同意书。
1.2 研究方法
1.2.1 干预方法
CG组采用常规护理,由护士在入组后向患者介绍肌少症相关知识和防治方法,如注意增加膳食中蛋白的摄入,多参与体育活动等。AT组与RT组接受运动处方干预:(1)队伍组建。干预前成立由2名影像科医师、2名运动治疗师、2名体适能教练,6名护士和8名社区卫生服务中心工作人员组成的运动干预队伍。影像科医师要求为影像学主治医师,负责L3 椎体平面骨骼肌及脂肪定量测量。运动治疗师要求具有康复治疗师资格证,擅长运动疗法,负责患者运动处方的开具。体适能教练要求具有体适能教练高级认证,擅长中老年功能性训练,负责干预过程中患者运动的指导和监督。社区卫生服务中心人员要求是在社区卫生服务中心工作1年以上,主要负责患者入组后运动处方的实施与反馈,与护士共同协作完成研究进程监测和患者管理。所有成员需进行肌少症相关知识培训,确保运动干预队伍成员掌握中老年健康体适能常见处方和肌少症运动改善方法。(2)干预流程。本研究总计干预周期为20周,干预期间每4周组织一次社区健康宣讲,由体适能教练和社区医师对患者运动锻炼时遇到的问题进行答疑和指导,激发患者运动积极性。初次宣讲结束后,由社区医师对患者既往病史和现有疾病进行问询,由护士依据业余运动锻炼水平问卷(leisure-time physical activity level questionnaire,LPALQ)[10]对其运动水平进行测量,由运动治疗师结合患者健康状况及LPAL得分制定相应运动处方,并根据患者情况对运动处方进行适应性调整。LPALQ由学者廖八根等[10]根据“可变体育活动问卷”[11]并结合我国中老年群众运动特点修订而成,该问卷可对被试对象的业余体育活动水平进行评估,计算公式为:LPAL=月数×月平均运动次数×每次平均运动时间×MET÷60÷52,单位为METs-h/周。LPAL得分将受试者运动水平划分为3个等级,即不运动(LPAL<10.0 )、中低水平运动(10.0≤LPAL<40.0)和高水平运动(LPAL≥40.0)。运动处方主要内容见表1。(3)质量控制。由护士和社区卫生服务中心工作人员共同负责运动干预的规范性。由护士进行每周1次的电话随访,确定患者运动处方执行情况,建议患者在运动处方执行的过程中对运动情况进行自我监督,如佩戴运动手环,记录运动中的心率,以便运动治疗师在后续运动处方制定时对运动强度进行调整;由社区卫生服务中心工作人员对所在社区周边患者运动情况进行不定期抽检,确认其运动方式、时间和地点。本次试验仅有一名患者因踝关节扭伤无法进行运动退出实验,其余患者依从性较为良好。
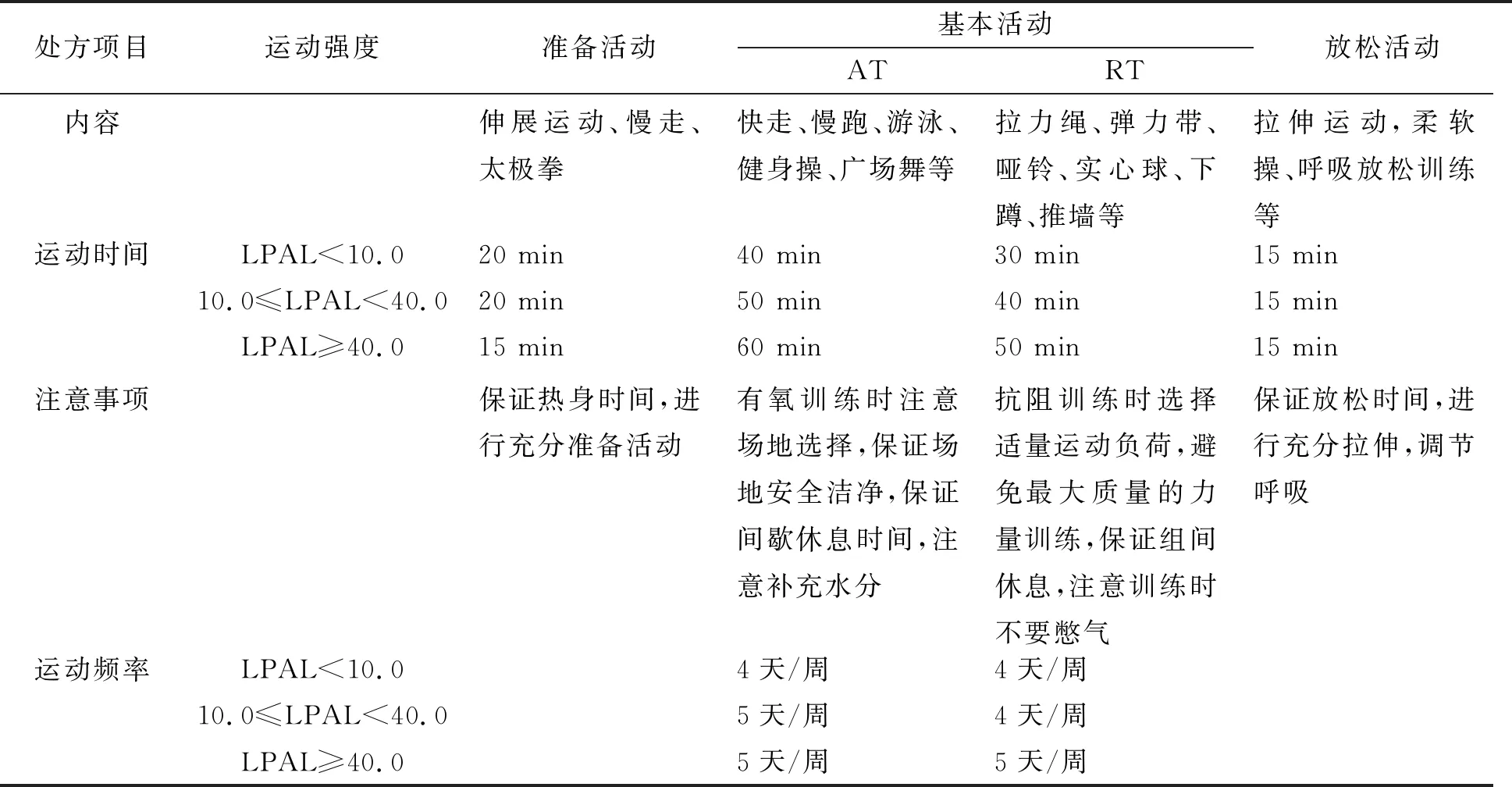
表1 运动处方内容
1.2.2 CT扫描条件与指标测量方法
采用美国GE公司256排Revolution CT扫描仪在干预前、后一周内对患者各进行一次上腹部扫描,患者仰卧位,两臂上举,GSI扫描参数,管电压80、140 kV瞬时切换,管电流智能调节,层厚5 mm,层间距5 mm,扫描结束后数据自动导入GE-ADW 4.7工作站。
本文选用患者L3 SMA、L3 SMD、骨骼肌间隙脂肪面积以及骨骼肌间隙脂肪密度作为观测指标。选取L3水平层面并使用工作站内X Section软件沿骨骼肌手动勾画兴趣区,骨骼肌定量测量选取范围为-29~150 HU[12],测量兴趣区内L3 SMA(cm2)、L3 SMD(HU);脂肪定量测量阈值选取-200~0 HU[13],测量兴趣区内骨骼肌间隙脂肪面积(cm2)以及骨骼肌间隙脂肪密度(HU)。计算L3水平骨骼肌MFI程度的公式为:骨骼肌间隙脂肪组织面积(cm2)/[骨骼肌面积(cm2)+骨骼肌间隙脂肪组织面积(cm2)]×100%[14]。
1.3 统计方法
使用SPSS 25.0软件对实验数据进行统计学分析,采用S-W检验数据分布情况。本研究数据符合正态分布,实验前各组间变量使用单因素方差分析、事后检验和卡方检验分析组间差异。使用双向重复测量方差分析检验各变量的组间与时间交互作用,并对有交互作用的变量进行简单效应分析。连续变量以平均值±标准差表示,分类变量以数量值表示。P小于0.05表示具有统计学意义。
2 结果
2.1 一般资料比较
干预前,3组研究对象的性别构成比、年龄及BMI差异均无统计学意义(P>0.05,见表2)。

表2 3组研究对象一般资料比较
2.2 干预前后CT定量测量结果比较
不同组别典型病例干预前后的CT影像见图1。根据CT影像进行定量测量,结果见表3。
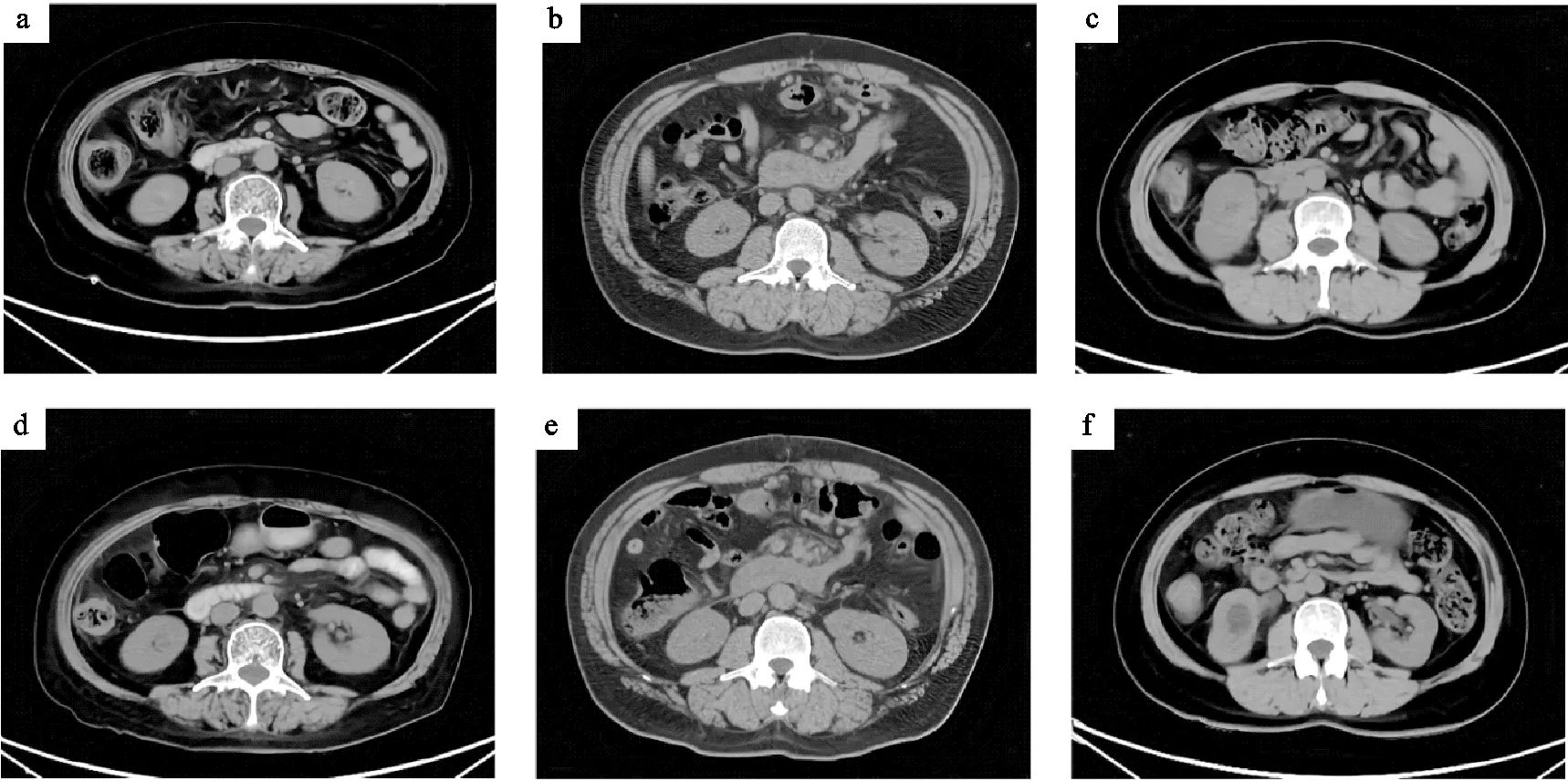
a为干预前AT组典型病例L3椎体水平轴位CT片;b为干预后AT组典型病例L3椎体水平轴位CT片;c为干预前RT组典型病例L3椎体水平轴位CT片;d为干预后RT组典型病例L3椎体水平轴位CT片;e为干预前CG组典型病例L3椎体水平轴位CT片;f为干预后CG组典型病例L3椎体水平轴位CT片。
2.2.1 干预前后三组L3 SMA比较
由表3可知,干预前3组间的L3 SMA无显著性差异(P>0.05);干预后AT组、RT组和CG组患者的L3 SMA均有不同程度提升,其中仅RT组干预前后差异具有统计学意义(P<0.05),且组别与时间交互效应显著(P<0.05);干预后,RT组的L3 SMA最高,AT组次之,CG组最低,且RT组较CG组干预后L3 SMA差异具有显著性(P<0.05)。

表3 干预前后3组的CT定量测量结果比较
2.2.2 干预前后3组L3 SMD比较
由表3可知,干预前3组间的L3 SMD无显著性差异(P>0.05);干预后AT组和RT组患者的L3 SMD有明显提升(P<0.05),RT组干预效果显著(P<0.01),仅CG组L3 SMD下降,且组别与时间交互效应显著(P<0.05)。干预后,RT组的L3 SMD最高,AT组次之,CG组最低,其中RT组与AT组较CG组干预后L3 SMD差异均具有显著性(P<0.05)。
2.2.3 干预前后3组L3椎体水平骨骼肌间隙脂肪面积比较
由表3可知,干预前3组间的L3椎体水平骨骼肌间隙脂肪面积无显著性差异(P>0.05);干预后3组患者的L3椎体水平骨骼肌间隙脂肪面积有不同程度升高,但干预前后差异均不具有统计学意义(P>0.05)。
2.2.4 干预前后3组L3椎体水平骨骼肌间隙脂肪密度比较
干预前3组间的L3椎体水平骨骼肌间隙脂肪密度无显著性差异(P>0.05);干预后AT组与RT组患者的L3椎体水平骨骼肌间隙脂肪密度降低,但差异不具有统计学意义(P>0.05),仅CG组患者的L3椎体水平骨骼肌间隙脂肪密度较干预前上升;干预后,RT组的L3椎体水平骨骼肌间隙脂肪密度最低,AT组稍高,CG组最高,组间差异均不具有统计学意义(P>0.05)。
2.2.5 干预前后3组L3椎体水平MFI程度比较
根据CT定量测量结果对L3水平骨骼肌MFI程度进行计算,结果见表4。干预前3组间的L3椎体水平MFI程度无显著性差异(P>0.05);干预后AT组与RT组患者的L3椎体水平MFI程度明显降低(P<0.05), 其中RT组干预前后差异具有显著性(P<0.05),仅CG组患者的L3椎体水平MFI程度较干预前升高,且组别与时间交互效应显著(P<0.05)。干预后,RT组的L3椎体水平MFI程度最低,AT组次之,CG组最高,RT组较CG组差异具有统计学意义(P<0.05)。

表4 干预前后3组L3椎体水平MFI程度
3 讨论
欧洲老年人肌少症工作组(the european working group on sarcopenia in older people,EWGSOP)认为:肌少症是伴随年龄增长出现的一种进行性骨骼肌质量和肌力下降的衰老综合征[15]。营养不足与吸收障碍会阻碍骨骼肌代谢,是影响肌少症发展的重要原因[16]。本研究中,3组研究对象的性别比、年龄及BMI差异均无统计学意义(P>0.05),可排除干预前组间差异对结果造成的影响。结果发现研究对象的BMI普遍低于世界卫生组织所定义的正常体质量标准(18.5~25 kg/m2),更接近低体质量、消瘦(<18.5 kg/m2)[17],表明低BMI是肌少症的危险因素[18],其生理学机制可能在于:吸收不良和消化障碍是影响肌少症发生发展的重要因素,该因素的直接作用结果是患者营养不足,故而BMI偏低。
骨骼肌质量和力量的渐进式下降是肌少症的主要临床表现。有研究显示,骨骼肌面积与骨骼肌质量紧密相关[19]。临床医师常以L3椎体水平骨骼肌整体肌量或椎后肌群肌量判断患者肌肉是否存在退变和衰减[19]。既往研究证实[20-21]体育运动可增加肌肉质量、改善体成分,不同类型运动作用效果存在差异。Menshikova等[22]发现,有氧运动能增强肌肉抗氧化能力;董欣等[23]认为,抗阻运动较有氧运动更能促进肌肉生长。本研究结果表明,经过20周的AT、RT及健康知识宣讲干预后,3组老年肌少症患者的L3 SMA均有一定程度的增加,RT组患者L3 SMA的提升效果最为显著(P<0.05),且明显优于CG组(P<0.05)。该结果证实体育运动可增加肌肉横断面积,进而提升骨骼肌质量,在此方面RT较AT更有效,这与既往研究[24-25]结果一致。由此可以推断,相较于其他类型运动,抗阻训练对肌少症患者肌肉横断面积和质量的积极影响更为显著。
SMA反映骨骼肌量的变化,SMD则反映骨骼肌质的发展[26]。骨骼肌密度反映单位体积肌肉质量,骨骼肌密度值区间为0~100 HU,CT值处于31~100 HU为正常骨骼肌组织,处于0~30 HU则为低密度骨骼肌。骨骼肌密度与肌肉内肌细胞数量呈正相关,与肌间脂肪含量呈负相关[27]。本研究发现,运动干预后,AT组与RT组患者L3 SMD均有所提升,其中RT组患者提升效果显著(P<0.01);CG组患者L3 SMD下降,且明显低于RT组患者(P<0.05)。该结果表明,骨骼肌密度会随年龄增长而下降,运动可以逆转该变化,且RT较AT更有效。其生理机制是运动可以破坏肌肉的微细结构,相较于有氧运动,抗阻力运动后的恢复过程中会产生更多新的肌纤维[28],肌纤维数量增多可导致骨骼肌横截面积增大、密度上升。另外,本研究发现CG组L3 SMD出现与另外2组相反的变化,该结果与Miljkovic等[29]的发现一致,伴随年龄增长骨骼肌会产生脂肪浸润,肌间脂肪组织增多引发骨骼肌密度下降。
随年龄增长多余的脂肪细胞会在骨骼肌内或周围异位积累,由此构成了肌间脂肪组织[30],肌间脂肪组织的异位堆积将影响骨骼肌代谢,有研究证实肌肉退变与肌间脂肪组织增多有关[31],并且肌间脂肪组织积累是肌肉萎缩的重要表现[32]。长时间的持续有氧运动能使脂肪充分代谢,不同类型运动同样可改变骨骼肌内脂肪代谢过程[33-34],但此类研究多以皮下脂肪等脂肪组织为观测指标。本研究对L3椎体水平骨骼肌间隙脂肪面积(cm2)、骨骼肌间隙脂肪密度(HU)进行测量,并结合L3 SMA推算L3椎体水平MFI程度,发现进行运动干预后,3组患者的L3椎体水平骨骼肌间隙脂肪面积均呈现上升趋势,但上升效果并不明显(P>0.05),干预后3组L3椎体水平骨骼肌间隙脂肪面积无显著差异(P>0.05),AT组L3椎体水平骨骼肌间隙脂肪面积最小,RT组稍高,CG组最高。这表明伴随年龄增长老年人肌间脂肪含量会逐渐升高,该结果与Wroblewski等[35]结果一致。另外,本研究显示AT与RT均有助于预防老年人与年龄相关的肌间脂肪积累,但无法实现肌间脂肪积累的逆转,该结果不同于Bang等[36]有关AT可明显减少肌间脂肪组织积累的结论。上述矛盾结果产生可能与研究对象运动的强度与频次不同有关。肌间脂肪密度与筋膜下和骨骼肌间隙脂肪组织的质量相关,单位体积脂肪组织的质量越差则密度越低[37]。骨骼肌间隙脂肪组织的累积与肌纤维类型有关,Ⅰ型纤维较Ⅱ型纤维的脂肪含量更高[38]。本研究结果表明,干预后AT组与RT组患者的L3椎体水平骨骼肌间隙脂肪密度有一定程度降低,CG组则略有上调,但各组干预前后骨骼肌间隙脂肪密度的变化并不显著(P>0.05),干预后,L3椎体水平骨骼肌间隙脂肪密度在3组间差异仍不具有统计学意义(P>0.05)。这说明伴随年龄增长肌间脂肪积累将逐渐增多,运动可以减少肌间脂肪的增加,AT与RT均有助于预防老年人与年龄相关的肌间脂肪积累,但依据现有研究和结果,尚无法就AT与RT下调肌间脂肪密度进行合理解释。
肌间脂肪组织增多引发的MFI程度加深是导致骨骼肌肌力下降的主要因素[39]。Poltronieri等[40]发现,肌少症患者MFI程度加深的发生早于骨骼肌质量下降。而相较于骨骼肌质量,MFI才是预测和评估老年人骨骼肌退变的关键指标[41-42]。本研究结果显示干预前后AT组与RT组患者的MFI程度均明显下降(P<0.05),其中RT组MFI程度下降十分显著(P<0.01),而CG组患者MFI程度则较干预前小幅上升(P>0.05)。尽管干预后AT组L3椎体水平骨骼肌间隙脂肪面积增幅最小,但结合L3 SMD的变化,RT组的L3椎体水平MFI最低,干预前后变化幅度最大,其生理机制在于:MFI程度越高,胰岛素敏感度越低,胰岛素敏感度下降将抑制骨骼肌蛋白质合成,继而造成肌肉萎缩,肌力降低[43]。Fiatarone等[44]认为,RT是提高老年人肌力的最佳运动方式,但其具体机制仍存在争议。本文认为,RT相较AT在降低MFI程度方面效果突出,甚至可以逆转随老化发生的MFI程度加深,MFI程度的显著下调使得RT显著改善骨骼肌的质量与功能。
4 结论
老年人罹患肌少症后病情将持续发展,若不及时加以干预,老年人会出现骨骼肌密度下降、骨骼肌间隙脂肪面积增加和脂肪浸润程度升高。
运动可有效延缓肌少症发展,RT的效果优于AT。RT可有效改善甚至逆转老年人与年龄有关的骨骼肌肌量进行性下降,AT与RT均有助于预防老年人与年龄相关的肌间脂肪积累,但无法实现肌间脂肪积累的逆转。在预防肌少症发生发展中,RT较其他运动干预更具优势,其机制可能与骨骼肌内肌纤维与脂肪之间的复杂关系有关。
老年人肌少症需要得到积极的预防和干预,运动干预是防治肌少症的有效方案。鼓励和指导老年群体进行抗阻运动,可预防肌少症的发生发展。

