超声征象在甲状腺良恶性结节鉴别诊断中的应用价值
龚进坤 钟创锋 李佳
甲状腺癌作为头颈部常见恶性肿瘤疾病,其发病率逐年升高,其中分化型甲状腺癌占所有类型的90%,而分化型甲状腺癌主要包括乳头状癌和滤泡癌[1]。近年来,甲状腺癌发病率呈现迅速上涨的趋势,尤其是癌灶直径小于1 cm的微小灶乳头状癌,其升高与甲状腺乳头状癌的发生率增高有关,严重威胁患者的身体健康和生命安全。针对甲状腺癌患者,尽早诊断并采取有效措施进行干预有助于提高患者生存质量[2]。目前,超声技术得到了迅速发展,高频超声在临床诊断有着广泛的应用,对于提高甲状腺癌疾病的临床诊断率具有重要作用。本研究旨在探讨甲状腺癌的超声表现,分析甲状腺超声征象与甲状腺癌之间的相关性,以提高临床诊断率和准确率,为甲状腺癌患者的早期诊断提供理论指导。
1 资料与方法
1.1 一般资料
选择2019年6月—2021年11月在广东省第二中医院超声科行甲状腺细胞穿刺活检的70例可疑恶性甲状腺结节患者为研究对象,以病理为恶性结节作为研究组,以病理为良性结节作为对照组。本研究已经通过医学伦理委员会批准,活检术前患者均签署了知情同意书。其中男性患者17例,女性患者53例,年龄在25~73岁,平均年龄为(49.3±14.3)岁,病程为2~8个月,平均病程为(5.7±1.9)月。纳入标准:(1)结节直径≤10 mm。(2)结节经过2名经验丰富主治以上级别医师超声诊断均提示为可疑甲状腺癌。(3)结节均行细针穿刺活检(fine needle aspiration, FNA)并有明确病理诊断结果。排除标准:(1)超声留存图像显示不清,不能辨别超声征象。(2)基于2017美国放射学会甲状腺影像报告及数据系统(American College of Radiology -thyroid Imaging Reporting and Data System,ACR TIRAS),2名主治级别以上医师一致诊断为良性病变。(3)患者曾行手术治疗或FNA而影响甲状腺结节的形态结构观察。
1.2 方法
采用彩色超声诊断仪(型号:Cannon Aplio-400,日本佳能)进行检查,采用高频探头(频率8~12 MHz)。根据预设条件调节超声诊断参数,保证最佳成像质量。检查方式:患者仰卧位,用棉枕垫高患者肩部以充分暴露颈前区,由2名丰富经验的超声科主治以上级别医师共同进行会诊检查。
1.3 观察指标
超声诊断过程中需要通过切换纵切、横切和多层断面等方式进行诊断,观察病灶成分(实性、囊性等)、回声(无回声、高回声或等回声、低回声、极低回声)、形态(纵横比≤1、纵横比>1)、边缘(光滑、不规则或分叶或腺外侵犯)、强回声灶(粗大钙化、边缘钙化及微小钙化)等,详细记录并存档。
1.4 统计学方法
采用SPSS 26.0统计软件分析数据,对超声征象等计数资料以n(%)表示,行非参数检验(曼-惠特尼U概率法、威尔科克森W检验)Fisher确切概率法及Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
70例入选病例中,29例为良性滤泡性结节,41例诊断为甲状腺乳头状癌,形态异常者良恶性组中分别为4例、19例,边缘异常者良恶性组中分别为4例、12例,粗大钙化良恶性组中分别为4例、1例,边缘钙化良恶性组中分别为8例、0例,微小钙化良恶性组中分别为0例、24例。超声征象(形态、边缘、钙化)在良恶性病理组间行非检参数验(Z=-2.836,P=0.005;Z=-1.508,P=0.132;Z=-3.311,P=0.001),超声征象(形态、边缘、钙化)与良恶性病理组间相关性(r=0.341,P=0.004;r=0.182,P=0.133;r=0.395,P=0.001),钙化表现(未见 /粗大钙化/边缘钙化/微小钙化)在良恶性病理组间差异有统计学意义(P=0.000),详见表1-4。

表1 超声征象(形态)在病理组间差异性统计及相关性分析[例(%)]
3 讨论
目前对于甲状腺结节性疾病的初步诊断,临床主要依靠高频超声检查,对于临床可疑恶性结节确诊,可采取FNA进行细胞学病理诊断,基本无创。因甲状腺良恶性结节的二维图像存在一定的重叠性[3],且癌变发展缓慢、早期病灶较小,故检查中存在较高的漏诊、误诊率[4],所以熟悉甲状腺恶性结节的超声特征,帮助临床找出可疑恶性结节进行确诊,关系到治疗选择和疾病预后。有学者根据FNA病理诊断比较具有良性细胞学的结节与具有恶性细胞学的结节的超声特征时,结节的不规则形状和边界不清,微钙化和低回声显著增加了恶性细胞学结果的可能性,同时,性别和年龄与细胞学分类结果没有关联[5]。本研究主要基于2017 ACR TI-RADS进行结节筛选,由于等回声、高回声结节绝大多数为良性结节,恶性概率较低,本研究选取的均为低回声实性成份为主的结节,通过对结节形态、边缘及钙化表现进行分析。
甲状腺结节微小钙化属于甲状腺癌患者的一种特异性表现,微小钙化是指直径<1 mm高回声,无声影,多呈散在分布,少数呈簇状,其大小不一致、分布不均匀性,识别并不困难,有时需与浓缩的胶质结晶相鉴别,后者彗星尾>1 mm出现在结节的囊性成分中[6]。甲状腺恶性结节的钙化检出率远高于良性结节,李素军等[7]研究173例甲状腺结节,甲状腺癌患者总钙化率83%,远高于甲状腺良性结节患者21%,本资料中可疑恶性结节中钙化发生在良恶性中的比例分别为41%、61%,表明结节钙化在甲状腺恶性结节中的发生率较高。另外本研究中粗大钙化/边缘钙化/微小钙化在良恶性结节中的比率分别为14%、27%、0和2%、0、59%,差异存在统计学意义(P=0.001),说明不同钙化形状分布在良恶性结节中存在明显差异,表明钙化形状与结节良恶性之间关系密切。赵月娥等[8]观察80例甲状腺恶性结节中37例即46%伴微钙化、杨叶林等[9]观察71例恶性结节中54例微钙化发生率76%,均提示恶性结节中微钙化发生率较高,这与本研究中恶性结节中微钙化率59%基本一致,表明微小钙化与甲状腺癌密切相关,本研究中粗大钙化在良性结节中的发生率14%,远超在恶性结节中的发生率2%,这与学者研究结论甲状腺良性结节以粗大钙化为主且钙化率较高、恶性结节以微小钙化为主且钙化率较低基本一致。另有国内学者按粗钙化发生部位发现发生在中央区较边缘及混合区恶性发生率高且差异有统计学意义[10],表明粗大钙化的位置分布与结节的良恶性可能存在相关,但该类研究目前较少临床意义尚不明确。对于边缘钙化对结节良恶性的鉴别作用,本研究统计结果表明其与粗大钙化在良恶性结节中分布差异无统计学意义(P>0.05),与微小钙化差异有统计学意义(P<0.05),这与国内外学者意见基本一致,如Malhi等[11]在97个边缘钙化的结节中活检发现27%的恶性结节,边缘钙化的连续性、内部成分的可见性和钙化边缘外软组织的突出显示与良性或恶性结节无明显关联,表明特定的边缘钙化特征无助于区分良性和恶性结节,国内亦有学者研究表明良性结节的环状钙化率与恶性结节比较显示差异无统计学意义[12],但另有学者指出环状连续型长弧形钙化与环状不连续短弧形钙化分别多见于良、恶性结节中[13],表明边缘钙化分型可能对结节良恶性鉴别及分类有一定的帮助。

表2 超声征象(边缘)在病理组间差异性统计及相关性分析[例(%)]
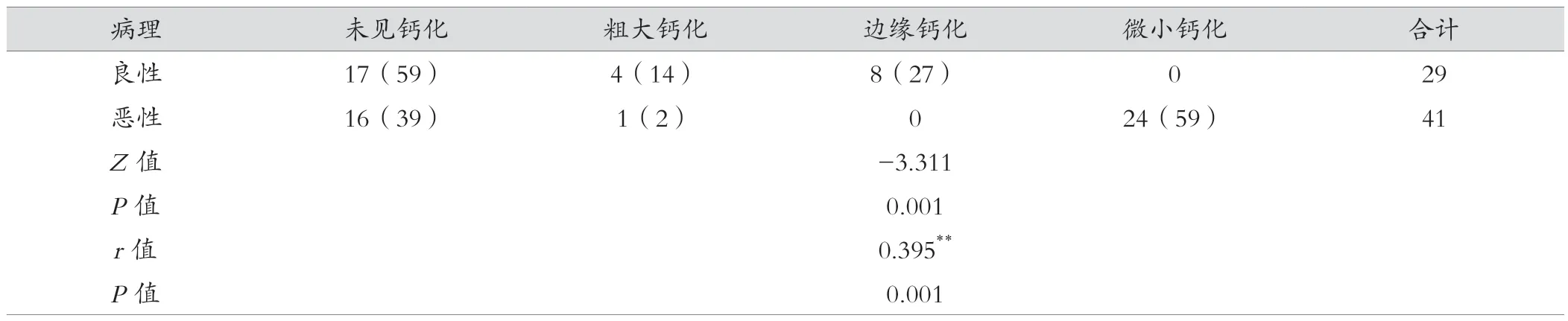
表3 钙化表现(未见/粗大钙化/边缘钙化/微小钙化)在病理组间差异性统计及相关性分析[例(%)]
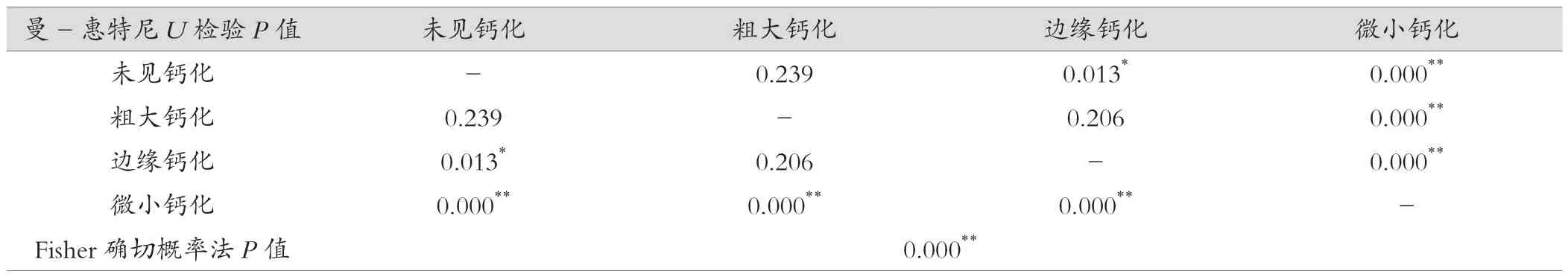
表4 钙化表现(未见/粗大钙化/边缘钙化/微小钙化)在病理组间差异性比较
边缘是通过观察结节和临近的甲状腺组织或腺体外组织界限表现,边缘不规则指结节的边缘有毛刺、参差不齐,或者呈锐角伴或不伴有明显的软组织侵入结节实质[14],临床认为边缘不规则主要见于恶性结节。本研究中,边缘不规则在良恶性结节的比例为14%、29%,与病理诊断的相关性较低,差异无统计学意义(P>0.05),与国内外学者研究表明边缘不规则与恶性结节有较显著的相关性或较高的特异性不一致[15-16],这可能与本研究对象中的甲状腺结节较小有关,因本研究对象为直径<10 mm的小结节,且其中较多直径位于4~7mm区间,除了4例超声图像显示存在明显包膜侵犯征象外,有相当一部分结节在判断边缘是否规则上并不能完全明确,因此会对统计分析造成一定的影响。
纵横比>1是鉴别甲状腺恶性结节的特异度较高的超声特征,这与各国指南中该项所占权重较高基本一致,如2020甲状腺结节超声恶性危险分层中国指南(Chinese Thyroid Imaging Reporting and Date System,C-TIRADS)中将垂直位实性结节(纵横比>1)纳入4C、5类,2017 ACR TI-RADS中给予评分3分,直接归属于低回声实性结节中的5类。有学者认为在甲状腺恶性肿瘤的重要指标中,带有微钙化的宽高结节最有可能是恶性的[17]。本研究中良恶性结节在纵横比>1上的比例分别为14%、46%,差异有统计学意义(P<0.01)。值得注意的是有报道称纵横比>1 更多发生于直径≤10 mm的结节,随着甲状腺结节体积的增大,纵横比对甲状腺良恶性结节的鉴别诊断敏感度逐渐下降[18-19]。
综上,本研究体现了ACR TI-RADS指南对甲状腺结节良恶性鉴别的重要临床参考作用,其中纵横比>1、微小钙化是区分低回声实性小结节是否甲状腺乳头状癌的重要特征;对于直径<10 mm的可疑小结节,边缘是否规则或分叶超声图像不易判断,不建议据此征象来进行结节的良恶性鉴别。本研究的不足之处在于样本量偏少,对于甲状腺结节中发生率较低的边缘钙化及粗大钙化,在良恶性结节中鉴别诊断作用未有充分的说服力。

