基于TMT蛋白组学技术探讨氯化汞致小鼠肝脏损伤的机制*
曹 鑫, 张雅楠, 毛侃敏, 杨 淼, 郝丽萍
华中科技大学同济医学院公共卫生学院营养与食品卫生学系,食品营养与安全湖北省重点实验室,武汉 430030
汞是一种典型的重金属食品污染物,2017年《食品安全国家标准-食品中污染物限量》(GB2762-2017)规定了汞的限量指标[1]。据美国毒物管理委员会(Agency for Toxic Substance and Disease Registry Agency,ATSDR)报道,汞是仅次于砷和铅的第3大危险重金属[2]。汞有3种不同的化学形式,分别是元素汞、有机汞(主要是甲基汞)、无机汞(主要是氯化汞)[3],汞可通过呼吸道、消化道和皮肤接触的方式被机体摄入导致毒性反应[4]。
造成环境污染的汞的来源主要分为自然排放与人为排放2种,自然排放包括火山活动、土壤释放、自然风化等;人为排放是造成汞污染的主要原因,包括对于汞的使用、物质中含有汞杂质、废物处理3大类。煤燃烧、废物焚化、金属冶炼、氯碱生产等是目前主要的人为排放类别[5]。无机汞是毒性最强的汞的化合物形式之一,在一些国家,暴露于过多无机汞制剂是人体汞中毒的重要原因。无机汞长期以来被用于药物、杀菌肥皂和护肤霜。有些护肤霜含有高达6%~10%的氯化汞或氯化亚汞,此外无机汞也被用于牙粉、蠕虫药和止疼药中[6]。研究显示,氯化汞由胃肠道吸收进入人体可造成肾毒性、神经毒性、生殖毒性和血液毒性等[7-10]。
肝脏是主要的代谢与解毒器官。研究显示,肝脏是汞蓄积的主要场所,汞在肝脏中过量蓄积会改变肝脏的结构和功能[11]。二价汞离子可以结合一系列蛋白分子,如酶、谷胱甘肽、微管蛋白、离子通道和转运蛋白等,这种结合抑制了这些蛋白分子的正常生理功能,诱导机体细胞发生炎症、氧化应激和凋亡等损伤反应[12-15],但具体的毒性机制需要进一步的研究探索。随着组学技术的发展,定量蛋白质组学技术在毒理学研究中发挥了重要作用,而关于汞造成肝毒性的蛋白质组学研究报道较少。对此,本研究基于串联质谱标签(tandem mass tag,TMT)定量蛋白组学技术对氯化汞染毒小鼠的肝脏组织进行分析,筛选差异表达的蛋白质,并通过生物信息学方法分析差异表达蛋白的功能和涉及的分子通路,为氯化汞肝毒性机制研究提供线索。
1 材料与方法
1.1 主要试剂与仪器
氯化汞、氨水、碘乙酰胺(iodoacetamide,IAM)、三乙基碳酸氢铵缓冲液(triethyl ammonium bicarbonate buffer,TEAB)购自Sigma公司;丙酮、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)购自上海国药集团化学试剂有限公司;Trypsin蛋白酶购自PROMEGA公司;蛋白酶抑制剂、蛋白定量BCA试剂盒、10%蛋白电泳预制胶、三(2-羧乙基)膦[tris(2-carboxyethyl)phosphine,TCEP]溶液、乙腈、甲醇、甲酸、TMT 16Plex购自ThermoFisher Scientific公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)检测试剂盒购自南京建成公司。Spectra Max plus384酶标仪购自Molecular Devices公司;EPS-300数显式稳压稳流电泳仪购自上海天能科技有限公司;Vanquish F高效液相色谱仪、Orbitrap Exploris 480串联质谱仪购自ThermoFisher Scientific公司;Tanon-3500R全自动数码凝胶图像分析系统购自上海天能科技有限公司。
1.2 实验动物
6周龄雄性C57BL/6小鼠,购自湖北省实验动物研究中心,动物生产许可证号为SCXK(鄂)2020-0018;小鼠于SPF环境中饲养,室温(22±2)℃,相对湿度50%左右,12 h∶12 h昼夜交替。本动物实验方案经过华中科技大学同济医学院实验动物伦理委员会审批通过([2020]IACUC号:S2455)。
1.3 肝毒性小鼠模型建立
小鼠适应性喂养1周后,按照体质量随机分为对照组、低剂量组(1 mg/kg)、中低剂量组(4 mg/kg)、中高剂量组(8 mg/kg)和高剂量组(16 mg/kg),每组各9只,氯化汞的染毒剂量基于参考文献[16-17]和预实验结果。各剂量组给予相应剂量氯化汞溶液灌胃,对照组以等体积纯水灌胃,灌胃体积为0.1 mL/10 g体重,连续灌胃28 d,每日1次。小鼠自由进食、饮水,每隔3 d监测体质量变化。染毒28 d后,小鼠称重并处死,采集血液与肝脏组织,用于后续检测。
1.4 血清及肝脏组织生化指标检测
分离血清,采用赖氏法检测小鼠血清ALT、AST活性;取适量肝脏用0.9%的生理盐水按照1∶9的质量体积比制作肝脏匀浆液,2500 r/min离心10 min,取上清液,用比色法、钼酸铵法分别检测肝脏GSH-Px活性、CAT活性,检测步骤均按照相应试剂盒说明书操作。
1.5 肝脏组织病理学检查
以4%多聚甲醛溶液固定小鼠肝脏,经石蜡包埋、切片、染色,在显微镜下观察肝脏组织的病理学、形态学变化。
1.6 肝脏蛋白提取及定量
肝脏解冻后于振荡研磨管中加入适量蛋白裂解液(含蛋白酶抑制剂),研磨仪充分研磨。4℃,16000×g离心30 min,取上清进行BCA定量测定和SDS-PAGE电泳检测。
1.7 蛋白酶解及TMT标记
分别取对照组及高剂量组小鼠肝脏样本100 μg,加入TEAB溶液,使TEAB终浓度为100 mmol/L;加入TCEP溶液,使TECP终浓度为100 mmol/L,37℃孵育60 min;加入IAM溶液,使IAM终浓度为40 mmol/L,室温避光40 min;加入丙酮(丙酮∶样本=6∶1),-20℃沉淀4 h;10000×g离心20 min,留取沉淀;用100 μL 100 mmol/L TEAB溶液充分溶解;按照酶∶蛋白=1∶50加入胰蛋白酶,37℃酶解过夜。取200 μL微离心管,加入5 mg乙腈、100 μg样本与20 μL TMT 16Plex,室温孵育2 h;加入5 μL 5%羟胺,室温放置30 min;真空浓缩仪抽干。
1.8 蛋白鉴定和生物信息学分析
使用EASY-nLC 1200色谱仪进行分离,流动相A:2%乙腈和0.1甲酸溶液,流动相B:80%乙腈和0.1%甲酸溶液。分离之后的样本用Orbitrap Exploris 480串联质谱仪检测,利用UniProt(Universal protein)数据库与Proteome Discoverer 2.4软件进行蛋白质鉴定。对鉴定的差异蛋白(differentially expressed proteins,DEPs)进行GO富集分析、KEGG通路富集分析。
1.9 统计学分析
2 结果
2.1 氯化汞对小鼠生理指标影响
2.1.1 氯化汞对小鼠体质量影响 氯化汞染毒28 d,建立肝毒性小鼠模型,各组小鼠初始体质量(第1天)无显著性差异。随着氯化汞染毒时间延长,中高剂量组和高剂量组分别于第13天和第7天较对照组体质量明显降低(均P<0.05)。结果见表1。

2.1.2 氯化汞对小鼠肝功能和肝脏氧化应激水平的影响 氯化汞中高剂量组和高剂量组小鼠的血清ALT活性较对照组分别升高了24%和45%,而各组血清AST水平并未出现显著性差异(图1A、1B)。与对照组相比,氯化汞中高剂量组和高剂量组小鼠肝脏的GSH-Px活性分别降低14%和19%,CAT活性分别降低25%和27%(图1C、1D,均P<0.05)。
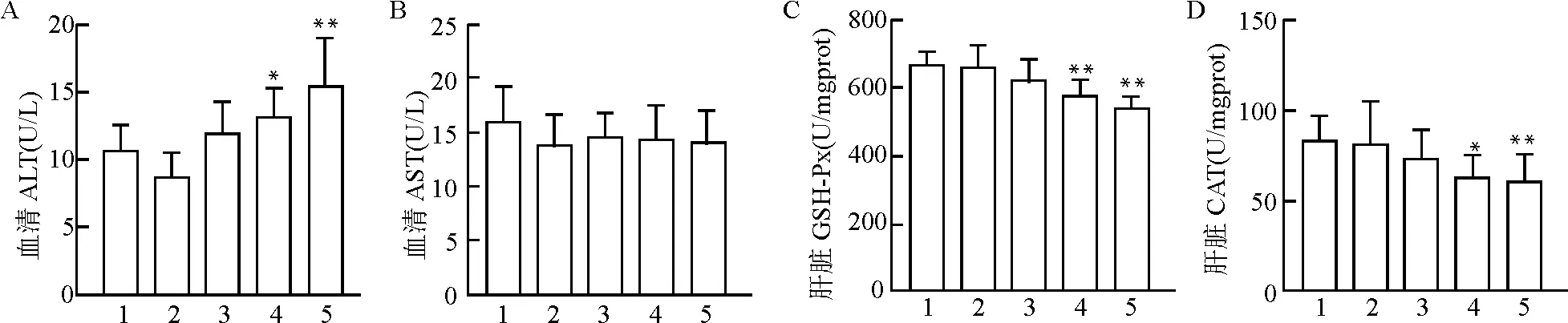
1:Control;2:HgCl2(1 mg/kg);3:HgCl2(4 mg/kg);4:HgCl2(8 mg/kg);5:HgCl2(16 mg/kg);A:血清ALT活性;B:血清AST活性;C:肝脏GSH-Px活性;D:肝脏CAT活性;与对照组比较,*P<0.05 **P<0.01图1 氯化汞对小鼠肝功能和肝脏氧化应激水平影响Fig.1 Effect of mercury chloride on liver function and hepatic oxidative stress levels of each
2.1.3 氯化汞对小鼠肝组织结构影响 小鼠肝脏病理切片的HE染色结果如图2所示,与对照组相比,氯化汞低剂量组肝脏并无显著的病理学变化,中低剂量组有轻微的肝细胞肿胀现象,中高剂量组和高剂量组则有明显的脂肪变性及肝细胞坏死的表现。
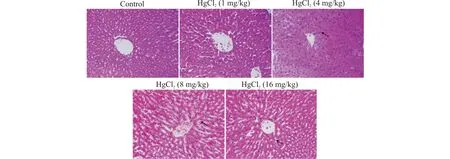
图2 各组小鼠肝脏病理学表现(苏木精-伊红染色,×400)Fig.2 Pathological features of mice liver sample in each group(HE staining,×400)
2.2 氯化汞对小鼠肝毒性影响的生物信息学分析
2.2.1 氯化汞染毒小鼠肝脏DEPs筛选 取对照组与氯化汞高剂量组小鼠肝脏进行蛋白组学分析,经过搜库鉴定和波峰分析,获得同一蛋白在不同样本中的表达丰度,本研究以表达差异倍数(fold change,FC)和P值作为参考标准,以FC<0.83或FC>1.2,P<0.05为DEPs筛选标准。与对照组相比,高剂量组小鼠肝脏共筛选出195个DEPs,其中99个上调蛋白,96个下调蛋白。
2.2.2 DEPs的GO富集分析 将样本总蛋白质和筛选的DEPs以GO数据库进行GO富集分析,结果如图3所示。GO富集分析主要包括生物学过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF),结果显示DEPs参与的BP有糖代谢的负调控、天冬氨酸家族氨基酸代谢、行为节律以及细胞产热等;CC方面,DEPs主要富集于免疫球蛋白复合物;涉及到的MF有激素-激素受体结合、跨膜受体-酪氨酸激酶结合、信息素-细胞膜受体结合等。参与糖代谢负调控的DEPs为主要尿蛋白(major urinary proteins,Mups)家族(Mup2、Mup7、Mup14、Mup17、Mup20、Mup21)、Fam3c(family with sequence similarity 3,member C)蛋白等。
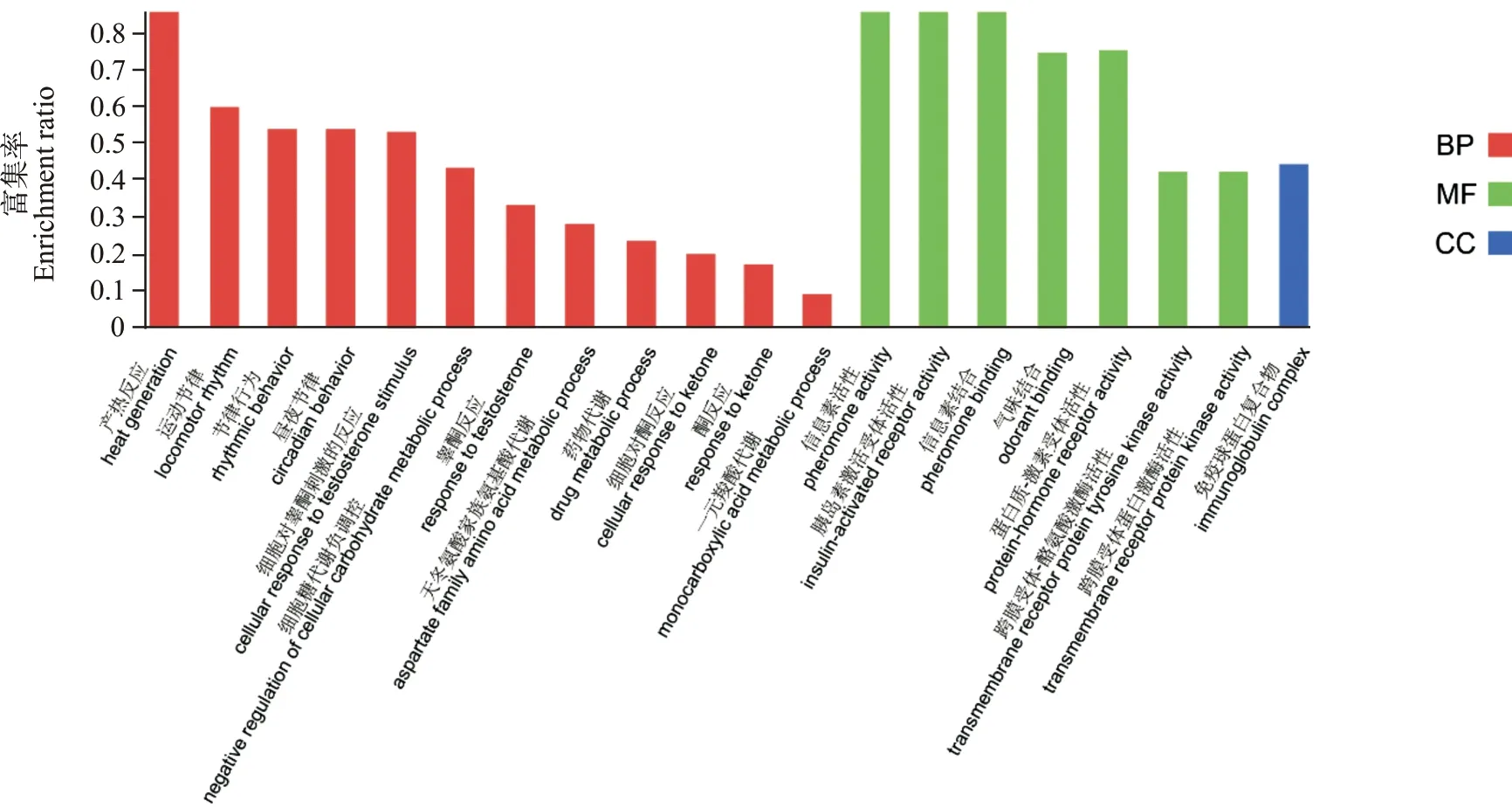
图3 DEPs GO富集分析结果(前20位)Fig.3 GO enrichment analysis of DEPs(Top 20)
2.2.3 DEPs的KEGG功能注释和富集分析 DEPs的KEGG功能注释及富集分析结果见图4。与对照组相比,氯化汞高剂量组小鼠肝脏的DEPs集中在类固醇激素生成、花生四烯酸(arachidonic acid,AA)代谢、细胞色素P450酶(cytochrome P450,CYP450)介导的外源化合物代谢、视黄醇代谢、胆汁分泌、化学致癌作用等信号通路。在本研究中,筛选出多个参与CYP450介导的外源化合物代谢通路的DEPs,包括有CYP2e1、多种谷胱甘肽S转移酶(glutathione S-transferase,GST)亚型(GSTp1、GSTm1、GSTt3、mGST3),尿苷二磷酸葡萄糖醛酸基转移酶(UDP-glucuronosyltransferase,UGT)各亚型(UGT2A3、UGT1a5、UGT2b37),磺基转移酶5a4(sulfotransferase 5a4,SULT5a4)、羰基还原酶1(carbonyl reductase 1,CBR1)。另外参与AA代谢通路的DEPs有CYP450酶(CYP8b1、CYP2e1、CYP2u1、CYP4v2、CYP4a12a、CYP2c67、CYP7b1、CYP4a12b)以及羰基还原酶1(carbonyl reductase 1,CBR1)。
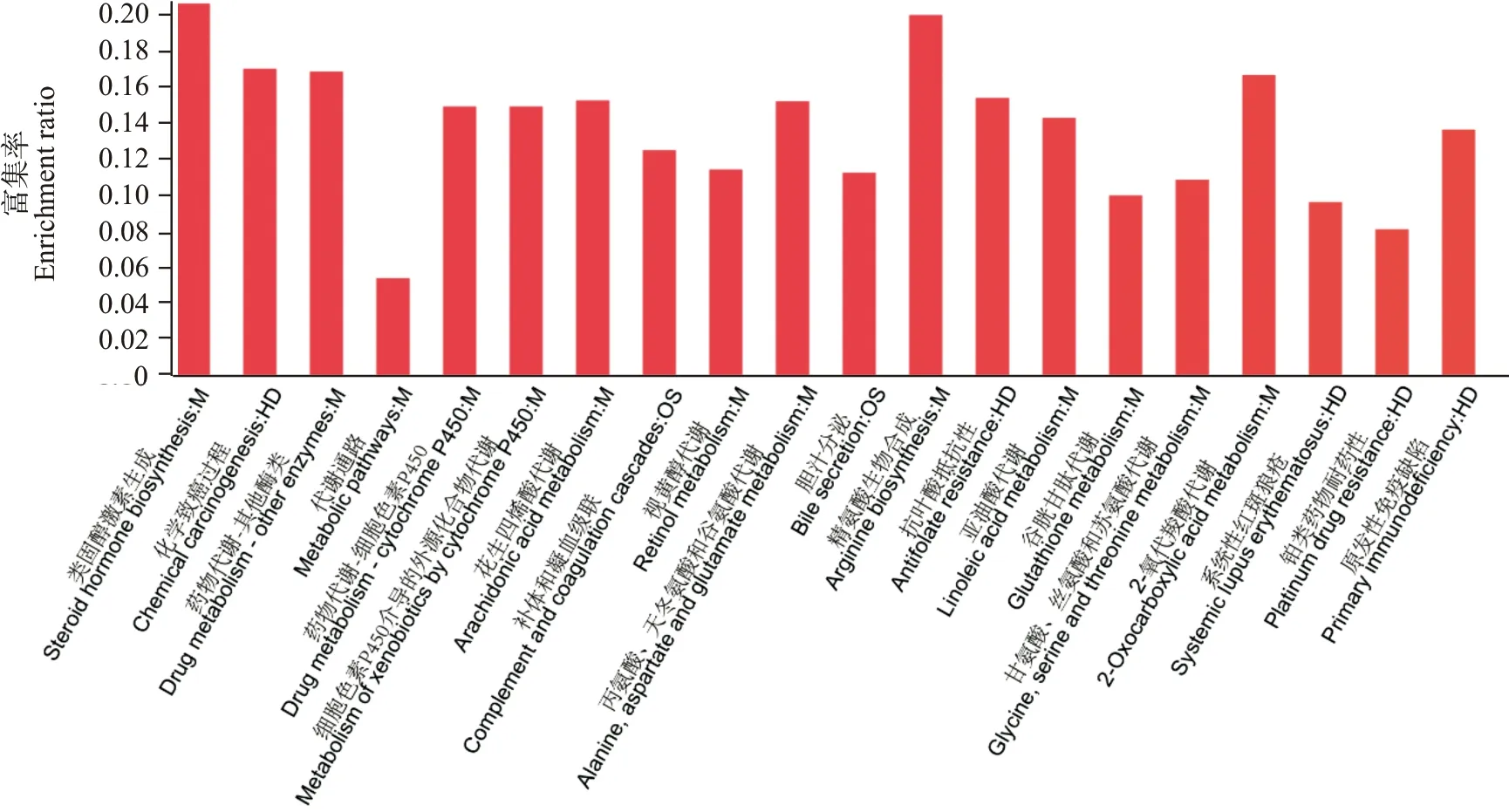
图4 DEPs KEGG通路富集结果(前20位)Fig.4 KEGG pathway enrichment of DEPs(Top 20))
3 讨论
本研究给予雄性小鼠氯化汞灌胃处理,结果显示氯化汞染毒能够显著降低小鼠体重(P<0.05);中高剂量组(8 mg/kg)与高剂量组(16 mg/kg)染毒明显增加小鼠血清的ALT活性,而显著降低小鼠肝脏抗氧化酶GSH-Px与CAT活性(均P<0.05),且呈剂量依赖性;氯化汞染毒后小鼠肝组织出现肝细胞肿胀、脂肪变性、细胞坏死等现象。本研究结果提示氯化汞染毒可能通过氧化应激途径导致小鼠的肝脏损伤,与已有研究结果一致[18-20]。
2003年新型、高效的TMT标记技术被引入到蛋白组学领域,其特点是提高了检测蛋白相对表达水平和蛋白翻译后修饰的敏感性[21]。本研究通过TMT定量蛋白组学技术对小鼠氯化汞肝毒性进行DEPs的筛选,共鉴定出195种DEPs,其中99个上调蛋白,96个下调蛋白。DEPs的GO功能富集分析显示,参与糖代谢负调控的DEPs主要为表达水平上调的Mups蛋白,提示氯化汞染毒后可以增加Mups的基因表达,从而导致小鼠肝脏的糖脂异常调控[22]。DEPs在细胞组分上富集在免疫球蛋白复合物,根据二价汞离子具有结合一系列蛋白质的特点,以及外源化合物在肝脏中经过Ⅰ相代谢可形成毒性降低或升高的蛋白复合物,二价汞离子在代谢过程中有可能形成毒性较强的蛋白复合物,从而对肝脏造成损伤[23]。
Wang等[24]对无机汞暴露的清鳉鱼进行脑组织蛋白组学分析,结果显示汞离子暴露可引起抗氧化物GST、过氧化物还原酶-1(peroxiredoxin-1,Prx-1)的表达升高。Lee等[25]用氯化汞染毒SD大鼠,肾脏蛋白组学结果显示GST多种亚基的表达上调。GST可以催化GSH与氧化物结合,在细胞的氧化应激防御系统中发挥着重要作用,本研究的肝脏蛋白组学中也检测到GST蛋白的上调,以及GSH代谢通路的KEGG富集结果。有研究表明,在氢氧化物存在的情况下,GST还可以起到谷胱甘肽还原酶的作用,通过增加还原型谷胱甘肽含量以减少ROS引起的细胞损伤[26]。
对于DEPs的KEGG通路富集分析显示,氯化汞染毒涉及到肝脏中CYP450介导的代谢通路,这与Biswas等[27]关于斑马鱼经硫化汞暴露后的脑组织蛋白组学研究结果一致。CYP450酶是一种膜结合蛋白,在外源化合物代谢、细胞代谢方面具有重要作用,各种外源化合物或内源性底物可以通过与膜受体结合诱导或者抑制CYP450酶[28]。Ⅰ相代谢酶将外源化合物转化为具备极性基团的中间体,由Ⅱ相代谢酶将中间体与内源性结合剂(如谷胱甘肽)结合,形成活性降低、极性增加且易被排出的代谢物。CYP450酶在细胞中充当Ⅰ相代谢酶的作用,保护细胞免受外源化合物的损害。然而CYP450介导的生物转化可能导致外源化合物代谢活化为毒性产物。在多种CYP450酶中,CYP2e1在肝毒素的代谢中具有重要作用,某些肝毒性物质如对乙酰氨基酚、四氯化碳等可通过CYP2e1的激活,在体内转换成具有毒性的中间代谢物[29]。和其他CYP450酶相比,CYP2e1表现出更高的氧化酶活性,是微粒体ROS的重要来源,研究显示过表达CYP2e1的HepG2细胞ROS产生升高了40%~50%[30]。CYP2e1的诱导因素如二氯甲烷、1-硝基萘、二甲亚砜等能够抑制CYP2e1的降解,从而使细胞内CYP2e1水平较正常偏高[31]。本研究DEPs的KEGG富集分析结果显示氯化汞的染毒影响到小鼠肝脏的CYP450代谢通路上的多种代谢酶,包含多种Ⅰ相代谢酶CYP450和Ⅱ相代谢酶GST、UGT等,表明氯化汞可通过引起小鼠肝脏CYP450介导的代谢通路上的部分代谢酶的表达量发生改变,提示氯化汞诱导产生的肝脏毒性可能是由CYP450介导的外源化合物代谢通路紊乱导致。
AA作为一种多不饱和脂肪酸,主要以磷脂的形式在细胞膜上存在,在肝脏的正常生理过程中发挥重要作用。AA主要通过4种酶代谢:环氧合酶-1/2(cyclooxygenase-1/2,COX-1/2)、脂氧合酶(lipoxygenases,LOX)、CYP450酶、脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH)。AA在经过上述酶代谢后可形成大量具有生物活性的代谢产物,参与细胞的糖脂代谢、氧化应激、炎症反应、内质网应激等病理过程[32-33]。KEGG富集分析显示AA代谢通路上的DEPs主要是CYP450酶,均为上调蛋白,CYP450酶可以参与AA的非酶氧化过程,将AA转化为为ω-1和ω-2羟基化代谢物,提示氯化汞染毒可以通过增强AA的CYP450酶代谢途径,产生活性代谢物从而导致肝脏糖脂代谢紊乱、氧化应激、炎症反应等毒性反应[30]。
另外KEGG富集分析的结果显示DEPs富集在视黄醇代谢通路,肝脏非实质细胞主要由肝脏星状细胞(hepatic stellate cells,HSCs)组成,该细胞内具有大量含有视黄醇的脂滴,在肝细胞的损伤刺激下,HSCs可被激活,在形态学和生理功能上发生改变,在HSCs的激活过程中,视黄醇的释放降解是特征之一[34-35]。视黄醇可对HSCs的DNA合成产生抑制作用从而抑制肝脏的纤维化改变,即氯化汞染毒可能会通过影响HSCs视黄醇代谢导致肝脏细胞的损伤[36]。
除上述通路外,生物信息学分析结果还显示氯化汞的毒性作用还与肝脏的类固醇激素生成、胆汁分泌、化学致癌作用等通路相关。本研究采用TMT标记定量蛋白组学技术有效筛选了氯化汞染毒小鼠肝脏中的DEPs,并对其进行了相应的生物信息学分析,有助于了解氯化汞肝毒性的生物学过程和代谢通路,为氯化汞的肝毒性机制研究提供线索,但氯化汞肝毒性涉及的具体通路尚需进一步的研究与验证。

