甘蔗不同基因型对白条病抗性的评价
杜金霞,李奕莎,李美霖,陈文浛,张木清
甘蔗不同基因型对白条病抗性的评价
杜金霞,李奕莎,李美霖,陈文浛,张木清
广西大学农学院/亚热带农业生物资源保护与利用国家重点实验室/广西甘蔗生物学重点实验室,南宁 530005
【目的】甘蔗白条病是影响甘蔗产业的一种重要细菌检疫性病害,选择抗病品种可有效降低病害的发生。了解甘蔗基因型的白条病抗性,规范抗性评价方法,为甘蔗白条病抗病种质资源的选育和利用提供依据。【方法】以桂糖46号分离得到的黄单胞菌株JG43菌株为接种病原,采用截头法人工接种于70个不同基因型的甘蔗上。通过蘸有细菌悬浮液(108CFU/ml)的剪刀剪切甘蔗生长点上方,并用棉花吸取500 μl细菌悬浮液置于斜切面上。分别于接种后14、28、42、56和70 d,对每个甘蔗基因型的发病情况进行调查,计算发病率(incidence,IC)。根据甘蔗白条病严重度评判标准计算病情指数(disease index,DI)和病害进展曲线下面积(area under the disease progress curve,AUDPC)。利用SPSS 25.0软件分别进行方差分析、主成分分析和判别分析。其中,采用一般线性模型和类型Ⅲ的平方和模型进行方差分析,以IC、DI和AUDPC作为因变量,基因型、区组及接种后时间为固定因子。原始数据经过标准化(Z-score)处理后,通过KOM和Bartlett球体检验法进行主成分分析。运用DPS 9.50软件的WPGMA法,计算欧几里得距离(euclidean metric)进行聚类分析。以聚类分析结果中的不同抗性等级作为分组变量,AUDPC、IC和DI作为自变量,根据Fisher准则进行判别分析,计算分类准确率。【结果】接种14 d,部分基因型叶片开始发病,出现1—2条铅笔状条纹;接种28 d,条纹数增多且逐步向边缘扩展;接种42 d,叶片黄化或白化症状从边缘逐步向叶脉扩展;接种56 d,叶片向内卷曲枯死;接种70 d时,发病严重的甘蔗整株枯萎死亡。方差分析发现,不同基因型(genotype,Gen)、接种后持续时间(days post-inoculation,Dpi)及其互作(Gen×Dpi)对IC、DI和AUDPC均具有极显著影响(<0.01),其中,总方差的42%归因于接种后时间效应,表明不同接种时间甘蔗基因型的抗性反应存在显著差异。接种56 d,病害的发生达到相对稳定状态,这一时期的病害数据经平均值多重比较后能较好地进行甘蔗基因型间的抗性划分。判别分析与聚类分析的结果基本一致,将70个基因型分为5个不同抗病等级,包括高抗基因型15份、抗病基因型14份、中抗基因型15份、感病基因型11份、高感基因型15份。【结论】通过截头法人工接种进行甘蔗抗白条病鉴定时,以接种56 d基因型的IC、DI和AUDPC作为抗性鉴定评价指标,在聚类分析的基础上增加判别分析,可以提高试验结果的准确性。筛选出中蔗9号、中蔗4号、中蔗2号、GUC19、GUC8、云瑞03-103、云瑞05-649、云瑞05-182、云瑞05-367、云瑞89-159、福农11-601、福农09-4059、桂糖02-467、桂糖08-297、新台糖22号等15个高抗品种,可进一步用于甘蔗抗白条病育种研究。
甘蔗;白条病;抗性鉴定;聚类分析;主成分分析;判别分析
0 引言
【研究意义】甘蔗()是一种重要的糖料和经济作物,中国的蔗糖主要产自广西和云南[1]。然而,每年因病害造成的产量损失约为25%[2]。甘蔗白条病(sugarcane leaf scald)是其主要的检疫性细菌病害。近年来,研究人员通过病原菌分离和分子生物学鉴定,在广西多个蔗区发现了甘蔗白条病[3-4]。甘蔗白条病是由黄单胞菌()引起的一种细菌性病害,主要通过抑制叶绿体分化[5]、堵塞甘蔗维管束和木质部[6],导致甘蔗产量和品质下降。发病植株通常节间变短并从茎底部长出侧枝[7],蔗径横切面变红,发病严重时整株死亡。发病叶片多为下部叶,植株顶端叶和上部叶很少出现铅笔线白色条纹[8]。甘蔗白条病菌能够通过砍刀等收获工具进行传播,也可通过感染病菌的种茎传播,还可通过植株间叶、根等接触性传播,在降雨量充足时,通过气流传播[9]。种植抗病材料可以很大程度上降低病害的发生,是预防甘蔗白条病最经济有效的方法。【前人研究进展】甘蔗品种的抗性评价主要通过田间自然发病和人工接种验证。与田间自然发病相比,人工接种具有灵活性大、周期短等优点,能够保证寄主被单一病原菌侵染的前提下降低环境因子对结果的影响。通常采用截头法进行人工接种甘蔗白条病菌的抗性鉴定[10],Egan[11]使用铝盖截头法分别于1966年和1967年鉴定了15种已知抗性的甘蔗品种,提供了一种可以快速有效地划分抗病和高感品种的方法;Rott等[12]用截头法鉴定了7个甘蔗品种在新植和宿根蔗的抗性,并建议减少感病品种B69-379的种植;Gutierrez等[13]和Garces等[14]采用截头法和qPCR方法检测甘蔗叶片中白条黄单胞菌含量,从而进行品种间抗性的划分。此外还有浸种法和剪叶法,Lopes等[15]通过浸种法对甘蔗品种进行抗白条病性鉴定,结果表明,利用EC50的评价结果与田间自然发病的观察结果一致;吴广悦等[16]用浸种法和截头法分别接种桂糖46号和中蔗6号来评价24个菌株的致病性差异;傅华英等[17]通过苗期剪叶法评价甘蔗品种的抗白条病性。【本研究切入点】广西是中国重要的甘蔗产区,由于前人对甘蔗基因型抗白条病评价的数量有限,尚未发现高抗品种,且抗病鉴定大多以最后一次的病情指数作为主要依据,评价方法存在局限性和片面性。因此,扩大中国甘蔗抗病种质范围,应用多种指标去综合评价甘蔗品种的白条病抗性至关重要。【拟解决的关键问题】本研究通过对70个甘蔗基因型人工接种后的发病率、病情指数和病害进展曲线下面积进行方差分析、主成分分析、聚类分析和判别分析,了解病害的发生规律及不同基因型甘蔗的抗性,明确甘蔗基因型通过截头法人工接种后进行抗性鉴定的最佳时间,规范抗性评价方法,为甘蔗抗病育种提供依据。
1 材料与方法
1.1 田间设计
选用中国最近引进选育的70个甘蔗基因型作为甘蔗白条病抗性鉴定材料。其中,中蔗系列(ZZ)材料5份,美国系列(GUC)材料15份,新台糖系列(ROC)材料7份,福农系列(FN)材料16份,云瑞系列(YR)材料15份,桂糖系列(GT)材料12份。每个基因型挑选蔗芽饱满、一致的种芽90个,经温汤脱毒处理后,于2021年5月种植在广西大学农学院扶绥基地温室中。试验采用完全随机区组设计,单行区,行长3.0 m、行距1.2 m,3次重复,每个小区每个基因型30个芽。以GT46和ROC22为感病和抗病对照种。
1.2 白条病原菌的活化和接种
供试菌株JG43为前期从桂糖46号上分离、纯化和保存。在超净工作台中用牙签蘸取菌种,接种于MW(蔗糖10 g·L-1,蛋白胨5 g·L-1,磷酸氢二钾0.50 g·L-1,硫酸镁0.25 g·L-1,亚硫酸钠0.05 g·L-1,琼脂15 g·L-1,pH7.0)平板培养基上,28℃活化5—7 d,然后挑取少许接入MW液体培养基中,220 r/min,28℃培养3 d。用分光光度计测量细菌悬浮液的浓度后,使用无菌水调节菌液浓度为108CFU/mL。将细菌悬浮液短时间置于4℃条件下备用。待甘蔗长到5个节时,采用截头法人工接种,用蘸有细菌悬浮液的剪刀剪切甘蔗生长点上方,不同基因型甘蔗剪切后,需用酒精棉擦拭剪刀,随后用棉花吸取500 μl细菌悬浮液置于斜切面上[18],同时用ddH2O作阴性对照。
1.3 调查方法
分别于接种后14、28、42、56和70 d(感病对照基因型病情指数达到稳定)调查甘蔗白条病发病情况。参考傅华英等[17]方法进行白条病严重度分级(表1),根据发病情况及严重程度计算发病率(incidence,IC)、病情指数(disease index,DI)和病害进展曲线下面积(area under the disease progress curve,AUDPC)。
病情指数(DI)=∑(各级病株数×该病级值)/(调查总株数×最高病级值)×100
病害进展曲线下面积(AUDPC)=
其中,y、y1为次与1次记载的病情指数,t1-t为第+1次与第次记载的间隔天数。

表1 甘蔗白条病发病严重度评判标准
1.4 统计分析
利用Excel 2019对表型数据进行记录与处理。利用SPSS 25.0软件进行方差分析、主成分分析和判别分析。采用一般线性模型和类型Ⅲ的平方和模型进行方差分析,IC、DI和AUDPC作为因变量,基因型、区组及接种后时间为固定因子,计算主效应及基因型与接种后时间的交互效应和各因子的方差占比。由于变量的量纲不同,进行主成分分析时,数值变化范围大的变量所占比重较大,因此,使用SPSS 25.0软件对原始数据进行标准化(Z-score)处理后,通过KOM和Bartlett球体检验法进行主成分分析。利用DPS 9.50软件将标准化处理后的AUDPC、IC和DI原始数据运用WPGMA法,计算欧几里得距离(Euclidean metric)进行聚类分析。利用SPSS 25.0软件将不同抗性等级作为分组变量,AUDPC、IC和DI作为自变量,根据Fisher准则进行判别分析,计算分类准确率。
2 结果
2.1 甘蔗白条病症状表现
接种14 d(图1-b),部分甘蔗基因型叶片开始褪绿,出现与主脉平行的1—2条白色铅笔状条纹,且多出现在叶片中;接种28 d(图1-c),白色铅笔状条纹逐步向边缘扩展,多数基因型叶片出现典型的白色条纹且条纹数增多;接种42 d(图1-d),叶片黄化或白化症状从边缘逐步向叶脉扩展;接种56 d(图1-e),条纹中出现红色小点,从叶边缘开始出现组织枯萎坏死,叶片向内卷曲;接种70 d(图1-f),发病严重的甘蔗基因型整株枯萎死亡。

a:健康叶片;b:接种14 d发病叶片;c:接种28 d发病叶片;d:接种42 d发病叶片;e:接种56 d发病叶片;f:接种70 d发病叶片
2.2 甘蔗不同基因型的方差分析
方差分析(表2)结果表明,接种14—70 d,基因型间的DI、IC和AUDPC均达到极显著水平(<0.001),接种后时间对3种病害指标也有极显著影响(<0.001),但是区组间差异不显著(>0.05),说明除基因型和观测时间以外其他条件的一致性和重复性好,鉴定结果比较可靠。从方差占比来看,IC平方和(SS)的18.98%归因于基因型效应,42.82%归因于时间效应,20.00%归因于Gen×Dpi互作效应;DI平方和(SS)的20.13%归因于基因型效应,42.69%归因于时间效应,20.17%归因于Gen×Dpi互作效应;AUDPC平方和(SS)的21.12%归因于基因型效应,42.22%归因于时间效应,18.99%归因于Gen×Dpi互作效应。不同因子对IC和DI的影响:接种后时间效应>基因型×时间效应>基因型效应;对AUDPC的影响:接种后时间效应>基因型效应>基因型×时间效应。接种后病害发生情况主要受时间效应的影响,因此,在甘蔗白条病抗性评价时,选择适宜的调查时期是病害鉴定的关键。
2.3 主成分分析及抗性鉴定综合评价模型
将IC和DI在接种后不同时间的原始数据标准化处理后,进行主成分分析,结果显示,KMO值为0.686(>0.60),Bartlett球体检验结果为969.62,Sig值为0.000,表明该数据适用主成分分析法。从贡献率(表3)可知,前3个成分可以代表原始数据的绝大部分信息,且累计贡献率达到87.4%。其中,第一主成分Y1反映了原始数据的大部分信息,解释了方差变异的51.1%,因子权重为58.5%,IC和DI在接种后42—56 d时均有较大的正载荷,说明该阶段是病害鉴定的关键时期;第二主成分为接种14 d;第三主成分为接种70 d。由图2可知,从接种56 d开始,70个甘蔗品种的IC和DI变化不显著(>0.05),甘蔗白条病病害的发生达到稳定阶段。因此,为节省观测时间可在接种56 d记录病害发生情况。
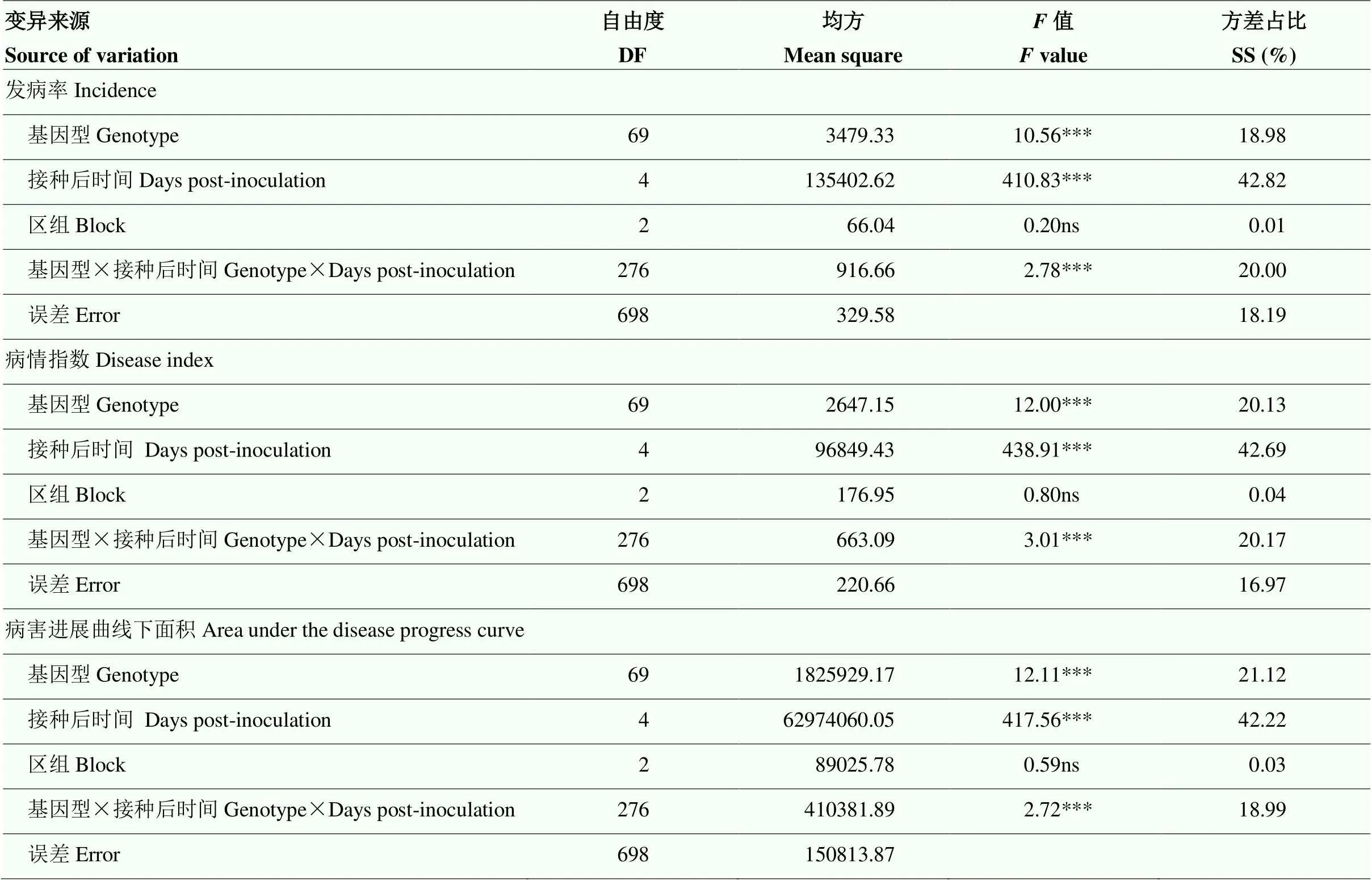
表2 接种14、28、42、56和70 d时病情指数(DI)、发病率(IC)和病害进展曲线下面积(AUDPC)的方差分析
***:在≤0.001水平差异显著;ns:差异不显著(>0.05) ***: significant levels at≤0.001; ns: not significant (>0.05)
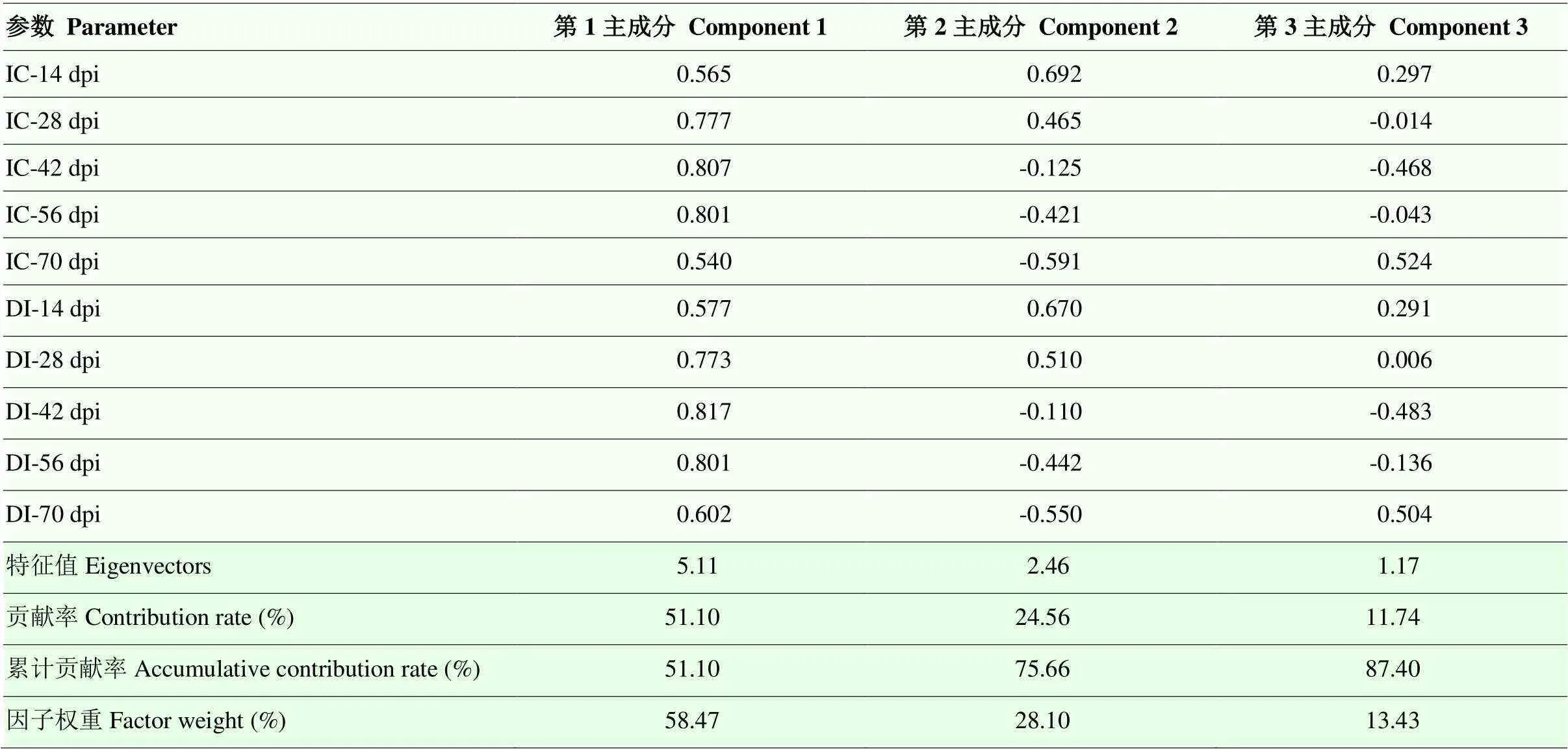
表3 发病率和病情指数在接种后不同时间点主成分的特征值、贡献率、累计贡献率、因子权重和成分载荷矩阵
IC:发病率;DI:病情指数。下同 IC: Incidence; DI: disease index. The same as below
2.4 甘蔗基因型抗白条病评价
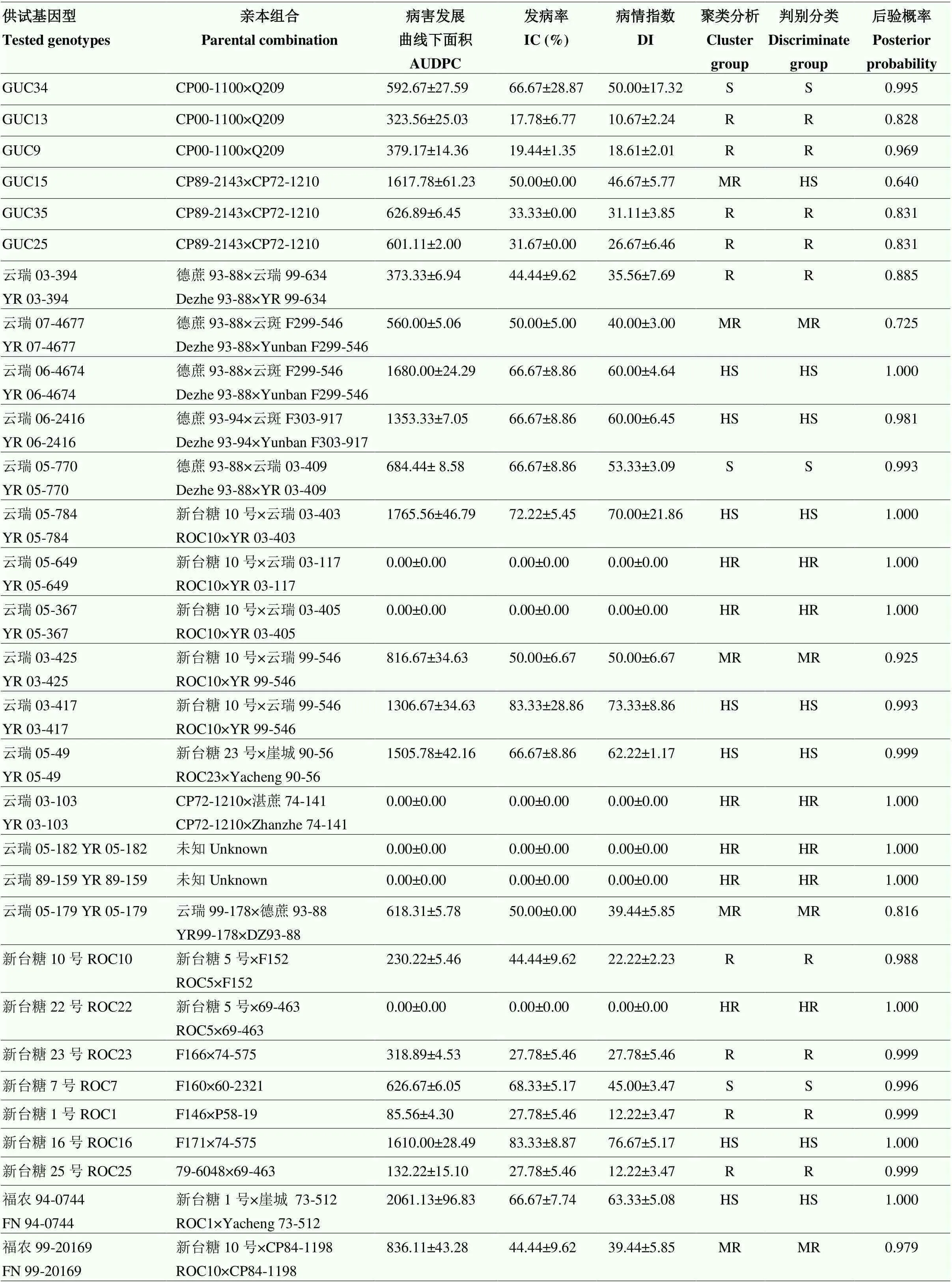
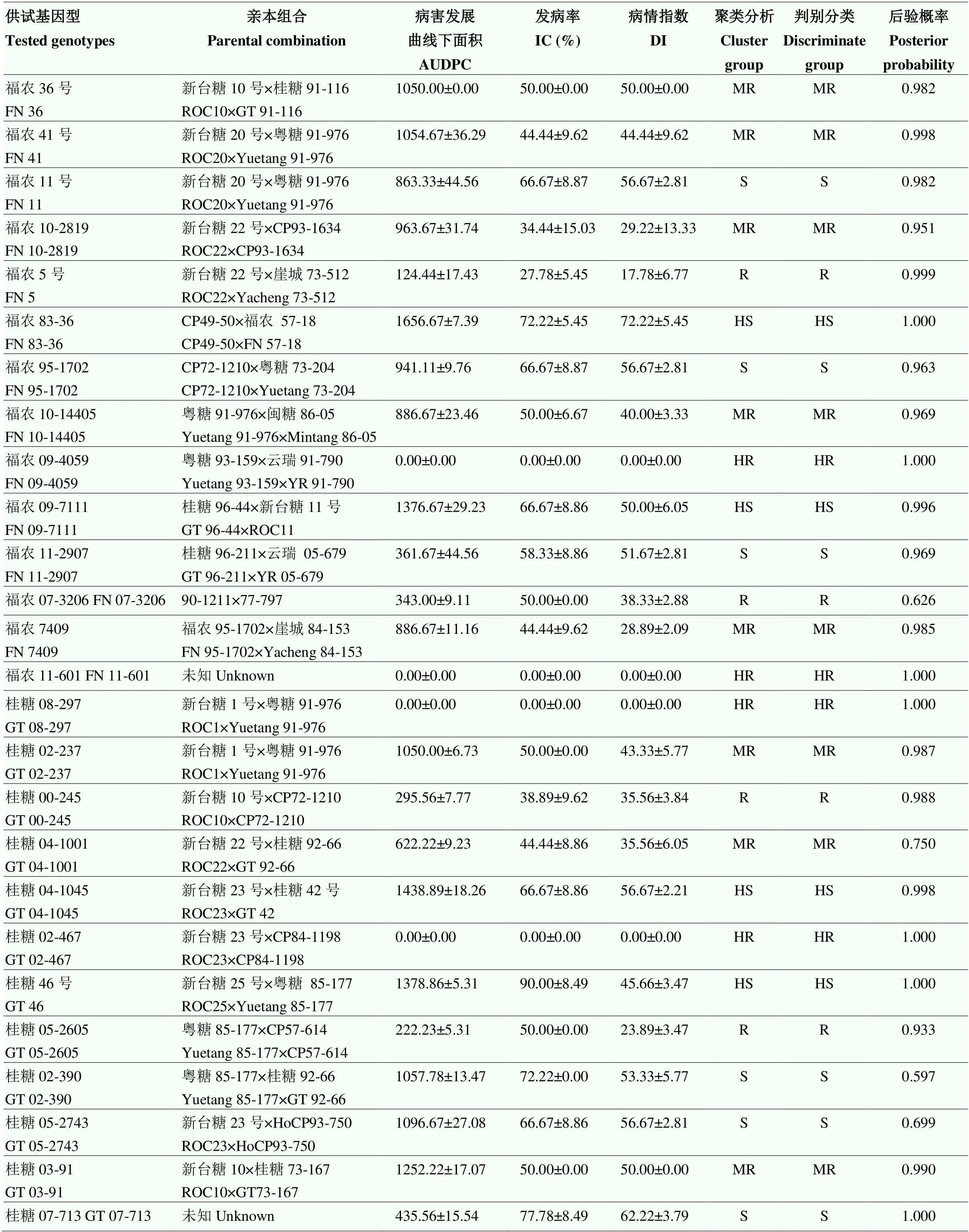
将接种56 d的IC、DI和AUDPC原始数据经标准化转化后进行聚类(图3)和判别分析(表4)。结果表明,2种分析方法对基因型的评价结果基本一致,只有1个基因型被误判,即GUC15由中抗被判为高感(表4)。将判别分析后的3个病害指标按高抗、抗、中抗、感病和高感5个等级划分,不同抗性等级间经过平均值多重比较后存在显著差异(表5)。其中,高抗组包括抗病对照品种(ROC22)和ZZ9在内的15个基因型(占比21.43%),抗病组包括ZZ5在内的14个基因型(占比20.00%),中抗组包括ZZ6在内的15个基因型(占比21.43%),感病组包括GUC34在内的11个基因型(占比15.71%),高感组包括感病对照品种GT46在内的15个基因型(占比21.43%)。
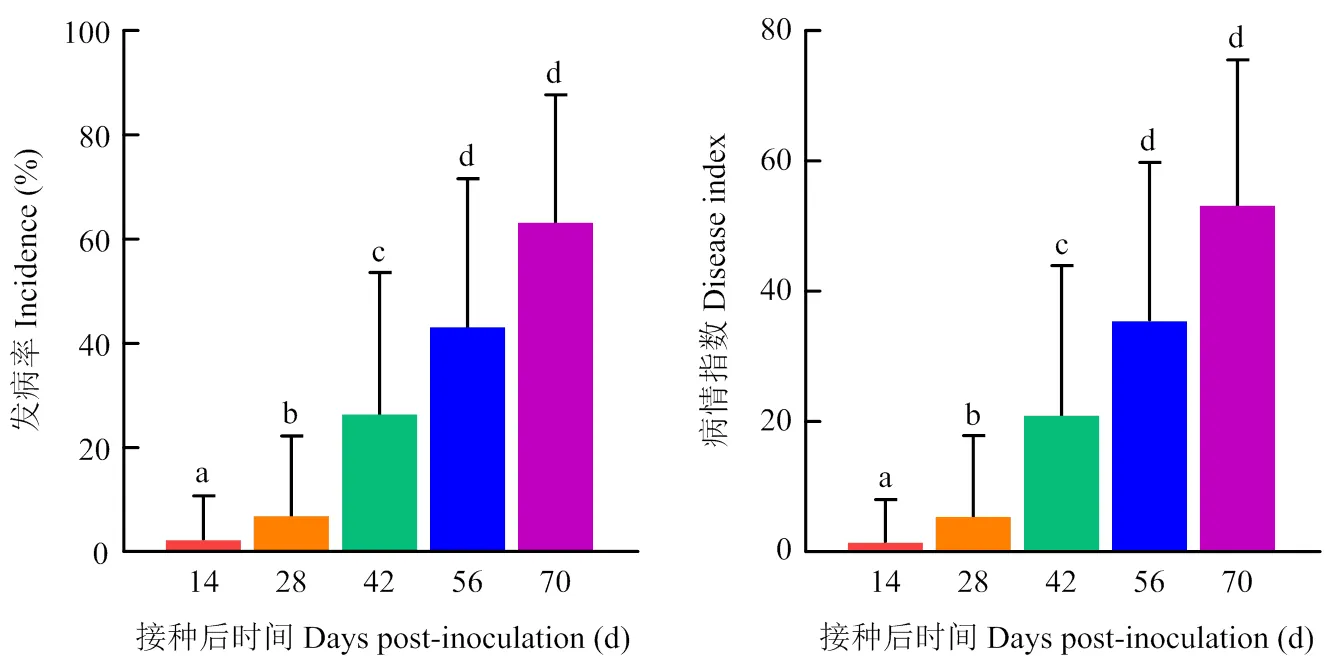
小写字母表示接种后不同时间点发病率和病情指数的差异显著性(P<0.05)
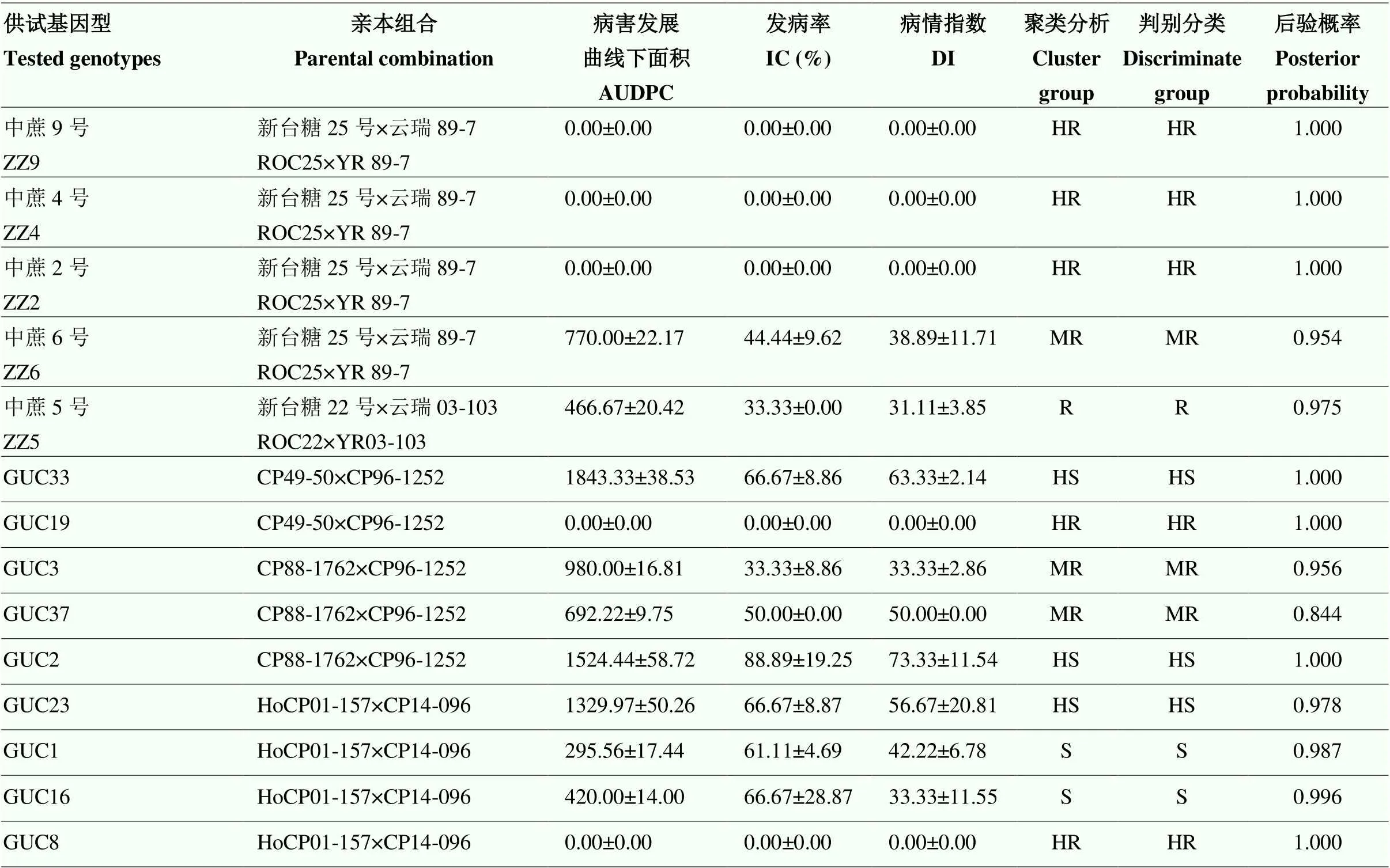
表4 甘蔗基因型的聚类分析与判别分析
续表4 Continued table 4
续表4 Continued table 4
AUDPC:病害进展曲线下面积。HR:高抗;R:抗病;MR:中抗;S:感病;HS:高感。下同
AUDPC: area under the disease progress curve. HR: High resistance; R: Resistance; MR: Moderate resistance; S: Susceptibility; HS: High susceptibility. The same as below
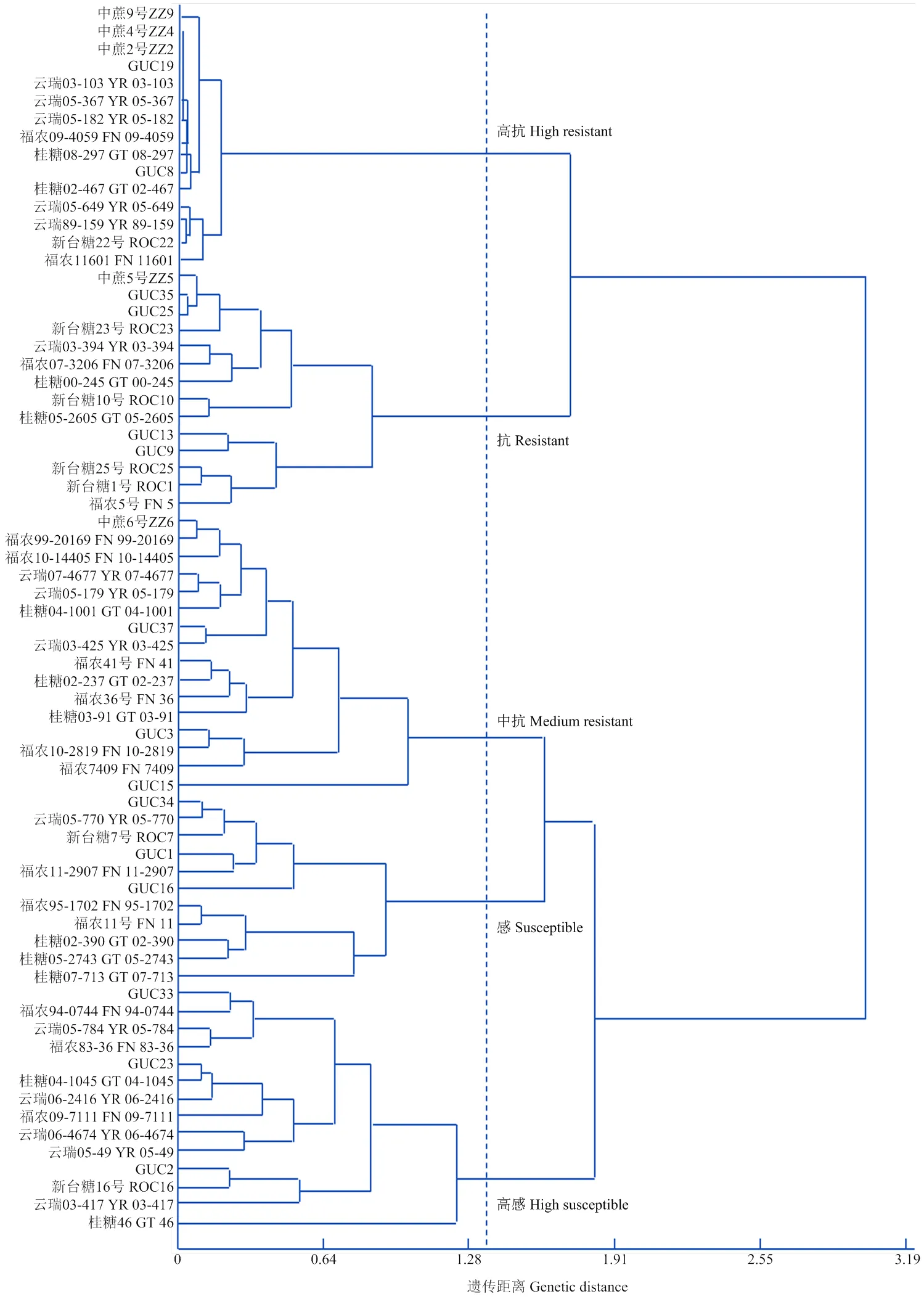
图3 70个甘蔗基因型白条病抗性的聚类分析树状图
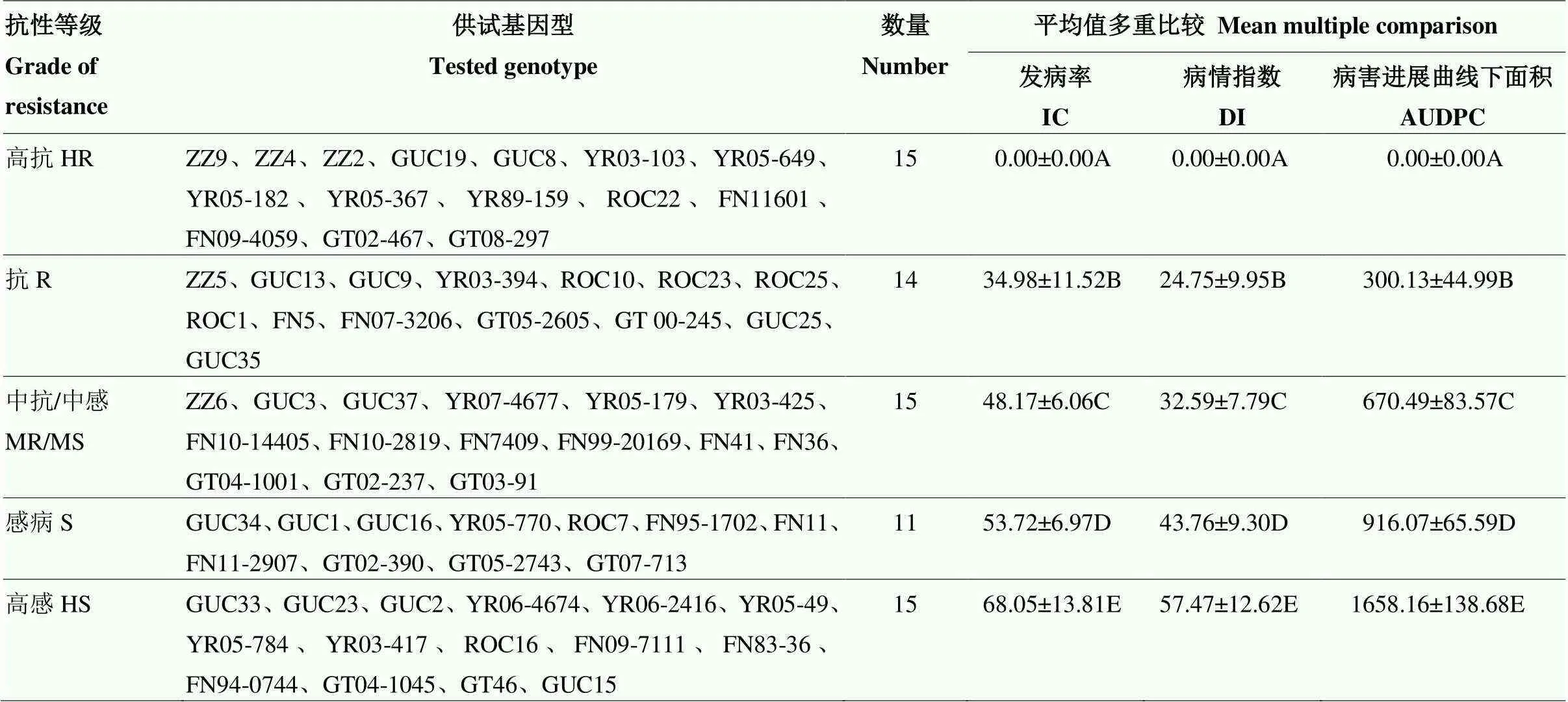
表5 供试基因型间抗白条病的差异
同一列中不同字母表示差异显著(<0.01)
The different letters in the same column showed significant differences (<0.01)
3 讨论
3.1 白条病抗性鉴定的规范化利于试验结果的准确性
无论是抗病育种材料的筛选还是甘蔗品种的审定,准确评价品种的白条病抗性是技术核心。因此,综合各项指标,建立一个条件可控、快速稳定的白条病抗性鉴定体系至关重要。肖春芳等[19]采用病情指数和病害进展曲线下面积2种鉴定方法对马铃薯品种抗病性进行判定,证明2种方法在筛选抗性品种方面均具有实用性。Zhu等[20]通过病情指数、植株死亡率和病害进展曲线下面积评估了棉花品种接种不同枯萎病菌后的抗性差异。赵丽红[21]利用病情指数和病害进展曲线下面积的相对值对14个棉花品种抗黄萎病性进行判定,认为AUDPC评价方法优于病情指数的评价方法。病情指数和发病率是考虑病害发生范围和严重度的综合指标,在材料基数大、资源种类繁多的情况下[22],能有效反映不同材料间抗性水平的差异。利用AUDPC法进行抗性鉴定,从出现病症开始,到感病对照品种发病达到稳定结束,在此期间开展连续调查,避免了感病品种死亡后或病害已经严重感染感病基因型时评估感病和抗病材料间差异的风险,从而能比较全面地评价不同基因型的抗病性[19, 23]。评价方法的单独使用会降低评价结果的准确性,因此,本研究在准确调查的基础上综合利用IC、DI和AUDPC对甘蔗白条病的抗性进行评价,提高了抗病鉴定的准确性。
DI、IC和AUDPC的方差分析表明,接种后时间的方差占比明显高于基因型方差占比,说明时间效应对基因型发病严重程度有重要影响,因此,在进行白条病抗性评价时选择适宜的调查时间非常重要。本研究利用主成分分析发现通过截头法进行人工接种抗白条病鉴定的最佳调查时间为接种后56 d,该时间点白条病的发生达到一个相对稳定的状态,病害数据具有代表性,能够很好地进行基因型间抗性划分。这与Gutierrez等[13]通过截头法人工接种发现接种56 d时的视觉病害调查结果与qPCR检测结果的一致性最高这一结论相符合。同时,观测次数的减少也可以提高试验的准确性,降低试验过程中的人为误差,缩短试验周期。判别分析是在聚类分析的基础上对其分类结果进行判定,本研究聚类分析与判别分析的结果基本一致,仅GUC15由中抗被判为高感。因此,建议在进行抗性评价时,应在聚类分析的基础上增加判别分析,增加试验结果的准确性。
3.2 选育抗白条病甘蔗基因型对生产及育种进程的重要性
白条病是中国甘蔗的一种检疫性病害,也是导致甘蔗产量和蔗汁质量下降的主要原因之一[24]。选育抗病品种是防控白条病的最重要途径[25]。本研究通过截头法人工接种和多元统计分析,发现不同基因型间的发病差异较大,在评价的70个甘蔗基因型中,表现高抗的基因型有15个、抗的基因型14个、中抗15个、感病11个、高感15个,与育成品种单位没有明显的关系,福农(FN)、中蔗(ZZ)、美国(GUC)、新台糖(ROC)、云瑞(YR)、桂糖(GT)分布在5个类型中。研究中选择的高感对照基因型GT46,经长期、多地筛选鉴定,被公认为高感甘蔗白条病[16, 18]。李文凤等[26]通过田间自然发病试验鉴定出白条病中感品种FN41和高抗品种ROC22,与本研究通过截头法人工接种试验的鉴定结果一致。甘蔗白条病的爆发与易感品种的大面积种植密不可分。1964年毛里求斯2个易感品种CP74-383和LCP82-89的广泛种植导致甘蔗白条病在该地区的大规模发生[27]。在佛罗里达州,主栽品种CP72-1210和CP70-1133的种植造成平均每公顷有成百上千株甘蔗感染白条病[28]。此外其他感病品种,如澳大利亚的Q63,墨西哥南部的Mex69-290[29]在当地的种植均造成了产量的严重下降。因此,建议对本研究筛选出的26个甘蔗白条病中感以上基因型在抗白条病育种中慎重使用。同时,应该对更多的甘蔗种质资源进行筛选,挖掘新的抗病材料,为甘蔗抗病育种及新品种推广应用提供更丰富的来源。通过查阅供试基因型系谱发现,甘蔗亲本的抗性水平与杂交后代的表现并不一致,主栽品种CP72- 1210高感白条病,但作为亲本时与品种CP89-2143和新台糖22号的杂交后代抗病,推测可能与另一亲本的抗性有关。由同一亲本CP49-50×CP96-1252、HoCP01-157×CP14-096和CP00-1100×Q209培育的杂交后代的白条病抗性水平差别较大,推测是由于甘蔗本身为异源多倍体,遗传基础复杂,个体性状分离极易受环境影响[30-31]。
4 结论
通过截头法人工接种进行甘蔗抗白条病鉴定时,以接种56 d的基因型IC、DI和AUDPC作为抗性鉴定评价指标,通过在聚类分析的基础上增加判别分析,可以提高评价结果的准确性。筛选出的中蔗9号、中蔗4号、中蔗2号、GUC19、GUC8、云瑞03-103 、云瑞05-649、云瑞05-182、云瑞05-367、云瑞89-159、福农11601、福农09-4059、桂糖02-467、桂糖08-297、新台糖22号等15个高抗品种,可以在生产上推广种植,同时也可作为抗病亲本进一步培育新材料,对于选出的26个白条病中感以上基因型甘蔗在抗白条病育种中要慎重使用。
[1] KHAN A, JIANG H T, BU J Y, ADNAN M, GILLANI S W, HUSSAIN M A, ZHANG M Q. Untangling the rhizosphere bacterial community composition and response of soil physiochemical properties to different nitrogen applications in sugarcane field. Frontiers in Microbiology, 2022, 13: 1-12.
[2] LUGTENBERG B. Principles of plant-microbe interactions. Microbes for Sustainable Agriculture. Springer Nature, 2015. 17-24.
[3] ZHANG R Y, SHAN H L, LI W F, CANG X Y, WANG X Y, YIN J, LUO Z M, HUANG Y K. First report of sugarcane leaf scald caused byin the province of Guangxi, China. Plant Disease, 2017, 101(8): 1541.
[4] LING H L, NTAMBO M S, ROTT P C, WANG Q N, LIN Y H, FU H Y, GAO S J. Molecular detection and prevalence of, the causal agent of sugarcane leaf scald, in China. Crop Protection, 2018, 109: 17-23.
[5] FLEITES L A, MENSI I, GARGANI D, ZHANG S, ROTT P, GABRIEL D W.OmpA1 appears to be functionally modular, and both the OMC and C-like domains are necessary for leaf scald disease of sugarcane. Molecular Plant- Micorobe Interactions, 2013, 26(10): 1200-1210.
[6] DUAN Y Y, ZHANG Y Q, XU Z X, LIN Y, MAO L R, WANG W H, DENG Z H, HUANG M T, GAO S J. First report ofcausing leaf scald on two chewing cane clones in Zhejiang province, China. Plant disease, 2021, 105(2): 485.
[7] BIRCH R G.and the antipathogenesis approach to disease control. Molecular Plant Pathology, 2001, 2(1): 1-11.
[8] CERVANTES-ROMERO B, PEREZ-RODRIGUEZ P, ROTT P, VALDEZ-BALERO A, OSNAYA-GONZALEA M, ROBLEDO-PAZ A, HERNANDEZ-JUAREZ C, CROSSA J, ROSAS-SAITO G H, SILVA-ROJAS H V. Distribution, phylogeny, and pathogenicity ofcausing sugarcane leaf scald in Mexico. Crop Protection, 2021, 150(2): 105799.
[9] DAUGROIS J H, BOISNE-NOC B R, CHAMPOISEAU B P, BULLET P, ROTT P. The revisited infection cycle of, the causal agent of leaf scald of sugarcane. Functional Plant Science & Biotechnology, 2012, 6(2): 91-97.
[10] PATRO T S S K, RAO G V N. Reaction of sugarcane clones to leaf scald disease incited by. Journal of mycology and plant pathology, 2006, 36(2): 241-243.
[11] EGAN B T. Evaluation of the aluminum cap method for leaf scald disease resistance testing in Queensland. Proceedings of the International Society of Sugarcane Technologists, 1969, 13: 1153-1158.
[12] ROTT P, SOUPA D, BRUNET Y, FELDMANN P, LETOURMY P. Leaf scald () incidence and its effect on yield in seven sugarcane cultivars in Guadeloupe. Plant Pathology, 1995, 44(6): 1075-1084.
[13] GUTIERREZ A, GARCES F F, HOY J W. Evaluation of resistance to leaf scald by quantitative PCR ofin sugarcane. Plant Disease, 2016, 100(7): 1331-1338.
[14] GARCES F F, GUTIERREZ A, HOY J W. Detection and quantification ofby qPCR and potential characterization of sugarcane resistance to leaf scald. Plant disease, 2013, 98(1): 121-126.
[15] LOPES S A, DAMANN K E, HOY J W, GRISHAM M P. Infectivity titration for assessing resistance to leaf scald among sugarcane cultivars. Plant disease, 2001, 85(6): 592-596.
[16] 吴广悦, 李奕莎, 李美霖, 张桂英, 陈保善, 张木清. 广西蔗区甘蔗白条病菌的鉴定与致病力分析. 植物病理学报, 2022, 52(1): 9-16.
WU G Y, LI Y S, LI M L, ZHANG G Y, CHEN B S, ZHANG M Q. Identification and pathogenicity analysis ofcausing sugarcane leaf scald in Guangxi. Acta Phytopathologica Sinica, 2022, 52(1): 9-16. (in Chinese)
[17] 傅华英, 张婷, 彭文静, 段瑶瑶, 许哲昕, 林艺华, 高三基. 甘蔗新品种(系)苗期白条病人工接种抗性鉴定与评价. 作物学报, 2021, 47(8): 1531-1539.
FU H Y, ZHANG T, PENG W J, DUAN Y Y, XU Z X, LIN Y H, GAO S J. Identification of resistance to leaf scald in newly released sugarcane varieties at seeding stage by artificial inoculation. Acta Agronomica Sinica, 2021,47(8): 1531-1539. (in Chinese)
[18] ROTT P, FLEITES L, MARLOW G, ROYER M, GABRIEL D W. Identification of new candidate pathogenicity factors in the xylem-invading pathogenby transposon mutagenesis. Molecular Plant-Microbe Interactions, 2011, 24(5): 594-605.
[19] 肖春芳, 王甄, 张等宏, 闫雷, 沈艳芬. 不同马铃薯品种对晚疫病的田间抗性评价. 中国植保导刊, 2022, 42(5): 44-48+19.
XIAO C F, WANG Z, ZHANG D H, YAN L, SHEN Y F. Field resistance evaluation of potato cultivars to late blight. China Plant Protection, 2022, 42(5): 44-48+19. (in Chinese)
[20] ZHU Y, ABDELRAHEEM A, WHEELER T A, DEVER J K, WEDEGAERTNER T, HAKE K D, ZHANG J F. Interactions between cotton genotypes and Fusarium wilt race 4 isolates from Texas and resistance evaluation in cotton. Crop Science, 2021, 61(3): 1809-1825.
[21] 赵丽红. 棉花黄萎病抗性评价关键技术及分子检测方法研究[D]. 北京: 中国农业科学院, 2016.
ZHAO L H. Study on key technology of cotton verticillium wilt resistance evaluation and molecular identification method[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[22] REIS E M, ZANATTA M, CARREGA P, PEIS A C. Asian soybean rust control efficacy calculated with AUDPC and with final severity data. Summa Phytopathology, 2022, 48(1): 28-31.
[23] IRFAQ M, AJAB M, MA H X, KHATTAK G. Assessment of genes controlling area under disease progress curve (AUDPC) for stripe rust (F. Sp.in two wheat (L.) crosses. Cytology Genetics, 2009, 4: 25-38.
[24] ZHANG R Y, WANG X Y, SHAN H L, LI J, LI W F, CANG X Y, LUO Z M, YIN J, HUANG Y K. Identification and phylogenetic analysis of(Ashby) dowson based on multiple gene sequences in Yunnan Province, China. Sugar Tech, 2019, 21(5): 1-8.
[25] NTAMBO M S, MENG J Y, ROTT P C, ROYER M, LIN L H, ZHANG H L, GAO S J. Identification and characterization ofcausing sugarcane leaf scald in China using multilocus sequence analysis. Plant Pathology, 2019, 68(2): 269-277.
[26] 李文凤, 单红丽, 张荣跃, 仓晓燕, 王晓燕, 尹炯, 罗志明, 黄应昆. 广西蔗区检测发现检疫性病害甘蔗白条病. 中国农学通报, 2018, 34(13): 144-149.
LI W F, SHAN H L, ZHANG R Y, CANG X Y, WANG X Y, YIN J, LUO Z M, HUANG Y K. Sugarcane leaf scald disease found in Guangxi sugarcane region. Chinese Agricultural Science Bulletin, 2018, 34(13): 144-149. (in Chinese)
[27] RICAUD C, RYAN C, RICAUD C, EGAN B T, GILLASPIE A G, HUGHES C G. Disease of sugarcane major disease. Amsterdam: Elsevier Science Press, 1989: 39-58.
[28] COMSTOCK J C. Outbreak of leaf scald of sugarcane, caused by, in Florida. Plant Disease, 1992, 76(4): 426.
[29] CERVANTES-ROMERO B, PEREZ-RODRIGUES P, ROTT P, VALDEZ-BALERO A, SILVA-ROJAS H V. Distribution, phylogeny, and pathogenicity ofcausing sugarcane leaf scald in mexico. Crop Protection, 2021, 150(2): 105799.
[30] PAN Y B, GRISHAM M P, BURNER D M. A polymerase chain reaction protocol for the detection of, the causal agent of sugarcane leaf scald disease. Plant disease, 1997, 81(2): 189-194.
[31] LAKSHMANAN P, GEIJSKES R J, AITKEN K S, GROF C L P, BONNETT G D, SMITH G R. Sugarcane biotechnology: the challenges and opportunities. In Vitro Cellular Developmental Biology Plant, 2005, 41: 345-363.
Evaluation of Resistance to Leaf Scald Disease in Different Sugarcane Genotypes
DU JinXia, LI YiSha, LI MeiLin, CHEN WenHan, ZHANG MuQing
College of Agriculture, Guangxi University/State Key Laboratory of Conservation and Utilization of Subtropical Agro-Bioresources/ Guangxi Key Laboratory of Sugarcane Biology, Nanning 530005
【Objective】Sugarcane leaf scald disease is an important bacterial disease affecting sugarcane yield. Selection of disease-resistant genotypes can effectively reduce the incidence of this disease. This study aimed to explore the leaf-scald resistance of sugarcane genotypes, standardize resistance evaluation method, and provide a basis for the selection and utilization of germplasm resources of sugarcane. 【Method】JG43 isolated from Guitang 46, was used as inoculum on 70 different sugarcane genotypes using the decapitation method by placing 500 mL of bacterial suspension on the surface previously cut above the apical meristem with scissors dipped in the inoculum suspension of 108CFU/mL. The disease incidence (IC) was calculated at 14, 28, 42, 56, and 70 days post-inoculation (Dpi). The disease index (DI) and the area under the disease progress curve (AUDPC) were calculated according to the disease severity of leaf scald in sugarcane. Variance, principal component, and discriminant analysis were performed using SPSS 25.0 software. Among them, a general linear model procedure (PROC) and the square sum model of type III were used to analyze the variance, with IC, DI and AUDPC as dependent variables, genotype, block and days post-inoculation as fixed factors. After the original data were processed by standardization (Z-score), principal component analysis was carried out by KOM and Bartlett sphere test. The Euclidean metric was calculated for cluster analysis using the WPGMA method of DPS 9.50 software. The discriminant analysis was performed to evaluate the clustering results according to Fisher’s criterion. 【Result】Some genotypes displayed white pencil lines at 14 dpi, then gradually expanded to the edge at 28 dpi. The leaves began yellowing or albinism from the edge to the veins at 42 dpi, then curled inward and died at 56 dpi. The severely infected plant withered and eventually died at 70 dpi. Variance analysis exhibited highly significant effects for IC, DI, and AUDPC among genotype (Gen), days post-inoculation (Dpi), and their interactions effect (Gen × Dpi) (<0.01). Approximately 42% of the total sum of square was attributed to Dpi effect, indicating significant differences among genotypes resistance across the days post-inoculation. At 56 dpi, the disease reached a steady plateau, and the data in this period could be better divided among sugarcane genotypes. The results of discriminant and cluster analysis showed that 70 genotypes were divided into five different groups, including 15 highly resistant, 14 resistant, 15 moderate, 11 susceptible, and 15 highly susceptible genotypes. 【Conclusion】The resistance of sugarcane genotypes to leaf scald was assessed using the decapitation method, the IC, DI and AUDPC at 56 dpi were used as the evaluation indicators. The combined method of clustering and discriminant analysis could improve the accuracy of clustering results. Fifteen genotypes of high resistance to leaf scald were assessed and used for the sugarcane breeding program in China, including Zhongzhe 9, Zhongzhe 4, Zhongzhe 2, GUC19, GUC8, Yunrui 03-103, Yunrui 05-649, Yunrui 05-182, Yunrui 05-367, Yunrui 89-159, Funong 11601, Funong 09-4059, Guitang 02-467, Guitang 08-297, ROC22.
sugarcane; leaf scald; disease resistance; cluster analysis; principal component analysis; discrimination analysis

10.3864/j.issn.0578-1752.2022.21.003
2022-07-18;
2022-08-11
广西科技基地和人才专项(2020AC18001)、国家糖料产业技术体系(CARS170109)
杜金霞,E-mail:2448603739@qq.com。通信作者张木清,E-mail:zmuqing@163.com
(责任编辑 李莉)

