Wnt5a介导Wnt/Ca2+通路对BCG诱导牛原代肺泡上皮细胞自噬的调控作用
陈 琪,杜长征,郑雪迪,马伯利,徐金瑞*,杨 易*
(1.宁夏大学 西部特色生物资源保护与利用教育部重点实验室,银川 750021;2.宁夏大学生命科学学院,银川 750021)
2021年世界卫生组织(WHO)发布的《2021年全球结核病报告》显示,2020年全球结核潜伏感染人群近20亿,新发结核病(tuberculosis,TB)患者约987万,发病率为127/10万,我国估算结核病发病数位居世界第2位,死亡率为2.1/10万,由于新型冠状病毒肺炎(COVID-19)大流行,结核病死亡人数出现了十余年来的首次增加[1]。结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)是结核病的致病菌,其通过宿主代谢和能量代谢途径侵扰受感染细胞的自噬和凋亡[2],Mtb可侵入机体各种器官,主要是肺,引起肺结核[3]。肺泡上皮细胞(alveolar epithelial cells,AECs)是抵抗外来物入侵的第一道防线,在肺免疫中担负着由先天免疫到获得性免疫的桥梁作用[4]。Mtb在AECs内有更高的复制增殖能力,刺激AECs分泌各种细胞因子,产生细胞毒性,以促进Mtb的传播和结核病的发生与发展[5]。虽然目前有多种方法来分离AECs,但仍未有一种公认的方法能够得到纯度高且产量大的上皮细胞,因此,探讨高效分离培养原代AECs的方法对肺功能特性研究意义重大。
自噬在维持细胞体内平衡中起着至关重要的作用,在调控细胞命运和抗感染性疾病进程中至关重要[6]。Wnt5a是Wnt蛋白家族成员之一,通过与膜受体或共受体复合物结合激活细胞中磷酸化蛋白传递信号,既作用于经典Wnt/β-catenin信号通路,又活化非经典Wnt信号通路[7]。Wnt5a通过激活钙/钙调蛋白依赖的蛋白激酶II(calcium/calmodulin-dependent protein kinase II,CaMKII)及钙调磷酸酶的作用,促进细胞内Ca2+释放,使胞内Ca2+浓度升高,活化T细胞核因子(nuclear factor of the activated T cell, NFAT),发挥抑癌作用[8-9]。胞内Ca2+在自噬调控中起着重要作用[10],也在结核发病机制中起着至关重要的作用,Mtb操纵Ca2+信号以阻止吞噬体成熟及吞噬体和溶酶体融合的能力被广泛研究[11],特异性阻断Ca2+显著减少自噬小体的形成,且升高Mtb细菌载量,表明Ca2+在Mtb胞内存活和细胞自噬中发挥重要作用[12]。但Ca2+在Mtb感染过程中调节自噬的确切作用尚不清楚,因此,探讨Wnt5a是否通过非经典Wnt/Ca2+信号通路调控BCG感染的BAECs细胞自噬,对宿主导向的抗结核治疗方法的研究具有重要意义。
本课题组前期已证明Wnt5a对BCG感染的小鼠肺上皮细胞自噬有调控作用[13],因此,本研究通过分离BAECs,用BCG感染BAECs建立模型,抑制Wnt5a的表达处理,Western blot和免疫荧光染色检测自噬相关蛋白及非经典Wnt/Ca2+信号通路相关因子的蛋白水平表达,以明确Wnt5a对BCG感染的BAECs细胞自噬的调控机制,为肺结核治疗和预防提供新视角。
1 材料与方法
1.1 试验材料
成年健康牛肺组织。
1.2 主要试剂及仪器
硫酸链霉素、氨苄青霉素(Amersco,美国),两性霉素(Sigma,美国),胶原酶I(Gibco,美国),RNase-Free DNase I、红细胞裂解液(天埂生化科技有限公司),Biolaminin包被液(上海逍鹏生物科技有限公司),Wnt5a特异性抑制剂Box-5(Sigma,美国),DMEM/F12培养基(BI,美国),胎牛血清及TrypleTM胰酶(Gibco,美国),青霉素/链霉素溶液(北京索莱宝科技有限公司),全蛋白提取试剂盒(赛默飞世尔科技有限公司),BCA蛋白含量检测试剂盒(南京凯基公司),脱脂奶粉(BD,美国),一抗Cytokeratin14、Cytokeratin5、Atg5、P62、内参GAPDH兔多克隆抗体、二抗HRP-Goat、LC3荧光一抗和山羊抗兔荧光二抗(Proteintech,美国),LC3一抗(CST,美国),Atg7一抗(Abcam,美国),预染彩虹蛋白Marker(大连美伦生物技术有限公司),ECL 显影液(环亚生物科技有限公司),4%多聚甲醛(BD,美国),Triton X-100(Sigam,美国),封闭用驴血清、含DAPI 的荧光封片剂(北京索莱宝科技有限公司)。CO2细胞培养箱(SANYO,日本),全自动细胞计数仪(Bio-Rad美国),高通量组织细胞破碎仪(北京仪嘉林科技有限公司),电转仪和电泳仪(Bio-Rad,美国),GE化学发光检测仪(Gene,美国),光学显微镜(Motic公司,中国),荧光显微镜(Olympics,日本)。
1.3 结核分枝杆菌BCG来源及培养
将购自成都生物制品研究所有限公司牛结核分枝杆菌卡介苗(BCG)疫苗株粉末用7H9培养液(含0.2% Tween-80和10% ADC)溶解重悬,置于细胞培养瓶中于饱和湿度、5% CO2、37 ℃恒温培养箱中培养,待达到对数生长期时进行感染试验。
1.4 牛原代肺泡上皮细胞的分离培养
参考Xu等[14]和廖伟等[15]分离原代肺上皮细胞的方法,并进一步优化:取成年健康牛肺组织,纵切支气管并切成小块,置于无菌50 mL离心管,加入预冷的PBS(含双抗及两性霉素B)漂洗至洗液澄清。将组织块置于预冷消化液(PBS+20% DMEM+15%胎牛血清+5%双抗+1 g·L-1胶原酶I+胰酶+10 mg·L-1DNase I+2.5 mg·L-1两性霉素B),放入4 ℃冰箱消化至出现浑浊,加等体积PBS终止消化。将管腔面向上,刮刷管腔,收集洗液,1 000 r·min-1离心5 min,加入红细胞裂解液去除红细胞,补加DMEM/F12培养液(DMEM/F12+12%胎牛血清+1%双抗)于200目细胞筛过滤,接种于培养皿中2~4 h,使易于贴壁的成纤维细胞等贴壁。收集未贴壁的细胞悬液,1 000 r·min-1离心5 min,用含DMEM/F12培养液重悬,接种于提前用Biolaminin包被液包被的培养皿中,饱和湿度下,5% CO2,37 ℃培养。
1.5 BAECs鉴定
将分离的细胞以2×105个·孔-1接种于提前放置玻璃片的12孔板中贴壁8 h,弃培养液,PBS漂洗, 5 min×3;4% 多聚甲醛固定20 min,同上PBS漂洗;0.2% TritonX-100通透细胞20 min,PBS漂洗;10% 驴血清/PBS封闭1 h,PBS润洗,5 min×2;37 ℃静置孵育CK14和CK5一抗(稀释比 200∶1)2 h,PBS洗涤后37 ℃避光孵育荧光二抗(稀释比100∶1)30 min,PBS洗涤3次后用含DAPI 封片剂染核指甲油封片,荧光显微镜观察结果。
1.6 BCG感染及抑制Wnt5a处理BAECs
待BAECs生长至80%左右时,用胰酶消化后台盼蓝染色计数,将细胞以4×105个·孔-1接种于6孔板培养皿,贴壁8 h,弃培养基,补加1 mL培养液,根据已有试验[13]基础用感染复数10∶1的BCG感染BAECs 4 h,设置对照组(C组)和BCG感染组(BCG);不同浓度Wnt5a特异性抑制剂Box-5处理BAECs 6 h收样,设置对照组(C组)及Box-5浓度为5、10、30、50和100 μmol·L-1处理组;用适宜浓度Box-5预处理BAECs 2 h,BCG继续感染BAECs 4 h(MOI=10),设置对照组(C组),BCG感染组(BCG),Box-5 抑制剂组(Box-5)和抑制剂与BCG共处理组(Box-5+BCG)。
1.7 总蛋白提取及Western blot检测
将不同处理组BAECs用PBS缓冲液润洗2次,每孔加100 μL全蛋白裂解液,置于4 ℃摇床15 min,使细胞充分裂解。将细胞刮下,收集于提前加了细胞磁珠的1.5 mL离心管中,置于细胞破碎仪破碎1 min左右至裂解液澄清,于低温离心机离心(4 ℃,14 000 r·min-1,15 min),收集上清液。BCA检测试剂盒测定蛋白浓度后定量加入上样缓冲液,于沸水浴灭活5 min后于-20 ℃保存备用。将30 μg变性蛋白经SDS-PAGE电泳后,湿转至PVDF膜上,用含5% 脱脂奶粉的TBS室温封闭2 h,TBS洗涤,4 ℃过夜孵育一抗,TBST洗涤,室温孵育二抗2 h, TBST洗涤,加ECL化学发光液,用GE化学发光检测仪记录蛋白条带。
1.8 免疫荧光染色检测
将BAECs以2×105个·孔-1接种于提前放置玻璃片的12孔板中贴壁8 h,同“1.6”处理,弃培养基用PBS洗涤2次,用4%多聚甲醛室温固定20 min,PBS洗涤5 min×3,0.2% Triton X-100通透 20 min,PBS洗涤5 min×3,用10%的驴血清室温静置封闭1 h,PBS洗涤5 min×2,37 ℃静置孵育LC3一抗(一抗稀释液按照稀释比200∶1稀释)2 h,PBS洗涤5 min×3,37 ℃避光孵育荧光二抗(PBS按照稀释比100∶1)30 min,PBS洗涤5 min×3,用含DAPI 封片剂染核指甲油封片,荧光显微镜观察结果。
1.9 统计学分析
2 结 果
2.1 牛肺泡上皮细胞的分离培养
对牛肺组织进行细胞分离,在培养36 h视野中出现明显的细胞团(图1A),第一代细胞经胰酶消化离心重悬后,用台盼蓝染色计数发现细胞活率均在85%~92%之间,显微镜观察传代培养24 h细胞形态(图1B)。
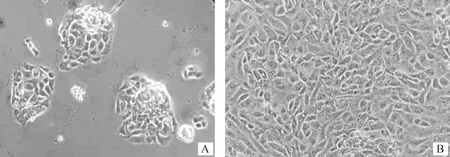
A. 分离培养36 h原代细胞;B. 传代培养24 h的原代细胞
2.2 牛肺泡上皮细胞鉴定
2.2.1 免疫荧光染色检测CK14的表达 为了鉴定分离肺细胞类型,依据上皮细胞类型的特异性表面标记抗原,CK14是一种具有特异性的上皮标记蛋白[16],免疫荧光染色检测CK14的表达,结果发现绝大部分细胞表达CK14(图2),提示分离的肺细胞是BAECs。

免疫荧光染色检测细胞CK14的表达,CK14为绿色,DAPI为蓝色;A~C. 放大倍数100;D~F. 放大倍数200
2.2.2 免疫荧光染色检测角蛋白5的表达 CK5为细胞骨架中间丝蛋白,具有维持上皮细胞形态完整性作用,免疫荧光染色检测CK5的表达,结果显示绝大部分细胞表达CK5(图3),进一步表明分离的细胞是BAECs。
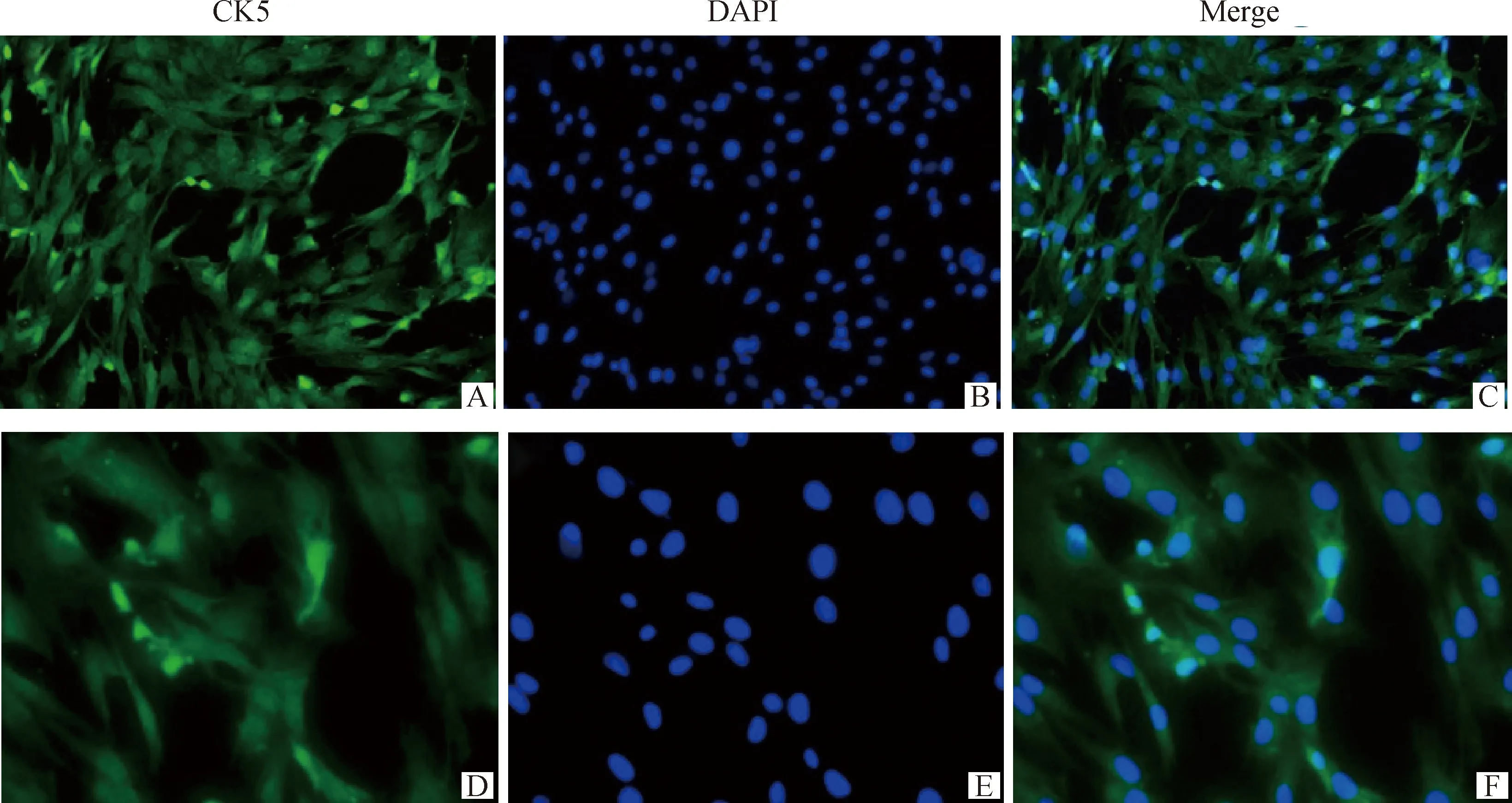
免疫荧光染色检测细胞CK5的表达,CK5为绿色,DAPI为蓝色;A~C. 放大倍数100;D~F. 放大倍数200
2.3 BCG感染对BAECs自噬相关蛋白及Wnt5a表达的影响
为确定BCG感染BAECs的细胞自噬及Wnt5a表达水平,用BCG感染BAECs后,Western blot检测细胞内Wnt5a及自噬相关因子 LC3蛋白水平表达。结果显示,相较对照组(C组),BCG组Wnt5a及自噬相关蛋白LC3II蛋白表达水平均显著升高(P<0.01,图4),表明BCG感染BAECs上调Wnt5a表达水平,增加细胞自噬。
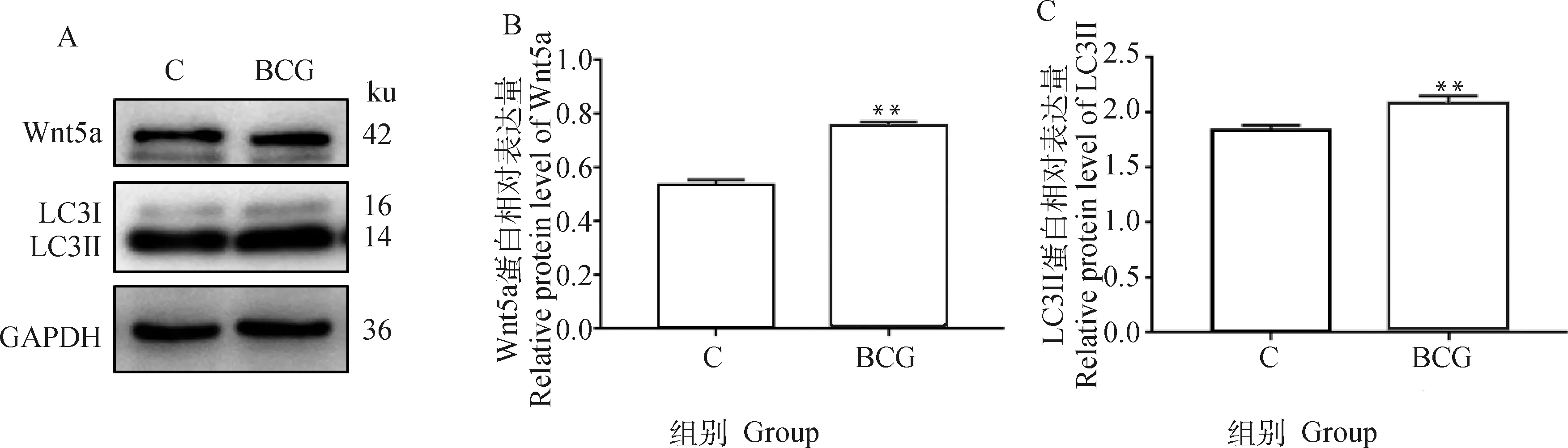
A. 蛋白表达印迹图;B、C.直方图。**. P<0.01,下同
2.4 不同浓度Box-5作用BAECs后Wnt5a及细胞自噬相关蛋白的表达
为了确定Wnt5a特异性抑制剂Box-5抑制Wnt5a的表达水平,不同浓度Box-5作用BAECs,Western blot检测胞内Wnt5a及自噬相关蛋白LC3表达水平显示,Box-5浓度为50 μmol·L-1时Wnt5a的表达水平显著低于其他组(P<0.001),且LC3II较C组(0 μmol·L-1)显著升高(P<0.001,图5)。因此确定Box-5处理浓度50 μmol·L-1为抑制BAECs中Wnt5a表达的最适浓度。
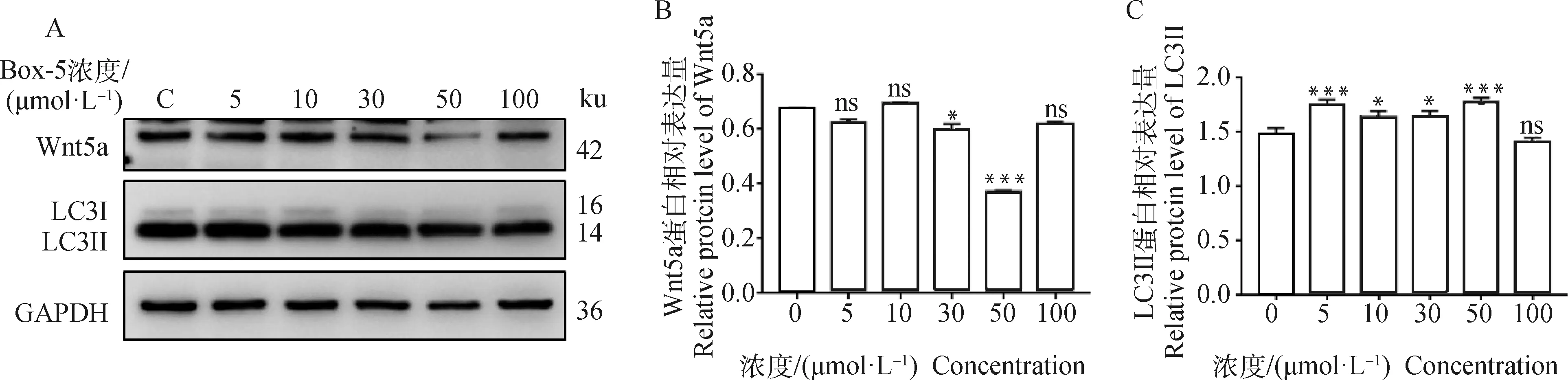
A. 蛋白表达印迹图;B、C. 直方图。ns.无差异;*. P<0.05;***. P<0.001。下同
2.5 Wnt5a对BCG诱导BAECs自噬相关蛋白表达的影响
为确定Wnt5a对BCG感染BAECs自噬的调控作用,用Box-5与BCG单独或共处理BAECs,Western blot检测自噬相关蛋白LC3、Atg5、Atg7及P62的表达水平,结果显示, Box-5+BCG组较BCG组自噬相关因子LC3II、Atg5、Atg7及P62的蛋白水平表达均明显降低(P<0.01,图6)。表明Wnt5a对BCG诱导的BAECs细胞自噬有调控作用,且抑制Wnt5a的表达下调BCG诱导的BAECs细胞自噬。
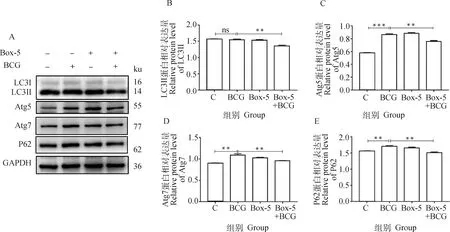
A. 蛋白表达印迹图;B~E. 直方图
2.6 Wnt5a对BCG诱导BAECs自噬体形成的影响
LC3是自噬体成膜过程中的重要参与因子,被用来作为自噬体形成的标记[18],自噬形成时,RFP-LC3 融合蛋白转位至自噬体膜,在荧光显微镜下形成荧光斑点。为了进一步探究Wnt5a对BCG感染的BAECs细胞自噬的调控作用,免疫荧光染色检测BAECs内LC3绿色荧光斑点数量及亮度。结果显示,BCG感染BAECs内LC3荧光斑点(绿色)数量与荧光强度较C组均明显增加,且Box-5+BCG 组较BCG 组细胞荧光斑点数量和强度均明显降低(图7)。表明抑制Wnt5a对BCG感染BAECs细胞自噬体的形成有抑制作用,进一步证明抑制Wnt5a的表达下调了BCG诱导的BAECs细胞自噬。
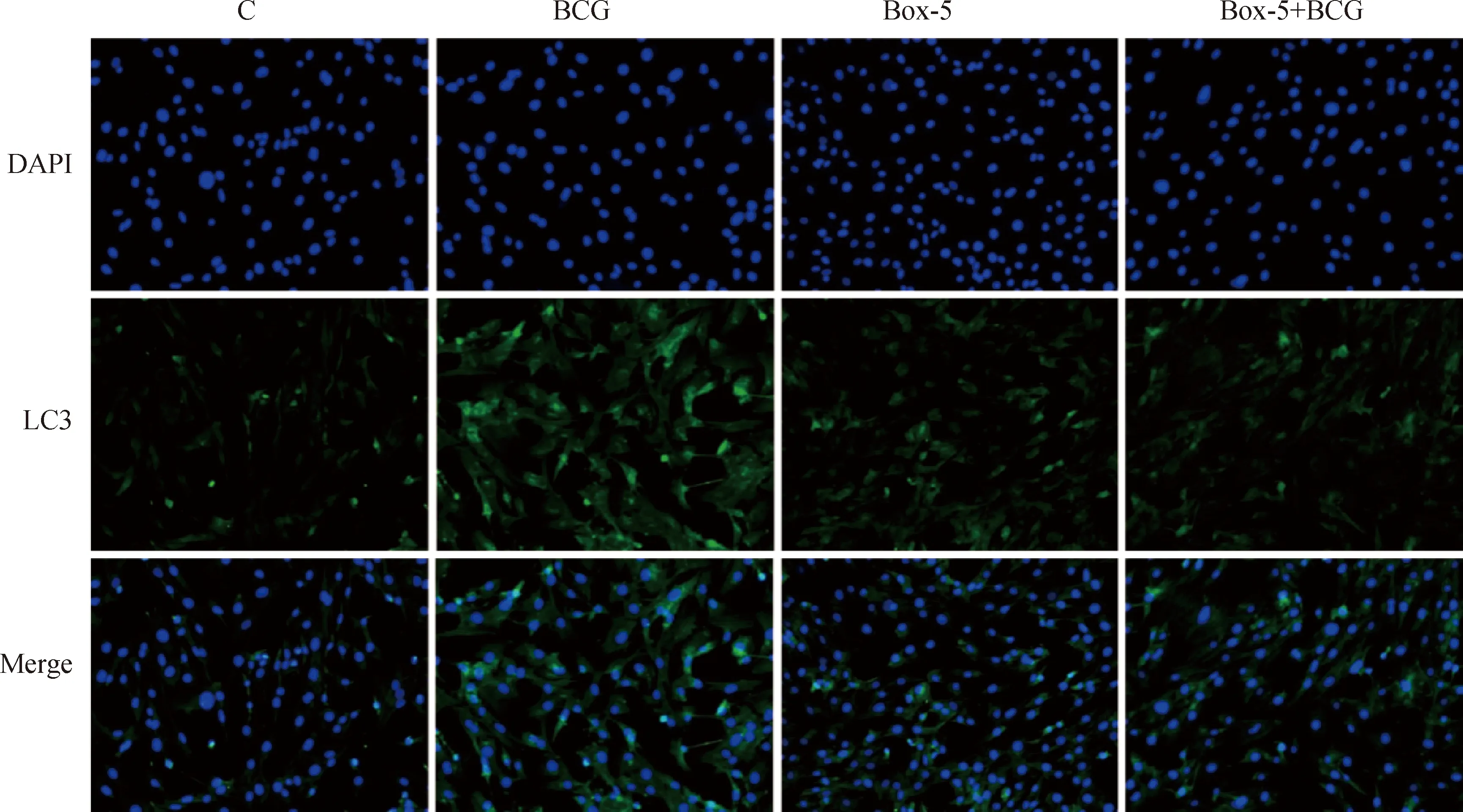
免疫荧光检测细胞内LC3的表达,LC3为绿色,DAPI为蓝色,放大倍数100
2.7 Wnt5a调控BCG诱导的BAECs细胞自噬机制
为了探讨Wnt5a调控BCG感染的BAECs细胞自噬机制,用Box-5及BCG单独或共处理BAECs,Western blot检测非经典Wnt/Ca2+通路相关因子Wnt5a、CaMKII及NFAT蛋白水平表达。结果显示,BCG感染BAECs内Wnt5a、CaMKII及NFAT的蛋白水平较C组均升高(P<0.05),Box-5+BCG组相较于BCG组Wnt5a、CaMKII及NFAT的蛋白水平均降低(P<0.05,图8),结果表明,Wnt5a介导非经典Wnt/Ca2+通路调控BCG诱导的BAECs细胞自噬。

A. 蛋白表达印迹图;B. 直方图
3 讨 论
结核病是由Mtb感染引发通过呼吸道传播的人畜共患传染病,也是世界上最致命的单一病原体死因,肺结核为最常见的结核病[19]。肺作为机体与外界之间的主要屏障,通过不同类型上皮细胞组成一层连续的上皮细胞层,构成对吸入物质和病原体的物理和生物屏障[20],肺上皮细胞是抵御肺部感染的第一道防线,具有防止病原体和毒素侵害的作用[21],也是微生物防御的积极效应器,对肺的先天免疫功能和适应性免疫功能都起着重要的作用[22]。目前分离BAECs方法有机械分散法、组织块培养法和酶消化分离法等,各有优缺点[23-24]。本研究采用酶联合消化法和机械刮刷法获取BAECs,而在分离BAECs过程中可能混合其他细胞(如纤维细胞和肌肉细胞等),利用不同细胞贴壁时间不同,差速贴壁纯化BAECs。角蛋白(cytokeratin,CK)是细胞骨架中间丝蛋白,特异性表达于上皮细胞,其在维持上皮细胞形态完整性中扮演重要角色[25-26],研究表明,CK14是上皮细胞基底细胞特异性表面标记抗原[27-28],CK5为细胞骨架中间丝蛋白,具有维持上皮细胞形态完整性作用,因此,本研究将CK5和CK14作为鉴定上皮细胞的标记,采用免疫荧光鉴定分离的细胞,发现分离纯化的上皮细胞纯度极高,因此,本研究提供了一种纯度较高的分离BAECs的方法,对探究牛属动物结核病感染及发病机制具有重要作用。
自噬是一种细胞内分解代谢过程,通过溶酶体降解过程维持体内平衡或清除入侵的病原体,自噬及其相关途径是免疫和炎症的中心稳态机制[29]。Wnt5a是一种主要的非经典Wnt配体,存在于上皮细胞中[30],Wnt5a 介导相关自噬通路是宿主细胞先天免疫的重要组成部分,也是限制病原菌感染的关键[31]。ESAT-6分泌系统-1(ESX-1)作为Mtb毒力决定因子,ESX-1基因是阻止吞噬体成熟的关键,由RD1基因位点编码,缺乏RD1是导致BCG毒力减弱的原因,也是诱导细胞自噬关键[32]。因此,研究Wnt5a与自噬的关系对肺结核的预防和治疗具有现实意义。本研究探讨抑制胞内Wnt5a对BCG感染BAECs细胞自噬的影响,结果表明Wnt5a对BCG诱导的BAECs细胞自噬有调控作用,且抑制Wnt5a的表达下调了BCG诱导的BAECs细胞自噬。进一步探究 Wnt5a对 BCG诱导BAECs细胞自噬的调控机制对结核预防和治疗具有重要意义。
Wnt5a与细胞膜上的Fzd受体和Ror2受体结合,通过CaMKII及钙调磷酸酶的作用,引起细胞内Ca2+浓度的增加,进而激活非经典Wnt/Ca2+信号途径。Ca2+在结核发病机制中起着至关重要的作用,Mtb操纵Ca2+信号以阻止吞噬体成熟及吞噬体和溶酶体融合的能力已被广泛研究[33]。Kim等[34]在体外试验中发现Wnt5a/Ca2+信号通路在炎症内皮细胞中被激活,能迅速诱发COX-2、IL-6 及IL-8 等炎性因子的表达;BLANC等[35]发现,Wnt5a 通过Wnt/Ca2+信号参与神经母细胞瘤的发病;也有研究发现非经典Wnt5a/Ca2+/CaN/NFAT信号在胚胎手指细胞发育中发挥了关键作用[36],非经典Wnt/Ca2+信号途径成为目前研究的热点。本研究探究抑制Wnt5a对BCG感染BAECs的Wnt/Ca2+信号通路相关蛋白表达的影响,结果表明,Wnt5a介导非经典Wnt/Ca2+信号通路调控BCG诱导BAECs细胞自噬。根据是否有 mTOR信号参与可将自噬分为 mTOR 信号依赖性自噬和mTOR非依赖性自噬[37],异丙酚通过Ca2+/CaMKKβ/AMPK/mTOR通路抑制自噬而介导氧糖剥夺再充氧诱发的神经元损伤[38],细胞内Ca2+浓度的积累激活CaMKKβ/AMPK信号级联,导致mTOR信号抑制,从而诱导自噬[39],因此,Wnt5a/CaMKII对BCG诱导BAECs细胞自噬的调控所依赖的自噬通路有待进一步探究,这将为结核病预防和控制提供新依据。
4 结 论
应用胶原酶I、胰酶和DNase I酶联合消化法结合细胞刮刷法,成功分离培养纯度和活率较高的BAECs,BCG感染促进BAECs胞内Wnt5a的表达及细胞自噬,抑制Wnt5a的表达下调BCG诱导的BAECs细胞自噬,且Wnt5a介导非经典Wnt/Ca2+信号通路调控BCG诱导的BAECs细胞自噬。

