血浆和脑脊液中自身抗tau 抗体的自然发生规律及对阿尔茨海默病的启示
陈伟明,周丽华,徐武华
1广州市红十字会医院康复医学科(神内二区),广东 广州 510220;2广东三九脑科医院神经内科,广东 广州 510510
随着Aβ疫苗研究的纷纷失败,阿尔茨海默病(AD)的病因和发病机制变得更加扑朔迷离[1],但免疫疗法依然保留在最有潜力的AD防治选项之中[2-4]。课题组前期研究发现,自然发生的抗β淀粉样蛋白抗体(nAb-Aβ)高频率、无差别地出现在AD患者和正常人群的外周血中[5],且可能先于脑内Aβ斑块的形成,并在自然衰老过程中呈现出"U"型的年龄相关性变化[6]。另一方面,既往研究采用双抗原夹心的ELISA方法也先后证实nAb-tau存在于AD患者、其他类型痴呆患者及正常人外周血及脑脊液(CSF)中[7-8],但因样本量较小且均未针对该抗体的免疫特性进行更深入的研究并未引起足够的重视,其临床价值也迄今未明。本研究将分别采用Western blot和IHC两种方法分别论证nAb-tau在AD型痴呆、其他类型痴呆患者以及不同年龄段认知正常者外周血和CSF中的发生率以及免疫特性,以期从脑内tau免疫应答的角度洞悉AD的病理机制,并探讨其作为AD生物学诊断标志物的科学性和可行性。
1 资料与方法
1.1 一般资料
2006~2018年于广州市红十字会医院康复医学科住院的95名痴呆患者及93名NC受试者中,选取5例AD患者、5例OD患者和10例NC受试者。同时获得血浆和CSF标本,并进一步行Western blot检测,20例NC组患者血浆进行IHC,其中OD组包括3例血管性痴呆、1例额颞叶痴呆及1例帕金森病痴呆。AD组纳入标准:AD诊断符合美国国立神经病学与语言障碍、卒中和阿尔茨海默病及相关疾病协会规定[9];OD组纳入标准:符合美国国立神经疾病与脑卒中研究所制定的诊断标准,血管性痴呆、额颞叶痴呆及帕金森病痴呆分别符合其相应诊断标准[9-11];NC组纳入标准:体格查体和神经心理学检查均排除痴呆的诊断。排除标准:患有严重的肝肾功能损伤、急性心肌梗死、恶性肿瘤及其他危及生命的疾病者。本研究得到广州市红十字会医院伦理委员会批准同意,所有的研究对象入组前均得到充分告知并签署了知情同意书。
1.2 实验方法
1.2.1 样品采集 收集部分患者在冻存的入院48 h内行腰椎穿刺术留取CSF 2.5 mL,4 ℃,3000 r/min 离心20 min,分离上清,置于-80℃冰箱保存,待测。收集患者在冻存的入院48 h内全血5.0 mL,4 ℃,3000 r/min离心20 min,分离上清制备成血浆,置于-80℃冰箱保存,待测。
1.2.2 Western blot法检测血浆和CSF中的nAb-tau 将人工合成的全氨基酸序列的Tau441 蛋白(Abcam,0.2 μg/L)配置成20 μL定量上样量加入SDS-PAGE凝胶,140V电泳分离后转移至PVDF膜,2%牛奶液(BIO-RAD)封闭非特异性结合后,分别置于AT-8(ThermoFisher Sci.,1∶1000)、CSF(1∶5000)、血浆(1∶1000)稀释液和PBS中,4 ℃孵育过夜。洗膜后,滴加辣根过氧化物酶标记山羊抗小鼠IgG(碧云天,1∶2000),室温孵育1 h,光化学显色法检测免疫反应带,采用Image lab6.0软件测量灰度值。
1.2.3 IHC检测nAb-tau的组织免疫学特性(1)Tg2576小鼠(雄性,体质量20~25 g,SPF级)脑组织切片制备:Tg2576小鼠处死后取一侧大脑半球制备成石蜡标本,切成5 μm厚的连续切片,4 ℃保存备用;(2)5 μm厚的Tg2576小鼠脑组织连续石蜡切片,常规脱蜡至水,微波修复抗原。分别采用AT-8(ThermoFisher Sci.,1∶400)、血浆(1∶100)、CSF(1∶100)和PBS 作为一抗,辣根过氧化物酶标记山羊抗小鼠IgG(碧云天,1∶50)作为二抗,DAB显色,苏木素复染细胞核,显微镜下肉眼判断染色结果。
1.3 统计学分析
1.3.1 样本量估计 本研究欲探讨血浆和/或CSF 中nAb-tau与AD发病的相关性,采取分层抽样的方法,根据以往资料发现AD患者血浆/CSF中nAb-tau的检出率约为95%[7-8],以95%的可信度,要求结果落实在总体真实率的10%以内,根据公式:N=Z1-α/22(1-p)/ε2p估算样本量。该研究中,p=0.95,ε=0.1,α=0.05,则Z1-α/22=1.96,计算结果如下:N=1.962×(1-0.95)/0.12×0.95=20.21,因此共需20例,在实际研究中心最初共纳入20名研究对象。
1.3.2 统计学方法 所有实验数据均采用SPSS25.0软件进行统计,各组计量资料均以均数±标准差表示,两组间比较采用t检验,计数资料采用n(%)表示采用χ2检验(样本量≥40且理论频数≥5)或校正χ2检验(样本量≥40且1≤理论频数<5)或Fisher确切概率法(样本量<40);定量数据的多组间比较采用单因素方差分析方法,随后两组间差异的比较采用SNK-q和LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测血浆或CSF中nAb-tau蛋白表达
2.1.1 受试者临床资料的比较 3 组患者的性别、年龄、病程、CSF蛋白、CSF葡萄糖的差异无统计学意义(P>0.05);MMSE 平均得分AD、OD 组较NC 组降低(P<0.001),而AD组与OD组MMSE评分的差异无统计学意义(P=0.938),AD、OD组受试者颅脑MRI可见脑萎缩,NC组患者则不明显。3组临床特征(表1)及头颅MRI结果图示(图1)。
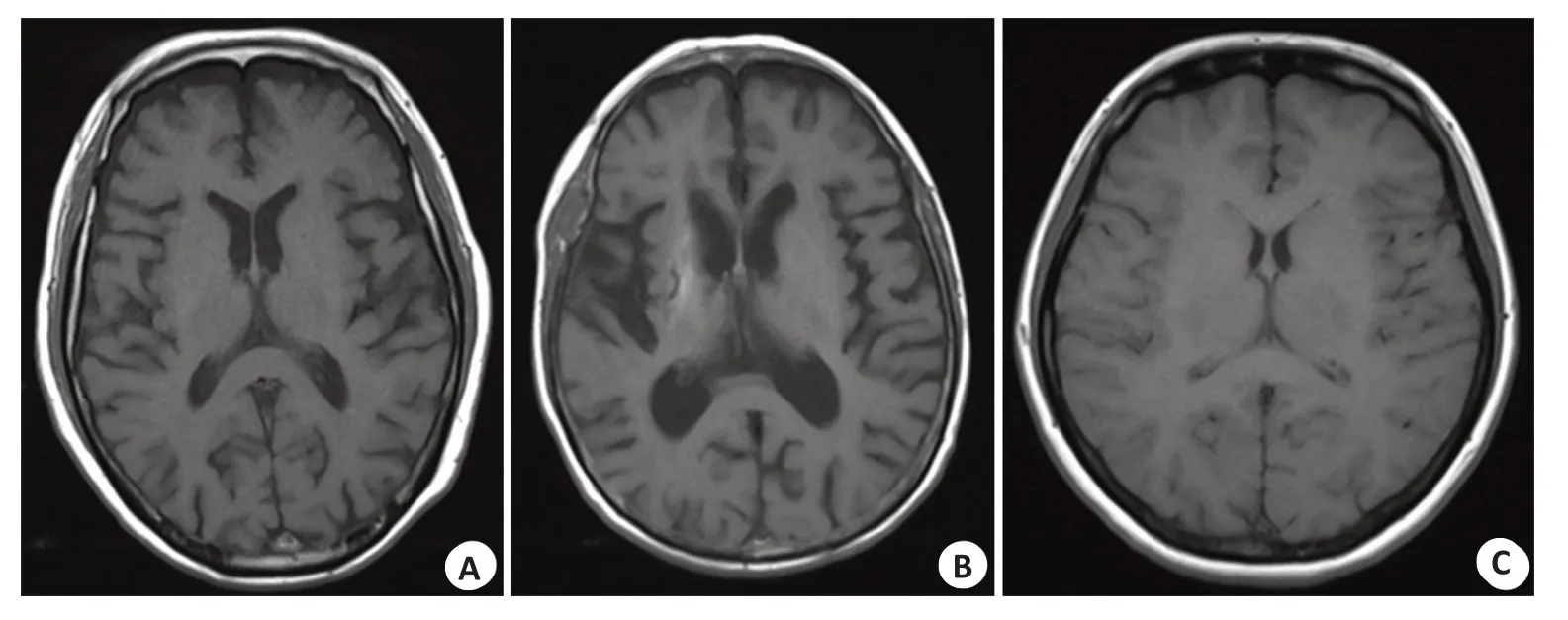
图1 3组患者头颅MRI结果Fig.1 MRI results of three groups.
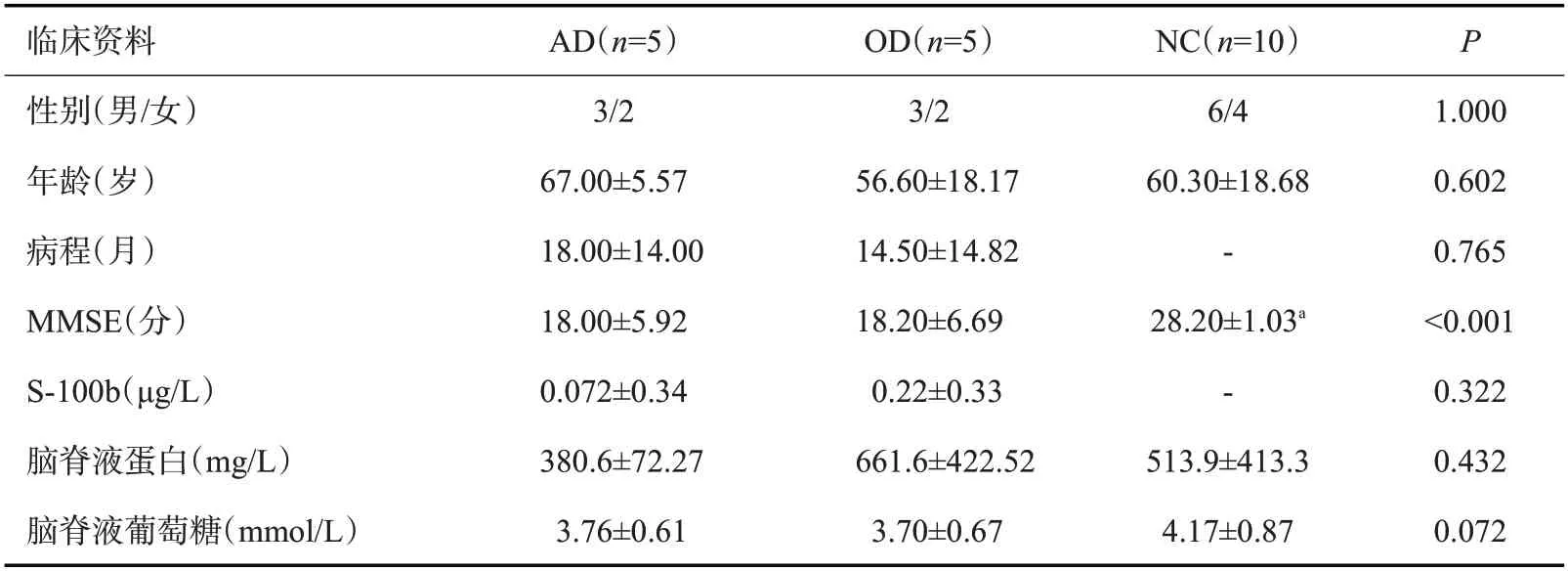
表1 3组患者的临床资料比较Tab.1 Comparison of clinical data of three groups(Mean±SD)
2.1.2 Western blot检测结果及其与MMSE分值的相关性 20份CSF标本及血浆标本分别来自AD、OD和NC组,其中19份(95%)CSF标本、2份(10%)血浆标本检出与AT-8相似的免疫阳性带(图2)。进一步分析发现,3组CSF中nAb-tau检出率差异无统计学意义(χ2=3.158,P=0.206,表2)。另外,2例阳性血浆均出现在NC组(2/10,20%),3组血浆中nAb-tau检出率差异无统计学意义(χ2=2.222,P=0.329,表3),nAb-tau检出率在CSF中较血浆增高(P<0.001),血浆和CSF的nAb-tau检出率与MMSE均分的差异无统计学意义(表4)。

表2 3组受试者CSFnAb-tau检出率的比较Tab.2 Comparison of detection rate of nAb-tau in CSF of three groups(n)
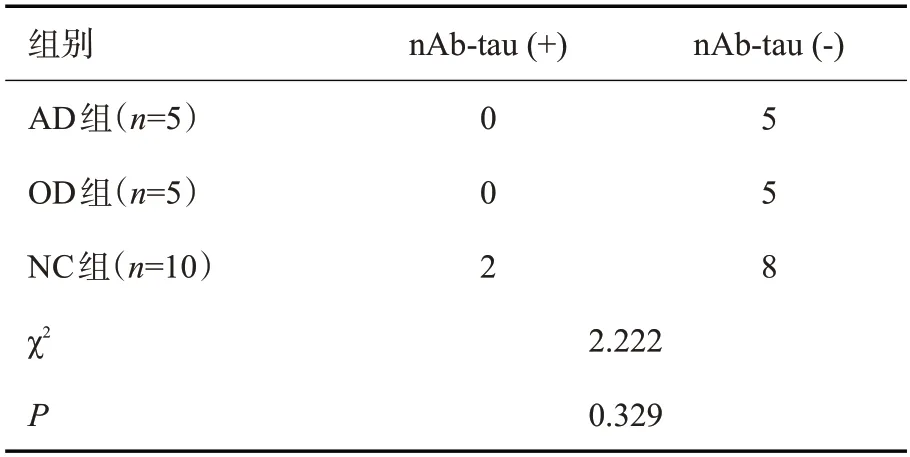
表3 3组受试者血浆nAb-tau检出率的比较Tab.3 Comparison of detection rate of nAb-tau in plasma of three groups(n)
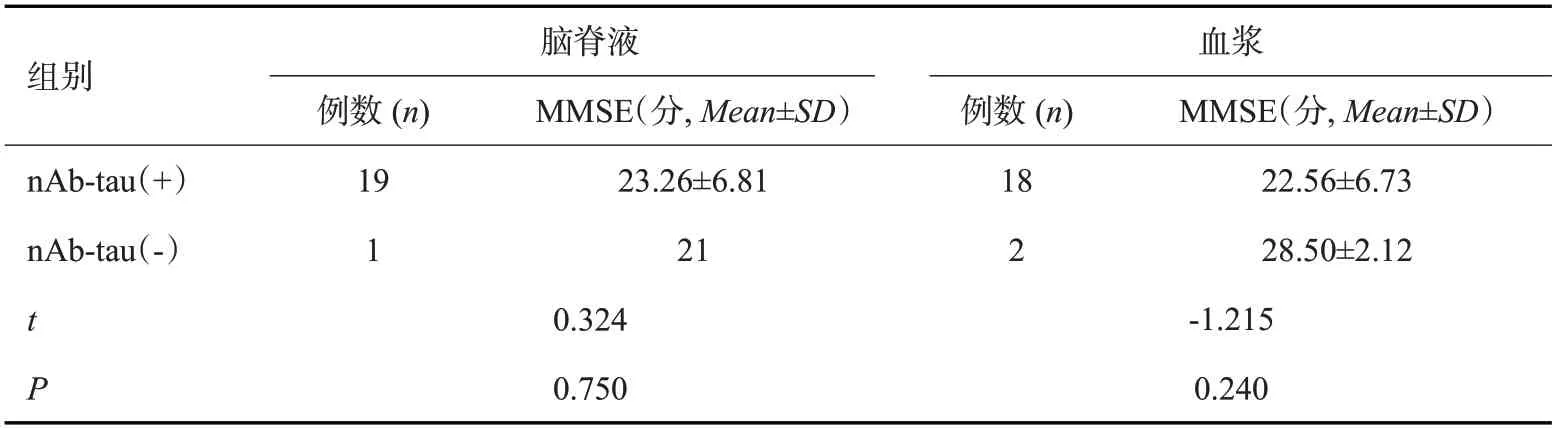
表4 3组受试者血浆/CSFnAb-tau检出率与MMSE均分相关性Tab.4 Correlation between the detection rate of nAb-tau in plasma/CSF and the average scores of MMSE in three groups
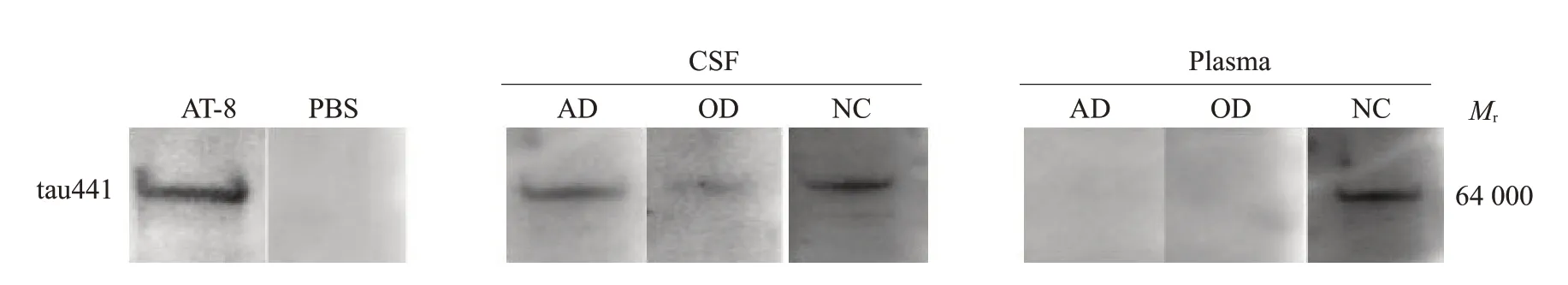
图2 血浆和CSFnAb-tau蛋白Western blot条带Fig.2 Western blot bands of nAb-tau protein in plasma and CSF.
3.2 IHC结果
为了解血浆nAb-tau在自然衰老过程中的发生规律,将20例0~80岁NC组患者血浆标本按~10岁一个年龄段分为7组(表5),鉴于61~70岁和71~80岁两个年龄段组仅有3例,故将其合并为61~80岁组。结果共检出11例(55%)阳性血浆,但各年龄组的阳性率的差异无统计学意义(χ2=4.512,P=0.608)。
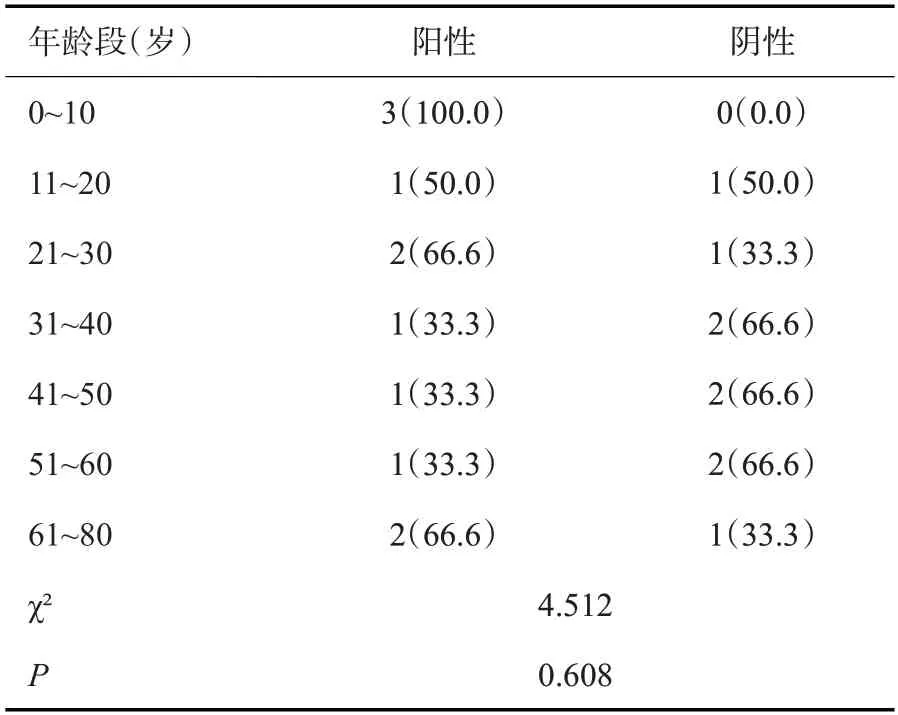
表5 不同年龄段NC组患者血浆免疫染色Tg2576小鼠脑组织切片的结果Tab.5 The results of plasma from different-aged normal controls immunostaining Tg2576 mice brain tissue sections[n(%)]
为进一步分析nAb-tau的免疫特性,分别随机选取Western blot(+)的CSF和血浆各1例、Western blot(-)的CSF和血浆各1例,进行IHC。结果显示Western blot(+)的CSF/血浆标本显示出与单克隆抗tau抗体AT-8相似的组织免疫特性,可清晰地识别Tg2576小鼠脑组织切片中的退变神经轴索(图3B、C),而Western blot(-)CSF/血浆则未见任何染色阳性的退变轴索。
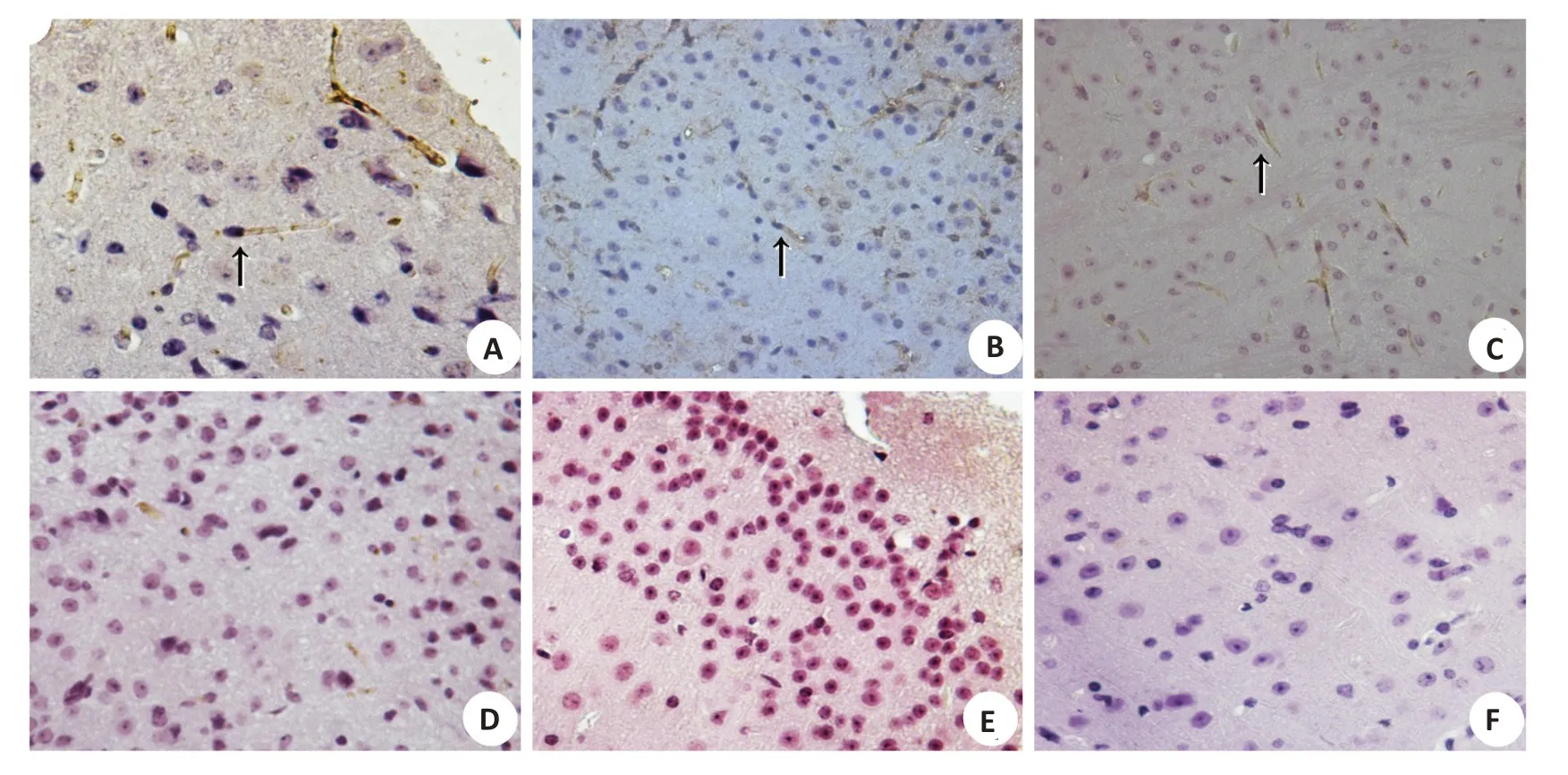
图3 血浆/CSF免疫染色Tg2576小鼠脑组织切片结果(IHC染色,×400)Fig.3 The results ofplasma/CSF immunostaining Tg2576 mice brain tissue sections(IHC staining,×400).
3 讨论
在诸多AD病理机制假说中,异构化的Aβ蛋白和tau蛋白可能是诱导脑内免疫应答异常和慢性迁延性炎症的源头[12-13]。课题组业已证实了外周血nAb-Aβ可能早于脑内Aβ斑块的形成,进一步提示了这一针对异构化生理蛋白的免疫应答过程并非仅发生在AD患者,也同样出现在各年龄段的正常人[6]。本研究采用了与前期研究相似的方法对nAb-tau的免疫特性和临床价值进行了研究,结果发现总阳性率(11/20,55%)略高于nAb-Aβ的35.6%[6],且各年龄组阳性率的差异无统计学意义(χ2=4.512,P=0.608)。免疫特性分析研究进一步证实,3 组CSF 中的nAb-tau 均可同时识别人工合成的tau441以及Tg2576小鼠脑组织切片中的退变神经轴索。由此认为,nAb-tau很可能与nAb-Aβ[5-6]一样高频率、无差别地出现在人类的全生命周期,并具备相似的免疫特性。
既往临床病理研究业已证实,神经原纤维缠结和Aβ斑块在AD大脑中存在着相似的跨脑区扩散的演变规律,但前者的临床意义远大于后者[14-15]。本研究和既往研究[7-8]均观察到nAb-tau广泛存在于AD及包括正常认知的非AD患者的CSF及外周血中,这一现象提示神经元细胞内的神经骨骼蛋白诱导的免疫应答可能较早地参与了包括AD在内诸多中枢神经系统变性疾病的病理过程,但同样的疑问也同时出现在nAb-Aβ和nAbtau中,即这两种自身免疫应答反应究竟是AD病理的始作俑者,抑或仅仅只是一种次病理现象;这两种自身抗体的出现对AD的发生和发展是保护性的,还是破坏性的。有学者定量对比研究了帕金森病性痴呆和帕金森病非痴呆两组患者的血清nAb-tau水平,结果发现前者明显低于后者(P=0.007)[16]。本研究显示,AD组及OD组血浆nAb-tau检出率(0%)低于NC组(10%,P=0.329),但随后的IHC研究也发现该抗体也存在55%正常认知人群中。有学者采用转人类tau基因小鼠(P301S)进行的tau蛋白抗体被动免疫研究发现,腹腔内注射单克隆抗tau抗体(HJ8.5)后模型小鼠血浆中的tau蛋白水平明显升高并伴随着脑内tau病理的改善和可溶性tau水平的升高[17-18]。上述结果均提示内源性和外源性抗tau抗体的出现对于AD病理的发生和发展可能具有潜在的保护作用,但其对AD的诊断价值和预测价值仍需要更多循证医学研究加以证实。本研究进行Western blot分析时脑脊液和血浆的稀释倍数分别为1∶5000和1∶1000,但前者的nAb-tau检出率仍远高于后者(P<0.001),提示该抗体很可能是从脑内溢漏到外周的[7,18]。
本研究中年龄最小的IHC阳性血浆出现在新生儿中,而2 例Western blot 阳性血浆也来自NC 组,类似的现象也见于nAb-Aβ研究[5-6]和其他的nAb-tau研究中[8,19],上述现象强烈提示:构成AD两大病理特征的关键蛋白Aβ和tau抗原很可能从生命初期就开始暴露在脑内的免疫应答之中。长期以来,中枢神经系统被视为相对封闭的免疫豁免区[20],但越来越多的研究证据显示血脑屏障的破坏早期参与了AD的发生和发展[21],且脑内的淋巴管系统也并非与外界完全隔绝[22]。上述发现也为深入理解为什么AD状态下如此多的脑内生理性蛋白质(Aβ、tau、低分子量神经丝蛋白等)被免疫系统识别并诱导产生自身抗体提供了理论依据[23-24]。
近年来,在探索AD生物学诊断标志物上取得了长足的进展,已发现至少3种具有明确诊断价值和数十种具有潜在诊断价值的生物学标志物[25],但其特异性和敏感度均存在较大的争议。另外,(分子)神经影像学的日新月异,以及多模态MRI、正电子发射断层扫描等技术的发展为AD的早期诊断和个体化治疗提供了全新的手段[26]。但基于种种原因,现今AD的临床诊断仍主要依赖最为传统的排他性诊断原则[27]。本研究试图通过Western blot和免疫病理两种方法论证nAb-tau的免疫特性和发生规律,也回归分析了其与MMSE分值之间关联(P>0.05),但均未发现其具备AD生物学诊断标志物的基本条件。而随着绝大多数Aβ和tau疫苗研究的近乎停滞[2-4,28-29],越来越多的学者更倾向于支持AD是一种病因复杂,发病机制多样的异质性中枢神经系统疾病,且病因和病理机制并不仅仅局限于脑内[30-32]。
目前尚无研究深入探讨nAb-tau出现的分子机制,但必须指出的是,在诸多业已证实存在的自身抗体中,尚未发现任何一种对AD临床具有参考价值[5-8,19]。综上,全面而深入研究脑内免疫应答机制以及血脑屏障在AD发生和发展中的作用,将有助于进一步理解包括nAb-tau等自身抗体的确切成因,并为未来的AD免疫治疗研究指明方向。