负载盐酸阿霉素的氯化壳聚糖-海藻酸微粒的制备及释药性能
刘彩霞,吴 志,夏智超,吴庆喜
(安徽大学生命科学学院生态工程与生物技术安徽省重点实验室现代生物制造安徽省重点实验室,安徽合肥 230601)
盐酸阿霉素(DOX)是一种广谱抗肿瘤抗生素药物,其药理机制是抑制癌细胞遗传物质核酸的合成,对多种肿瘤细胞具有杀灭作用,具有强烈的细胞毒性,抑制能力强,在肿瘤治疗中发挥着重要作用[1]。目前,盐酸阿霉素的给药方式主要为动脉或静脉注射,但因其毒性大,会产生许多毒副作用,使患者耐受性差。近年来,有学者研究了多种关于盐酸阿霉素的靶向缓释给药系统,如制备盐酸阿霉素纳米脂质体、盐酸阿霉素载药胶束、纳米颗粒、聚合物纳米凝胶、微粒、金属有机骨架、氧化石墨烯系统、阿霉素磁性毫微粒等[2],这些载体系统被证明有较好的装载率,可减少盐酸阿霉素的毒副作用,并增强化疗药物的特异性,在控释条件下可将适当剂量的药物远程输送到目标部位,实现盐酸阿霉素的高效利用。将盐酸阿霉素微囊化后不仅可以降低毒性,而且可以提高药物的稳定性及生物利用度。在微粒的保护下,盐酸阿霉素被运送到特定部位,在适宜的条件下,囊壁材料被逐步降解,药物得以释放,可起到缓释和靶向的效果。因而,探究良好的载体材料是开发新型盐酸阿霉素药物制剂的关键。
近年来,以聚合电解质复合物为材料设计的微载体在缓控释给药方面显示了良好的应用潜力。聚合电解质复合物(PEC)一般由2 种或2 种以上的聚阳离子和聚阴离子构成,理想的聚合电解质复合物特性有生物可降解、生物相容性及良好的稳定性[3,4]。海藻酸钠(NaAlg)是一种天然多糖海藻酸的衍生物,是一种聚阴离子物质,有着独特的理化性质,具有良好的热稳定性、无毒副作用、可降解、环境友好且成本低,是一种理想的制备缓释药物载体的天然高分子材料。氯化壳聚糖(CHC)是壳聚糖的水溶性衍生物,具有良好的性能,是一种聚阳离子物质,因此可与海藻酸钠形成聚合电解质复合物,在药物微载体材料方面具有一定的应用前景[5]。赵志娟[6]的研究表明,采用改进的乳化凝胶法,利用海藻酸钠和壳聚糖可制备载有BSA 的微球,并探索了最佳制备条件,显示药物能够完全释放。段好刚[7]以海藻酸钠和壳聚糖为载体材料,对其进行改造、修饰,构建了微球结肠定位给药载体,表明抗炎效果良好。然而,该类载体的力学强度较弱,其应用受到限制。有研究表明[8],交联剂的使用对微囊的内部结构有显著的影响,并进一步影响到微囊的性能。肖启[9]的研究发现,钙、镁、铁、锌、铜等二价金属离子对壳聚糖-海藻酸微囊的稳定性具有显著性影响。本课题以DOX 为模型药物,采用均质乳化法,以海藻酸钠和氯化壳聚糖为材料,以Ca2+,Zn2+和Cu2+3 种金属阳离子为交联剂,制备了聚合电解质复合物微粒,同时,利用扫描电镜、红外光谱和X 射线衍射对3 种微粒的形态与结构进行了表征,探究了Ca2+,Zn2+和Cu2+3 种不同交联剂对微粒形态、粒径、药物分布、包封率和载药量及释放性能的影响。
1 实验部分
1.1 试剂和仪器
盐酸阿霉素(DOX):购自上海阿拉丁生化科技股份有限公司;CHC:购自济南海得贝有限公司,相对分子质量为50.0×103,脱乙酰度为85.6%;Span-80:购自上海申宇医药化工有限公司;异辛烷:购自天津市光复科技发展有限公司;氯化钠(NaCl):购自上海麦克林生化科技有限公司;异丙醇、海藻酸钠:购自国药集团化学试剂有限公司;Tween-80、氯化钙(CaCl2)、七水硫酸锌(ZnSO4·7H2O)、五水硫酸铜(CuSO4·5H2O):购自生工生物工程(上海)股份有限公司。
紫外可见分光光度计:Alpha-1900s 型,上海仪电分析仪器有限公司;扫描电子显微镜:S-4800 型,日本Hitach 公司;马尔文激光粒度仪:Mastersizer 3000 型,英国马尔文仪器有限公司;傅里叶变换红外光谱仪:Vertex80+Hyperion2000 型,德国布鲁克公司;激光扫描共聚焦显微镜:FV1000 型,日本奥林巴斯。
1.2 载药微粒的制备
本文采用均质乳化法制备载有盐酸阿霉素的微粒。
1.2.1 连续相制备:将Span-80 和Tween-80 试剂按体积比7:3 配制成混合乳化剂。室温搅拌1 h 至混合均匀,取3 mL 加入到100 mL 异辛烷中,v=3000 r/min,均质乳化5 min。
1.2.2 分散相制备:用蒸馏水配置10 mL 2% g/mL的海藻酸钠溶液。40 ℃水浴,搅拌至完全溶解,将其加入到连续相中,v=3000 r/min,均质乳化5 min。
1.2.3 交联固化:用蒸馏水配置20 mL 6% g/mL 的金属阳离子溶液,室温搅拌至完全溶解。用一次性1 mL 注射器慢慢滴加到体系中,总体系在均质乳化机的作用下保持高速搅拌,均质乳化20 min。
1.2.4 洗涤分离:往体系中加入50 mL 异丙醇,室温搅拌1 h,再静置1 h,取下层水相,离心收集微粒(v=3000 r/min,t=5 min),蒸馏水洗涤3 次,离心后收集沉淀。
1.2.5 静置载药:精确称取盐酸阿霉素5 mg,溶于5 mL 蒸馏水中,与微粒沉淀混合,在迷你混合仪中振荡混合(v=600 r/min,t=2 h)。
1.2.6 静电包衣:配制10 mL 的0.5% g/mL 的水溶性壳聚糖溶液,与载药微粒在迷你混合仪中振荡混合(v= 600 r/min,t=30 min), 离心后保留沉淀。
1.2.7 样品冻干:将沉淀于-20 ℃冰箱冻存12 h,放入冷冻真空干燥机24 h,得到干燥的载药微粒。
1.3 载药微粒的表征
1.3.1 载药微粒的形貌:采用扫描电子显微镜(SEM)观察3 组载药微粒的形貌结构。干燥后的微粒经表面减压喷金处理后进行观察。
1.3.2 载药微粒粒径分析与Zeta 电位测定:采用激光粒度分析仪与粒径分析软件分析载药微粒的粒径大小及其分布。取CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组载药微粒各10 mg,加2 mL 蒸馏水分散,用移液枪吸取0.5 mL 于比色皿中,进行粒径分析。采用Zetasizer 软件测定载药微粒的Zeta 电位。将制备的样品各取1 mL 注入到样品池,将样品池插入仪器中,进行Zeta 电位测定,每个样品重复测试3 次。
1.3.3 傅里叶变换红外光谱分析:利用傅里叶变换红外光谱研究海藻酸钠、3 种金属阳离子交联剂(Ca2+,Zn2+和Cu2+)和氯化壳聚糖在微粒形成过程中化学结构的变化。将微粒组分以及所制备的3 种微粒分别与适量的溴化钾混合,研磨,压制成薄片,用傅里叶变换红外光谱仪进行测定,红外光谱测量范围在400~4000 cm-1内。
1.3.4 X 射线衍射分析:将适量的盐酸阿霉素、微粒组成成分的物理混合物、未载药微粒和载药微粒4种样品平铺于干净的样品台上,用磨砂玻璃片轻轻压平至样品表面平整,采用X 射线衍射仪进行检测,扫描速度为2(°)/min,记录5°~80°的X 射线衍射图谱。
1.3.5 载药微粒药物分布测定:采用激光共聚焦显微镜观察药物分布,使用ImageJ 软件检测平均荧光强度。用异硫氰酸荧光素(FITC)标记盐酸阿霉素,制备溶于0.1 mol/L 碳酸氢钠(pH= 9.0)的盐酸阿霉素溶液,将FITC 溶解于无水DMSO 中配制成1 mg/mL 的溶液。在盐酸阿霉素溶液中缓慢加入FITC 溶液,轻轻搅拌,将反应液于4 ℃避光孵育8 h,加入NH4Cl,4 ℃终止反应2 h,成功标记盐酸阿霉素颗粒。采用均质乳化法分别制备了含有FITC 标记的3 组载药盐酸阿霉素微粒。
1.3.6 包封率和载药率测定:用紫外分光光度计测定CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组 载 药 微粒中盐酸阿霉素的浓度。以纯盐酸阿霉素水溶液为标品,在229 nm 处测其吸光值,以盐酸阿霉素浓度为横坐标,吸光值为纵坐标测得标准曲线,经线性拟合得到回归方程。3 种样品各取10 mg,用1 mL 蒸馏水充分研磨,稀释至5 mL,对其进行离心(v=3000 r/min,t=5 min),过膜,在229 nm 处测出上清液的吸光值,根据回归方程计算出盐酸阿霉素的浓度。每组数据测定3 次,取平均值。包封率(EE)和载药率(LE)用式(1)和式(2)进行计算:
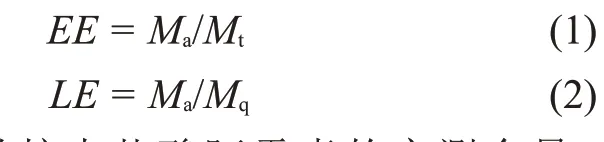
式中:Ma——载药微粒中盐酸阿霉素的实测含量,mg;Mt——载药微粒中盐酸阿霉素的理论含量,mg;Mq——载药微粒的总质量,mg。
1.3.7 载药微粒的释放性能:以pH=6.8 的PBS 缓冲液为体外模拟介质溶液,对3 种载药微粒的体外释药性能进行研究。分别将3 种载药微粒放入装有1 mL PBS 的透析袋中,放入装有20 mL PBS 的小烧杯中,将烧杯置于水浴摇床中,37 ℃,105 r/min 至60 h,恒温恒速进行释放。用紫外分光光度计在229 nm 处测定盐酸阿霉素的含量。根据标准曲线换算出所测PBS 缓冲液中的实际浓度。重复测定3次,取平均值。负载盐酸阿霉素微粒中的累积释放率(DR)按式(3)计算

式中:L0——初始载药微粒中盐酸阿霉素的理论含量,mg;Rt——t时载药微粒中盐酸阿霉素累积释放到PBS 缓冲液中的总量,mg
2 结果与讨论
2.1 载药微粒制备
采用均质乳化法分别制备了载有盐酸阿霉素的CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组微粒,其形成过程如Fig.1 所示。当二价金属阳离子(Ca2+,Zn2+和Cu2+)进入到Alg 微乳液中以后,会迅速置换Na+并与Alg 大分子共价交联形成水不溶性微小颗粒圆球;当形成的CaAlgCHC,ZnAlgCHC 和CuAlgCHC 微球进入到含有CHC 的大分子溶液时,微球表面的Alg 大分子残基(聚阴离子)在静电力驱动下与CHC大分子(聚阳离子)聚合形成聚合电解质复合物包衣膜层。研究表明[10],形成的PEC 膜具有微孔状结构,有利于药物分子的自由扩散。
2.2 形貌特征
如Fig.2 所示,3 组载药微粒形态均呈圆球形。将CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组微粒扫描电镜图进行对比,可发现CaAlgCHC 组载药微粒表面结构最为紧密,表面光滑(Fig.2(a)),ZnAlgCHC 组载药微粒表面有微小褶皱(Fig.2(b)),而CuAlgCHC 组载药微粒表面有少量细小微孔(Fig.2(c))。3 组微粒的表面形态与其交联固化程度密切相关,交联固化程度越高、结构越紧密,可以看出,不同类型的交联剂对微粒形貌结构产生了显著性影响,并会进一步影响微粒的药物包封、释放等性能。
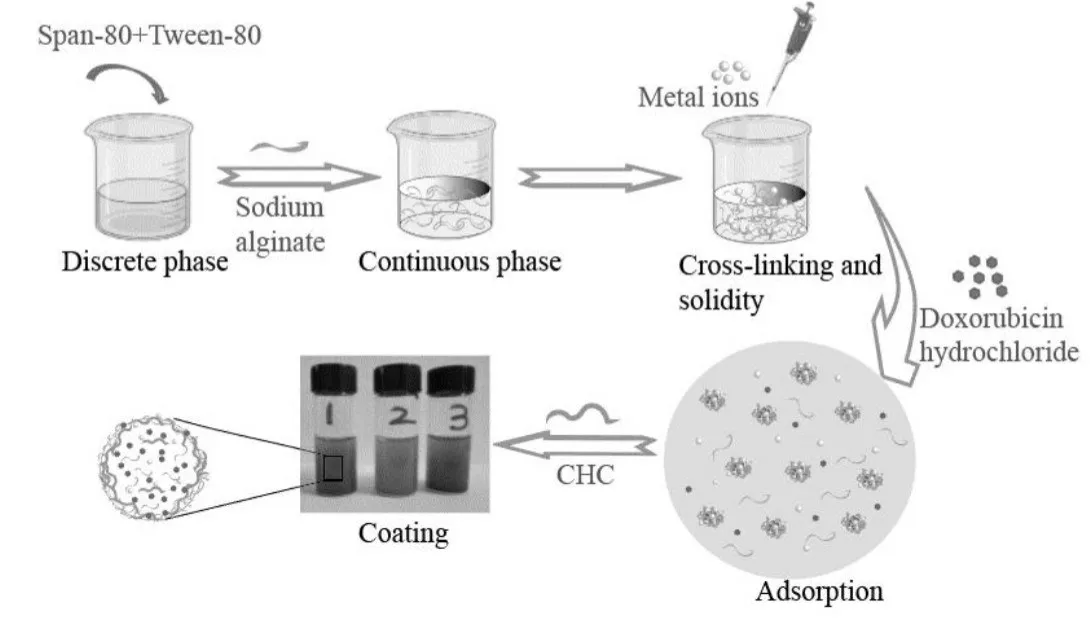
Fig.1 Schematic formation of the doxorubicin hydrochloride-loaded microparticles cross-linked by divalent metal ions

Fig.2 SEM images of the doxorubicin hydrochloride-loaded microparticles
2.3 粒径分布与Zeta 电位分析
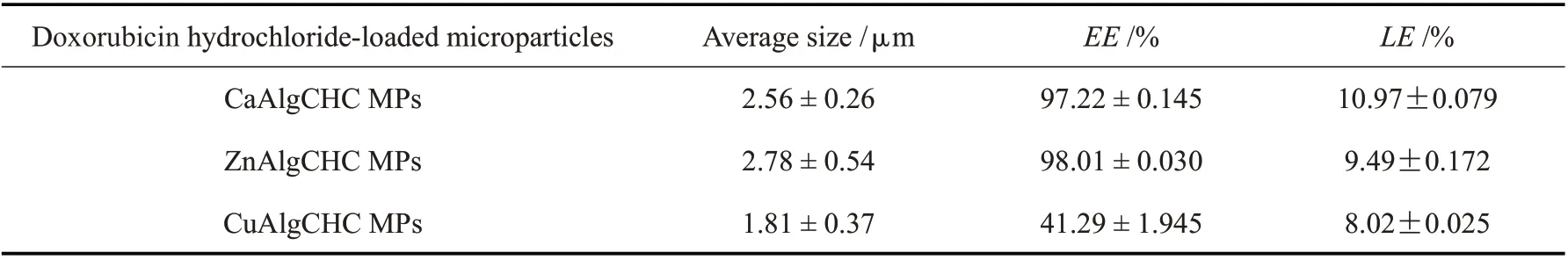
载体微粒的粒径大小及其分布对药物的递送性能起着至关重要的作用。利用激光粒度分析仪与粒径分析软件对3 组载药微粒的粒径进行了分析,各组微粒的粒径分布如Fig.3(a~c)所示。载有盐酸阿霉素的CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组微粒的平均 粒 径分别为(2.56 ± 0.26)μm,(2.78 ±0.54)μm 和(1.81 ± 0.37)μm。从3 组粒径分布图可见,CaAlgCHC 载药微粒和CuAlgCHC 载药微粒颗粒大小相对均匀,CaAlgCHC 载药微粒的PDI 为0.359,CuAlgCHC 载药微粒的PDI 为0.462,ZnAlgCHC 载药微粒的粒径偏大,且粒径分布较宽,其PDI 为0.550,这种结果和不同的交联剂与海藻酸钠的交联程度有关,是由3 组载药微粒表面疏松程度不同,在水溶液中吸水溶胀能力有所差异所致。
Zeta 电位可以评价颗粒之间相互排斥或吸引力的强弱,分散粒子越小,Zeta 电位的绝对值越高,体系越稳定。Fig.3(d)中,CaAlgCHC 微粒载药后,Zeta 电位值显著升高(P<0.01),稳定性提高,较ZnAlgCHC 微粒和CuAlgCHC 微粒稳定性更好。ZnAlgCHC 微粒与CuAlgCHC 微粒载药后,Zeta 电位值变化不显著(P>0.05),表明药物的载入对体系的稳定性影响较小。可见,在3 组交联剂的固化作用下,所得3 组载药微粒在水溶液中都具有良好的稳定性。
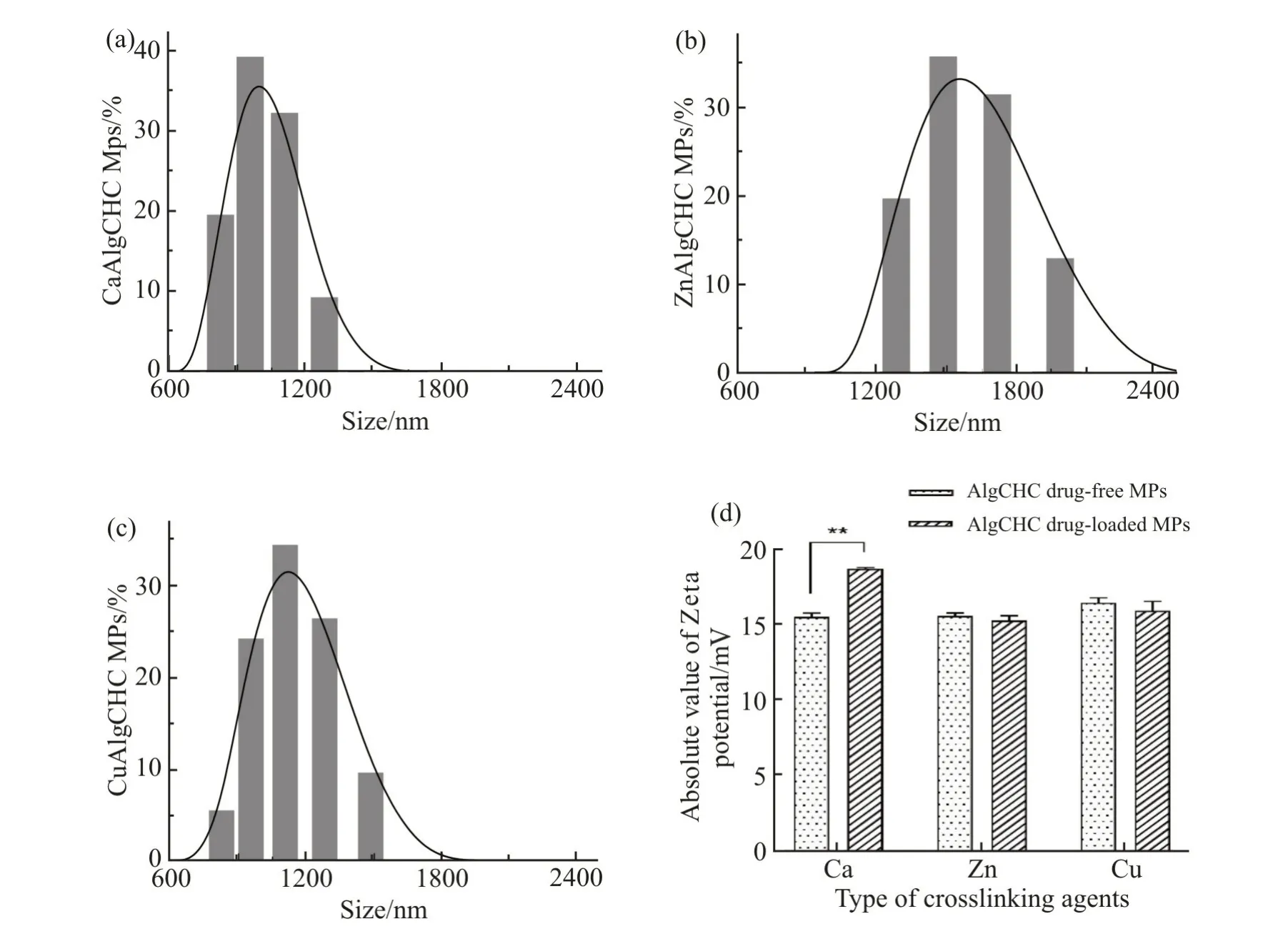
Fig.3 Particle size distribution of the doxorubicin hydrochloride-loaded microparticles and Zeta potential analysis
2.4 微粒化学结构的形成
采用傅里叶变换红外光谱研究微粒在形成过程中化学结构的变化。海藻酸是一种具有—COO—基团的聚阴离子大分子,如Fig.4a(1)所示,海藻酸的特征峰分别为1029.9 cm-1(C—O 拉伸振动)、1417.6 cm-1(对称—COO 拉伸振动)、1631.7 cm-1(非对称—COO拉伸振动)。氯化壳聚糖是一种具有—NH3+的聚阳离子大分子,从Fig.4a(2)中可以看出,氯化壳聚糖的特征峰分别为1092.6 cm-1(C—O 拉伸振动)、1523.7 cm-1(伯胺N—H 弯曲),同时,在1381.9 cm-1处由酰胺和氨基的N—H 伸缩振动引起的峰位。海藻酸钠和金属阳离子交联,与氯化壳聚糖形成聚合电解质复合物后,从Fig.4a(3)和(4)中可见,在1422.4 cm-1和1420.5 cm-1处出现特征峰,这是由于海藻酸钠的—COO—基团与金属交联剂Ca2+以及氯化壳聚糖的—NH3+基团发生反应后形成的新结构引起的。在ZnAlgCHC 与CuAlgCHC 微粒中也呈现类似规律(Fig.4(b)和Fig.4(c)),这一结果与已报道[11,12]的结论类似。
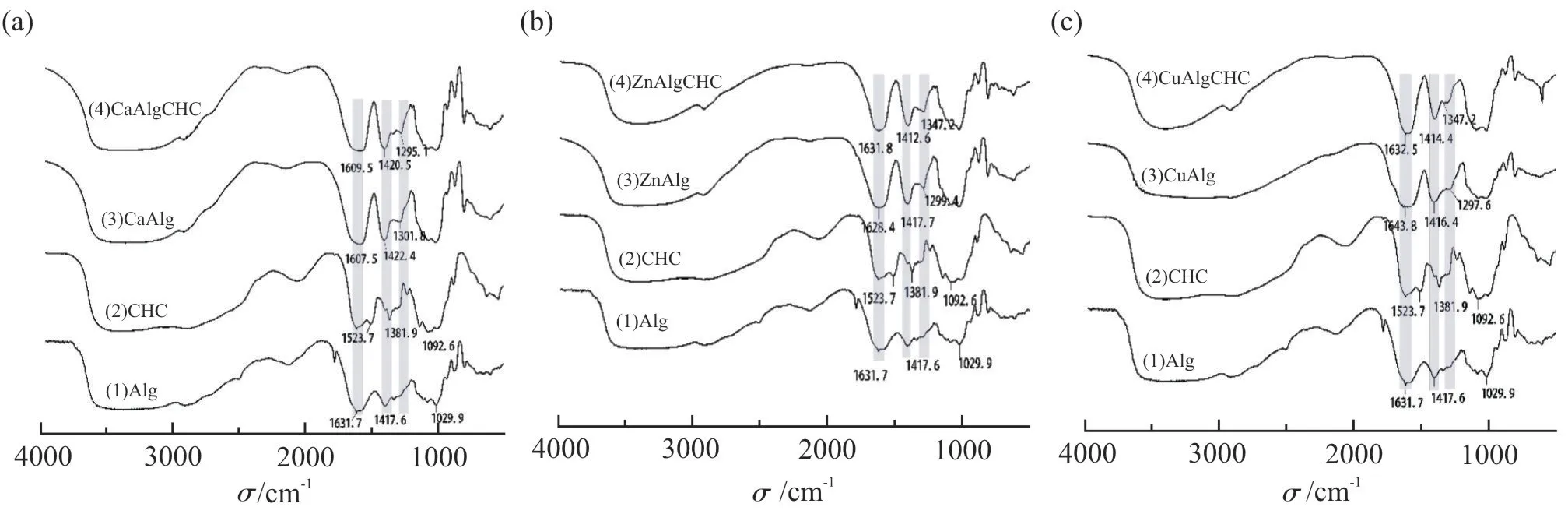
Fig.4 Fourier transform infrared spectrometer analysis of the microparticles and their components(a): CaAlgCHC microparticles; (b): ZnAlgCHC microparticles; (c): CuAlgCHC microparticles

Fig.5 X-ray analysis of the drug-loaded microparticles
2.5 载药微粒的X 射线衍射分析
对载药微粒进行X 射线衍射分析,可得知载药微粒中药物的存在形式。如Fig.5a(1)所示,DOX 以晶体形式存在,在13°~25°区间有强烈信号峰;物理混合中受无定形大分子成分影响(Alg/CHC),其强度明显减弱,部分信号峰与DOX 相同(Fig.5a(2));未载药的微粒由无定形形式的聚电解质复合物(PEC)形成,因而信号强度不明显(Fig.5a(3));与之对比,载药微粒中,部分峰值经放大后可见与DOX 主峰区间相似(Fig.5a(4)),同样由于受到无定形PEC 结构的影响,信号强度大大减弱,表明在AlgCHC 微粒中DOX 也主要以晶体形式存在,纯DOX 与载药微粒之间的强度差异可能是受到无定形PEC 的干扰。Fig.5(b)和Fig.5(c)呈现类似规律,Alnaief 和Tong 等[13,14]也报道了类似的结果。
2.6 FITC 标记盐酸阿霉素的分布
本研究采用激光扫描共聚焦显微镜观察异硫氰酸荧光素(FITC)标记的盐酸阿霉素在微粒中的分布。 如 Fig.6 所 示,CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组载药微粒的荧光强度差异显著,CaAlgCHC 组载药微粒的荧光强度最大,ZnAlgCHC组载药微粒次之,CuAlgCHC 组载药微粒荧光强度最弱。荧光强度直接反映了载药微粒中盐酸阿霉素的含量,与载药微粒的结构密切相关,CaAlgCHC组载药微粒的结构最为紧密,有利于FITC-DOX 的装载,与SEM 结果分析一致。
2.7 包封率与载药量测定
本研究通过测定微粒的包封率和载药率评价微粒载体的药物负载性能。盐酸阿霉素浓度计算的标准曲线经拟合方程为:y=0.062x-0.145,R2=0.999(n=7)。测算结果表明,CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组载药微粒的包封率分别为(97.22 ±0.145)%,(98.01 ± 0.030)%和(41.29 ± 1.945)%;载药率分别为(10.97±0.079)%,(9.49±0.172)%和(8.02±0.025)%。3 组载药微粒的包封率都比较高,其中CaAlgCHC 载药微粒的载药率高于其它组,这与CaAlgCHC 载药微粒的表面紧密结构有关,与激光扫描共聚焦显微镜观察到的结果一致;CuAlgCHC载药微粒的包封率和载药率均较低,分析与Cu2+交联剂与海藻酸钠交联程度弱,微粒表面结构疏松有关,这一结果与激光扫描共聚焦显微镜所观察到的盐酸阿霉素荧光强度弱也是一致的。
2.8 释药性能
Tab. 1 Average size and encapsulation efficiency and drug-loading efficiency of the doxorubicin hydrochlorideloaded microparticles
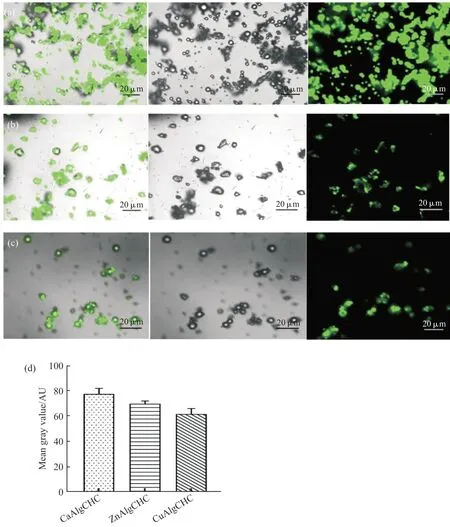
Fig.6 Laser scanning confocal microscopy observation of the doxorubicin hydrochloride-loaded microparticles labeled by FITC ((a): CaAlgCHC drug-loaded microparticles; (b): ZnAlgCHC drug-loaded microparticles; (c) :CuAlgCHC drug-loaded microparticles); (d) mean gray value of three drug-loaded microparticles
研究表明,壳聚糖类载药微粒的药物释放特性主要包括溶蚀释放、扩散释放和表面释放3 种方式[15]。本研究通过模拟人体生理pH 环境,对聚合电解质复合物所形成的载药微粒的体外释药特性进行探究,可得知载药微粒的释药规律,为下一步研究载药微粒的体内释药提供参考。负载盐酸阿霉素微粒的药物释放性能如Fig.7 所示,释药时间为60 h,随着时间延长,CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3 组载药微粒的释药率呈现逐渐上升的趋势,CuAlgCHC 载药组的累积释放率接近90%。分析其原因,CuAlgCHC 载药微粒的粒径较小,有较大的比表面积,在模拟生理pH 环境中,微粒膨胀,孔隙结构增大,导致包埋在微粒中的DOX 通过孔隙而快速释放;CaAlgCHC 和ZnAlgCHC 载药微粒表面结构致密,孔隙率低,比面积相对较小,对DOX 有更好的保护作用,在模拟生理pH 环境中,释放相对缓慢,这与上述实验分析结果吻合。3 组载药微粒都具有显著的缓释效果,可作为DOX 类药物的缓释载体。有关药物的释放机制,笔者将结合体内动物模型实验进一步深入研究。
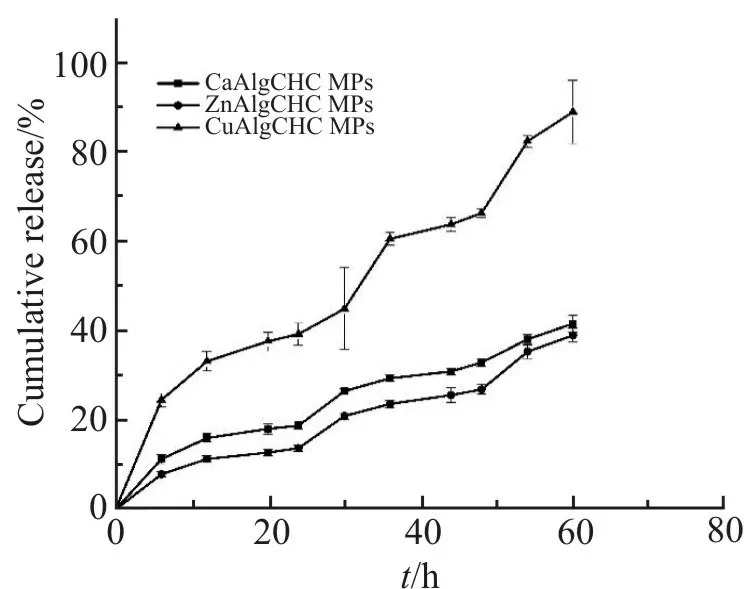
Fig.7 Drug release profiles of the doxorubicin hydrochlorideloaded microparticles
3 结论
本研究采用均质乳化法,以盐酸阿霉素为模型药物,制备了CaAlgCHC,ZnAlgCHC 和CuAlgCHC 3组载药微粒,并对其性能进行了评价。结果表明,不同的金属阳离子交联剂对载药微粒的表面形态、大小和结构有着显著的影响。3 种载药微粒均呈球形,其中以金属Ca2+为交联剂制备的CaAlgCHC 载药微粒表面光滑,结构更为紧密。载药微粒大小分布相对均匀,体系稳定。CaAlgCHC 载药微粒与ZnAlgCHC 载药微粒的包封率皆能达到90%以上,体外释放研究表明三者均具有缓释给药效果。本文所制备的微粒可为盐酸阿霉素类药物载体的设计提供一种新的思路。

