基于量子点编码微球的流式检测技术用于白血病诊断的研究
杨俊飞,王烨颖,周靖娥,王 镜,闫志强,俞磊
(华东师范大学 化学与分子工程学院,上海 200062)
0 引言
血清中多种表达异常的蛋白质的并行检测可以作为一些复杂疾病 (如癌症[1-3]、心脏病[4-5]及囊包性纤维症[6-7]等) 诊断的关键性依据.除此,并行检测也广泛应用于各种微生物分析中[8].酶联免疫吸附(Enzyme-linked Immunosorbent Assay,ELISA)[8-9]和蛋白质免疫印记 (Western Blotting,WB)是目前常用的免疫检测方法,虽然技术成熟,但通量低,所需要的样品量大,试剂等耗材量也大,不能满足全民医保和预防医疗理念的推广和实现.免疫临床诊断的发展方向是低消耗、高通量检测的实现,所以急需一种快速、灵敏、精确的多重蛋白定量检测方法,用于疾病诊断和生物分析等领域.
微阵列技术是高通量检测中的常用手段,可以对多种分子并行检测[10-11].较传统分析技术,其样品检测能力更强、灵敏度更高、成本更低[12].高通量检测技术主要分为3 种: 平面微阵列[13-14]、微珠阵列检测芯片[15]、基于微球的悬浮阵列技术[16].相比于前两者,悬浮微阵列技术运用了更高效的混合方式来加强微球与目标分子的结合,并通过流式细胞仪读出的信号实现定量检测.
根据荧光染料的不同,可分为有机荧光染料、荧光蛋白、量子点.近年来,随着有机荧光染料和荧光蛋白的发展,且一些有机荧光编码的微球被用来转化利用,逐渐暴露出许多问题.因为这样的检测系统往往需要能够产生多频段激发光的复杂光学系统,而且荧光染料种类有限,光谱特征存在广泛的重叠现象,这些极易引起错误识别.此外,有机染色微珠还存在易光漂白[17-18]、编码能力有限等缺点,限制了其进一步应用.与之相比,量子点的优点表现为: ①激发波段宽,发射峰窄而对称,一个范围内的激发波长可以同时激发不同发射波长的量子点,不易互相重叠和干扰;② 荧光强度和稳定性高;③只需要改变合成过程中单体组分的比例,或者改变尺寸大小,就会改变其发射波长,因而可以简单地获得不同发射波长的量子点;④ 生物相容性好.因此,基于量子点编码的悬浮微阵列可以克服有机荧光染料种类有限且光谱特征重叠等缺陷[19].
流式细胞术 (Flow Cytometry,FCM) 于20 世纪90 年代[20]被提出,在蛋白质、DNA、RNA、细胞因子、抗原、抗体等分子的含量分析中逐渐体现出优势.将量子点编码微球应用于流式检测,具有高效、快捷、定性、定量检测等优点,目前受到了越来越多的关注.如经典的三明治免疫夹心反应 (双抗夹心法),将量子点微球作为载体,表面连接功能性官能团和抗体,作为检测分子去识别抗原,实现定性检测;将另一种有机染料或者量子点标记的抗体作为探针分子,将抗原夹在其中,实现定量检测.
急性淋巴白血病 (Acute Lymphoblastic Leukemia,ALL) 属于淋巴瘤的一种,其发病机制是白血病细胞的增殖、分化以及凋亡受到阻碍,导致细胞受损和死亡,聚集在组织内无法排出,且造血功能受到严重抑制.白血病根据病情分类,可以分为急性和慢性 (患病率为6∶1);根据发病起因分类,可以分为淋巴细胞和非淋巴细胞.据统计,全球每年有几十万白血病患者,占全部癌症病人的四分之一.中国发病率较高,且病例数呈逐年上升趋势.男性患病率高于女性 (2∶1);相对于成人,儿童和青少年患病率占大多数,是唯一一个未成年人患病率高于成年人的癌症.更为重要的是,白血病患者生存率低,容易复发,并在治疗后可能会伴随后遗症,所以迫切需要完善的诊疗技术[21].在早期诊断方面,与该病的表达水平异常的抗原和细胞因子的检测成为首要选择,如白细胞介素家族 (Interleukin-IL-2、4、10)、血清肿瘤坏死因子(Tumor Necrosis Factor,TNF-α)、干扰素γ (Interferon-γ,IFN-γ)等[22-25].
综上,本研究用分散聚合法制备了微球种子 (seed),再以seed 为模板,聚合成更大粒径的多孔微球.多孔有利于量子点的掺杂,防止其泄漏,且羧基功能化后,利于IgG和IL-6 抗体的共价连接.在表征过程中,研究了量子点在微球中的渗透和分布状况,以及在生理条件下长期贮存后的稳定性.采用该策略,编码的微球荧光均匀,编码能力强,溶液稳定性好,表面的羧基可进行抗体偶联.所有这些优点都有利于长期存储和检测应用.使用人IgG 作为模型分析物,验证了QDs@PS 材料与抗原连接的有效性,并且进一步利用双抗夹心反应的原理,使用一抗和二抗两种不同的IL-6 抗体与材料共价结合.最后,将连接抗体的材料与ALL 血清样本共孵育,流式上机检测.
1 实验方法
1.1 材料
聚乙烯吡咯烷酮 K-30 (Polyvinyl Pyrrolidone K-30,PVP K-30)、十二烷基硫酸钠 (Sodium Dodecyl Sulfate,SDS)、甲基丙烯酸 (Methacrylic Acid,MAA,98%) 购于Sigma-Aldrich 公司,过氧化苯甲酰 (Dibenzoyl Peroxide,BPO)、氧化镉 (CdO,99.99%)、苯乙烯 (99%)、醋酸锌 (99.9%)、硒 (Se,99.9%)、硫 (S,99.9%) 购于麦克林公司,鼠抗-IL-6 (Ⅰ)、鼠抗-IL-6 (Ⅱ)、IL-6 蛋白购于北京义翘神州科技股份有限公司,甲苯、油酸 (Oleic Acid,OA)、EDC-HCl、1-十八烯 (1-Octadecene,ODE,90%)、二甲基丙烯酸乙二醇酯 (Ethyleneglycoldimethacrylate,EGDMA,98%)、三正辛基膦 (Tri-noctylphosphine,TOP,90%)、巯基丙酸 (3-Mercaptopropionic Acid,MPA,99.8%) 购于阿拉丁试剂公司,偶氮二异丁腈 (Azodiisobutyronitrile,AIBN)、环己烷、去离子水购于当地供应商,2-吗琳乙磺酸(2-Morpholinoethanesulfonic Acid,MES)、N-羟基琥珀酰亚胺 (N-Hydroxy Succinimide,NHS)、人免疫球蛋白G (IgG)、羊抗人IgG、牛血清白蛋白 (Bovine Albumin,BSA)、Tween-20 购于上海鼎国生物,鼠抗-IL-6 (Ⅰ)、鼠抗-IL-6 (Ⅱ)、IL-6 蛋白购于北京义翘神州科技股份有限公司,不同浓度的急性白血病(Acute Leukemia,AL)血清样本源于上海优卡迪生物医药科技有限公司.
1.2 聚苯乙烯微球 (PS) 的合成
按照相关文献[26],不断优化并制备尺寸为5 µm 的PS 球,实验步骤如下.
(1) 聚苯乙烯种子 (PS seed): 先将4 g PVP K-30和80 mL 乙醇溶液倒入150 mL 四颈烧瓶中,通氮气20 min,升温至70℃后,加入0.8 g AIBN和30 g 苯乙烯,聚合反应15 h.反应完成后,先用去离子水离心洗涤2 次,再用乙醇离心洗涤1 次,去除苯乙烯和PVP 残留,获得seed,然后在真空干燥机中干燥 (25℃、6 h),得到白色粉末.
(2) 先用去离子水配置一定量的SDS 水溶液 (3wt% (质量百分比)).称量0.1 g seed 分散在30 g SDS 水溶液中,超声 (10 min、100 W)使其分散;将0.3 g 环己烷加至10 g SDS 水溶液中,超声 (10 min、100 W) 使其乳化;将两者一起加至250 mL 四颈烧瓶中,通氮气20 min,在机械搅拌下反应溶胀10 h (25℃、200 r/min).
(3) 称量0.15 g BPO 加至10 g SDS 水溶液中,超声 (10 min、100 W) 后加至步骤(2)的反应溶液中,再将含5 g 苯乙烯、5 g EGDMA、1 g MAA、8 g 甲苯混合,加入上述反应溶液中,在机械搅拌下反应溶胀12 h (25℃、250 r/min).
(4) 将3 g 聚乙烯醇溶胀至100 g 水中,加热至120℃,快速搅拌0.5 h 后溶解,冷却至室温 (或者将3 g PVP K-30 加至100 g 去离子水中,超声溶解),随后用滴管吸取,缓慢加入反应体系中,通冷凝回流装置,水浴加热至85℃,在机械搅拌下聚合反应12 h (250 r/min).
(5) 反应结束后,将制备好的微球分离纯化.具体操作: 先将溶液离心 (10 000 r/min、10 min),得到沉淀,再加入去离子水超声溶解,再离心,重复2 次.最后用乙醇洗1 次,离心得到沉淀,最后置于真空干燥机中干燥 (25℃、6 h、0.1 MPa),得到白色粉末,4℃冰箱中保存使用.
1.3 不同发射波长量子点(QDs)的制备
(1) 根据相关文献[27],制备尺寸为6.5 nm 的QDs.称量 0.4 mmoL CdO、4 mmoL 醋酸锌、9.942 g OA、20 mL ODE 加至100 mL 圆底烧瓶中,将烧瓶置于磁力加热搅拌器中,连接冷凝回流装置并通N2,15 min 后将混合物加热至150℃并搅拌 (600 r/min).待反应溶液变澄清之后,进一步加热至308℃.
(2) 称量0.3 mmol Se 粉和4 mmoL S 粉,加至3 mL TOP 中,随后磁力加热、搅拌溶解 (90℃、800 r/min、10 min),然后冷却至室温.最后加至上述反应体系(1) 中,将反应烧瓶温度设置为300℃,反应10 min,以促进QDs 的生长.
(3) 反应结束后,将溶液分散至4 个50 mL 离心管中,每管加入10 mL 丙酮和10 mL 三氯甲烷,离心纯化QDs 3 次,然后将离心所得全部沉淀物分散至10 mL 氯仿或环己烷中,得到发射波长为550 nm 的油溶性QDs.为了改变QDs 的光学特性,从而获得多种发射波长,只需调节Se和S 物质的量的比例,保持其他参数(如CdO、醋酸锌、OA、ODE 或TOP、反应温度、反应时间等)不变.
(4) 量子点作为探针分子连接抗体或者抗原的需要进一步亲水改性.用巯基丙酸(MPA)代替附着在量子点表面的OA 制备水溶性量子点: 将20 mg QDs 与20 mL CHCl3超声混合,打开通风橱通风,加入4 mL MPA,磁力搅拌加热 (70℃、500 r/min、1.5 h).反应结束后,将溶液在6 000 r/min 下离心,用三氯甲烷纯化3 次,最终溶解至4 mL 去离子水中 (浓度约为5 mg/mL).
1.4 量子点掺杂多孔微球 (QDs@PS)
根据相关文献[28],先将多孔微球溶胀,有利于量子点的掺杂和渗透.称量1.2 节中制备好的 PS 固体粉末20 mg;量取10 mL 三氯甲烷、2 mL 异丙醇,混合超声 (10 min,100 W);取1.3 节中未亲水改性的油溶性QDs 400 µL 加入其中,超声 (10 min、100 W),随后放至真空干燥箱 (30℃、12 h、0.1 MPa).所有的溶剂挥发后,用乙醇和环己烷 (体积比为5∶1) 离心洗涤3 次.干燥,称重,得到纯化的QDs@PS.
1.5 偶联抗体及免疫荧光反应检测
1.5.1 量子点微球偶联人IgG (捕获分子)
将20 mg QDs@PS 加至活化缓冲液MES (1.2 mL、pH 6.0)、新鲜配制的EDC (400 µL、50 mg/mL)及NHS (400 µL、50 mg/mL) 中,旋转30 min,使表面羧基活化;用PBS 离心洗涤3 次,除去过量的EDC和NHS.将活化的QDs@PS 重新分散在2 mL PBS (pH 7.4) 中,加入200 µL 人IgG (1 mg/mL),在摇床上共孵育3 h (37℃、250 r/min);随后,用2 mL PBS (含有0.5% Tween-20) 离心洗涤3 次;最后分散在2 mL PBS 中,4℃冰箱中保存使用.按照同样的方法,偶联BSA 作为对照组.
1.5.2 水溶性量子点偶联羊抗人IgG (探针分子)
根据相关文献[29],将5 mg 上述水溶性量子点加入到EDC (400 µL、50 mg/mL) 及NHS (400 µL、50 mg/mL) 中,共孵育2 h (37℃、250 r/min),用PBS 离心洗涤3 次,随后重新分散在2 mL PBS 中.再加入羊抗人IgG (200 µL、1 mg/mL),在摇床上共孵育3 h (37℃、250 r/min).最后用PBS 离心洗涤3 次,分散在10 mL PBS 中.
1.5.3 免疫荧光反应
取1.5.1 节中得到的偶联两种蛋白的捕获分子各100 µL,分别加至1.5.2 节所述的检测分子100 µL 中,在摇床上共孵育2 h (37℃、250 r/min),用PBS 离心洗涤3 次,分散在2 mL PBS 中,用荧光光谱仪检测分析.
1.6 基于QDs@PS-IL-6 (一抗)和QDs-IL6 (二抗) 的双抗夹心反应
按照1.5 节同样的方法,制备得到QDs@PS 偶联鼠抗-IL-6 (一抗) 捕获分子和水溶性QDs 偶联鼠抗-IL-6 (二抗) 探针分子.取1 mL (1 mg/mL) QD@PS-IL-6 (一抗) 与10 mg 待测抗原IL-6 混合,在摇床中共孵育2 h (37℃、250 r/min),随后用PBS 离心洗涤3 次,分散在1 mL PBS 中.最后,加入1 mL(0.5 mg/mL) QDs-IL-6 (二抗) 纳米探针,共孵育2 h (37℃、250 r/min).反应结束后,用PBS 离心洗涤3 次,用荧光光谱仪检测分析.
1.7 量子点微球应用于流式检测人血清样本中的IL-6
按照1.6 节同样的方法,将已知IL-6 浓度为40 pg/mL 的白血病患者血清样本与QD@PS-IL-6(一抗) 共孵育2 h (37℃、250 r/min),离心洗涤后分散在PBS 中,再将QDs-IL-6 (Ⅱ) 加入其中,共孵育2 h (37℃、250 r/min),离心洗涤后分散在PBS 中.改变加入的白血病患者血清浓度(血清样本取自同一患者的不同时刻),最后用流式检测量子点探针荧光强度,每次检测收集5 000 个微球.
1.8 表征
使用荧光光谱仪检测量子点发射光谱,使用荧光显微镜观察量子点发光情况,使用动态光散射(Dynamic Light Scattering,DLS) 检测微球粒径,采用扫描电子显微镜(Scanning Electron Microscope,SEM)观察微球的形貌和孔径大小,结合Zeta 电位和傅里叶转换红外光谱 (Fourier Transform Infrared Spectroscopy,FTIR) 检测羧基,使用透射电子显微镜 (Transmission Electron Microscope,TEM) 观察QDs 的形貌和大小,使用405 nm 激发光进行流式检测.
2 结果与讨论
2.1 微球的形态表征
微球的制备方法有很多,首先分别用沉淀[30]、分散[31]、种子聚合法[32](图1) 合成了无孔的微球,根据图1 的SEM 图像显示,种子聚合法制备的微球的粒径和形貌最稳定,所以下一步采用种子聚合法制备多孔的微球.本文使用的致孔剂为甲苯,羧基单体为MAA.如图2 (a)—(c) 所示,微球具有良好的球形,平均粒径约为5 µm,孔径为几十纳米至几百纳米.因为量子点粒径较小,不会超过20 nm,所以有利于进一步掺杂量子点.图2 (d) 的红外光谱图显示,加了MAA 之后,在1 726 cm–1处,有–C=O 特征峰;在2 600~3 200 cm–1处,有–OH 特征峰.而无MAA 的对照组图像并无两种峰的出现,且结合图2 (e) 含有MAA 微球的Zeta 电位和对照组比较,出现了左移,进一步验证了微球表面羧基的存在,为进一步连接抗体提供了可能.

图1 不同聚合法方法制备的无孔微球Fig.1 Pore-free microspheres prepared by different polymerization methods
2.2 量子点的合成及其形态表征
本文采用单步合成法制备CdSe/ZnS (核/壳) 量子点.由于径向化学成分(或能级)梯度的存在,单步合成的量子点结构稳定,有效地缓解了晶格失配,并将电子和空穴限制在核内.因为量子点的发射波长可以通过其组分含量的变化来改变,所以本文探究了Se和S 的物质的量的比例,合成了几种不同发射波长的量子点.如图3 (a) 的TEM 图所示,量子点呈不规则的方形结构,形貌规整,晶格明显,分散性和均一性良好,尺寸为6.5 nm.图3 (b) 的荧光发射光谱图显示,合成了4 种不同发射波长的量子点,Se、S 的物质的量之比为0.2∶4.0,发射波长为540 nm;Se、S 的物质的量之比为0.4∶2.5,发射波长为595 nm;Se、S 的物质的量之比为0.4∶4.0,发射波长为565 nm;Se、S 的物质的量之比为1∶2.5,发射波长为605 nm.量子点的峰形呈高斯分布且对称,半峰宽均不超过40 nm.此外,该单步合成方法最多需要两种表面活性剂(油酸和三辛基膦TOP),是一种直接、简单、重复性好、经济的方法,可获得大量发光性能高、结构稳定的量子点.

图2 多孔微球的形态表征Fig.2 Morphological characterization of microspheres
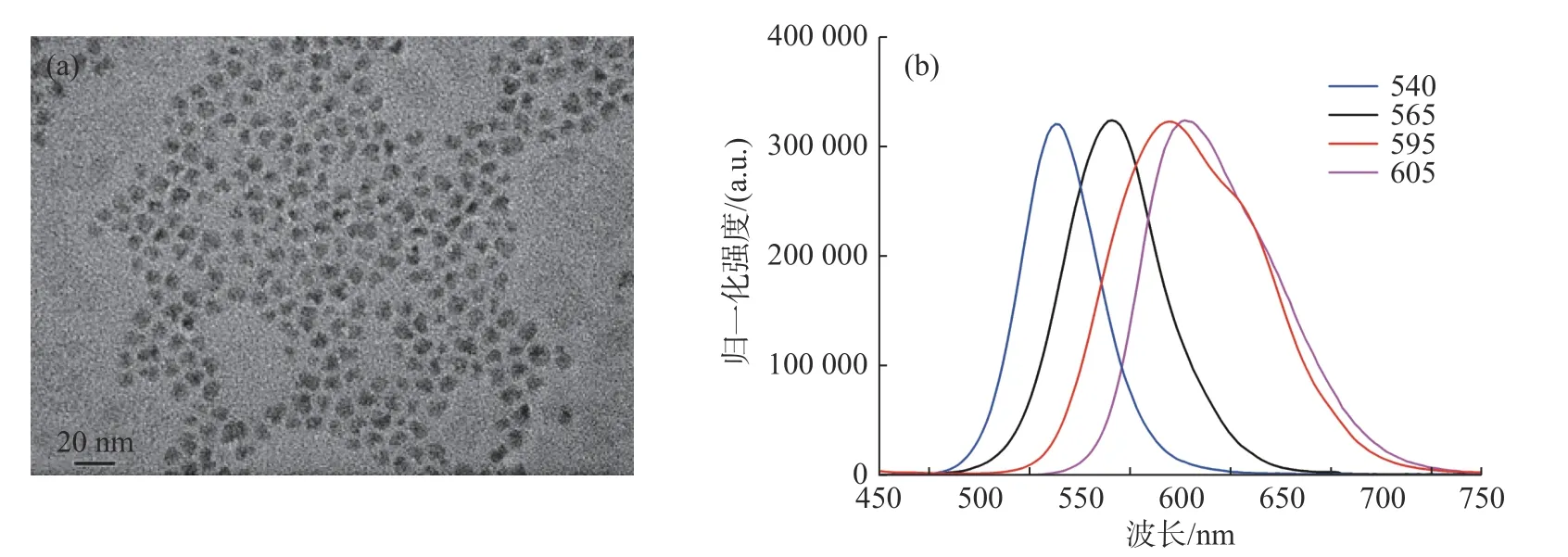
图3 量子点的扫描透射电镜图 (a)和荧光光谱图 (b)Fig.3 TEM (a) and photoluminescence (b) photographs of quantum dots
2.3 量子点在微球中的分布
为了获得稳定的量子点微球捕获分子,需要将量子点有效地掺杂到多孔微球中.与异丙醇相比,氯仿更适于量子点的分散,并对聚合物珠体表现出良好的溶胀能力,氯仿溶剂也可以溶胀交联的聚苯乙烯微球.本文将微球和发射波长为605 nm 的量子点分散在氯仿和异丙醇溶剂中,且超声 (10 min、100 W) 混合,放置于真空干燥箱 (30℃、12 h、0.1 MPa),等待溶剂挥发.在此过程中,氯仿将微球溶胀 (孔径) 变大,利于量子点更好地进入.由于氯仿挥发速度快,并随着不断地挥发,利用两种溶剂挥发速度的差距,氯仿浓度相对异丙醇减少,基于浓度梯度原理,量子点被动扩散到微球当中,当氯仿挥发完全,微球恢复到原来的状态,量子点被牢牢地固定在微球当中.
量子点在微球中分布状况很重要,如果只是分布在表面,说明量子点没有进入孔内,亮度就会很弱.其次,量子点大量分布在微球表面,会影响微球表面功能团 (羧基) 与目标分子的连接.更重要的是,如果量子点在微球上分布不均匀,也会导致发光不均匀.例如: 一个微球上某部分发光强,某部分发光弱甚至不发光;或者有的微球上量子点分布多,有的较少,以上都不利于材料在生物检测结果上的准确性.在荧光显微镜的观察下(图4),以绿光为激发光,在不同的倍镜下 (图4 (a)为10 倍,图4 (b)为40 倍) 观察,量子点均发出红色的光,且发光明亮.进一步在100 倍油镜下观察到,当用白光为光源时 (图4 (c)),可以清晰地看到量子点纳米颗粒均匀地分布在微球中;当用绿光激发时 (图4 (d)),微球显示出很强的红色荧光,并且亮度均匀,球形规整,说明量子点均匀地分布在微球当中.
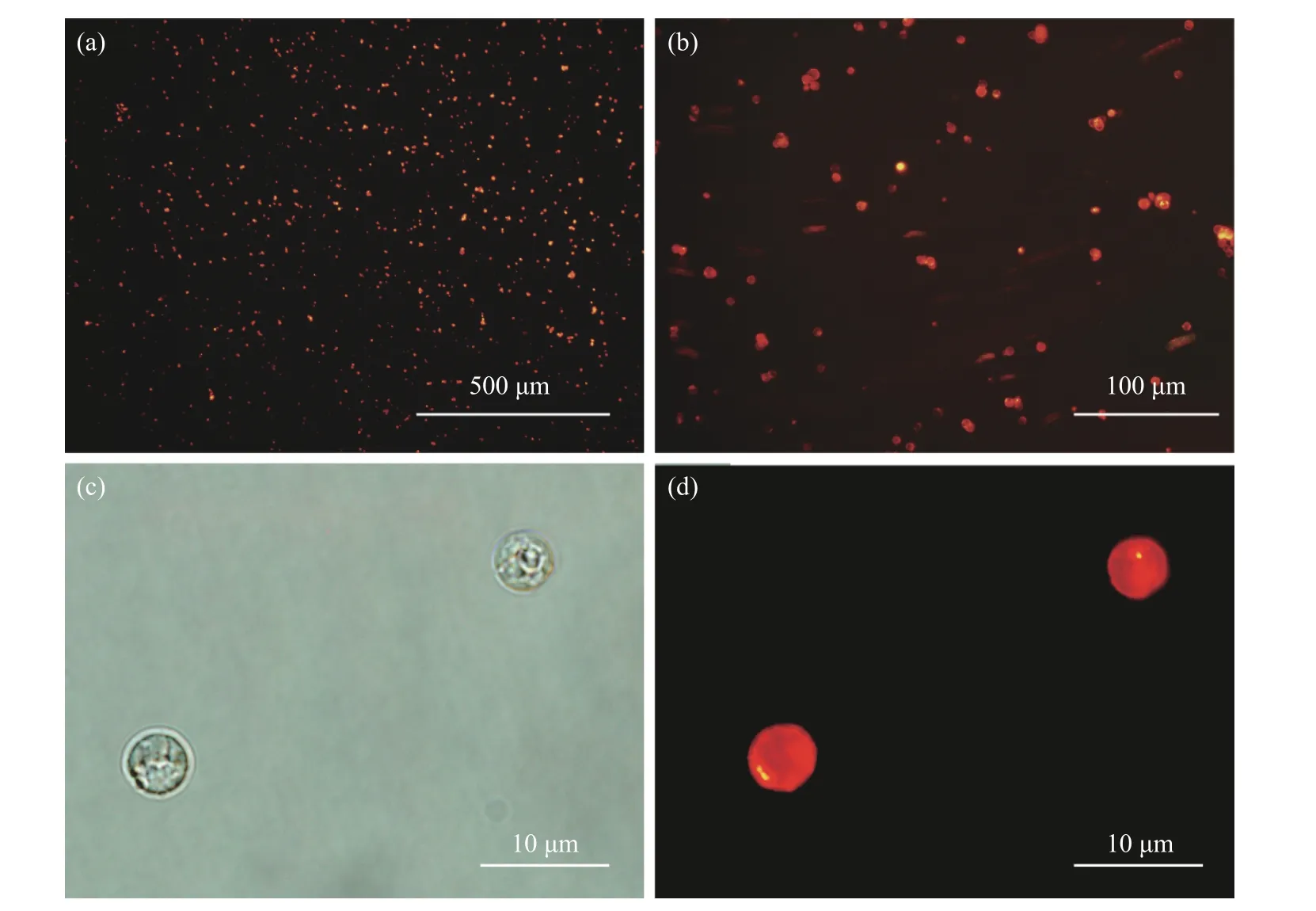
图4 荧光显微镜观察量子点的分布状况Fig.4 The distribution of quantum dots observed by a fluorescence microscope
2.4 量子点微球的荧光稳定性
对于检测应用,量子点微球应该在生理条件下保持其荧光的稳定.以磷酸盐缓冲盐PBS (Phosphate Buffered Saline,pH=7.4) 溶液为培养基,测试量子点微球(590 nm)的稳定性.样品保存在此环境条件下,定期每两天离心除去上清液,重新分散在等量的PBS 溶液中进行荧光光谱测量,观察发射峰位置对应的荧光强度(图5).从图5 (a)可以看出,微球在PBS 溶液中保存两周内的荧光强度变化很小;从图5 (b) 可以看出,量子点的荧光在第16 天仍保持明亮.结合两张图可以说明量子点荧光持久,且泄漏率很低 (不超过10%),良好的稳定性为检测提供了准确性.

图5 量子点编码微球的荧光在PBS 中随时间变化的情况Fig.5 Fluorescence of quantum dot encoded microspheres over time in PBS
2.5 基于量子点微球检测分子和量子点探针的荧光免疫分析
高性能荧光编码微珠作为微流控蛋白芯片载体用于微球表面的羧基可作为DNA 序列、抗原或抗体的附着位点,功能微球上固定的抗原与抗体之间的免疫反应可用于评价QDs 编码微球表面是否存在羧基.本文将制备的水溶性QDs (550 nm)与羊抗人IgG 抗体偶联作为探针分子,人IgG 抗原或BSA (对照组) 与量子点微球 (605 nm) 偶联,对照组用来证明反应的特异性和有效性.免疫反应结束后,通过荧光光谱仪检测,结果如图6 (a)和(b) 所示.实验组同时出现了两个峰,对应于捕获微球 (605 nm)和量子点探针 (550 nm) 的两个量子点的发射峰;而对照组BSA 只出现了捕获微球上量子点的峰(605 nm).由此可以说明: ①量子点微球上羧基的引入成功应用于抗原抗体的偶联;② 由于抗原抗体之间存在特异性,实验组出现了两个峰,而对照组只出现了一个峰,验证了反应的特异性结合,排除了非特异性反应的干扰.
验证了羧基化量子点荧光编码微球羧基的活性及免疫反应的特异性后,本文进一步研究了对白血病高表达抗原白介素-6 (IL-6) 的三明治免疫夹心反应,免疫反应流程见图7.首先,将QDs (605 nm)编码的微球与抗IL-6 (一抗) 连接,水溶性QDs (550 nm) 与抗IL-6 (二抗) 连接,一抗和二抗之间不发生反应,但均可和IL-6 发生特异性反应,且与IL-6 的反应位点不同,避免了竞争反应的发生.先将IL-6与量子点微球反应,再加入量子点探针,反应结束后,通过荧光光谱仪检测.结果如图6 (c) 所示,同时出现了两个量子点的发射峰,成功将材料应用三明治反应连接IL-6 抗原.
2.6 基于量子点微球的流式检测白血病IL-6
验证了三明治免疫反应的可行性后,进一步将量子点微球用于流式检测白血病血清样本中的IL-6.首先用流式细胞仪检测了微球的粒径分布(图8 (a)和(b)),微球尺寸分布均一.定量检测生物分子的能力,如癌症生物标志物,需具有足够的稳定性和特异性,这对癌症诊断和术后监测非常重要.首先挑选出同一患者不同时期的血清,并用流式检测得到血清中的IL-6 浓度,将不同浓度相同体积的血清与量子点微球共孵育,再加入550 nm QDs.免疫反应后,通过流式细胞仪测定量子点探针的荧光强度,每组检测时收集5 000 个微球,结果如图8 (c) 所示.随着白血病血清浓度的增加,550 nm QDs 探针分子的荧光强度也逐渐增加,并计算平均荧光强度 (Mean Fluorescence Intensity,MFI)值,得到相应的曲线,如图8 (d)所示.IL-6 浓度为120~450 pg/mL 时,图线几乎为直线,说明MFI 与IL-6 的浓度在此范围内具有线性关系,因此,可以通过计算量子点的MFI 来表示血清中IL-6 的浓度.

图6 IL-6 与量子点微球免疫反应原理流程图Fig.6 Flowchart of immune reaction mechanism between IL-6 and quantum dot encoded microspheres

图7 免疫反应后的荧光光谱图Fig.7 PL photographs of quantum dots after an immune reaction
3 总结
综上所述,本文成功研究了一种检测白血病血清中高表达抗原的检测方法.在材料方面,制备了多孔的羧基化聚苯乙烯微球 (PS),并成功将量子点掺杂进整个微球 (QD@PS),PS 的SEM 图像和流式细胞术数据显示,PS 具有良好的球形和均匀的粒径部分,为其在诊断分析和成像方面的潜在应用奠定了坚实的基础.荧光显微镜图像表明,采用甲苯作为致孔剂时,量子点已经分布到整个微球,并且荧光明亮,强度均匀.稳定性实验表明,荧光能至少保持两周.同时,免疫分析对人IgG和IL-6 检测的性能表明,量子点微球表面的羧基有利于生物大分子的高效附着,从而成功应用于双抗夹心反应.最后结合流式,成功实现了量子点微球对白血病血清中IL-6 的定量检测,这对白血病及其他血液疾病的诊断有很大意义,并且具有临床转化和商业应用的潜力.
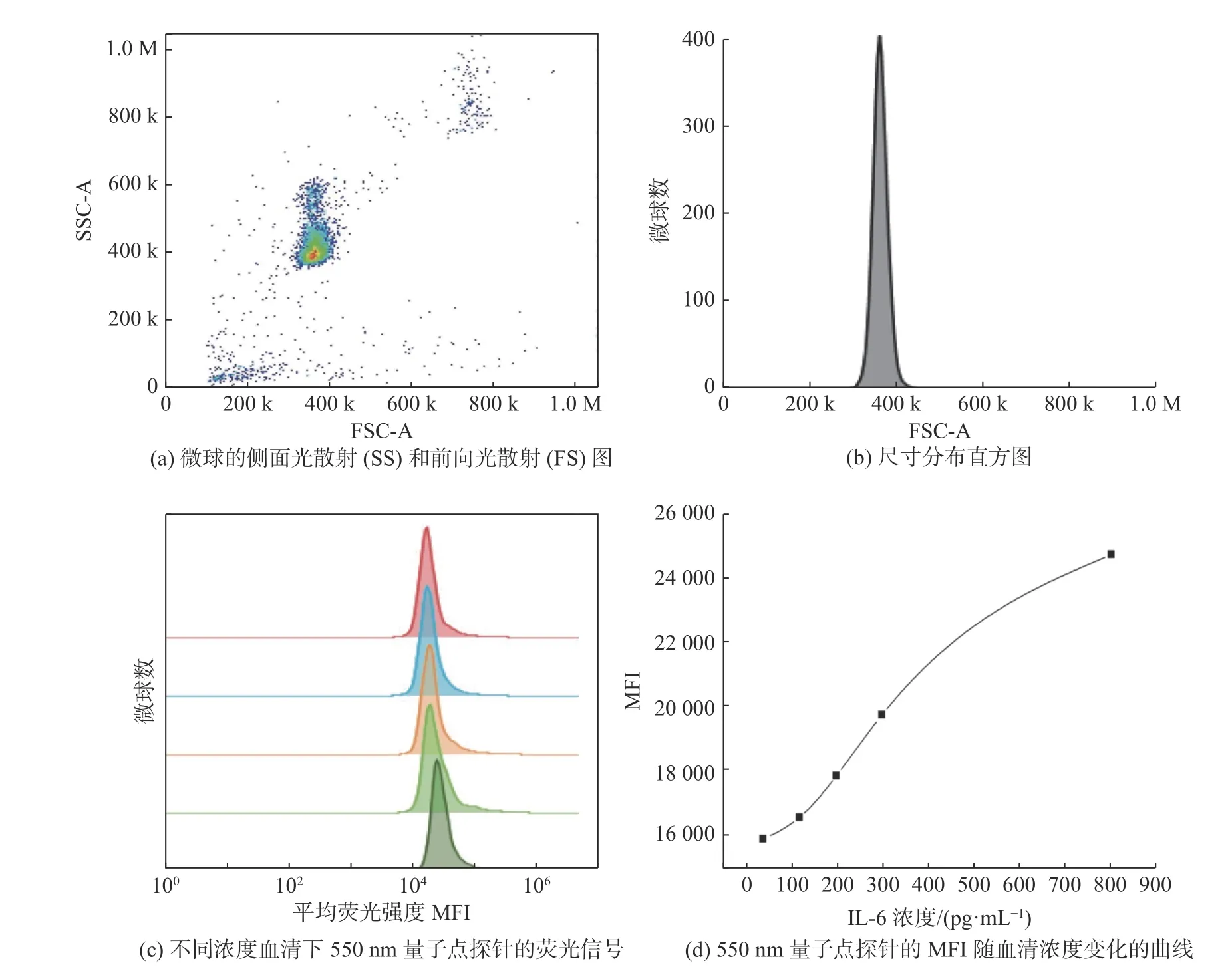
图8 微球与白血病患者血清中IL-6 抗原免疫反应后的流式分析Fig.8 Flow cytometry analysis of immunoreactive IL-6 antigen in the serum of leukemia patients with microspheres

