基于网络药理学和分子对接预测豆蔻干预原发性肝癌的作用靶点
包乌恩奇,包哈申,康萨如拉
(1.内蒙古医科大学 蒙医药学院,内蒙古 呼和浩特 010110;2.内蒙古自治区国际蒙医医院,内蒙古 呼和浩特 010020)
豆蔻(Alpinia KatsumadaiHayat)是姜科(Zingiberaceae)豆蔻属(Amomum)植物中白豆蔻的干燥成熟果实,蒙药又名苏格木勒。豆蔻味辛苦、性温、腻、锐、轻、燥,具有祛肾寒,镇赫依,助胃火,消食开胃,止吐等功能[1]。现代研究表明豆蔻中含有萜类、双苯庚烷类、酚类、黄酮类、二苯庚烷类和挥发油类,因其成分丰富而含有具有广泛的药理活性,具有保护胃黏膜、抗胃溃疡、促进胃肠功能、镇呕吐、抑菌、抗氧化、抗炎和抗肿瘤等多种药理作用[2],特别是豆蔻良好的抗肿瘤作用引起研究者的广泛关注[3]。
原发性肝癌(primary liver cancer,PLC)是最常见的原发性恶性肿瘤,在高恶性肿瘤死亡率中排名第六。2020 年全球一半以上肝癌引起的医疗卫生负担都发生在中国[4]。早期PLC 患者可采用局部手术切除、肝移植、射频消融和经动脉化疗栓塞治疗干预疾病的进展。但肝癌的发病隐匿,恶性程度高,发展迅速,易发生浸润、转移等特点,使大多数肝癌病人失去了最佳手术时机。同时最常见的治疗药物为全身药物治疗的抑制血管生成的酪氨酸激酶抑制剂,包括索拉非尼、乐伐替尼和瑞戈非尼等,通常会引起不良反应,如腹泻、皮疹、疲劳、手部不适等[5]。因此探索治疗PLC 的新药或辅助疗法的研究迫在眉睫。
经过前期对文献的整理,推测豆蔻对于肝癌可能具有潜在治疗价值,本研究通过网络药理学及分子对接的方法预测了豆蔻对干预肝癌的活性化合物以及关键靶点等临床价值,为豆蔻抗肿瘤研究奠定理论基础,以期为后续实验研究和临床组方应用提供参考。
1 材料与方法
1.1 豆蔻活性化合物的筛选
通过(TCMSP,https://tcmsp-e.com)对豆蔻的化合物成分信息进行有效筛选,以口服吸收利用度(oral bioavailability,OB)≥30%、药物类药性(drug-likeness,DL)≥0.18 进行二次筛选,最终得到药物的潜在的活性化合物。
1.2 肝癌的靶点收集和预测库的建立及共靶的获取
通过TCMSP、Swiss Target Prediction 等数据库,对其主要组成进行相应的靶标信息。同时以“liver neoplasms”“liver cancer”作为关键词在The Comparative Toxicogenomics Database(CTD,http://ctdbase.org/)中整理肝癌的相关靶点信息,以数据库收集的肝癌的生物标记物作为背景数据库。为保证筛选疾病靶点的特异性以及准确性,目标相关基因仅选取具有直接实验证据的类型,物种限制为Homo sapiens。将收录的豆蔻靶点数据置于背景数据集筛选,取交集后得到豆蔻可能作用肝癌的靶点信息。
1.3 豆蔻活性成分-靶点-疾病网络的建立
利用Cytoscape 3.7.2 软件,构建了豆蔻活性成分-靶点-疾病网络拓扑结构。节点代表豆蔻活性成分和干预肝癌靶点共靶,边代表活性成分与靶点相互作用关系。
1.4 靶点蛋白相互作用网络图
对豆蔻作用肝癌靶点共靶进行蛋白相互作用,可以更好了解药物发挥药理作用的关键靶点,将已筛选出的共同靶点基因导入String(https://string-db.org/),物种类型限定为Homo sapiens,获得蛋白互作关系(protein-protein interaction Networks,PPI),并利用Cytoscape3.7.2 将互作关系呈现。节点的大小代表其度值,节点越大,表示其度值越大即在网络拓扑中越重要。将度值的前五靶点进一步分析临床价值。
1.5 生物功能及通路富集分析
将药物作用肝癌的有效靶点进行生物功能分析以便了解靶点途经的功能及信号通路,为后续明确精准开发药物指明方向。采用R 语言cluster Profiler 进行了富集分析,其中包含生物过程、分子功能和细胞成分等。同时将参与抗肝癌的主要KEGG 通路的数据以图像呈现,为研究豆蔻干预肝癌的分子机制铺垫基础。
1.6 分子对接
分析豆蔻活性成分-靶点-疾病网络图中度值,选取度值前5 的药物分子作为豆蔻发挥作用的重要介质,与其对应的蛋白靶点进行分子对接。对接前需要对化合物和蛋白质进行处理,首先需要从PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库中核对活性成分的化合物名称以及相对分子质量后获取2D结构,然后在RCSB PDB 数据库(http://www.rcsb.org/)中下载所对应蛋白的3D 结构。在AutoDock 中进行对接工作,将目标蛋白的结构预处理,包括去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数。将选中化合物及对应靶点进行分子对接,其亲和力值即代表两者结合的结合能力,结合能力越低,配体与受体结合越稳定。最后,使用Pymol 软件展示对接位置。
1.7 核心靶点在肝癌中的临床意义
筛选出控制PPI 网络的关键基因,确定了目标靶点的位置,并在在GEPIA 数据库(http://gepia.cancer-pku.cn/)中,将其与正常样品的表达进行比较。具体条件为|Log2FC| Cutoff:1,p-value Cutoff:0.01,Log Scale:YES,Differential Methods:ANOVA,Jitter Size:0.4,Datasets:LIHC,Matched Normal data:Match TCGA normal and GTEx data。同时分析了目标基因的生存曲线信息,具体条件为Methods:Overall Survival,Group Cutoff:Median,Cutoff-High(%)以Cutoff-Low(%):50,Hazards Ratio(HR):Yes,95%Confidence Interval:Yes,Axis Units:Months。
2 结果分析
2.1 豆蔻活性成分的筛选
TCMSP 共收录豆蔻71 个化合物,通过搜索以及整理结果得到豆蔻有效成分12 个,主要包括Pinocembrin、Jaranol、luteolin 以及quercetin 等,详细的化合物信息见表1。

表1 豆蔻活性成分相关信息Tab.1 Information related to active ingredients of Alpinia Katsumadai Hayat
2.2 豆蔻抗肝癌的潜在作用靶点
经过整理后,得到发现筛选豆蔻化合物作用的靶点去重后共185 个,CTD 数据库数据库收录肝癌生物标记物共731 个。经过Unipro(thttps://www.uniprot.org/)数据库将相关靶点信息名称标准化,将化合物靶点以及疾病靶点进行对比,后取交集得到59 个共同靶点。
2.3 豆蔻活性成分-靶点-疾病网络的建立
采用Cytoscape 3.7.2 软件建立活性成分-疾病靶点-疾病网络拓扑图,如图1 所示。通过网络分析发现,豆蔻的12 个化合物的59 个靶点参与抗肝癌,其中quercetin(Degree=205,Average Shortest Path Length=1.461 数字意义下同)、luteolin(84,2.37)以及dehydrodiisoeugeno(l32,2.67)可能是豆蔻抗肝癌的关键药效物质,被豆蔻影响重要的靶点有PTGS2(22,1.94)、ESR1(12,3.48)、PPARG(11,2.13)以及HSP90AA1(9,2.02)。网络拓扑图的结果说明豆蔻含的不同的活性化学成分可作用于相同的靶点,同一活性化学成分也作用于不同的靶点,体现其多成分、多靶点的抗肝癌特点。

图1 豆蔻活性成分-靶点-疾病网络拓扑图Fig.1 Network topology of Alpinia Katsumadai Hayat active ingredient-target-disease
2.4 豆蔻抗肝癌靶点的PPI 网络
根据String 收录的数据,将共靶的共同靶点的59 个目标进行PPI 网络分析(图2),包含55 个节点,838 边,其中节点表示靶点,蛋白与蛋白之间线条表示靶点之间相互作用,线条越多表示之间的关联度越大,同时借助Cytoscape 3.7.2 的cytoHubba 中的MCC 算法对节点的重要程度进行计算,当颜色越深时节点越重要,结果发现排名较高的节点为TP53、JUN、MYC、CCND1 以及FOS。以上靶点可能为豆蔻干预肝癌的关键靶点。
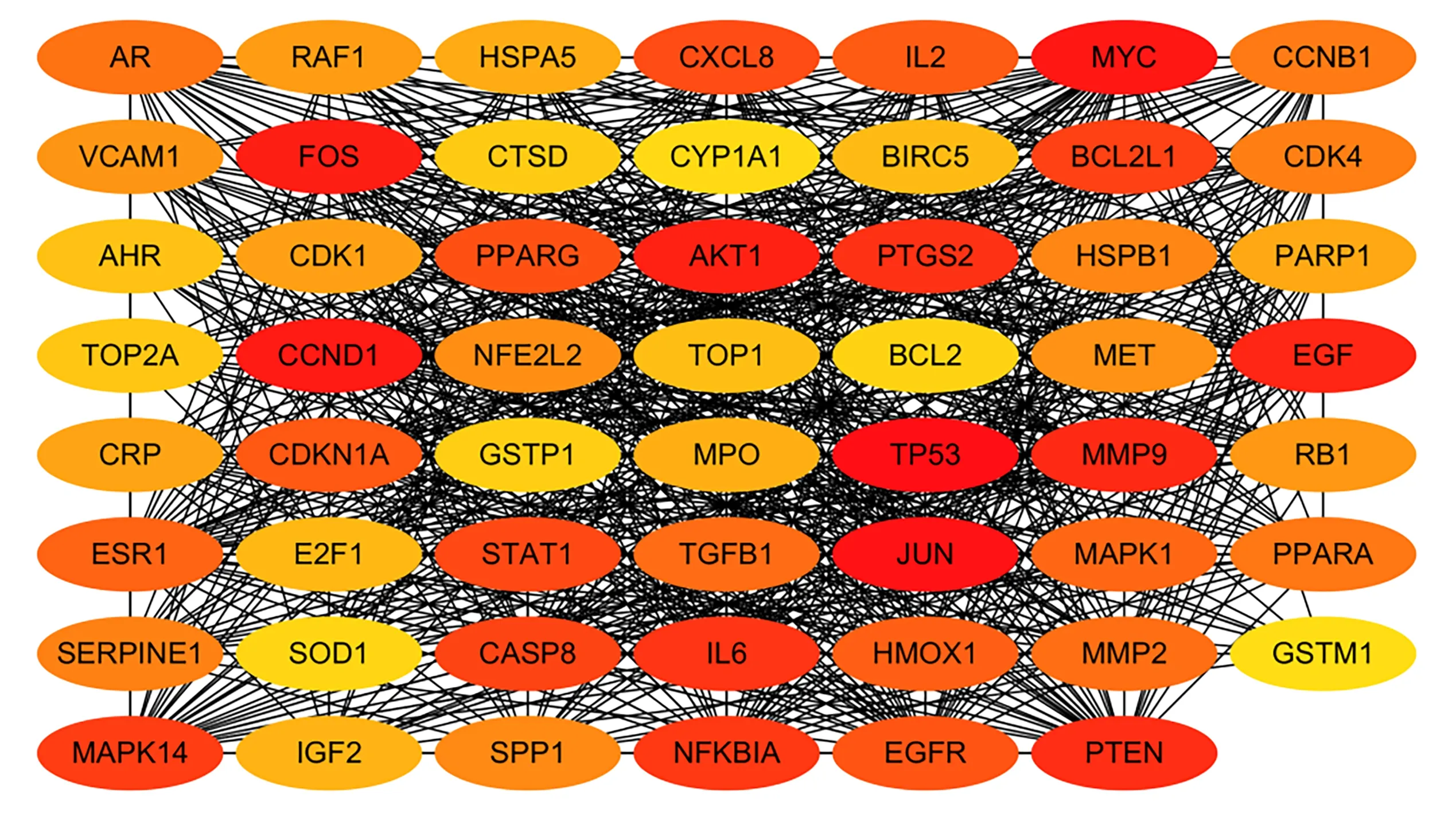
图2 豆蔻抗肝癌的靶点PPI 图Fig.2 PPI plot and frequency distribution of Alpinia Katsumadai Hayat
2.5 生物功能富集分析
在满足p.adj<0.05 &q value<0.2 条件下,BP 共有1 665 条,CC 共有40 条,MF 共有93 条,KEGG 共有128 条。具体结果为豆蔻抗肝癌的靶点定位主要为 cyclin -dependent protein kinase holoenzyme complex、transcription factor complex 以 及RNA polymerase II transcription factor complex 等,生物过程为response to metal ion、response to nutrient levels 以及response to antibiotic 等,分子功能为 phosphatase binding、RNA polymerase II transcription factor binding 以及protein phosphatase binding,KEGG 信号通路有Bladder cancer、Hepatitis B 以及Liver cancer等(图3)。
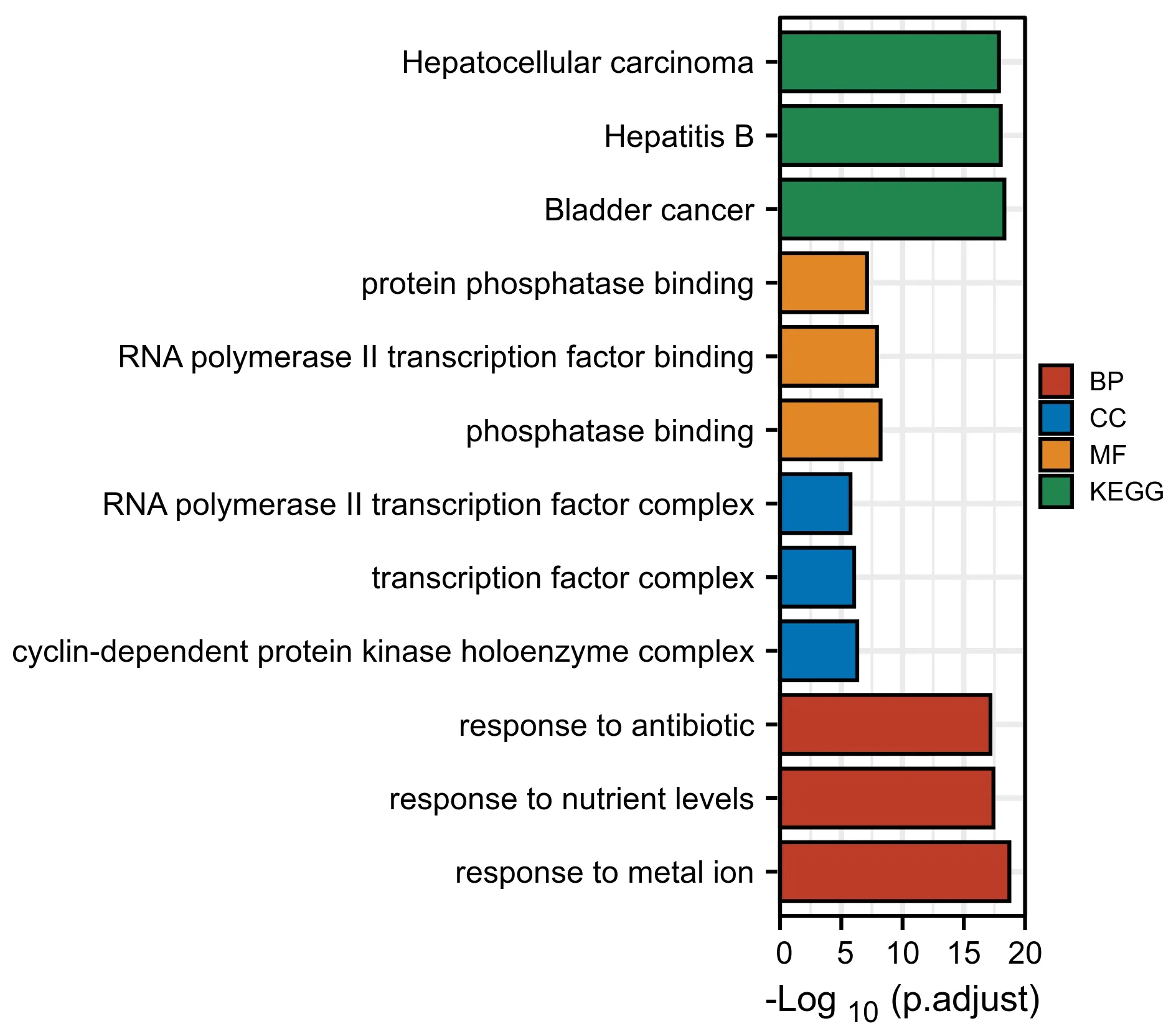
图3 豆蔻抗肝癌的靶点的GO 和KEGG 富集图Fig.3 GO and KEGG enrichment diagram of Alpinia Katsumadai Hayat anti-liver cancer targets
2.6 分子对接
将豆蔻抗肝癌可能的前5 个主要活性成分luteolin(Mol000006)、quercetin(Mol000098)、(4E,6E)-1,7-bis(3,4-dihydroxyphenyl)hepta-4,6-dien-3-one(MOL000224)、1,7-diphenyl-5-hydroxy -6 -hepten -3 -one(MOL000238)以及dehydrodiisoeugenol(Mol000258)与对应及同属高频率靶点AKT1 和PPARG 进行分子对接,一般认为结合能越小,则对接效果越好,小分子会更大可能影响蛋白八点的结构或者功能。对接结果显示为Mol000006-AKT1 的对接能量为28.03 J/mol,Mol000098-AKT1 的对接能量为28.86 J/mol,MOL000224-PPARG 的对接能量为35.14 J/mol,MOL000238-PPARG 的对接能量为30.54 J/mol,Mol000258-PPARG 的对接能量为39.74 J/mo(l图4)。结果可见豆蔻抗肝癌的主要化合物及对应靶点形成构象能量低,结构稳定,结合活性较高。
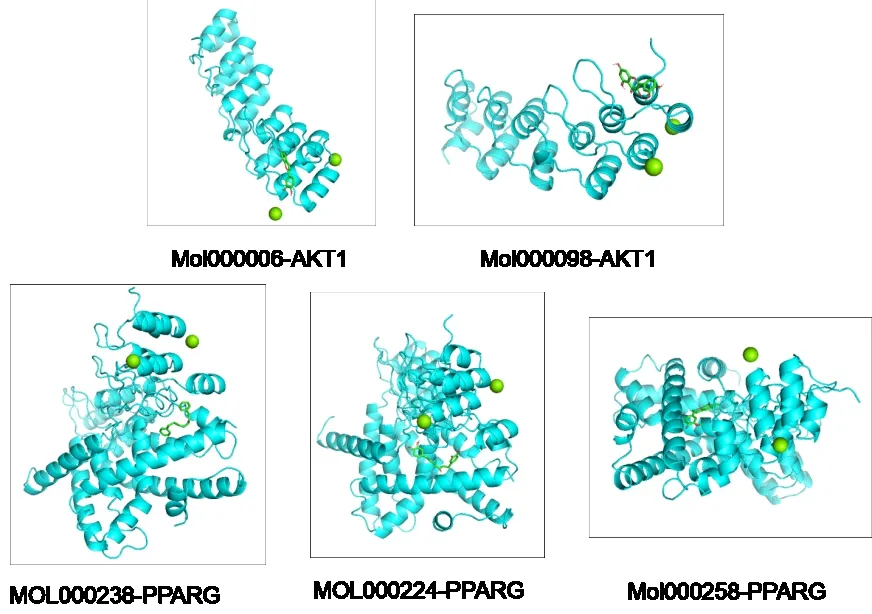
图4 豆蔻抗肝癌的关键化合物与靶点的分子对接图Fig.4 Molecular docking diagram of key compounds and targets of Alpinia Katsumadai Hayat against liver cancer
2.7 核心靶点在肝癌中的临床意义
根据2.4 中筛选的结果,将TP53、AKT1、JUN、MYC 以及ESR1 筛选继续分析(图5-6)。结果提示目标基因在肝癌中的表达可能具有微弱差异,其中ESR1 在肝癌中显著低表达(P<0.01)。另外发现高表达JUN 患者比较低表达患者的生存时间显著降低(P<0.05),以及低表达ESR1 患者比较高表达患者的生存时间显著降低(P<0.01)。
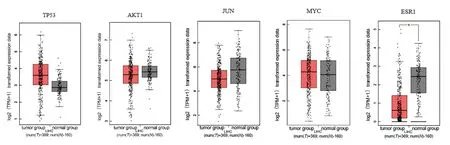
图5 关键靶点在肝癌中的表达Fig.5 Expression of key targets in liver cancer
3 讨论
肝癌作为世界第三高发恶性肿瘤类型,每年以80 万例新增病例的水平增长,并且病死率高达8.2%[6]。目前治疗肝癌的常规治疗方法虽然已经对肝癌患者的生命质量有显著提高,但是大多肝癌患者被诊断时已经是晚期,手术切除、肝移植很难进行,而靶向以及免疫药物治疗容易出现耐药性,或者明显的不良反应极大阻碍药物的持续性使用。这可能是由于肿瘤微环境呈现复杂动态的变化,可以随时逃避机体免疫及外用药物的伤害,因此针对肿瘤多靶点治疗是未来控制肿瘤的主流方式之一。现有研究表明传统医药能够预防肝癌发生,包括抑制恶性肿瘤细胞的增殖,阻遏肿瘤细胞的转移途径——上皮间质转化,阻滞细胞周期,同时还可以诱导肿瘤细胞自噬及衰老,也可以帮助现有化疗药减少耐药性的发生等[7]。依据我国传统医药治疗肝癌的治疗史,借助现代科技挖掘中医药干预肝癌的药效物质是科学可靠的。
肝癌在蒙医学中属于“痞病”范畴,蒙医药认为[8“]痞病”是在机体某一个器官和病根受损部位,病变物质瘀积聚结成疾的总称。在古籍文献中记载:“痞,即体内瘀积聚结之病。”此系由痼疾之果类瘀积型痼疾所引起的慢性病。“痞病”性质属于寒症范畴,主因消化不良,巴达干、血、赫依、黄水、虫等相博而引发痞病。临床上以调胃火的前提下以化痞、燥痞、破痞、泻痞为主,根据特征和具体情况以对症治疗为根本原则。
结合对蒙医的理论以及现代医学研究,豆蔻可能是干预肝癌的一个良好选择。目前已有的研究结果显示,豆蔻的活性成分对肿瘤细胞的增殖、侵袭、转移、细胞凋亡、调控细胞的能量代谢等都有一定的影响。如豆蔻中的α-蒎烯可以通过改变目标蛋白的其磷酸化从而影响细胞周期相关蛋白,并呈浓度依赖性地阻滞细胞周期于G2/M 期,达到抑制肝癌细胞生长的效果[9]。同时豆蔻中的高良姜素可以通过影响TGF-β/Smad信号通路诱导HepG2 肝癌细胞自噬引起细胞凋亡[10]。另外肿瘤细胞偏好借助糖酵解途径消耗葡萄糖用以改变适合肿瘤细胞生长的微环境,帮助肿瘤细胞促进免疫逃逸,豆蔻中白杨素可以抑制己糖激酶2 进而发挥抑制肝癌细胞糖酵解达到遏制肿瘤细胞转移的效果[11]。
本研究中最终筛到木犀草素(luteolin)、槲皮素(quercetin)、(4E,6E)-1,7-bis(3,4-dihydroxyphenyl)hepta-4,6-dien-3-one、1,7-diphenyl-5-hydroxy-6-hepten-3-one 以及dehydrodiisoeugenol 可能在抗肝癌过中发挥重要作用。木犀草素(luteolin)是一种黄酮类化合物,可以诱导Bax/Bak 线粒体易位和JNK 信号通路的来诱导肝癌细胞凋亡[12]。同时木犀草素还可以抑制细胞基质硬度改变通过CXCR4 所介导的肝细胞的异常增殖和EMT 的生物学效应,这可能与抑制YAP-UBTD1 信号通路相关[13]。此外木犀草素可以作为自噬调节剂诱导人肝癌SMMC-7721 细胞凋亡,也可以协同5-氟尿嘧啶对人类HCC 细胞发挥抗肿瘤作用[14-15]。研究表明dehydrodiisoeugenol 具有良好的抗氧化和抑菌能力[16]。槲皮素(quercetin)作为一种常见的黄酮类化合物,已经明确具有保护肝脏疾病的作用,现有大量研究已经明确槲皮素作为单体药物的抗肝癌作用,如槲皮素可以在肝细胞癌LM3 细胞中减弱JAK2/STAT3 信号通路显示出抗肿瘤作用[17]。槲皮素也可以抑制肝癌细胞中己糖激酶2 和Akt-mTOR 通路从而减少细胞糖酵解达到抑制细胞的的增殖[18],另外槲皮素可以通过抑制的MEK1/ERK1/2 信号通路介导的蛋白酶体的糜蛋白酶样活性抑制肝癌HepG2 细胞增殖[19]。
在本研究中,GO 和KEGG 分析用于预测豆蔻治疗肝癌的潜在机制。GO 分析结果表明,常见靶点在细胞周期蛋白依赖性蛋白激酶复合体、转录因子复合体以及RNA 聚合酶II 转录因子复合物中显著富集,表明这些基因参与多种细胞代谢。在GO-MF 结果,基因参与磷酸酶结合、RNA 聚合酶II 转录因子结合以及蛋白磷酸酶结合。在GO-BP 中,常见靶基因在对金属离子的反应、对营养水平的反应以及对抗生素反应中最为丰富,这表明豆蔻可能与细胞凋亡、肝脏代谢、和药物代谢有关。KEGG 分析表明,豆蔻可能通过多种途径产生抗肝癌作用,包括膀胱癌、乙型肝炎以及肝细胞癌信号通路中的途径。既往研究报道,HBV 感染与肝癌发展呈正相关,整合到宿主基因组中的HBV 可导致抑癌基因失活或原癌基因激活[20]。
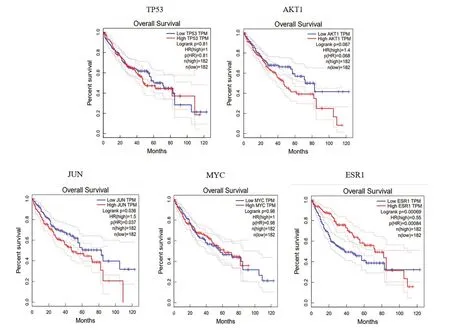
图6 关键靶点在肝癌中的生存曲线Fig.6 Survival curves of key targets in liver cancer
利用PPI 网络对豆蔻发挥药效的几个关键靶基因进行鉴定,相关实验和文献显示,Akt 在肝癌细胞中的表达明显高于正常肝组织中的表达。Akt1 的过表达可能促进HepG2 肝癌细胞的迁移和侵袭[21]。豆蔻会通过调控PI3K/Akt/mTOR 的信号转导途径,从而诱导肿瘤细胞凋亡,从而对肿瘤的增殖起到一定的抑制作用。另外研究发现JNK 的磷酸化可能与AP-1 激活以及肝癌细胞中c-Jun 和JunD 的表达相关。JNK/c-Jun/JunD/AP-1 信号通路可能在乙肝相关性肝癌的发病机制中起重要作用[22]。MYC 也通过诱导URI1 表达参与了HBV 相关肝癌的发生和进展[23]。低ESR1 表达与肝癌较差的总生存期患者相关,可能是与ESR1 可以通过抑制间充质而发挥抑制肝癌细胞有关[24]。TP53 作为常见的抑癌基因在肝癌中也处于失调状态,若纠正其正常表达可有助于延缓肝癌的发生发展[25]。研究表明,豆蔻对原发性肝癌有较好的疗效,但尚有一些局限,有待进一步的实验证实。本研究表明,豆蔻具有一定的抗肿瘤活性,其机制可能与多种靶点、多途径有关,为后续实验研究和临床组方提供了依据。

