内生真菌对青贮玉米幼苗抗旱性的影响
王英娜,王佳玮,夏依婷,刘 涛,李联欢,刘建利,康 鹏,李素芬
(1.北方民族大学生物科学与工程学院,国家民委黄河流域农牧交错区生态保护重点实验室,宁夏特殊生境微生物资源开发与利用重点实验室,宁夏 银川 750021;2.西鄂尔多斯国家级自然保护区管理局,内蒙古 鄂尔多斯 014300)
干旱作为最主要的非生物胁迫因素限制了干旱和半干旱地区农作物生长,导致生产力大幅降低,进而造成巨大的农业经济损失[1]。干旱区约占全球陆地表面积的41%,全球约38%以上的人口生存依赖干旱区。我国旱区约占国土面积的53%~68%,其中西北内陆荒漠草原、黄土高原、黄河流域的绝大部分区域都属于干旱区[2-3]。
植物微生物作为植物的“第二基因组”存在于根际或根内,有研究表明植物微生物有助于提高宿主植物对不良环境的抗性[4-6]。内生真菌作为这些有益微生物的重要组成部分广泛存在于植物组织中,相较于根际微生物,内生真菌可与宿主形成较强的共生关系[7-9]。研究表明内生真菌有利于提高宿主植物应对干旱胁迫的能力,尤其以专性共生的禾草内生真菌(Epichlo⊇spp.)、印度梨形孢(Piriformosporaindica)和深色有隔内生真菌(DSE)研究居多。李飞[10]和夏超[11]研究发现内生真菌(Epichlo⊇gansuensis)与醉马草(Achnatheruminebrians)共生提高了宿主抗旱性。张雪[12]、任颖[13]、He等[14]和Liu等[15]报道了DSE提高植物抗旱性。蒿若超等[16]、韦巧等[17]、徐乐等[18]和Xu等[19]报道了印度梨形孢提高植物抗旱性。
西鄂尔多斯是我国干旱半干旱地区生物多样性保育的关键地区以及全球温带草原灌木物种起源地和分布中心。该地区的植被类型主要包括沙生植被、草原化荒漠植被、荒漠植被和干旱草原植被,且超旱生灌木、半灌木在植物群落中占据生态位优势。由于该区地处草原向荒漠的过渡带,加之边缘效应及古地理等原因,故该地区生长着丰富的古地中海孑遗植物、亚洲中部珍稀濒危荒漠植物及我国特有植物,如沙冬青(Ammopiptanthusmongolicus)、四合木(Tetraenamongolica)、绵刺(Potaniniamongolica)、半日花等(Helianthemumsongaricum)[20],这些超旱生植物共生微生物资源急需开发利用。
青贮玉米作为食草家畜的优质饲料在宁夏和内蒙河套地区农牧交错带干旱半干旱地区种植面积较大,但由于其种植需水量大,对水分胁迫敏感,产量受干旱影响较大[21]。因此,加强青贮玉米抗旱性的微生物菌剂研究对于干旱半干旱地区青贮玉米种植具有重要意义[22]。本研究用从西鄂尔多斯荒漠强旱生植物四合木、绵刺和沙冬青根内分离出的8株内生真菌和1株内生真菌模式种印度梨形孢接种青贮玉米幼苗,评价植株在聚乙二醇6000(PEG6000)模拟干旱胁迫下植株的抗旱能力,检测荒漠强旱生植物内生真菌能否帮助异源宿主植物提高抗旱性,研究成果可为开发利用荒漠超旱生植物共生微生物资源奠定理论基础。
1 材料与方法
1.1 供试材料
供试内生真菌菌株共9株:菌株Tm02、Tm30、Tm36分离自四合木根内,菌株Pm06、Pm37、Pm38和Pm53分离自绵刺根内,菌株Am04分离自沙冬青根内,印度梨形孢购自中国普通微生物菌种保藏管理中心。青贮玉米品种为‘宁丹33’,购自宁夏润丰种业有限公司。
1.2 试验方法
1.2.1 供试内生真菌制备 将供试菌株接种到PDA固体培养基上27℃培养7 d,待菌丝长满平板后用灭菌后的1 mL枪头打成菌饼,将5个菌饼接入200 mL PDA液体培养基中,在温度28℃和转速180 r·min-1条件下培养5 d,将培养液用榨汁机打碎,用PDA液体培养基调整OD600值为0.932用于接种。
1.2.2 盆栽青贮玉米幼苗 挑选大小一致且颗粒饱满的玉米种子自来水冲洗后采用无菌水浸泡12 h,用2.5%次氯酸钠溶液表面消毒3 min,无菌水冲洗3~4次,再用70%酒精消毒5 min,无菌水冲洗3~4次,最后用0.1%氯化汞溶液消毒1 min,无菌水冲洗3~4次。将消毒后的种子置于水琼脂培养基上,在28℃培养箱中催芽,2 d后胚根长度达2 cm左右。
蛭石80℃干热灭菌6 h后,装入酒精消毒后的花盆(盆高14.0 cm,上口径20.1 cm,下口径12.9 cm)。将催芽后的种子种入花盆中,每盆3粒种子,试验设置9株内生真菌和1个阴性对照组共10个处理,接种阳性对照印度梨形孢处理为E+,未接种阴性对照处理为E-,其余每组处理按菌株编号标记,每个处理分为干旱胁迫组(D+)与非干旱胁迫组(D-),每组各6盆,共120盆。
1.2.3 回接内生真菌试验 种子移入盆中10 d后,轻轻拨开三叶期青贮玉米幼苗根部土壤,使其根系裸露出来,将10 mL内生真菌培养液围绕青贮玉米幼苗根系四周进行浇灌,对照组以等体积的无菌PDA液体培养基灌根处理,每株内生真菌接种12盆,接种后3 d不浇水或营养液,平时用烧杯浇800 mL无菌水,每3 d浇一次30 mL无菌的Hoagland’s营养液,将每个处理盆栽随机摆放,为规避位置效应,每7 d挪动位置,培养25 d左右至拔节期。
1.2.4 PEG6000模拟干旱胁迫试验 将E-、E+和每个接种内生真菌拔节期青贮玉米幼苗各取6盆置于托盘中,向托盘内倒入深度为10 cm的30% PEG6000(-1.2 MPa)溶液,确保盆中蛭石能将PEG6000溶液上吸,另6盆托盘中放置等体积的无菌水作为非干旱胁迫对照,约2周后,当E-干旱胁迫处理植株叶片全部萎蔫卷曲时停止胁迫。
1.2.5 植株生理指标测定 地上部分生理指标参考黄倩等[23]和郝建军等[24]方法进行测定,采用丙酮提取法[24]测定叶绿素含量,采用茚三酮法测定脯氨酸含量,采用硫代巴比妥酸法测定丙二醛含量,采用愈创木酚法测定过氧化物酶活性,采用分光光度法测定过氧化氢酶活性,采用氮蓝四唑光化还原法测定超氧化物歧化酶活性。根系生理指标参考陈鹏狮等[25]方法测定。
1.2.6 染色镜检青贮玉米幼苗根系侵染 参考陈思杰等[26]和Mcgonigle等[27]方法稍作修改:将青贮玉米幼苗根系用自来水冲洗干净,随机挑选直径小于2 mm的细根剪成1 cm长的根段,各处理分开放置,共10个试管,向各试管中加入10% KOH溶液淹没根样,90℃水浴加热1 h后倒掉KOH溶液,用无菌水冲洗干净控干水分,加入10%碱性H2O2溶液室温放置30 min,倒掉H2O2溶液无菌水冲洗干净控干水分后加入1% HCl溶液浸泡5 min,倒掉HCl溶液后加入0.05%台盼蓝染液室温染色25 min,倒去染液,将染色后的根样置于乳酸甘油混合液中脱色12 h,每10个根段置于一个载玻片上,盖上并轻敲盖玻片,将根段组织均匀分散在载玻片上,观察并统计侵染率。
侵染率(%)=受侵染根段数/总镜检根段数×100%
(1)
1.3 数据统计分析
相对含水量(RWC)=[(样品鲜重-样品干重)/(样品饱和鲜重-样品干重)]×100%
(2)
抗旱系数计算公式:只选E-干旱胁迫处理组和非干旱胁迫处理组测定值有显著差异的指标计算抗旱系数。
MDA含量抗旱系数(DTC)=-(干旱胁迫测定值/未干旱胁迫测定值)
(3)
其余指标耐旱系数(DTC)=干旱胁迫测定值/未干旱胁迫测定值[28-29]
(4)
采用Excel软件进行数据处理,采用SPSS 13.0软件进行主成分分析[28,30]和方差分析,采用Origin 2019软件进行回归分析。
2 结果与分析
2.1 接种内真菌对青贮玉米幼苗地上部分抗旱性的影响
如图1所示青贮玉米幼苗地上部分,E-所有干旱胁迫植株叶片均表现出卷曲萎蔫甚至出现枯死现象,而非干旱胁迫处理的植株生长正常。各接菌组胁迫植株均出现不同程度叶卷曲症状,其中接种菌株Pm53、Pm06、Am04、Tm30较严重,E+及接种其它菌株的植株能在一定程度上缓解干旱胁迫对植株的影响。
为进一步量化干旱胁迫对青贮玉米幼苗的影响,测定了非胁迫和干旱胁迫后的植株株高、基径粗、总叶片数、地上部分鲜重、地上部分干重等5个地上部分形态学性状,以及叶绿素含量和叶相对含水量等2个生理指标。研究发现,只有地上部分鲜重、叶相对含水量、叶绿素含量等指标在E-的非干旱胁迫和干旱胁迫之间存在显著差异,胁迫造成这3个指标都比对应的非胁迫值低。因此,只基于这3个指标计算所得的抗旱系数均小于1.0。如图2所示,各处理地上部分鲜重抗旱系数在0.6~0.8之间,其中E-、E+和菌株Am04处理最高,显著高于接种其它组,菌株Pm57处理最小,较E-组降低了30.59%;叶相对含水量抗旱系数也在0.6~0.8之间,其中E-和菌株Am04最高,显著高于其他接种其它菌株,E+次之、菌株Pm53最小;叶绿素含量抗旱系数在0.3~0.9之间(图3),其中菌株Am04 和Pm53最高,显著高于其他组,菌株Pm38和Tm30最小。

注:E-:未接种内生真菌;E+:接种印度梨形孢;Pm38:接种内生真菌Pm38;Pm57:接种内生真菌Pm57;Pm53:接种内生真菌Pm53;Tm36:接种内生真菌Tm36;Pm06:接种内生真菌Pm06;Am04:接种内生真菌Am04;Tm30:接种内生真菌Tm30;Tm02:接种内生真菌Tm02;D+:干旱胁迫处理;D-:非干旱胁迫处理,后同。Note:E-:not inoculated with endophytic fungi;E+ :inoculated with Piriformis indica;Pm38:inoculated with endophytic fungi Pm38;Pm57:inoculated with endophytic fungi Pm57;Pm53:inoculated with endophytic fungi Pm53;Tm36:inoculated with endophytic fungi Tm36;Pm06:inoculated with endophytic fungi Pm06;Am04:inoculated with endophytic fungi Am04;Tm30:was inoculated with endophytic fungi Tm30;Tm02:was inoculated with endophytic fungi Tm02;D+:was a drought stress treatment,D-:was a non-drought stress treatment,the same later.图1 干旱胁迫下接种内生真菌对青贮玉米幼苗地上及地下部分影响Fig.1 The morphology of aboveground part and underground part of silage maize seedling inoculated with endophytic fungi under drought stress
2.2 接种内生真菌对青贮玉米幼苗根系抗旱性的影响
如图1所示青贮玉米幼苗地下部分根系,与非干旱胁迫相比,干旱胁迫后的青贮玉米幼苗植株根系均出现不同程度的体积增大和根数增多现象。

注:不同小写字母表示差异显著。下同。Note:Different lowercase letters indicate significant difference.The same below.图2 接种内生真菌对青贮玉米幼苗地上部分鲜重抗旱系数及叶相对含水量抗旱系数的影响Fig.2 Effects of endophytic fungi on the drought resistance coefficient of fresh weight and relative leaf water content of the aboveground part of silage maize seedlings inoculated with endophytic fungi
根表面积、根体积、根鲜重、根干重和根干物质含量等5个指标在E-的非干旱胁迫和干旱胁迫植株之间存在显著差异,且在大多数接种组中,干旱胁迫造成除根鲜重外的4个指标都比对应的非干旱胁迫植株高。因此,基于这5个指标所得的抗旱系数均大于1.0(除根鲜重)。如图4所示,根体积抗旱系数在1.5~5.5之间,除菌株Pm57和Pm53外,其他菌株均显著高于E-组,其中菌株Tm36最大,为E-的3.55倍;根表面积抗旱系数在1.2~2.5之间,除菌株Pm57和Pm53小于E-,菌株Pm06和E-无差异外,其余菌株均显著大于E-,其中菌株Tm36和Am04较高;根鲜重抗旱系数在0.3~0.6之间,只有接种Am04与E-组差异不显著,其余均显著低于E-;根干重抗旱系数在1.2~2.5之间,其中E-、菌株Tm02和Am04较高,菌株Pm38和Tm30较低;根干物质含量抗旱系数在1.5~5.0之间,除菌株Pm53外,其余组菌株均大于E-组,其中E+最大,菌株Pm38、Tm36、Am04和Tm02次之。

图3 内生真菌对青贮玉米幼苗叶绿素含量抗旱系数的影响Fig.3 Effect of endophytic fungi on the drought resistance coefficient of chlorophyll content of silage maize seedlings inoculated with endophytic fungi

图4 内生真菌对青贮玉米幼苗根系各指标抗旱系数的影响Fig.4 Effect of endophytic fungi on every drought resistance coefficient of silage maize seedlings inoculated with endophytic fungi
2.3 接种内生真菌对干旱胁迫下青贮玉米幼苗渗透调节物质和保护酶的影响
植物体内的脯氨酸(Pro)含量、膜脂质过氧化产物丙二醛(MDA)含量、保护酶超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性等指标,干旱胁迫处理和非干旱胁迫处理之间均存在差异显著,故以这5个指标为基础计算抗旱系数。
如图5所示,干旱胁迫造成植株体内渗透压调节物质Pro含量增加,因此其抗旱系数介于1.0~4.0之间,其中菌株Tm02最大,菌株Pm38、Pm53和Tm30低于E-;干旱胁迫导致MDA含量增加或降低,其含量与植株抗旱性呈负相关关系,因此其抗旱系数介于-0.3~-5.0之间,其中菌株Pm53最大,菌株Pm57最小;干旱胁迫导致SOD、POD和CAT等3种保护酶活性增高,因此导致其抗旱系数整体表现为大于1.0。如图6所示,SOD抗旱系数介于1.0~6.0之间,其中菌株Tm02最高,是E-的1.63倍,其余菌株均低于E-。POD抗旱系数介于0.5~2.0之间,其中菌株Pm57和Pm06小于1.0,其余菌株则大于1.0,菌株Pm57、Tm36、Am04和E-无显著差异,其余菌株均低于E-;CAT抗旱系数介于0.5~2.5之间,菌株Pm57、Pm53、Pm06、Am04、Tm30小于1.0,其余菌株大于1.0,菌株E+、Tm36、Tm02最高,分别为E-的1.93倍、1.70倍和1.74倍。
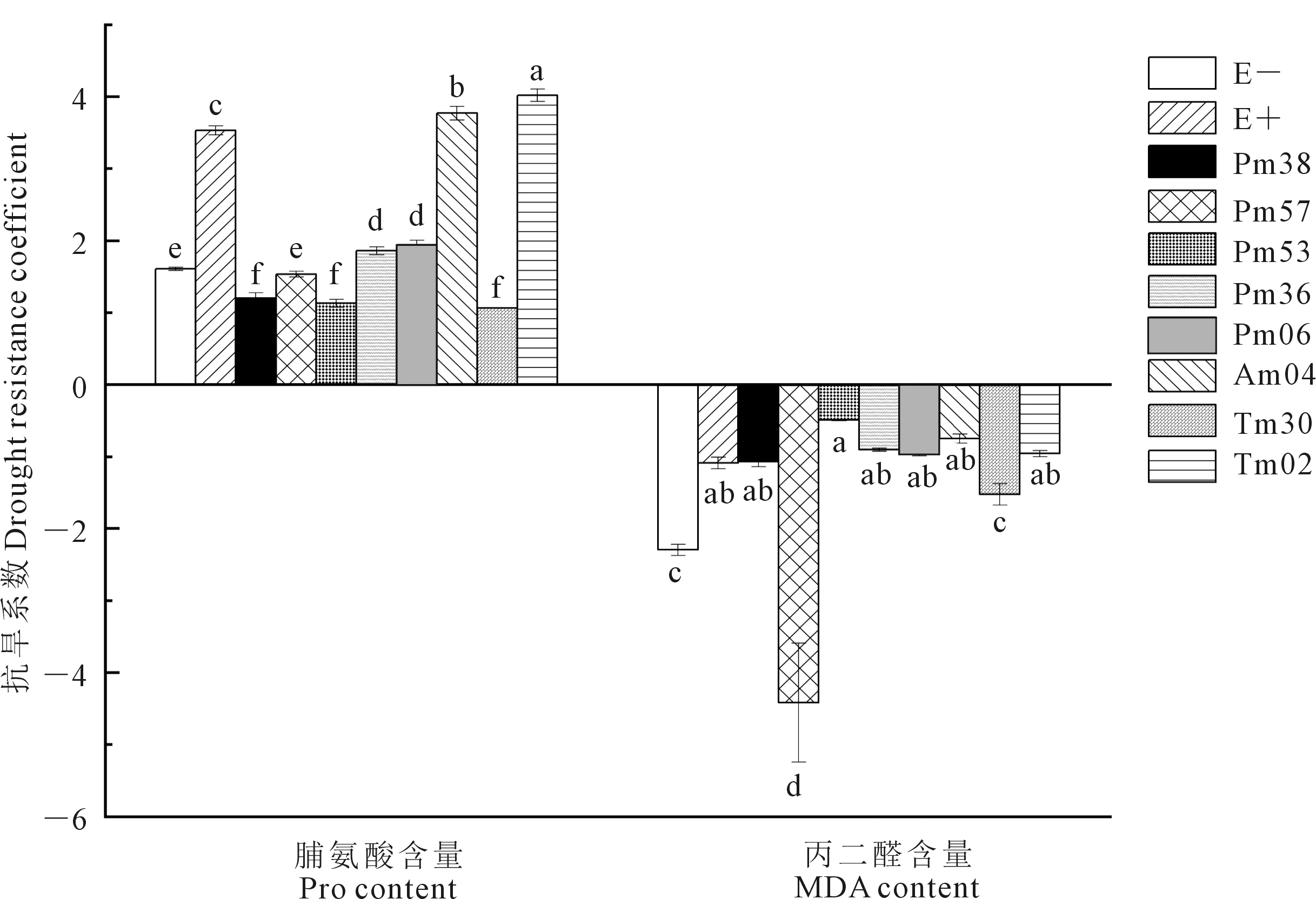
图5 内生真菌对青贮玉米幼苗渗透调节物质抗旱系数的影响Fig.5 Effect of endophytic fungi on the drought resistance coefficient of osmotic adjustment of silage maize seedlings inoculated with endophytic fungi

图6 内生真菌对青贮玉米幼苗体内保护酶抗旱系数的影响Fig.6 Effects of endophytic fungi on the drought resistance coefficient of protective enzymes of silage maize seedlings inoculated with endophytic fungi
2.4 各指标抗旱性系数相关性分析
如表1所示,根干重抗旱系数和地上部分鲜重抗旱系数呈显著正相关;根鲜重抗旱系数与根干重抗旱系数呈显著正相关关系;根体积抗旱系数与根表面积抗旱系数呈极显著正相关关系;根干重抗旱系数与SOD活性呈显著正相关关系;CAT活性抗旱系数和Pro含量抗旱系数均与根干物质含量抗旱系数呈显著正相关关系。
2.5 指标抗旱系数主成分分析
将13个指标抗旱系数进行主成分分析,前5个主成分的特征值均大于1,因此提取出5个主成分(F1~F5),其贡献率分别为32.812%、21.096%、14.049%、12.784%、9.589%,累计贡献率为90.329%(表2)。主成分载荷矩阵中青贮玉米幼苗植株各项指标主成分负荷的相对大小可以表示该指标对主成分影响的程度。由表2可知,F1的所有指标均起正向作用,其中根干重抗旱系数、地上部分鲜重抗旱系数和Pro含量抗旱系数对其正向作用较大;F2的根表面积抗旱系数和根干物质含量抗旱系数正贡献较大,根鲜重抗旱系数和根干重抗旱系数负贡献较大;F3的MDA含量抗旱系数和POD含量抗旱系数正贡献较大,相对含水量对其负向作用较大;F4中根体积抗旱系数正贡献较大,CAT活性抗旱系数和SOD活性抗旱系数负贡献较大;F5中叶绿素含量抗旱系数和SOD活性抗旱系数正贡献较大,地上鲜重抗旱系数和POD活性抗旱系数负贡献较大。
根据各指标因子得分系数矩阵,构建5个主成分的函数表达式,随后根据每个主成分的贡献率计算综合得分,结果见表3(见 53页),与未接种菌株的E-组相比,接种菌株Am04、Tm36、Tm02和E+的青贮玉米幼苗植株综合得分均高于E-,说明接种菌株Am04、Tm36、Tm02、印度梨形孢等4株内生真菌可提高青贮玉米幼苗抗旱性,并以菌株Am04最优;而接种菌株Pm53、Tm30、Pm38、Pm06、Pm57等5株内生真菌反而降低了青贮玉米幼苗抗旱性。
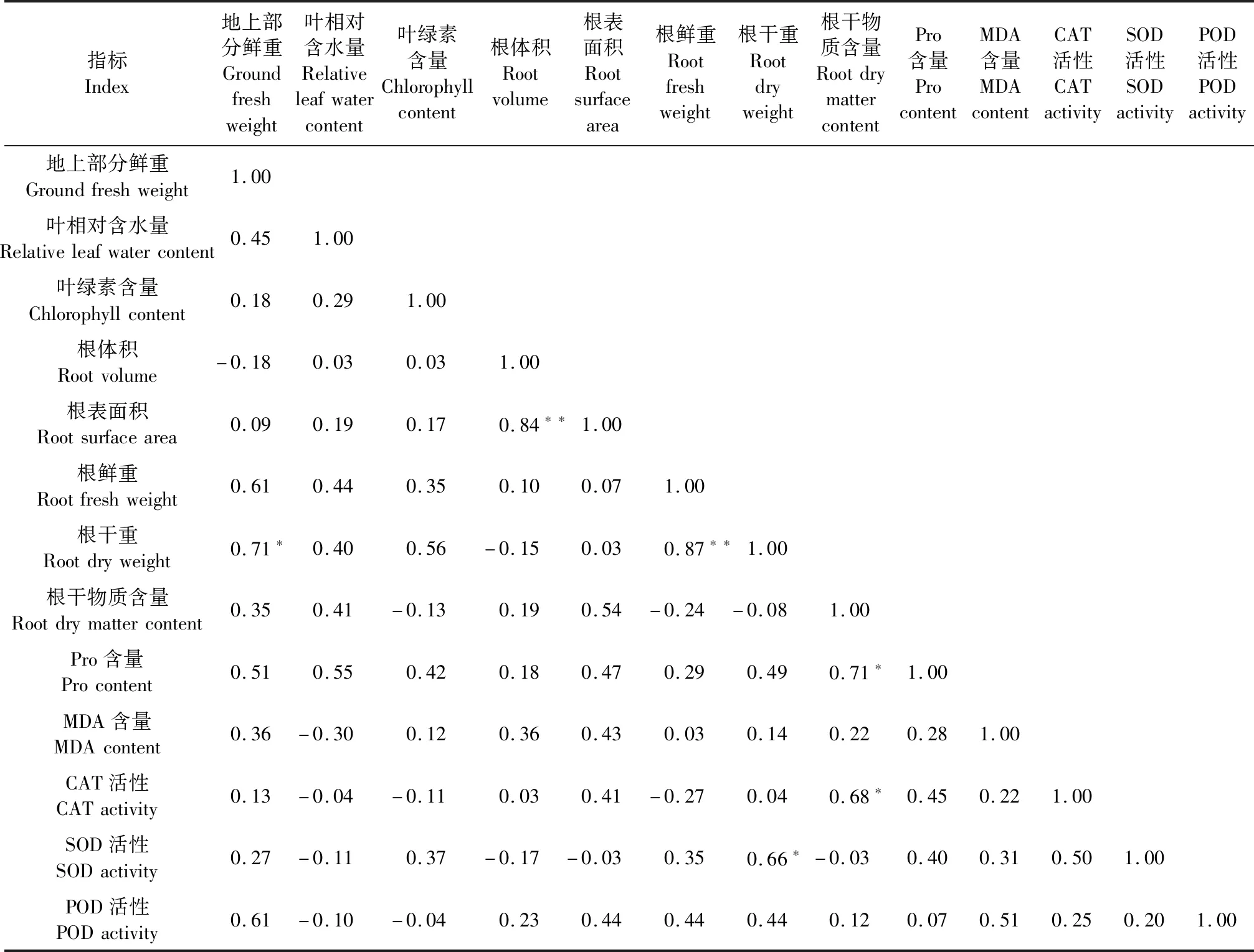
表1 各指标抗旱系数相关性Table 1 Correlation analysis of various drought resistance coefficient

表2 各指标抗旱系数的主成分特征值、方差贡献率、累计贡献率和成分载荷矩阵Table 2 Principal component eigenvalues,variance contribution rate,cumulative contribution rate and component loading matrix of drought resistance coefficient
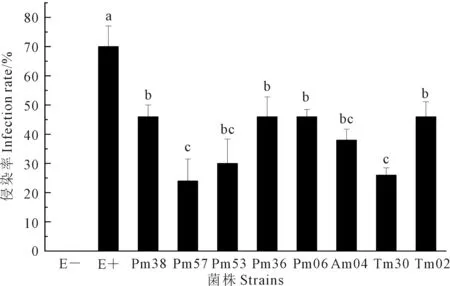
图7 青贮玉米幼苗根系内生真菌侵染率 Fig.7 Infection rate of endophytic fungi in the root system of silage maize seedlings
2.6 接种内生真菌系侵染率与抗旱系数相关性
菌液灌根20~25 d后,将青贮玉米幼苗根系进行染色,显微观察内生真菌侵入植物根系共生情况,E-内未见根内菌丝,E+和其余菌株接种菌发现发现根内存在菌丝,菌丝呈蜿蜒状或直线型,可见分叉,具横隔,具有丝状真菌典型形态,接种菌株Pm06植株根内可见微菌核,其余菌株未见微菌核。
对各处理侵染率进行方差分析,如图7所示,E-侵染率为0,接种E+的在单个植株的平均根系侵染率最高(70%),其余8株内生真菌在单个植株的平均侵染率仅在20%~50%之间,远低于E+。
将侵染率与各指标抗旱系数、抗旱系数主成分综合得分进行线性回归,只有根鲜重抗旱系数与侵染率之间存在显著线性相关(R2=0.346,P=0.043),其余各指标抗旱系数、抗旱系数主成分综合得分都与侵染率之间均不存在显著线性相关关系(表4,见54页)。
3 讨 论
本研究采用主成分分析法综合分析接种9株内生真菌的青贮玉米幼苗在PEG6000模拟重度干旱胁迫下与非干旱胁迫植株有显著差异的13个指标,接种Am04、Tm36、Tm02、印度梨形孢等4株内生真菌可提高青贮玉米幼苗抗旱性,而接种Pm53、Tm30、Pm38、Pm06、Pm57等5株内生真菌反而降低了青贮玉米幼苗抗旱性。接种印度梨形孢试验结果和徐乐等[18]、Xu等[19]、张文英等[31]报道的印度梨形孢提高玉米抗旱性一致,接种其它内生真菌的结果与胡美玲等[32]报道的部分内生真菌能提高玉米抗旱性一致。
在大多数接种菌剂提高植物抗逆性试验中,除与禾草共生的Epichlo⊇属内生真菌可以依靠检测种子带菌情况建立E+和E-植株外[10-11],其它非专性共生内生真菌与宿主植物共生体的建立均需在建立在种子消毒建立E-植株的基础上,人工回接建立E+植株,然后再施以各种胁迫处理检测内生真菌对植物抗逆性影响,因此,试验中大多设置接菌+干旱处理组、未接菌+干旱处理组、未接菌+非干旱处理组。数据分析过程中,首先对未接菌+干旱处理组和未接菌+非干旱处理组各生理指标绝对值进行比较,确定干旱胁迫对植物产生了影响,然后各个接菌+干旱处理组和未接菌+干旱处理组各生理指标绝对值比较,以及各个接菌+干旱处理组各生理指标绝对值之间比较,确定接菌对植物抗旱性有无影响以及各个菌株影响力大小[12-19]。本研究中,在胁迫试验开始时,发现各接菌植株长势差异较大,其原因是为确保胁迫试验中的植株均与接种内生真菌共生,镜检发现内生真菌侵染植物根部存在差异,部分侵染较慢,此时有些内生真菌的促生作用已显现,因此导致各接菌植株长势差异很大。在胁迫试验结束后,直接比较各个接菌+干旱处理组和未接菌+干旱处理组,以及各个接菌+干旱处理(菌株组之间各生理指标绝对值,以评价接种各种内生真菌菌株对植物抗旱性影响大小,显然不合理。因此,本试验参考朱志明等[28]和朴明鑫等[29]方法,避免接种各内生真菌的植株胁迫试验前的长势本底差异对胁迫后各生理指标的影响,采用抗旱系数,即同一接菌处理组的干旱胁迫值/非干旱胁迫值来度量植株抗旱性,比较各生理指标绝对值更能准确反映植物抗旱能力的大小,抗旱系数越大代表植株抗旱性越强,这样抗旱系数不同真正代表接种内生真菌不同。

表3 不同处理青贮玉米幼苗的主成分得分、综合得分(F) 及优良度排序Table 3 Principal component score,comprehensive score (F) and goodness ranking of silage corn seedlings with different treatments
当接菌植株受到干旱胁迫后,根表面积抗旱系数、根体积抗旱系数、根干重抗旱系数、根干物质含量抗旱系数、Pro含量抗旱系数、CAT活性抗旱系数、SOD活性抗旱系数和POD活性抗旱系数等指标抗旱系数大于1,说明胁迫造成这些指标绝对值增高;而地上部分鲜重抗旱系数、叶相对含水量抗旱系数、叶绿素含量抗旱系数、根鲜重抗旱系数和MDA含量抗旱系数等指标抗旱系数小于1,说明胁迫导致这些指标绝对值降低,并且同一指标抗旱系数在不同接菌处理间的变化幅度存在差异,鉴于采用各抗旱系数之间比较,很难获得统一结论,其原因是植物的抗旱性是一个复杂综合能力,是多因素共同作用的结果,在不同的生理指标上体现出的变化幅度并不相同,采用某单一指标未必能够直观、准确地评价其抗旱性。为了弥补单一指标评价的不足,本试验参考朱志明等[28]和朱娟娟等[30]方法,以13个指标抗旱系数为基础,采用主成分分析法综合评价抗旱性更客观、科学。
内生真菌侵染植物并与植物建立共生体,影响植物生长、发育和次生代谢产物积累,以往的研究中很少有检测内生真菌与植物是否形成共生体的报道,并未证明接种的内生真菌是否真正在植物体内“内生”,尤其在接种异源植物的研究中更是如此。本试验通过染色镜检,发现印度梨形孢在单个青贮玉米幼苗植株的平均侵染侵染率高达70%,另外8株内生真菌对单个青贮玉米幼苗植株的平均侵染率仅在20%~50%之间。用侵染率与各指标抗旱系数、抗旱系数主成分分析综合得分进行线性回归分析,表明只有根鲜重抗旱系数与侵染率之间存在显著线性关系(P<0.05),说明共生成功只是内生真菌影响植物的前提条件,内生真菌在植物体内的生物量、菌株刺激植物的机制、植物应答内生真菌的机制等都可能影响内生真菌对植物的效应。

表4 侵染率与各指标抗旱系数及主成分综合得分线性回归分析Table 4 Linear regression analysis diagram of infection rate, drought resistance coefficient of each index and principal component comprehensive score
植物面对胁迫时,会从各个方面对胁迫做出响应,本试验选取在未接菌(E-)组的非干旱胁迫和干旱胁迫植株之间差异显著的地上部分鲜重、叶相对含水量、叶绿素含量、根体积、根表面积、根鲜重、根干重、根干物质含量、Pro含量、MDA含量、CAT活性、SOD活性、POD活性等13个生理指标进行考察,发现虽然接种Am04、Tm36、Tm02、印度梨形孢等4株内生真菌可提高青贮玉米幼苗抗旱性,但各菌株对这些指标的影响存在较大差异。菌株Am04可显著降低地上部鲜重的损失,增加叶片的保水性、玉米植株根体积与根表面积、根系保水性和干物质累积;同时提高植株体内过氧化物酶活性,增加脯氨酸和叶绿素含量,并且能显著降低丙二醛含量,最大化减少植株受干旱胁迫的损伤。菌株Tm36可显著增加根系体积与表面积,显著降低青贮玉米幼苗体内丙二醛的累积;菌株Tm02可增加根系干物质的累积,显著提高过氧化氢酶活性,增加脯氨酸含量降低丙二醛的积累;印度梨形孢可以影响地上部鲜重和根干物质含量,还可以显著增加脯氨酸含量并显著降低丙二醛含量。以上分析可以看出菌株Am04帮助植株对干旱胁迫的响应是从形态到生理生化多方面的,而其余3种菌株则更侧重于抗氧化系统的酶活性和细胞渗透物质的调节。
4 结 论
用内生真菌模式种印度梨形孢和分离自荒漠强旱生植物根系的8株内生真菌接种青贮玉米幼苗,所有菌株均能侵入青贮玉米幼苗根系形成共生,但侵染率存在差异,且侵染率和大多数抗旱性生理指标之间无相关性;基于13个生理指标进行主成分分析,表明只有Am04、Tm36、Tm02、印度梨形孢等4株内生真菌可提高青贮玉米幼苗抗旱性,并以菌株Am04最优;而Pm53、Tm30、Pm38、Pm06、Pm57等5株内生真菌并未提高青贮玉米幼苗抗旱性。

