心力衰竭分期和肠道菌群组成相关性研究
刘继轩,兰翔,赵晓静,许振国,贾倩,孙志军,何昆仑
心力衰竭(心衰)是由各种病因引起的特征为心排血量减低和室壁张力增高的临床综合征,对循环的影响为动脉系统血流减少而静脉系统血流淤积。尽管随着人们对心衰机制认识的加深,对心衰的临床管理逐步优化,但心衰仍是导致死亡的主要原因之一,且其病因研究尚不充分[1,2]。因此迫切需要对心衰的发生、发展的新认识去改变这一现状。肠道菌群和心衰的相关性是目前研究热点之一[3-7]。然而,既往对肠道菌群和心衰相关性的研究多将失代偿的或严重心衰患者作为实验组,而对照组为完全健康的患者,在对心衰患者发生发展的观察中,缺失了心衰B期(HFB)及存在心脏结构功能异常,但并未出现心衰症状的患者。我们在本研究中加入HFB的患者进行观察,并与严重心衰患者及相对健康的患者比较,探索肠道菌群结构及功能的变化出现在心衰发展的具体阶段,尝试解释肠道菌群和心衰发生发展的因果关系。
1 资料与方法
1.1 研究对象选取2018年3月至2018年6月于中国人民解放军总医院心血管内科连续住院的心力衰竭C期或D期的患者25例[平均年龄(60.31±11.62)岁,男性15例],根据年龄、性别及冠心病病因进行1:1匹配同期住院的心衰B期及心衰A期(HFA)的患者各25例。心衰分期标准参考最新修订的美国心脏病协会慢心衰管理指南。其他纳入标准包括:①年龄≥18岁;②汉族;③低盐低脂饮食;④入院3 d内自主排大便。排除标准包括:①急性冠脉综合征;②近1月口服抗生素和/或益生菌;③恶液质;④怀孕;⑤拒绝签署参与本观察性研究知情同意书。
1.2 方法根据患者的心衰分期进行分组,心衰C期或D期组(HFCD),即存在心脏结构及功能异常且有心衰症状或体征; HFB组,即存在心脏结构及功能异常但无心衰临床表现; HFA组,即有高血压、冠心病等发生心衰的危险因素,但没有结构性心脏病和心衰的症状。比较各组间临床指标及菌群组成的差异。研究方案设计通过中国人民解放军总医院伦理委员会同意,所有研究对象均签署研究知情同意书。
通过电子病历系统形式收集研究对象人口统计学特征,既往病史,个人史及一般检查化验结果。收集患者入院后第一自主排便便标本,后对便标本进行DNA提取后扩增V3~V4区域16sRNA基因。按照Cutadapt(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)对16sRNA基因进行质量控制,参考Silva Database(https://www.arb-silva.de/)数据库对相似性大于97%的序列进行OTUs分配,用Uparse(V7.0.1001,http://drive5.com/uparse/)及MUSCLE software(Version 3.8.31,http://www.drive5.com/muscle/)软件进行序列分析。参考京都基因和基因组百科全书(KEGG)途径,对细菌代谢功能进行预测。
1.3 观察指标包括:①人口统计学特征[年龄、性别、体质指数(BMI)],合并症(高血压、糖尿病、高脂血症及冠心病),个人行为(吸烟、饮酒),用药情况及心功能相关指标[射血分数,N末端脑钠肽前体(NT-proBNP)水平]组成的临床指标;②使用Quantitative Insights in Microbial Ecology(QIIME v.1.8.0)对16S rRNA基因序列进行分析和处理,并对每个样品序列进行质量控制、序列进行纠错、嵌合体去除。进而,所有剩余序列以97%的序列相似性聚类到OTU中,选择每个OTU最丰富的序列作为代表序列并生成OTU表以进行后续分析。采用Observedspecies,Chao1,Shannon,Simpson,几种不同的α多样性指数,以表征样品中物种分布的多样性和均匀度,并直观展示测序深度和数据量情况;主要采用的是加权和非加权的算法计算β多样性,评价组间多样性差异;菌群分类差异及菌群代谢功能预测的菌群组成指标。
1.4 统计学分析分类变量使用百分比(%)表示,连续变量为正态分布时用平均值±标准偏差(SD)表示,非正态分布时采用中间值(第25和第75百分位)表示。采用单因素方差分析比较正态分布和方差齐性的连续数据,否则采用Mann-Whitney检验。分类数据经χ2分析比较。采用Wilcox检验通过分类操作单元(OTU)、Chao1,Shannon,Simpson 和 PD_whole_tree这5个指数比较α多样性差异。采用QIIME软件(Version 1.9.1)分析比较组间β多样性差异。使用Kruskal Wallis检验在门、属和种三个级别上的菌群种分类差异。所有数据均采用R软件(Version 2.15.3)进行统计分析,统计评估均假设在5%显著性水平下进行双侧检验。
2 结果
2.1 两组患者临床特征比较每个心衰分期分别纳入25例患者,按照年龄、性别及冠心病病因进行1:1匹配,因此各组间年龄、性别及冠心病病因组成无差异。在除冠心病外的其他心脏病危险因素比例方面,包括吸烟、高血压、2型糖尿病及高血脂各组间均无显著统计学差异(P均>0.05),表1。各组间一般临床情况,包括BMI(P=0.834),静息血压(收缩压P=0.484,舒张压P=0.456)、心率水平(P=0.196),及表示肾功能的血清肌酐水平(P=0.175)方面均无显著统计学差异。在有关心衰严重程度的指标纽约心脏病协会(NYHA)分级方面及反应心衰严重程度的指标,NT-proBNP各组间差异显著,HFCD组显著高于HFA及HFB组(P<0.001)。在用药方面,各组间使用阿司匹林、氯吡格雷、他汀、硝酸酯、血管紧张素受体阻滞剂(ARB)、β受体阻滞剂及华法林的用药比例均无显著差异。在心衰程度更严重的HFCD组中,血管紧张素转换酶抑制剂(ACEI)和利尿剂的使用比例更高(P<0.001)而钙离子阻断剂(CCB)类药物使用比例更低(P=0.002),表1。
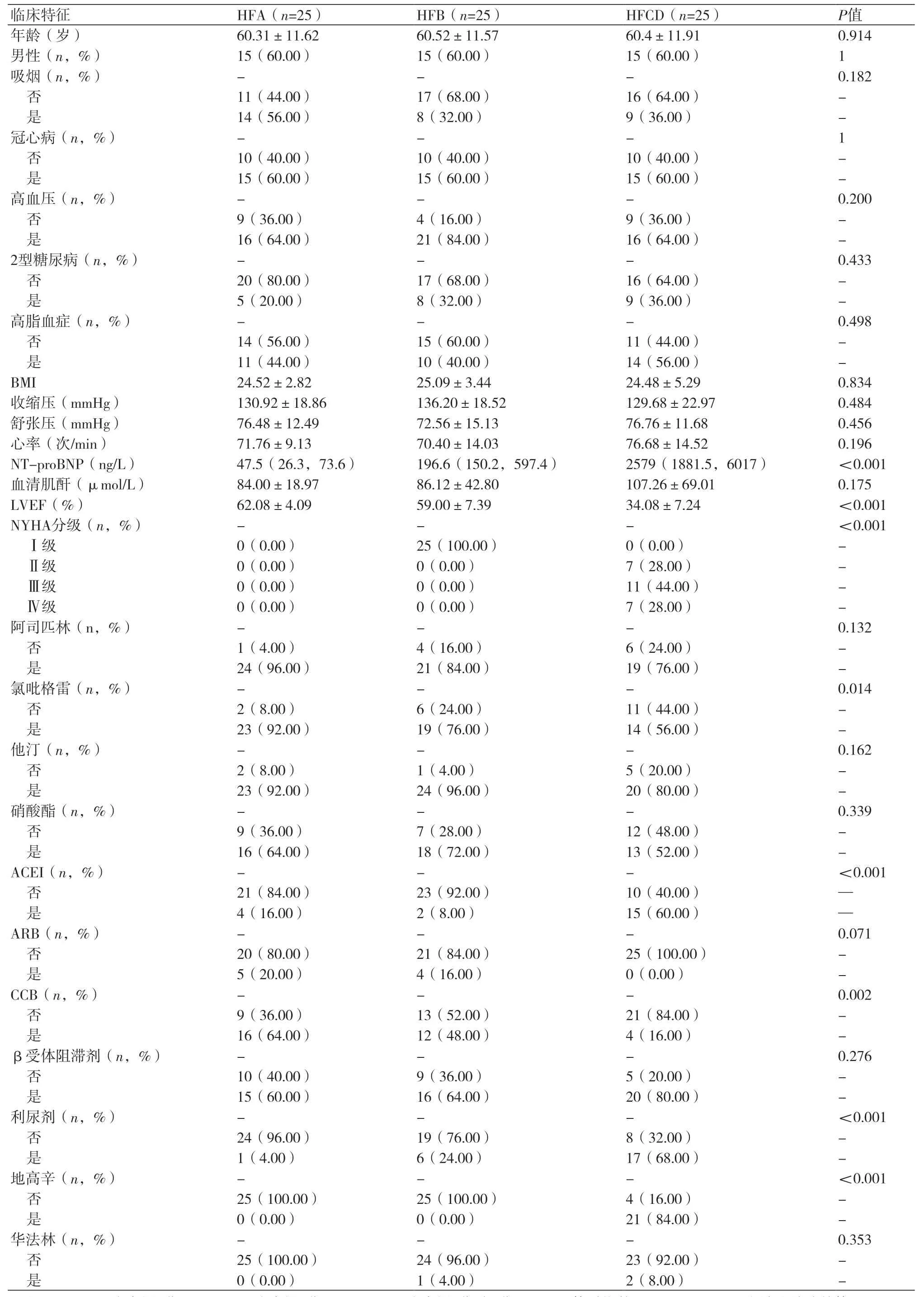
表1 不同心衰阶段分组的临床特征的组间比较
2.2 患者肠道菌群的α及β多样性从表示α多样性的指标中,我们发现HFA组与HFCD组在Chao1(P=0.005),OUT(P=0.018)及PD_whole_tree(P=0.011)这三个指数上存在显著差异,提示HFA组的α多样性优于HFCD组(图1)。此外虽然HFA组与HFB组,及HFB组和HFCD组虽然在组间未观察到统计学意义差异,但在Chao1,OUT及PD_whole_tree这三个指数上可观察到从HFA组到HFB组,及HFB组到HFCD组一致的α多样性下降趋势。
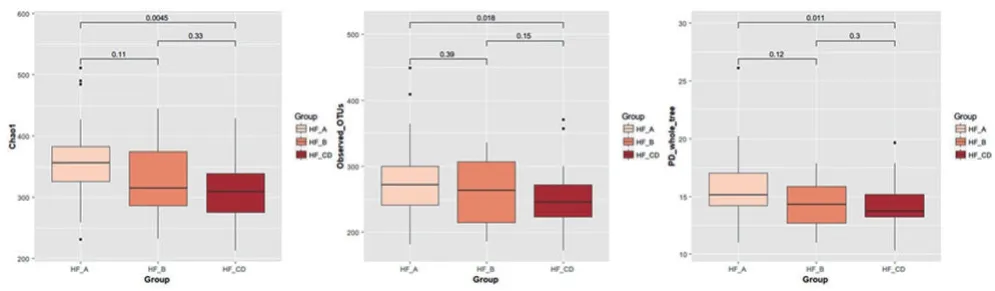
图1 多指标箱式图显示各组间α多样性的差异
关于β多样性,PCoA-Unweighted Unifrac分析显示,在据所有临床因素进行调整之后,我们根据心衰分期进行的分组的患者之间β多样性存在显著差异(R2=0.073,P<0.001),并且我们的心衰分期分组是对基质分布的影响最为显著的因素,图2。
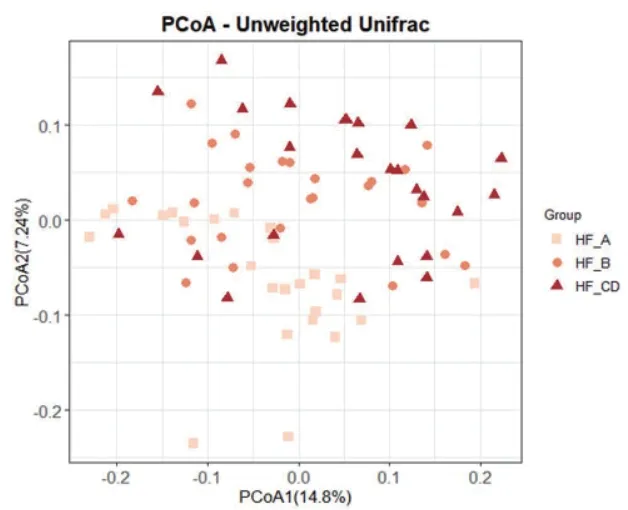
图2 PCoA-Unweighted Unifrac分析显示各组间β多样性的差异
2.3 菌群分类和功能预测差异分析我们在属水平上对各组间肠道菌群相对丰度的差异分析发现,HFB组噬胆菌属(Bilophia)的相对丰度显著高于HFA组(P=0.011)。同时,HFB组的解琥珀酸菌属(Succiniclasticum)(P=0.011)和多尔氏菌属(Dorea)的相对丰度水平显著降低。与HFCD组相比,HFA组的瘤胃球菌属(Ruminococcus)相对丰度显著增加,而噬胆菌属、韦荣氏球菌属、Flavonifractor和考拉杆菌属(Phascolarctobacterium)丰度显著减少。HFB组与HFCD组之间在各菌群属水平上无显著性差异,图3。

图3 各组间菌群在属水平相对丰度的差异
此外,我们参考京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEEG)途径对各组菌群功能进行了预测分析,结果显示各组间在多种代谢功能方面存在显著差异,且在在HFA组和HFB组间即可观察到5种代谢功能的差异,图4。
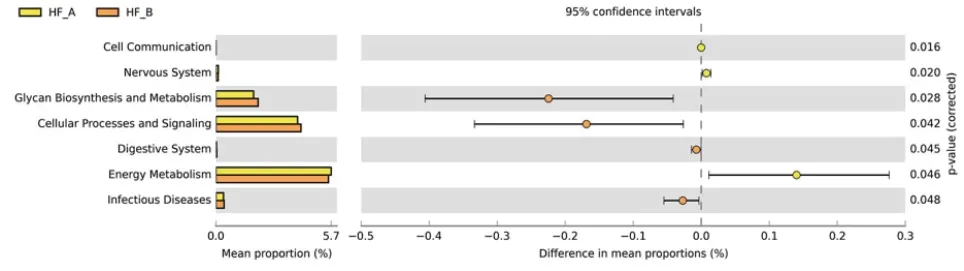
图4 森林图显示HFA组和HFB组在基于KEEG途径对组间菌群预测代谢功能的差异
3 讨论
肠道菌群对人体的影响及其与各种疾病间的相关性近些年成为临床医学领域的研究热点。机制研究显示肠道中脂多糖释放增加,引发炎症信号级联反应,对心血管疾病的进展产生不利影响;肠道微生物也可能增强能量和脂肪收集的能力,增加心脏的风险和负担[8]。在基础理论支持上,诸多研究者开始关注肠道菌群和心血管疾病之间的关系,这些心血管疾病包括高血压[9-11]、脑卒中[12]、冠心病[13]等。
既往研究心衰患者中观察到了肠道菌群结构的变化,但既往研究多为横断面研究,肠道菌群结构变化和心衰发生发展的因果关系尚不明确[3-7,14-17]。一方面因心衰造成的肠道动脉系统的缺血和静脉系统淤血,引起肠道粘膜功能和通透性改变,肠道的氧气和能量供应不足,最终导致肠道菌群结构的改变[18]。另一方面,肠道菌群抗原脂多糖和肠道菌群代谢产物三甲胺从肠道中往循环系统迁移,造成了全身的炎症反应,促进了心衰的发生发展[19]。
值得注意的是,心衰一种慢性进展性的疾病,美国心脏协会指南对心衰的分期着重强调了心衰分期的不可逆性[20]。然而,既往对肠道菌群和心衰相关性的研究总是将失代偿的或者严重的心衰患者作为实验组,而对照组为完全健康的患者,在对心衰患者发生发展的观察中,缺失了HFB及存在心脏结构功能异常,但并未出现心衰症状的患者。从逻辑关系上讲,如果肠道菌群是心衰竭发生发展的病因的话,不仅应在HFA与HFCD的患者中发现肠道菌群结构的差异,还应在心衰的初始从A期到B期的发展中观察到差异。我们的研究结果从一定程度上支持了肠道菌群的变化病因说。观察到了从HFA和HFB的患者即开始出现肠道菌群α、β多样性的差异,考虑肠道菌群的代谢及功能分类在属水平及区域趋于一致,因此仅把属水平的差异分析结果放入本文。在特定菌群和菌群预测功能上同样开始出现差异。此外在差异菌属中噬胆菌属通过参与三甲胺代谢影响心血管疾病的风险[21],与之前关于三甲胺预测心血管疾病结局的研究相呼应[22],提示这一菌属的变化可能预示心衰进展。
总的来讲,本研究发现了心衰的分期和肠道菌群组成相关性,在一定程度支持肠道菌群的变化为心衰进展的原因。然而本研究依然为单中心横断面研究,证据等级有限。目前已经有注册的前瞻性临床研究去评估针对肠道微生物群的药物对射血分数降低的心衰稳定患者左心室功能、生活质量和功能能力以及对炎症标志物的影响[23],但该试验尚未完成,期待更多的前瞻性研究来验证肠道菌群和心衰的因果关系。

