坛紫菜分离蛋白的提取与结构解析
陶凤庭,潘创,戚勃,胡晓,赵永强,3,杨贤庆,3*,杨莉莉
(1.上海海洋大学 食品学院,上海 201306;2.中国水产科学研究院南海水产研究所 农业农村部水产品加工重点实验室国家水产品加工技术研发中心,广东 广州 510300;3.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;4.广东百维生物科技有限公司,广东 化州525100)
海藻是重要的海洋生物资源,是海洋中最古老的低等隐花植物之一[1]。众多研究表明,藻类含有的蛋白质、多糖、多肽和多酚等生物活性物质具有抗氧化、抗感染、抗糖尿病、抗癌、抗病毒、抗菌和抗肥胖等多种生理功能[2],已被广泛应用于医药、食品、化工和农业等方面[3]。紫菜是中国大规模种植的经济海藻种类之一,其中的坛紫菜Porphyrahaitanensis是中国特有的暖温带品种,主要分布于广东、浙江和福建等地,年产量约占全国紫菜产量的70%以上[4]。目前,坛紫菜虽然已实现了工业化培育、养殖和采收,但其仍作为初级产品进入销售市场,而生长后期的坛紫菜由于口感差、利润低,养殖户常放弃采收,造成了资源的浪费和环境的污染。因此,促进坛紫菜高附加值产品的开发已成为坛紫菜产业亟待解决的重要问题。
坛紫菜粗提液(crude extract ofPorphyrahaitanensis,CEPh)具有较强的抗氧化活性,且粗提液中蛋白浓度与抗氧化活性间存在剂量依赖关系,其中大量存在的蛋白被认为是一种潜在的高效天然抗氧化剂[5]。然而,复杂的多糖基质会阻碍蛋白的提取[6],李春霞[7]、孔祥佳等[8]、于娇等[9]先后以蒸馏水为提取剂,分别运用溶胀加组织捣碎法、超声波酶解法和超声波辅助水提法对坛紫菜蛋白进行提取,不同提取方法得到的蛋白提取率存在明显差异。硫酸铵盐析沉淀分离蛋白法操作简便且对蛋白有保护作用,从而被广泛应用[10],但不同饱和度硫酸铵溶液对坛紫菜分离蛋白组分的理化性质、结构特性及抗氧化活性的影响目前尚未见报道。本研究中,将2种提取液搭配3种破壁方法组合成6种提取方法,进行坛紫菜蛋白提取率对比试验,并用提取率最高的方法制备坛紫菜粗提液制备分离蛋白,通过蛋白沉淀量、紫外吸收光谱、红外光谱、圆二色光谱、SDS-PAGE凝胶电泳等方法,比较了不同饱和度硫酸铵对坛紫菜粗提液中蛋白的理化特性和抗氧化能力的影响,以期为坛紫菜蛋白的分离提取、结构解析和活性研究提供科学参考。
1 材料与方法
1.1 材料
试验用三水晒干坛紫菜购于广东省潮州市饶平县,粉碎过245 μm筛后避光保存。按GB 5009.6—2016中的方法测得其蛋白含量为32.85%。
试剂:Nu PAGETM12% Bis-Tris预制胶、Nu PAGETMMOPS SDS电泳缓冲液(20×)购自赛默飞科技(上海)有限公司;BeyoColor TM彩色预染蛋白分子量标准(相对分子质量为6 500~270 000)、SDS-PAGE蛋白上样缓冲液(5×)、考马斯亮蓝超快染色试剂盒和Bradford蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司;总抗氧化能力(T-AOC)检测试剂盒购自北京索莱宝科技有限公司;KBr购自美国PIKE公司;ABTS和DPPH购自合肥博美生物有限公司;其余试剂均为国产分析纯。
仪器与设备:JY99-IIDN超声波细胞破碎仪(中国,上海沪析实业有限公司);IR-Affinity-1红外光谱仪(日本,岛津公司);Mini-PROTEAN Tetra小型垂直电泳槽和PowerPac Basic基础电泳仪(美国,Bio-Rad公司);Synergy全功能酶标仪(美国,BioTek公司);Chiranscan圆二色光谱仪(英国,应用光物理公司);UV-2550紫外分光光度计(日本,岛津公司)。
1.2 方法
1.2.1 坛紫菜粗蛋白的提取 各称取18份坛紫菜粉末,每份1 g,均分为两组,分别将坛紫菜与蒸馏水或0.05 mol/L磷酸盐缓冲液(pH 6.8)以料液比为1∶100(g∶mL)进行混合,然后每组用溶胀法(4 ℃下放置72 h)、反复冻融法(冻融6次)和超声波辅助法(1 000 W,6 s 开,6 s关,共1 h)各处理3份,再经4 000g离心后取上清液,得到6种不同处理条件下的坛紫菜粗提液(CEPh)各3份。采用Bradford蛋白浓度试剂盒测定蛋白含量,结果取其平均值。
1.2.2 硫酸铵沉淀法粗分离坛紫菜蛋白 将“1.2.1节”中蛋白提取率最高的方法用于制备坛紫菜粗提液CEPh。根据粗提液的体积,添加相应的硫酸铵粉末制成饱和度为10%的硫酸铵坛紫菜粗提液,静置2 h后离心15 min(10 000g,4 ℃),取沉淀用一定体积的0.05 mol/L磷酸盐缓冲液(pH 6.8)复溶,分离出的蛋白组分命名为10%-PhPI(坛紫菜分离蛋白,Porphyrahaitanensisprotein isolate);根据上清液的体积添加硫酸铵粉末至饱和度为20%,静置2 h后离心15 min(10 000g,4 ℃),取沉淀用相同浓度的磷酸盐缓冲液复溶,分离蛋白组分命名为20%-PhPI,以同样方法继续制得30%-PhPI、40%-PhPI、50%-PhPI、60%-PhPI分离蛋白组分,6个组分所得的蛋白沉出量(mg)计算公式为
蛋白沉出量=Cpro×V。
其中:Cpro为测得的蛋白浓度;V为沉淀复溶用磷酸盐缓冲液的体积。
1.2.3 紫外-可见分光光度计测定 将经硫酸铵盐析得到的6个分离蛋白组分别制成质量浓度为0.5 mg/mL的蛋白溶液,采用紫外可见分光光度计在400~650 nm下进行扫描测定。
1.2.4 傅里叶红外光谱(FT-IR)分析 取冻干的6个分离蛋白组分样品各1 mg,与干燥KBr粉末按质量比为1∶100混合后压成透明薄片,采用红外光谱扫描并记录吸光值。扫描波长为4 000~400 cm-1,扫描次数为32,分辨率为2 cm-1。
1.2.5 蛋白分子量的测定 在Mini-PROTEAN Tetra 小型垂直电泳槽中进行SDS-PAGE凝胶电泳,测定CEPh和6个分离蛋白的相对分子质量。样品上样量为10 μg,电泳结束后用考马斯亮蓝超快染液进行染色,并用水进行脱色,直至背景清晰。
1.2.6 圆二色光谱(CD)分析 参考杨肖杰等[11]的方法,采用0.05 mol/L磷酸盐缓冲液(pH 6.8)将6个分离蛋白的质量浓度统一调整为0.1 mg/mL,选择190~270 nm区域进行扫描。CD强度用摩尔椭圆率[θ] 表示。二级结构含量由CDNN软件进行计算。
1.2.7 体外抗氧化活性分析
1)DPPH自由基清除能力。将CEPh和6个分离蛋白溶液样品稀释至蛋白质量浓度为0.5 mg/mL,并参考李诗雅等[12]的方法测定DPPH自由基清除能力。
2)ABTS自由基清除能力。将CEPh和6个分离蛋白溶液样品稀释至蛋白质量浓度为0.1 mg/mL,并参考李月等[13]的方法测定ABTS自由基清除能力。
3)还原力。配制质量浓度为0、0.1、0.2、0.3、0.4、0.5 mg/mL的维生素C(VC)溶液,以VC的质量浓度为横坐标,吸光值为纵坐标制作标准曲线。将CEPh和6个分离蛋白溶液样品稀释至蛋白质量浓度为0.5 mg/mL的样品溶液,并测定不同蛋白的还原力,以相同吸光值对应的VC质量浓度与蛋白质量浓度的比值来表示。
4)总抗氧化能力(T-AOC)。将CEPh和6个分离蛋白溶液样品稀释至蛋白质量浓度为0.5 mg/mL的样品溶液,采用T-AOC检测试剂盒进行测定。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同提取方法对坛紫菜蛋白提取率的影响
从图1可见:在提取液相同的情况下,溶胀法和反复冻融法的蛋白提取率无显著性差异(P>0.05),且均显著低于超声波辅助法(P<0.05);在相同提取方法下,以磷酸盐缓冲液作为提取液的蛋白提取率均显著高于以蒸馏水作为提取液的蛋白提取率(P<0.05),其中,使用超声波辅助磷酸盐缓冲液提取法,坛紫菜蛋白提取率最高(55.28%)(P<0.05)。故本试验中选用超声波辅助磷酸盐缓冲液法提取坛紫菜的全蛋白。
2.2 不同饱和度硫酸铵对蛋白沉出量的影响
从图2可见:随着硫酸铵饱和度的增加,蛋白沉出量呈先上升后下降的趋势,不同分离蛋白总沉出量为154.9 mg,占CEPh中蛋白总量(220.9 mg)的70.11%;硫酸铵饱和度为40%~60%时,CEPh中的蛋白被大量沉出,其中,硫酸铵饱和度为50%时沉出的蛋白为81.3 mg,占蛋白总沉出量的52.47%。在硫酸铵饱和度增加的过程中,溶液颜色由暗红色变为紫色,最后变成淡黄色,沉淀逐渐呈胶状。沉淀复溶后的溶液即图2中的分离蛋白溶液,由淡红色变为深紫色,再变为淡红色,最后变为肉粉色,这说明坛紫菜蛋白溶液中含有色素结合蛋白,且不同硫酸铵饱和度沉淀下来的色素结合蛋白种类及含量有一定差异。
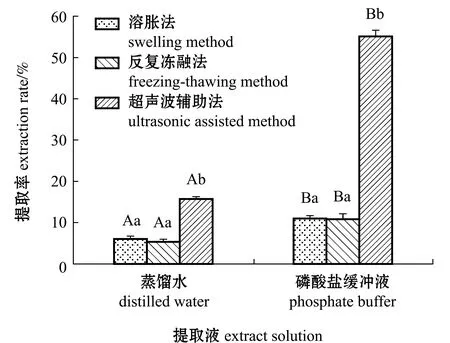
标有不同大写字母者表示同一提取方法下不同提取液之间的蛋白提取率有显著性差异(P<0.05);标有不同小写字母者表示同一提取液下不同提取方法之间的蛋白提取率有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。Means with different capital letters are significant difference in protein extraction rate between different extracts solution under the same extraction method (P<0.05);Means with different letters are significant difference in protein extraction rate between different extraction methods under the same extraction solution (P<0.05), and means with the same letters are not significant difference between groups (P>0.05).图1 6种提取方法的蛋白提取率比较Fig.1 Comparison of protein extraction rate of six extraction methods

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.图2 不同饱和度硫酸铵处理后坛紫菜蛋白的沉出量Fig.2 Protein precipitation of laver Porphyra haitanensis precipitated by different concentration gradients of ammonium sulfate
2.3 紫外可见光谱分析
从图3可见:坛紫菜6个分离蛋白均含有结合色素的藻胆蛋白,3个明显的特征吸收峰来源于藻胆蛋白,分别在496、552、614 nm附近,且均为中间峰高于两边峰;10%-PhPI、20%-PhPI、60%-PhPI蛋白的吸收峰强度较弱,吸光值均低于0.25,30%-PhPI、40%-PhPI、50%-PhPI蛋白的吸收峰值均高于0.40,其中40%-PhPI蛋白在553、616 mm处的吸收峰值最大,而在497 nm处的吸收峰值低于50%-PhPI。从图3的表格中可知,6组分离蛋白中仅60%-PhPI蛋白在614 nm附近缺失吸收峰。

图3 不同饱和度硫酸铵处理后坛紫菜分离蛋白的紫外可见光谱(400~650 nm)Fig.3 UV spectrum of laver Porphyra haitanensis protein exposed to different ammonium sulfate concentrations (400-650 nm)
2.4 傅里叶红外光谱分析
从图4可见,6个分离蛋白组分均含有蛋白特征峰酰胺Ⅰ带(1 654 cm-1)、酰胺Ⅲ带吸收峰(1 242 cm-1)、O—H伸缩振动吸收宽峰(3 600~ 3 200 cm-1)和C—H伸缩振动吸收峰(2 934 cm-1),仅50%-PhPI和60%-PhPI蛋白缺失酰胺Ⅱ带吸收峰(1 539 cm-1),但增加了2个非蛋白吸收峰(1 155 cm-1和773 cm-1)。
2.5 蛋白的相对分子质量组成分析
从图5可见:未经硫酸铵处理的坛紫菜提取液(CEPh)电泳条带多且浅,蛋白种类丰富;经硫酸铵处理的分离蛋白存在明显的蛋白条带(相对分子质量为55 000、20 000和18 000);当硫酸铵饱和度为10%~30%时,相对分子质量为55 000、20 000和18 000的蛋白条带颜色逐渐加深,这3个相对分子质量的蛋白在低盐离子强度下溶解度较高,而相对分子质量为28 000和42 000的蛋白条带颜色逐渐变弱,这说明这2个分子量的蛋白仅在该饱和度区间内沉出;当硫酸铵饱和度大于30%时,仅相对分子质量为55 000、20 000和18 000的蛋白条带明显。
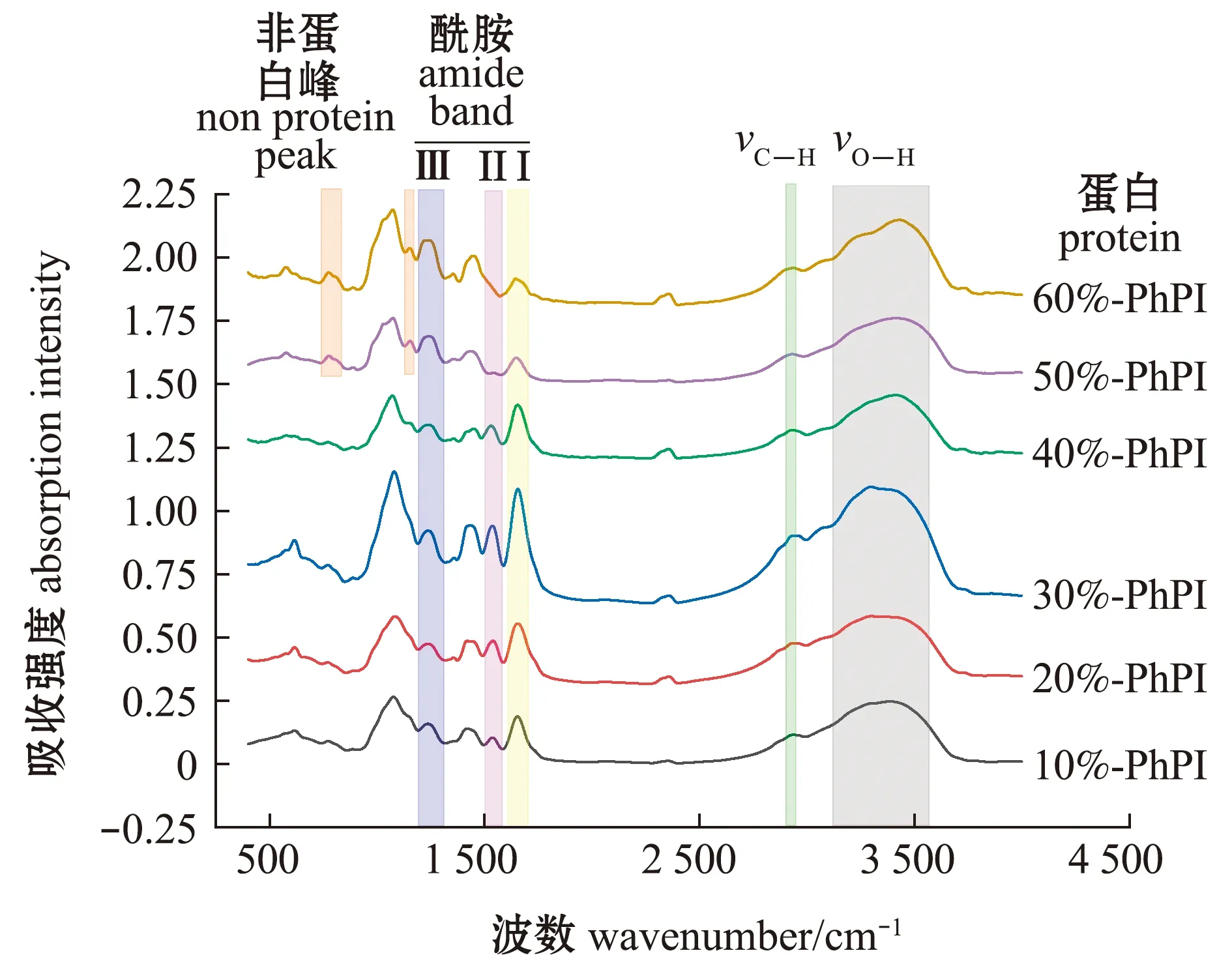
图4 不同饱和度硫酸铵处理后坛紫菜分离蛋白的红外光谱(400~4 000 cm-1)Fig.4 FT-IR spectrum of laver Porphyra haitanensis protein exposed to different ammonium sulfate concentrations(400-4 000 cm-1)

图5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图Fig.5 SDS-PAGE analysis of the proteins
2.6 圆二色光谱分析
从图6可见,经不同饱和度硫酸铵处理的6个分离蛋白在193 nm处产生一个正峰,222、210 nm处产生2个负峰,是典型的以α-螺旋为主的二级结构,其中,60%-PhPI蛋白在222 nm的峰向短波长方向移动,即出现蓝移。经CDNN软件计算,随着硫酸铵饱和度的增加,坛紫菜分离蛋白的α-螺旋相对含量呈先增加后减少的趋势;60%-PhPI蛋白的α-螺旋相对含量最低,无规卷曲相对含量最高,形成了以β-折叠和无规卷曲为主的二级结构,而40%-PhPI蛋白的α-螺旋相对含量最高,无规卷曲相对含量最低,结构最为有序。
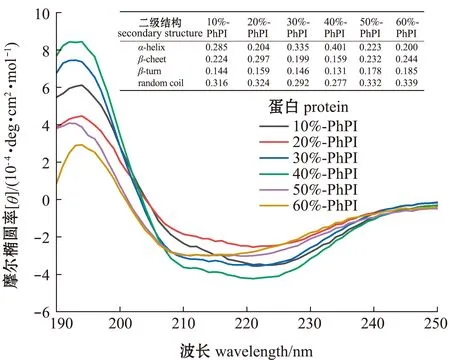
图6 不同饱和度硫酸铵处理后坛紫菜蛋白圆二色光谱Fig.6 CD spectrum of laver Porphyra haitanensis protein after treatment with different ammonium sulfate concentrations
2.7 体外抗氧化活性测定
从表1可见:50%-PhPI蛋白的DPPH自由基清除活性最强,清除率为81.70%,与CEPh无显著性差异(P>0.05),但显著高于20%-PhPI、30%-PhPI、40%-PhPI和60%-PhPI蛋白组(P<0.05); 60%-PhPI蛋白的ABTS自由基清除活性最强,清除率为88.33%,显著高于CEPh及其他蛋白组(P<0.05);10%-PhPI蛋白的总抗氧化能力最高,显著高于CEPh及其他蛋白组(P<0.05);蛋白含量为0.5 mg/mL的CEPh还原力相当于0.085 mg/mL VC溶液的还原力,显著高于6组分离蛋白(P<0.05),说明硫酸铵处理去除了部分还原力较高的物质,使得还原力水平下降。
3 讨论
3.1 坛紫菜分离蛋白的提取
植物细胞存在细胞壁,破壁技术是高效提取蛋白的关键,其次就是溶解蛋白所用的提取液种类。超声波作为一种机械波,在介质中传播时会引起介质粒子的机械振动,并引发一系列的物理化学作用,从而达到提取植物细胞内容物的效果[14],如从藻类中高效提取牛磺酸[15]、藻油[16]和多糖[17]等物质。蔡苗苗等[18]探究了不同破壁技术对舌状蜈蚣藻Grateloupialivida蛋白的提取效果,结果显示,超声波辅助水提法得到蛋白提取率高于溶胀法、反复冻融法和珠磨法,与本试验结果一致。姚兴存等[19]研究表明,超声波辅助磷酸盐缓冲液提取法较酶解法、超微粉碎法和氯化钙法等更适合于从紫菜中制备藻胆蛋白。本试验表明,在超声波辅助下用磷酸盐作为提取剂优于用蒸馏水。盐析法常用于溶液中分离蛋白,本研究中以10%饱和度为一个梯度,对坛紫菜蛋白粗提液用硫酸铵沉淀后制备分离蛋白,发现分离蛋白在40%~60%饱和度下大量析出,且每个分离组分溶液的颜色均不相同,说明分离蛋白存在差异,故后续对其理化性质、结构特性及抗氧化活性进行了进一步分析。

表1 体外抗氧化活性指标的测定Tab.1 Determination of antioxidant activity in vitro
3.2 坛紫菜分离蛋白的理化性质与结构解析
坛紫菜粗提液中存在结合藻胆色素的藻胆蛋白,主要为藻红蛋白(PEs,λmax=540~570 nm)和藻蓝蛋白(PCs,λmax=610~620 nm)[20]。坛紫菜中的藻胆蛋白含量较高,大约占坛紫菜干质量的4%左右,其中,藻红蛋白含量最高可达干质量的2.43%[9]。本研究中,30%-PhPI、40%-PhPI、50%-PhPI的藻胆蛋白紫外吸收特征峰明显,说明硫酸铵饱和度达到30%时藻胆蛋白大量溶出,在饱和度达到50%时溶出量达到峰值,当硫酸铵饱和度达到60%时分离蛋白溶液呈肉粉色,紫外光谱显示,其存在藻红蛋白特征吸收峰,而藻蓝蛋白吸收峰消失,这表明藻蓝蛋白在上一梯度已全部离心沉出,提取藻蓝蛋白使用的硫酸铵饱和度应小于50%,故20%~50%饱和度的硫酸铵适用于制备藻胆蛋白。钱晓婕等[21]从坛紫菜中制备藻胆蛋白所采用硫酸铵饱和度为45%,在此区间中。
傅里叶红外光谱是量化蛋白样品间变化和差异的有用工具,通过这种技术可以分析氨基酸酰胺键的不同振动,主要是酰胺Ⅰ带(1 600~1 700 cm-1)、酰胺Ⅱ带(1 500~1 600 cm-1)和酰胺Ⅲ带(1 330~1 220 cm-1)[22]。本试验中,6个分离蛋白组分均含有典型的蛋白吸收峰,其中50%-PhPI、60%-PhPI缺失了酰胺Ⅱ带的特征吸收峰,但增加了1 155 cm-1和773 cm-12个非蛋白吸收峰。Yan等[23]用红外光谱分析多糖时认为,在1 200~1 000 cm-1(1 068 cm-1、1 155 cm-1)内的吸收峰归因于吡喃糖中的C—O—C和C—O—H键,773 cm-1处的峰可能为α-吡喃环对称伸缩振动产生的,与本研究中新增的2个峰相似,说明有非蛋白物质发生沉淀,可能为多糖。王月华[24]曾用75%饱和度的硫酸铵从红藻中提取凝集素(糖蛋白),这说明当溶液中硫酸铵饱和度超过50%时,糖结合蛋白发生了沉淀,高饱和度的硫酸铵适合提取糖结合蛋白。
藻胆蛋白的基本构建单位是α和β亚基,相对分子质量为17 000~22 000,在藻红蛋白中,一个额外的γ亚基(相对分子质量约为30 000)通常结合α和β亚基形成稳定的(αβ)6γ六聚体[20]。本试验中,SDS-PAGE电泳得到的相对分子质量为20 000和18 000的蛋白条带极可能是藻胆蛋白的α和β亚基,此结果同紫外吸收光谱结果吻合。董宏坡等[25]对坛紫菜进行纯化时,发现一条相对分子质量为55 000的条带,并认为其有可能是由α或β亚基、γ亚基和连接肽组成,这与本试验中所得的相对分子质量为52 000~66 000的蛋白条带相似,故研究相对分子质量为55 000的蛋白时,应选择饱和度为10%~30%的硫酸铵。
CD光谱远紫外区(190~240 nm)的圆二色性反映了肽链主链的构象,常用于分析蛋白的二级结构。α-螺旋、β-折叠、β-转角和无规卷曲是蛋白二级结构的4种主要类型,每种类型均有其独特的CD光谱[26]。坛紫菜藻胆蛋白中的α亚基和β亚基虽然一级结构不同,但它们的二、三级结构却十分相似,均含有9个α-螺旋,且每两个α-螺旋间有不规则转角相连[27]。由此推测,本研究中,40%-PhPI蛋白的α-螺旋结构含量最高,这可能与以α-螺旋结构为主的藻胆蛋白集中沉出相关。
3.3 坛紫菜分离蛋白的体外抗氧化活性
本研究团队在先前的试验中,对坛紫菜粗提液CEPh的DPPH自由基清除活性和ABTS自由基清除活性进行了测定,结果显示,半数抑制浓度(IC50)依次为250、42 μg/mL,还原力测试结果为质量浓度1 mg/mL的蛋白粗提液相当于质量浓度0.05 mg/mL的VC溶液,具有较高的抗氧化活性且呈量效关系[5]。故本试验中以其为标准,探讨了不同饱和度硫酸铵对坛紫菜蛋白抗氧化活性的影响。目前,关于坛紫菜蛋白的抗氧化活性研究大多集中于藻胆蛋白,如周站平等[28]探讨了光照和脱辅基蛋白结构对藻胆蛋白抗氧化活性的影响,结果表明,藻胆蛋白黑暗下能够清除自由基。Chen[29]用超声波辅助水提法结合硫酸铵沉淀法制备的藻胆蛋白,结果同样显示该蛋白具有体外抗氧化活性。本研究中,6组分离蛋白的DPPH自由基清除能力水平均在60%以上,说明硫酸铵沉淀对该自由基清除活性的影响较小;60%-PhPI蛋白相较于其他组分具有最高的ABTS自由基清除活性(清除率为88.33%),从红外光谱中可以看出,其非蛋白峰强度较高,活性可能来源于非蛋白组分;10%-PhPI蛋白相较于其他组分具有最高的总抗氧化能力(0.88 μmol/mg prot),从SDS-PAGE电泳图可以看出,其相对分子质量为28 000和42 000的蛋白条带较为明显,活性可能来源于这两种蛋白;经硫酸铵沉淀后蛋白溶液的还原力均显著下降,故4种体外抗氧化活性指标中受硫酸铵沉淀影响最大的是还原力,这可能与硫酸铵去除的具有供电子能力的小分子物质有关。由此可见,6组分离蛋白均保持了一定的抗氧化活性,但其间存在显著性差异,原因可能是抗氧化体系是各种抗氧化活性成分协同作用的结果,并非仅由某一种物质决定着坛紫菜抗氧化活性的强弱。
4 结论
1)采用0.05 mol/L磷酸盐缓冲液(pH 6.8)作为提取液优于蒸馏水,超声波辅助提取法优于溶胀法和反复冻融法;超声波辅助磷酸盐缓冲液法为坛紫菜蛋白最优提取方法,得率为55.28%。
2)在硫酸铵饱和度低于50%时,分离蛋白结构性质稳定,坛紫菜中的藻胆蛋白几乎全部沉出。
3)硫酸铵处理后得到的6组分离蛋白均表现出体外抗氧化活性,不同指标下活性强弱存在显著性差异。
4)不同饱和度硫酸铵沉淀坛紫菜蛋白粗提液得到的分离蛋白结构特性存在较大差异,可为提取相应结构的蛋白提供合适的饱和度区间参考。

