中间球海胆黑嘴病病原菌的分离与鉴定
刘岩松,张伟杰,王中,殷维骏,欧凡江,田文卓,刘雷,常亚青
(大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
中间球海胆Strongylocentrotusintermedius作为一种优质海胆种类,具有生长速度快及生殖腺色泽光亮、质地饱满和味甜等特点。中间球海胆原产于日本北方沿海和俄罗斯远东部分地区沿海,中国自1989年从日本引入该种后,便对其开展了生物学、生态学、人工育苗及遗传育种等一系列研究[1-2],同时开始进行人工增养殖生产。目前,中间球海胆已成为中国重要的海珍品增养殖种类之一[2]。近年来,海胆逐渐被中国消费者认可,其养殖规模不断扩大,但细菌性疾病如黑嘴病[3]、红斑病[4-5]和病变综合征等[6]也开始在养殖生产中频繁暴发,严重制约了海胆养殖业的健康发展。
黑嘴病是中间球海胆养殖过程中危害最严重的疾病之一。春夏交替时的低温期是黑嘴病频繁暴发的高峰期,且黑嘴病病原菌对受损伤海胆致病性较强[7],患病海胆的主要特征是围口膜颜色发黑,随着病情逐渐加重,其不能正常进行附着和摄食活动,棘逐渐脱落直至死亡[3]。黑嘴病传染性强,死亡率高,在中间球海胆养殖过程中危害较大,因此,开展黑嘴病病原的分离和鉴定及病原菌病原特性的研究,对有效防控中间球海胆黑嘴病具有重要意义。目前,已有研究对中间球海胆黑嘴病致病菌的鉴定尚有争议。Takeuchi等[8]从患黑嘴病中间球海胆中分离出一种菌株,根据病原菌的生化特性、DNA-DNA同源性和血清学分析,证明该病原菌为弧菌属Vibrio;而李太武等[3]根据该病原菌的形态特征及生化特性,鉴定中间球海胆黑嘴病的病原菌为坚强芽孢杆菌Bacillusfirmus。原因可能是黑嘴病的病原菌有多种,导致分离出的致病菌种类不一,也可能是因为试验方法及鉴定方法不同,导致结果出现分歧。鉴于目前细菌鉴定技术的不断进步,有必要对黑嘴病病原菌进行重新鉴定。本研究中,对患有黑嘴病的中间球海胆进行了病原菌分离纯化,并采用电镜观察、革兰氏染色、生理生化鉴定和16S rRNA序列比对等系列手段对该病原进行了鉴定,以期为海胆黑嘴病的防治提供科学参考。
1 材料与方法
1.1 材料
试验用患病及健康中间球海胆均取自大连海洋大学农业农村部北方海水增养殖重点实验室同批人工繁育群体,挑选具有典型黑嘴病病症的个体作为病原分离的试验材料。
抗菌药物药敏纸片购自杭州微生物试剂有限公司;细菌微量鉴定管购自海博生物技术有限公司;2216E培养基、无菌接种环和PBS试剂均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 病原菌的分离与纯化 在无菌条件下,对具有典型黑嘴病病症的中间球海胆进行解剖,吸取其体腔液于2216E固体培养基上进行划线分离,在16 ℃下恒温培养12 h后,对菌落形态、大小和颜色等进行观察比较,挑取优势菌落进行纯化培养,将菌液与体积分数为80%的甘油按体积比1∶1混合均匀后置于-80 ℃下保存备用,分离的细菌编号为D1。
1.2.2 人工回感试验 采用浸泡法进行人工回归感染试验,随机取200只健康无病症的中间球海胆,等分放入4个10 L灭菌水槽中,暂养3 d后开始试验,使用1 mL无菌注射器针头从海胆围口膜处刺入造成损伤后,向水槽中加入10 μL浓度为108cfu/mL的D1菌液,最终浸泡胁迫浓度为 102cfu/mL,对照组仅使用针头损伤海胆,养殖于无菌海水中。试验期间保持水温为(17±1)℃,连续观察7 d并记录试验海胆的发病症状及死亡情况。
1.2.3 病原菌形态观察 将纯化后的病原菌涂布在载玻片上,经火焰固定,随后分别加结晶紫染液1 min后水洗、碘液1 min后水洗、脱色液1 min后水洗及复染液30 min后水洗,晾干后进行镜检。
取10 mL浓度为109cfu/mL的D1菌液离心(3 000g),去除上清液,加入5 mL 0.1 mol/L PBS清洗,清洗3次后加入5 mL体积分数为2.5%的戊二醛固定3 h,用PBS清洗2次,用纯水清洗2次,再用体积分数为30%、50%、70%、80%、90%和100%的乙醇溶液梯度脱水,最后滴加处理好的样品于1 cm×1 cm的贝壳上,置于烘箱中进行烘干,样品充分干燥后进行扫描电镜观察。
1.2.4 病原菌生化特征鉴定 将分离株D1接种于2216E固体培养基上,在16 ℃下恒温培养24 h,用无菌接种环挑取适量单菌落接种于细菌微量鉴定管中,用无菌封口膜封口,在37 ℃下恒温培养。
1.2.5 病原菌分子生物学鉴定 将新鲜培养的单菌落挑取至2216E液体培养基中,于16 ℃下恒温培养12 h后,取1 μL稀释5倍作为模板。利用通用引物(引物序列为8F:AGAGTTTGATCCTGGCTCAG,1492R:GGTTACCTTGTTACGACTT)扩增16S rRNA基因全长。反应体系(共50 μL):正、反向引物各2 μL,DNA模板1 μL,rTaq 0.4 μL,dNTP Mixture 4 μL,10×PCR Buffer 5 μL,用无菌水补足至50 μL。反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,43.6 ℃下退火30 s,72 ℃下延伸1 min,共进行35个循环;最后再在72 ℃下延伸10 min。将所得未纯化PCR产物送至生工生物工程(上海)股份有限公司测序。运用MEGA X软件将返回的D1菌株16S rRNA基因扩增序列进行拼接,得到全长后在Ezbio Cloud数据库中进行多序列比对。将EzBio Cloud数据库中与D1菌株的16S rRNA基因序列相似度较高的几种常见致病弧菌,用MEGA X软件进行比对,并采用邻接法(NJ)构建系统发育树, 以自举数据集为1 000次的自举分析(bootstrap)进行置信度检测。
1.2.6 药敏试验 对病原菌D1运用药敏纸片扩散法进行药敏试验。取200 μL新鲜菌液涂布于2216E固体培养基上,将药敏纸片用无菌镊子贴于涂布新鲜菌液的培养基表面,在16 ℃下恒温培养24 h,根据杭州微生物试剂有限公司提供的《药敏试验纸片法的抑菌范围解释标准》,通过测定抑菌圈直径确定病原菌株的药物敏感性。
2 结果与分析
2.1 病原菌分离纯化
从图1可见,从患病中间球海胆中提取的优势病原菌D1在2216E培养基上培养12 h(16 ℃)后,菌落呈圆形、乳白色、不透明。
2.2 人工回感试验
人工回感试验发现,海胆在感染48 h内出现围口膜变黑,管足回缩,附着能力丧失,运动能力减弱等病症(图2),与自然发病的海胆症状相同。从表1可见:感染后的海胆在48 h后开始出现死亡,第8天时3组的平均死亡率为30.67%±1.15%;对照组海胆损伤后置入无菌海水中暂养,并未发生病状。同时,再次从人工感染的发病海胆中进行优势菌分离,用二次分离到的菌株感染健康海胆,出现的海胆黑嘴病症状与自然发病症状相同,16S rRNA序列比对结果均与菌株D1一致。这表明,菌株D1为中间球海胆黑嘴病病原。

图1 分离的菌株D1Fig.1 Isolated strain D1

图2 菌株D1回感海胆Fig.2 Strain D1 challenged to the sea urchin

表1 菌株D1感染试验Tab.1 Strain D1 infection experiment
2.3 病原菌形态观察
如图3、图4所示,D1菌株经过革兰氏染色,结果为革兰氏阴性菌,菌株呈短杆状,长×宽为(2.10±0.31)μm×(0.68±0.08)μm(n=30)。
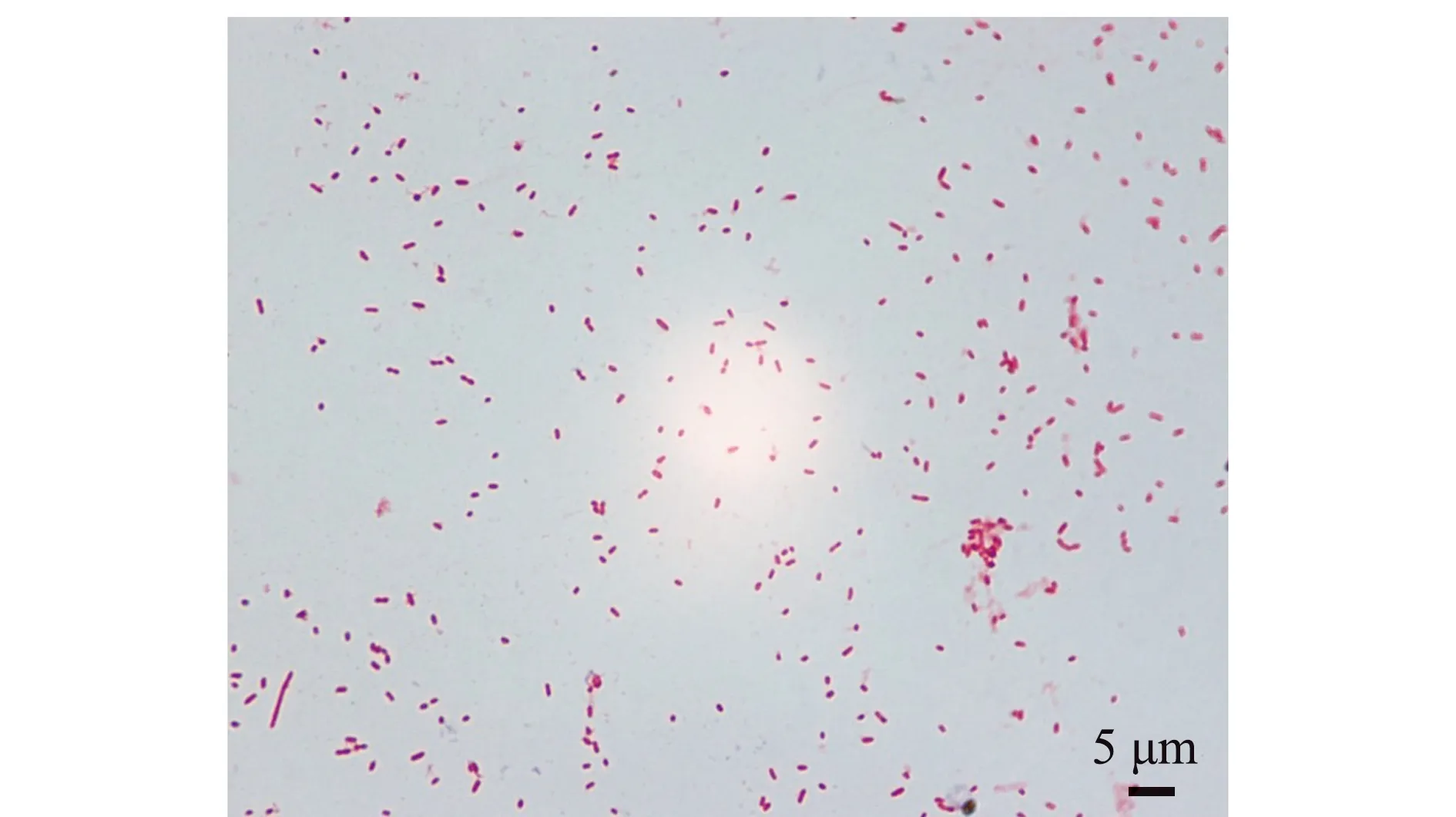
图3 菌株D1革兰氏染色图片Fig.3 Micrograph of strain D1 by Gram-staining
2.4 生理生化鉴定
利用细菌微量鉴定管对菌株D1进行鉴定,结果显示菌株D1在6%氯化钠胨水中可以生长,无芽孢,不可以利用鸟氨酸、赖氨酸和精氨酸脱羧,V-P反应、甲基红反应呈阴性,氧化酶反应呈阳性,可以利用蔗糖,不可以利用西蒙氏枸橼酸盐、葡萄糖、甘醇、水杨苷,不产生吲哚,不能分解尿素,与常见弧菌属有一定差别(表2)。
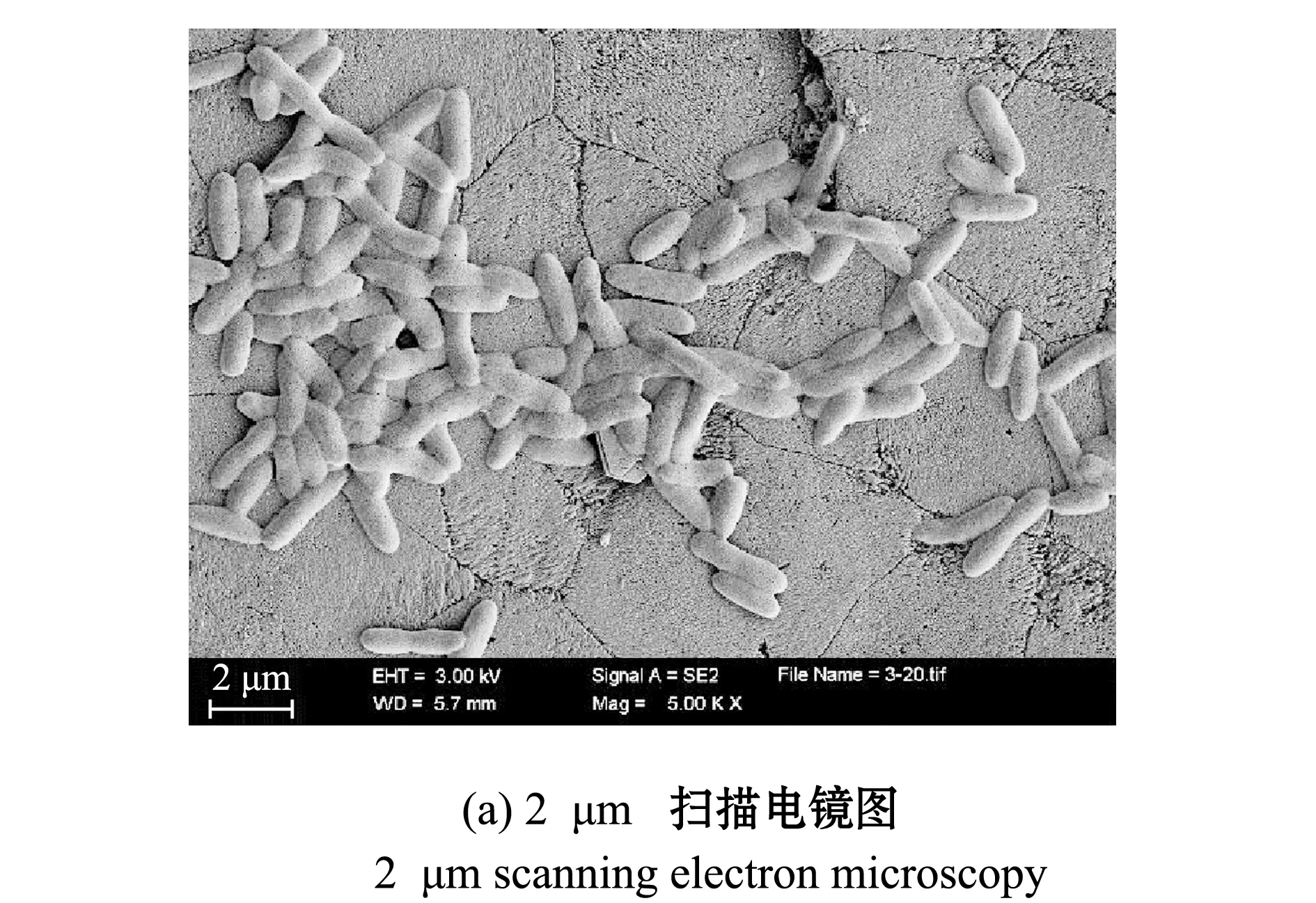

图4 菌株D1的扫描电镜图Fig.4 Scanning electron microscopy of strain D1
2.5 分子生物学鉴定
利用通用引物对菌株D1进行16S rRNA基因全长扩增,在EzBio Cloud数据库中将菌株D1的16S rRNA基因片段序列进行序列比对,结果显示,菌株D1与参考菌株棘皮动物弧菌Vibrioechinoideorum的一致性为99.04%(图5)。
选择EzBio Cloud数据库中已报道的同源性较高的棘皮动物弧菌及其他8种弧菌的16S rRNA基因序列,采用邻接法构建系统发育树,结果显示,菌株D1与棘皮动物弧菌单独聚为一支,表明二者的亲缘关系最近(图6)。根据生理生化试验和16S rRNA生物学鉴定结果,确定D1菌株为棘皮动物弧菌V.echinoideorum。

表2 病原菌D1的理化特性及与常见弧菌的比较Tab.2 Physicochemical characteristics of pathogenic bacterium D1 and comparison with common Vibrio species

图6 基于16S rRNA基因序列的D1系统发育进化树Fig.6 Phylogenetic tree of strain D1 based on 16S rRNA gene sequence
2.6 药敏试验
从表3可见:菌株D1对麦迪霉素、万古霉素和庆大霉素等11种抗菌药物耐药,对头孢哌酮、新霉素和青霉素3种抗菌药物中度敏感,对诺氟沙星、环丙沙星、呋喃唑酮等16种抗菌药物敏感。
3 讨论
3.1 黑嘴病及其致病机理
黑嘴病是中间球海胆养殖过程中常见的一种疾病,对海胆养殖具有较大的危害,可造成大规模死亡。李太武等[3]研究发现,黑嘴病症状首先是出现围口膜变黑,对其组织病理切片进行观察后,发现围口膜上无明显病变,认为可能是细菌通过破坏口器中的肌肉组织,使海胆无法摄食并导致死亡。张勃等[9]研究发现,患黑嘴病的海胆体腔细胞CAT活性、SOD活性和总抗氧化能力明显降低。本研究团队应用该病原菌(棘皮动物弧菌)开展的研究发现,中间球海胆在黑嘴病病原菌入侵后,首先通过提高酸性磷酸酶等与吞噬作用相关的免疫酶活性及吞噬相关免疫基因表达等方式增强吞噬作用,并通过细胞凋亡和再生保持细胞数量,在感染后期,由于不能清除病原菌,吞噬作用逐渐减退,细胞坏死率大幅上升,导致海胆发病[10]。Hira等[11]揭示了棘皮动物弧菌的致病机理,即该菌具有较强的β-溶血活性,具有杀伤宿主细胞的能力,同时还具有溶解海胆体腔细胞的能力。

表3 菌株D1的药敏试验结果Tab.3 Drug sensitive test results of strain D1
3.2 海胆黑嘴病病原鉴定
导致海胆发病的媒介有许多,包括细菌、真菌和寄生虫等,其中,细菌被认为是大多数海胆疾病的主要病原体[12]。本试验中,从患病海胆体腔液中分离出一株优势菌D1,综合生理生化及分子生物学方法鉴定结果,确定该菌株为棘皮动物弧菌。而李太武等[3]的研究认为,中间球海胆黑嘴病的病原菌为坚强芽孢杆菌,Takeuchi等[8]的研究认为病原菌为弧菌属。本研究中,利用分离的病原菌进行人工回感试验时,能够复制中间球海胆黑嘴病自然发病症状,且从人工感染的患病海胆体腔液中再次得到相同的分离菌株,证实棘皮动物弧菌为中间球海胆黑嘴病的病原菌。
弧菌是水产动物主要的致病菌,引起的病症有多种。溶藻弧菌V.alginolyticus是导致海参患腐皮综合征的主要致病菌之一[13];方斑东风螺Babyloniaareolata和长牡蛎Crassostreagigas在感染哈维氏弧菌V.harveyi后出现死亡现象[14-15];红鳍东方鲀Fugurubripes在感染哈维氏弧菌后会出现烂鳍烂尾、体色发黑和死亡等症状[16];溶珊瑚弧菌V.coralliilyticus可导致中间球海胆发生红斑病[17];强壮弧菌V.fortis、罗尼氏弧菌V.shilonii、哈维氏弧菌和灿烂弧菌V.splendidus是中间球海胆病变综合征的病原菌[6];鳗弧菌V.anguillarum可导致紫球海胆S.purpuratus发生秃海胆病[18]。弧菌的形态一般呈弧状,而棘皮动物弧菌的形态呈短杆状。在水产动物中,这种情况时有发生,如异育银鲫Carassiusauratusgibelio肠道中存在的蛭弧菌Bdellovibriobacteriovous和青石斑鱼Epinephlusawoara病鱼体表及内脏中存在的哈维氏弧菌均为短杆状[12,19]。Hira等[20]发现,棘皮动物弧菌同样为短杆状,菌株长度为(1.9±0.1)μm,与本研究中菌株长度(2.10±0.31)μm十分接近。值得注意的是,Hira等[20]在绿海胆S.droebachiensis病变表皮中分离出该菌,说明棘皮动物弧菌也可能会导致海胆发生其他疾病,但本研究在回感试验中未观察到感染海胆出现其他症状,这可能与感染条件(如水温)等有关。
3.3 海胆黑嘴病的控制方法
水产动物疾病的治疗一直是较难攻克的问题,对于鱼类等脊椎动物来说,可研发针对特定病原的疫苗来预防感染[21],但对于缺少获得性免疫的无脊椎动物来说,目前尚无疫苗用于疾病预防[22]。抗菌药物在预防和治疗水产动物细菌性疾病中发挥着重要作用[23-24]。本研究中,明确了棘皮动物弧菌对30种抗菌药物的敏感性,该菌对麦迪霉素、万古霉素、克林霉素和丁胺卡那等11种抗菌药物不敏感,对诺氟沙星和氧氟沙星等16种抗菌药物敏感。值得注意的是,上述敏感药物并不一定可用于预防和治疗海胆的黑嘴病,原因有两方面:一是许多抗菌药物禁止用于水产动物,是否可用必须查询兽药典、兽药质量标准和相关公告;二是实际养殖环境复杂,药敏试验和实际使用效果是否一致还需进一步验证。
对于海胆黑嘴病的防控,目前亟须研发绿色无抗技术,作者提出建议如下:
1)对海胆的抗病力进行遗传改良是提升其抗病能力的根本途径。本课题组近期对中间球海胆不同选育家系间的抗病能力进行了比较,发现不同家系间的抗病力具有显著差异,通过构建复合抗病指数,可实现对抗病和生长性状的复合选择[25]。
2)通过开发生产海胆的特定疫苗及以病原菌为抗原制备卵黄抗体等方法,也可降低其患病概率、减少疾病损失,由于海胆的经济价值及养殖规模等因素,可考虑采用浸泡法。
3)海胆养殖过程中,在配合饲料中添加维生素、免疫增强剂,以及天然植物提取物和芽孢杆菌等益生菌,均可以提高海胆的免疫力,起到一定的防病害效果。
4)海胆损伤后致病菌更易侵入,导致海胆发病,故在养殖过程中应注意尽量避免海胆损伤。综上所述,本研究中分离获得的病原菌将为海胆抗病育种和提高免疫力研究提供有益参考。
4 结论
1)从患黑嘴病海胆体腔液中分离出的1株优势菌,菌株大小(长×宽)为(2.10±0.31)μm×(0.68±0.08)μm,为革兰氏阴性菌;通过生理生化试验及16S rRNA分子生物学鉴定,确定该菌株为棘皮动物弧菌。
2)病原棘皮动物弧菌对麦迪霉素、万古霉素、克林霉素、丁胺卡那等11种抗菌药物不敏感,对诺氟沙星、氧氟沙星等16种抗菌药物敏感。恩诺沙星是喹诺酮类抑菌剂,可以尝试在生产中用其预防和治疗黑嘴病,抗菌药物治疗必须依据兽药典、兽药质量标准和相关公告。

