NaCl胁迫对2种补血草种子萌发及幼苗生长的影响
郑伶杰,丁丁,丁冯洁,郭艳超
(河北省农林科学院滨海农业研究所/唐山市植物耐盐研究重点实验室/河北省盐碱地绿化技术创新中心,河北唐山 063299)
据报道,我国现有盐碱地总面积达99.13万平方千米,约占国土面积的10%,主要分布在黄淮海平原、东部滨海地区、新疆和西藏部分地区以及东北松嫩平原等地[1]。盐碱地土壤存在有机质含量少、肥力弱、理化性状差、对植物有害的离子多等诸多问题,因此,选择适应性强的植物类型是实现盐碱地绿化的重要途径之一。
补血草属植物是白花丹科(Plumbaginaceae)多年生泌盐草本植物,有耐干旱、耐盐碱、耐土壤贫瘠等特点,多分布于沙漠、戈壁滩和盐化草甸等环境,具有重要的生态利用价值[2]。补血草不仅可以作为园林绿化植物用于打造城市群体景观,也是不可多得的干花植物和插花素材;此外,补血草的根、叶、花还可以入药,具有医疗保健功效,可为医药工业原料。
澳洲补血草和欧洲补血草是河北省盐碱地绿化技术创新中心从国外引进的2种补血草属新品种,株型整齐美观,景观效果好。根据本课题组前期观察,2种补血草在河北滨海地区生长良好,可作为盐碱地绿化的优良地被植物。目前关于补血草属植物耐盐性的研究多集中在二色补血草、大叶补血草、黄花补血草等品种,对澳洲补血草和欧洲补血草的相关研究还未见报道。因此,本试验以澳洲补血草和欧洲补血草的种子和幼苗为试验材料,分别设计不同浓度NaCl处理,比较不同浓度盐胁迫对种子萌发和幼苗生长的影响,以期为耐盐补血草品种选育和应用提供理论依据。
1 材料与方法
1.1 试验材料
供试材料经河北省农林科学院滨海农业研究所王文成研究员鉴定为澳洲补血草和欧洲补血草,种子由河北省盐碱地绿化技术创新中心提供。
1.2 补血草种子在NaCl胁迫下的萌发试验
1.2.1 试验设计及处理方法 试验于2020年11月在河北省农林科学院滨海农业研究所实验室内进行,采用随机区组设计,设置NaCl溶液质量百分比浓度分别为0(CK1)、0.3%、0.6%、0.9%、1.2%、1.5%,3次重复。选取完整程度一致的2种补血草种子,先用次氯酸钠溶液浸泡20 min,然后用无菌水冲洗3次,用无菌滤纸吸干,均匀摆放于铺有两层滤纸的培养皿(直径120 mm)中,每皿30粒,随后分别加入各浓度NaCl溶液10 mL至滤纸完全湿润,用封口膜包裹培养皿边缘防止水分流失;将培养皿置于光照培养箱中,在温度(25±1)℃、湿度60%、光强4000 lx条件下培养。1.2.2 调查指标与计算方法 以种子露白作为发芽标准,在发芽试验第5天统计发芽势,第7天统计发芽率,并每皿随机取10粒已发芽种子,用游标卡尺测量胚根长、胚轴长,计算根轴比(胚根长与胚轴长的比值)。发芽率、发芽势、相对盐害率的计算公式如下:

1.3 补血草幼苗在NaCl胁迫下的培养试验
1.3.1 试验设计与处理方法 试验于2021年1月至5月在本研究所试验基地进行,采用随机区组设计,每处理重复4次,每重复一盆。将补血草芽苗小心移栽到含营养土的穴盘中,置于温度(25±1)℃、湿度60%、光照时间14 h/d、光强4000 lx的人工气候室中正常培养;待芽苗长至10片真叶时,移栽至装有基质(蛭石和草炭等体积混匀)的花盆中,每盆一株,于室外防雨棚中继续培养一个月后进行盐胁迫处理。配制NaCl质量百分比浓度分别为0(CK2)、1.0%、1.5%、2.0%、2.5%、3.0%的霍格兰营养液,根据试验设计分别浇灌补血草幼苗,每次每盆浇灌600 mL,并将流入托盘中的营养液倒回花盆中,每3 d浇灌一次,处理30 d,取样进行各指标测定。
1.3.2 测定指标及方法 取2种补血草植株相同部位的叶片,用游标卡尺测量叶片的覆盖直径、长度和宽度;将补血草幼苗地上部和地下部分别用自来水清洗干净,滤纸吸干水分,用电子天平称量地上部和地下部的鲜重,然后105℃杀青30 min后80℃烘干至恒重,用电子天平称量地上部和地下部的干重,计算相对含水率。
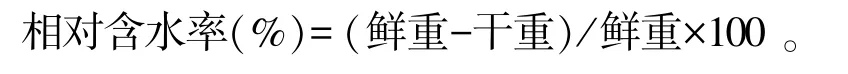
叶片色素含量采用95%乙醇提取、分光光度法测定,可溶性蛋白含量采用考马斯亮蓝比色法测定,可溶性糖含量采用硫酸蒽酮比色法测定;脯氨酸、甜菜碱、总黄酮和总三萜含量参考武香[3]、王思瑶等[4]的方法测定。
1.4 数据处理与统计分析
采用Microsoft Excel 2019软件对数据进行统计、处理,使用SPSS 26.0软件进行方差分析。采用Origin 2019b软件作图。
2 结果与分析
2.1 不同浓度NaCl处理对2种补血草种子萌发的影响
2.1.1 发芽势和发芽率 由图1可见,澳洲补血草、欧洲补血草种子在试验各NaCl浓度下均具有发芽能力,但明显低于CK1(发芽势、发芽率分别为98.8%、100%和78.9%、82.2%)。随NaCl浓度升高,其发芽势、发芽率均呈下降趋势,其中,澳洲补血草在0~0.6% NaCl处理下变化较缓,0.9%NaCl处理时发芽率仍为85.6%,之后快速下降;而欧洲补血草在低浓度NaCl(0.3%~0.6%)下即快速下降,0.6% NaCl处理时发芽势仅为18.9%,发芽率仅为CK1的24.3%,之后变化趋于平缓。两品种间比较,澳洲补血草的发芽势和发芽率在各浓度NaCl处理下均高于欧洲补血草,表明欧洲补血草对盐胁迫更敏感。
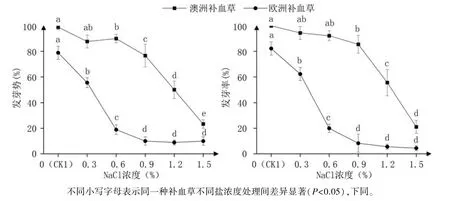
图1 不同浓度NaCl处理对补血草种子萌发的影响
根据前人研究结果[5],发芽率为75%、50%、10%时所对应的盐浓度分别为补血草种子萌发期耐盐的适宜浓度、半致死浓度和极限浓度。因此,以发芽率为因变量(y)、NaCl浓度为自变量(x)进行回归分析,得到澳洲补血草和欧洲补血草的回归方程分别为y=-50.734x2+26.815x+96.561(P=0.003,R2=0.9815)和y=50x2-129.333x+86.2(P=0.006,R2=0.9684),经计算得出澳洲补血草和欧洲补血草种子萌发期耐盐的适宜浓度、半致死浓度、极限浓度分别为0.97%、1.25%、1.59%和0.09%、0.32%、0.91%,表明澳洲补血草种子的耐盐性高于欧洲补血草。
2.1.2 胚根长和胚轴长 如表1所示,在NaCl浓度为0.3%~1.5%范围内,总体来说2种补血草种子的胚根长、胚轴长、根轴比随NaCl浓度升高呈降低趋势,相对盐害率呈上升趋势。与CK1相比,0.3% NaCl处理显著促进澳洲补血草胚根的伸长(11.57 mm),并显著抑制胚轴的伸长(1.79 mm),根轴比达到6.5;当盐浓度超过0.6%后,澳洲补血草的胚根长和胚轴长显著缩短,根轴比降低,相对盐害率大幅上升。盐胁迫抑制了欧洲补血草种子胚根和胚轴的伸长,0.6% NaCl处理下即达到显著水平,在较高盐浓度(1.2%~1.5%)时胚根无法正常生长,相对盐害率可高达94.6%。
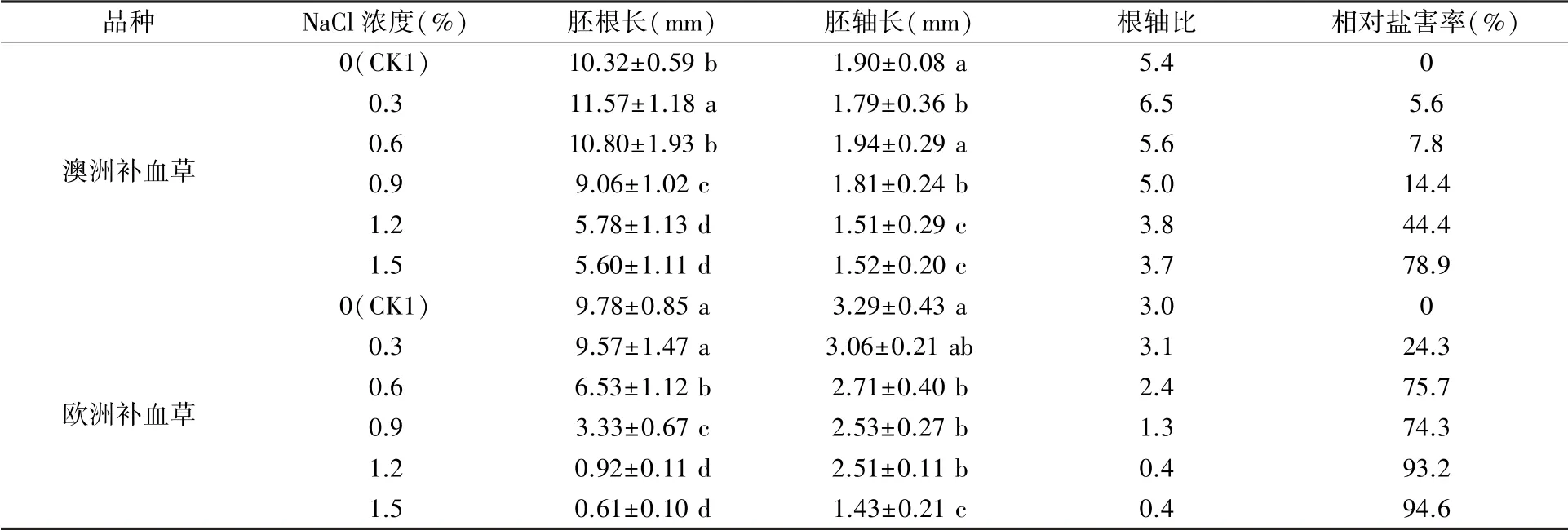
表1 不同浓度NaCl处理对2种补血草种子萌发后胚芽的影响
2.2 盐胁迫对两种补血草幼苗植株性状的影响
2.2.1 叶片覆盖直径 如图2所示,盐处理30 d后,随着NaCl浓度的升高,2种补血草的叶片覆盖直径呈降低趋势,但澳洲补血草变化幅度较小,在NaCl浓度2.0%以内与对照无显著差异,3.0%NaCl处理下叶片覆盖直径为6.05 cm,比CK2降低了23%。欧洲补血草的叶片覆盖直径明显高于澳洲补血草,但受NaCl胁迫显著抑制,且呈NaCl浓度越高抑制作用越明显趋势,在2.5%NaCl处理下叶片覆盖直径最低为10.1 cm,显著低于对照。结合形态观察并分析30 d内叶片覆盖直径的增长量发现,随着盐浓度的增加,2种补血草的叶片覆盖直径增长量整体呈现下降趋势,且欧洲补血草的增长量变化更为剧烈,当NaCl浓度超过2.0%后增长量被明显抑制,叶片皱缩边缘卷曲。

图2 不同浓度NaCl处理对2种补血草 幼苗叶片覆盖直径的影响
2.2.2 叶片长度和宽度 如图3A所示,欧洲补血草的叶片长度明显高于澳洲补血草,但其受NaCl胁迫的影响更大。澳洲补血草叶片长度在1.0%~1.5% NaCl处理下与CK2无显著差异,均约39.00 mm;当NaCl浓度达到2.0%后才显著降低,以2.0% NaCl处理最低,为32.00 mm。欧洲补血草叶片长度在NaCl处理下显著降低,2.5%NaCl处理下最低,仅为对照的60%。
由图3B可以看出,澳洲补血草和欧洲补血草的叶片宽度整体表现出先升高后降低再升高的变化趋势,低浓度NaCl处理对其叶宽生长有一定促进作用,均在1.5% NaCl处理下最大,分别为20.50 mm和23.71 mm。
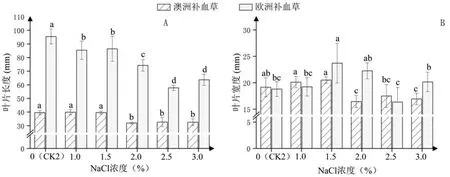
图3 不同浓度NaCl处理对2种补血草幼苗叶片长度和宽度的影响
2.2.3 地上部和地下部生长 由表2可知,澳洲补血草和欧洲补血草的地上部鲜重有随NaCl浓度升高先增加后降低的趋势,分别在1.5%和2.0% NaCl处理时最高,分别比CK2增加10.86%和6.54%;在较高浓度(2.5%~3.0%)NaCl胁迫下2种补血草的地上部生长都受到明显抑制。NaCl处理明显抑制2种补血草的地下部生长,NaCl浓度越高,其地下部鲜重下降越显著,3.0% NaCl处理下澳洲补血草和欧洲补血草的地下部鲜重分别为CK2的58.3%和26.5%。NaCl浓度达到1.5%后显著降低2种补血草的地上部相对含水率,但NaCl处理对地下部相对含水率无显著影响。由地上部鲜重与地下部鲜重的比值可见,CK2处理下2种补血草的该比值均为1.1,NaCl处理使该比值增大,且NaCl浓度越高值越大,3.0% NaCl处理时澳洲补血草和欧洲补血草的该比值最大,分别为1.6和4.0,说明盐胁迫对2种补血草尤其欧洲补血草地下部生长的抑制作用更大,盐浓度越高越明显。
表2 不同浓度NaCl处理对2种补血草幼苗地上部和地下部生长的影响
2.3 不同浓度NaCl胁迫对2种补血草幼苗叶片光合色素含量的影响
由图4可知,随着NaCl浓度的升高,澳洲补血草幼苗叶片内叶绿素a、叶绿素b、总叶绿素含量呈现先升高后降低的变化趋势,均在1.5% NaCl处理下达到最大值,且显著高于CK2。欧洲补血草幼苗叶片内的叶绿素a、总叶绿素含量也呈先升高后降低的变化趋势,均在1.0% NaCl处理下达最大值,其中总叶绿素含量与CK2差异达到显著水平;但叶绿素b含量波动变化,2.0% NaCl处理时值最高,其次为1.0% NaCl处理,均显著高于CK2。2种补血草叶片内类胡萝卜素含量随NaCl浓度升高的变化趋势存在明显差异,澳洲补血草的表现为先升高后降低再升高,欧洲补血草则表现为降低趋势。总体来看,低浓度(1.0%~1.5%)盐胁迫有利于补血草叶片中光合色素的积累,而较高浓度(2.0%~3.0%)盐胁迫抑制其积累。
图4 不同浓度NaCl处理对2种补血草幼苗叶片光合色素含量的影响
2.4 不同浓度NaCl胁迫对2种补血草幼苗叶片内渗透调节物质含量的影响
2种补血草叶片内的可溶性蛋白、可溶性糖、脯氨酸和甜菜碱4种渗透调节物质对盐胁迫的响应不同(图5)。随NaCl浓度升高,2种补血草叶片内可溶性蛋白含量均呈先升高后降低趋势,且均在2.0%NaCl处理下最大;与CK2相比,除2.0%NaCl处理下欧洲补血草可溶性蛋白含量与CK2差异显著外,2种补血草各处理间均差异不显著(图5A)。澳洲补血草叶片内可溶性糖含量除在1.0% NaCl处理下略低于CK2外,其余NaCl处理均能增加其含量,且随NaCl浓度升高呈先升后降变化趋势,在2.5%NaCl处理下达到最大,与CK2差异显著;NaCl处理明显增加欧洲补血草叶片内的可溶性糖含量,在1.0% NaCl处理下最大(5.03 mg/g),显著高于CK2,之后随着NaCl浓度升高而逐渐降低,与CK2差异不显著(图5B)。由图5C、D可以看出,澳洲补血草叶片内的脯氨酸和甜菜碱含量随着NaCl浓度的升高呈逐渐上升趋势,在3.0%NaCl处理下分别是CK2的8.6倍和1.5倍;欧洲补血草叶片内脯氨酸和甜菜碱含量均随NaCl浓度升高先增加后减少,分别在2.5%和2.0% NaCl处理下达到最大值,分别比CK2提高3.82倍和36.5%,差异显著。
图5 不同浓度NaCl处理对2种补血草幼苗叶片内渗透调节物质含量的影响
2.5 不同浓度NaCl胁迫对2种补血草幼苗叶片内活性物质含量的影响
如图6A所示,NaCl处理降低了2种补血草叶片内的总黄酮含量,且表现出随NaCl浓度升高先下降后上升趋势,除2.0% NaCl处理显著降低欧洲补血草的总黄酮含量外,其余处理均与CK2差异不显著。
由图6B可知,2.0% NaCl处理增加了澳洲补血草叶片内的总三萜含量,其余NaCl处理均降低总三萜含量,且1.0%~1.5% NaCl处理下降低显著。NaCl处理显著提高了欧洲补血草叶片内的总三萜含量,且随着NaCl浓度升高呈现先提高后降低的变化趋势,在2.0% NaCl处理下值最高。
图6 不同浓度NaCl处理对2种补血草幼苗叶片内活性物质含量的影响
3 讨论与结论
3.1 盐胁迫对2种补血草种子萌发的影响
种子萌发是作物生长过程的第一个阶段,也是其适应外界环境的关键时期。种子萌发期的耐盐能力,在一定程度上可以反映种质的耐盐性,可以作为早期鉴定种质耐盐性的一个方法[6]。本试验结果表明,0.3%~1.5% NaCl处理抑制了2种补血草种子的萌发,发芽势和发芽率大幅下降,且NaCl浓度越高抑制效果越显著。2种补血草间比较,欧洲补血草种子萌发对盐胁迫更敏感,0.3% NaCl处理即显著降低其发芽势和发芽率,而澳洲补血草种子萌发在高于0.6%的NaCl处理下才受到显著抑制,说明补血草属植物在盐胁迫下的萌发存在种间差异。前人对黑果枸杞[7]、花花柴[8]的研究表明,低浓度盐胁迫对其种子萌发的影响不显著,盐浓度越大抑制效果越明显。这可能是由于低浓度盐胁迫下种子虽然处于轻度渗透胁迫状态,但离子进入细胞后降低了细胞渗透势,种子吸水能力增强,从而促进种子萌发;而高浓度盐胁迫造成种子细胞离子失衡、渗透调节紊乱、种子吸水率下降,因此抑制种子萌发。
通过对2种补血草种子发芽率与NaCl浓度的回归分析,以耐盐半致死浓度和相对盐害率为参考指标[9],澳洲补血草种子耐盐半致死浓度高于欧洲补血草,相对盐害率低于欧洲补血草,表明澳洲补血草种子萌发期的耐盐能力强于欧洲补血草。
3.2 盐胁迫对2种补血草幼苗植株性状及叶片中光合色素积累的影响
植株对环境变化的反应最终体现在表型上,本研究结果表明盐胁迫明显影响了2种补血草幼苗的生长。欧洲补血草幼苗在盐浓度2.0%下叶片覆盖直径的增长被明显抑制,几乎停止增长,而澳洲补血草在盐浓度2.5%下才出现这种现象。分析叶片长度可以发现,盐浓度2.5%下澳洲补血草叶片长与CK2相比减少低于20%,而欧洲补血草则减少40%。前人研究认为[10],地上部生长能提高植物对光能的利用效率,促进有机物的积累,而地下部生长则体现了植物对土壤水分和无机养分的吸收能力。本研究结果显示,随NaCl浓度升高,2种补血草的地上部鲜重先增加后降低,地下部鲜重降低,地上部相对含水率呈降低趋势,地下部相对含水率无显著变化,地上部与地下部鲜重比值增加,并在3.0% NaCl处理下达到最大值(澳洲补血草和欧洲补血草分别为1.6和4.0),说明盐胁迫下2种补血草幼苗根系生长受到的抑制作用更强。
综合叶片覆盖直径增长量、叶片长度、地上部与地下部鲜重比值等表型指标来看,澳洲补血草幼苗的耐盐能力强于欧洲补血草,与种子萌发耐盐性结果具有一致性。
光合作用是绿色植物机体内主要的新陈代谢过程,光合色素含量多少能在一定程度上体现出植物光合作用效率的高低,影响光合产物的积累[11,12]。本研究结果显示,较低浓度(1.0%~1.5%)NaCl处理可增加2种补血草幼苗叶片中总叶绿素含量及澳洲补血草的类胡萝卜素含量,较高浓度(2.0%~3.0%)NaCl处理则降低2种补血草的总叶绿素和类胡萝卜素含量,这与在蒙古柳[13]、柽柳[14]上的研究结果一致,表明较高浓度盐胁迫对植物叶绿体膜系统造成伤害,使光合色素降解加速或合成受到抑制。
3.3 盐胁迫对2种补血草幼苗叶片内渗透调节物质和活性物质含量的影响
盐胁迫对植物的伤害以渗透胁迫伤害为主,外界高盐分造成的渗透势降低,导致细胞吸水困难甚至失水,从而产生生理性干旱。植物通过转运外界无机离子和自身合成有机小分子如脯氨酸、可溶性蛋白、可溶性糖等,可调节细胞渗透势,保护细胞膜以及蛋白的活性,使得水分的跨膜运输向着促进植物生长的方向进发[15-17],从而缓解盐胁迫造成的伤害。本研究结果显示,NaCl处理可提高2种补血草幼苗叶片中可溶性蛋白、可溶性糖、脯氨酸和甜菜碱含量,说明盐胁迫下甜菜碱与脯氨酸、可溶性糖、可溶性蛋白具有协同抗逆作用,维持细胞的稳定性,这与在番茄[18]、颠茄[19]上的研究结果一致。甜菜碱是一种季胺型水溶性生物碱,大多数植物在受到逆境胁迫时均能检测到甜菜碱的积累[20]。
黄酮类化合物和五环三萜类化合物均属植物次生代谢产物,黄酮类通过对自由基的清除和捕获延缓或防止脂质过氧化的发生,从而发挥药用活性功能[21]。总三萜类根据结构特点分为齐墩果烷型、乌苏烷型、羽扇豆烷型和木栓烷型,具有保肝、抗炎、抗肿瘤以及免疫调节等活性,在鹅掌柴[22]、桑黄[23]、刺梨[24]等药用植物中普遍存在,对其研究主要集中于活性成分提取鉴定和药用功能研究方面,但在补血草属植物中的研究还未见报道。本试验结果表明,NaCl胁迫降低补血草叶片中总黄酮的含量,这与在三叶青[25]上的研究结果一致。2种补血草叶片中总三萜含量受盐胁迫的影响有所不同,这可能是因为药用植物中活性成分合成与累积受逆境胁迫影响,而不同植物种类对逆境胁迫的响应存在差异。
综合本研究结果,盐胁迫能抑制2种补血草种子萌发和幼苗生长,高浓度盐胁迫的抑制效果更明显;2种补血草间相比,澳洲补血草种子和幼苗的耐盐能力强于欧洲补血草。这可为两种补血草种质的合理利用提供参考。

