多枝柽柳叶片响应NaCl胁迫的转录组分析
陈亚辉, 张师瑒, 杨庆山, 宋志忠, 姜 姜
(1.南京林业大学林学院,江苏南京210037;2.不列颠哥伦比亚大学理学院,温哥华V6T 1Z4;3.山东省林业科学研究院盐碱地造林试验站,山东济南250000;4.鲁东大学农林工程研究院,山东烟台264039)
盐渍土在全球分布广泛,其土壤中盐分含量高,土壤理化性质差,严重危害植物的生长发育[1-3]。盐渍土含有大量的Na+类盐分,Na+能够破坏蛋白质和膜的稳定性,产生渗透胁迫和离子毒害,导致细胞内活性氧ROS(Reactive oxygen species)信号的产生,使植物细胞功能紊乱,影响植物正常生长,严重时会导致植物死亡[4-6]。近二十年来,受全球人类活动和气候变化的影响,盐渍土面积不断扩大[7],如何科学修复盐渍化土壤和改善生态环境成为学者们关注的热点[8]。
多枝柽柳(TamarixramosissimaLcdcb)属于双子叶泌盐盐生植物[9],能通过被称为囊状毛状体或“盐腺”的特殊结构将盐从叶片表面排出[10]。在长期进化过程中,多枝柽柳形成了耐盐、耐干旱、抗风沙等优良特性,以适应恶劣的生存环境。在柽柳属植物中,对刚毛柽柳(TamarixhispidaWilld.)耐盐分子机制的研究较为深入。Lei等[11]发现在150 mmol/L NaCl胁迫条件下,刚毛柽柳ThCOL2基因过表达后,可通过调控保护酶的活性并降低体内O2·-和H2O2的积累,进而增强转基因刚毛柽柳对ROS的清除能力,以减少细胞损伤和死亡,增强植物对盐胁迫的适应能力。因此,推测ThCOL2基因能够响应盐胁迫。王培龙等[12]在刚毛柽柳中通过克隆获得ThPP2C基因,研究发现该基因参与植物耐盐胁迫和脱落酸、茉莉酸等激素应答。此外,有关多枝柽柳耐盐研究多集中在其在盐胁迫条件下的生长和生理响应,如鲁艳等[13]发现低浓度(≤100 mmol/L)NaCl胁迫会促进多枝柽柳的生长,而高浓度(≥200 mmol/L)NaCl胁迫则抑制其生长;刘咏梅等[14]采用液体培养法分析了甘肃柽柳(T.gansuensisH.Z.Zhang)、多枝柽柳和细穗柽柳(T.leptostachysBunge)3种柽柳材料在不同浓度NaCl胁迫条件下的生理指标和SOS1基因的表达水平,结果表明,3种多枝柽柳表现出较强的耐盐能力,可将多枝柽柳作为柽柳属代表性植物进行耐盐机制研究。
近年来,转录组测序(RNA-Seq)技术已被广泛用于植物抗逆研究,对揭示植物耐盐的分子机理起到推动作用[15-16]。WRKY、bHLH、bZIP、NAC、MYB、AP2/ERF等转录因子均参与盐胁迫[17-27]。张惠媛等[17]的研究结果表明,小麦WRKY转录因子基因TaWRKY33受盐胁迫诱导表达,提高了转基因拟南芥和小麦的耐盐性;屈兴红等[28]研究发现WRKY转录因子通过调控相关基因来参与调控超氧化物歧化酶(SOD)等氧化还原酶基因的转录表达以适应盐胁迫;练冬梅等[29]发现黄秋葵在盐胁迫处理24 h后,MYB4转录因子基因呈上调表达,黄秋葵幼苗耐盐性增强;Wang等[30]研究刚毛柽柳ThbZIP1基因时,发现过表达ThbZIP1可以增强过氧化物酶(POD)和超氧化物歧化酶的活性,并增加可溶性糖和可溶性蛋白质的含量,这表明ThbZIP1是通过介导多种生理途径的信号传导来促进耐盐性。此外,MAPK(Mitogen-activated protein kinase)级联是广泛存在于真核生物中重要的信号转导途径[31],参与植物生长发育及对盐胁迫的应答反应。它由MAPKKK-MAPKK-MAPK3类丝氨酸/苏氨酸蛋白激酶组成,通过磷酸化将信号进行传递和放大[32]。MAPK级联反应途径作用于下游靶蛋白进而激活相应的抗逆基因表达,调节渗透平衡、离子平衡以及氧化还原平衡,从而提高植物抵抗逆境胁迫的能力。有研究结果表明MKK4/5-MAPK3/MAPK6在信号传递过程中通过未知的机制启动转录因子WRKY22/WRKY29,诱导防御基因的表达[33]。Teige等[34]研究发现拟南芥中AtMEKK1-AtMAPKK2-AtMAPK4/AtMAPK6反应途径在抵抗盐胁迫中发挥重要作用,能够提高对盐胁迫的抗性。
本研究以多枝柽柳为研究材料,通过高通量转录组测序筛选200 mmol/L NaCl胁迫处理下叶片中的差异表达基因,并利用qRT-PCR验证候选基因的表达差异,从转录水平揭示多枝柽柳响应盐胁迫的关键基因及其潜在的调控网络,为研究柽柳属植物耐盐机制提供理论支撑和基因资源。
1 材料与方法
1.1 试验材料
供试多枝柽柳由山东省林业科学院东营试验基地提供,试验于2019年10月-2021年3月在南京林业大学林木遗传育种与生物技术重点实验室完成。选取5个月苗龄、长势相近的多枝柽柳扦插苗转移至盛有1/2 Hoagland营养液的24孔水培箱(尺寸为40 cm×30 cm×16 cm)中,放置于温度(26±2) ℃、相对湿度40%~55%的温室大棚中驯化培养2个月后备用。
1.2 试验处理
试验设置对照组和处理组,每组8株,3次重复。以1/2 Hoagland营养液培养多枝柽柳为对照组(CK),以添加200 mmol/L NaCl的1/2 Hoagland营养液培养多枝柽柳为处理组,每3 d更换1次培养液。分别在处理0 h、48 h、168 h时采集叶片样品,并立即放置于液氮中处理,然后移至-80 ℃冰箱保存备用。
1.3 转录组测序
液氮处理后的叶片样品送往基迪奥生物科技(广州)有限公司进行高通量转录组测序。采用Illumina HiSeqTM4000将纯化后的PCR产物根据标准操作在平台上进行双端测序(PE150)分析,利用Fastp软件进行质量控制,对原始数据进行数据过滤,得到过滤后的数据,使用Trinity软件[35]对过滤后的数据进行组装。首先将具有一定长度的重叠的过滤后的数据连成更长的片段,通过数据重叠得到不含高于RawReads百分比的组装片段,组装出Unigene,再使用BLAST2 GO[36]和KOBAS[37]得到GO功能和KEGG注释。
1.4 差异基因筛选
使用DESeq2[38]软件对测序所得的reads count数据进行分析,得到最终正确的FDR值(经过BH校正后的P值),FDR<0.05被认为是显著富集。基于差异分析结果,我们筛选FDR<0.05且|log2FC|>1的基因为显著差异基因。
1.5 qRT-PCR验证
利用Omega Bio-Tek公司(美国)的Omega试剂盒提取叶片材料的总RNA,采用宝生物工程 (大连) 有限公司 的PrimerScriptTMRT Master Mix(Perfect Real Time)试剂盒将其反转录成1链cDNA作为模板。设计DEGs特异性表达引物,使用赛默飞世尔科技(中国)有限公司的PowerUpTMSYBR Green Master mix试剂,在应用生物系统ABI ViiATM7 Real-time PCR system仪器进行qRT-PCR检测,所用引物见表1,每个候选基因进行4次技术重复,3次生物学重复。以Actin为内参基因,用2-△△Ct法[39]进行相对表达量的计算。

表1 特异性表达引物序列
1.6 数据处理
使用Excel进行数据统计,使用SPSS 26.0进行显著性分析,使用Origin 2018软件制图。
2 结果与分析
2.1 转录组测序质量分析
2.1.1 转录组数据分析 利用IlluminaHiSeqTM4000进行高通量转录组测序,在200 mmol/L NaCl胁迫条件下,多枝柽柳叶片在处理0 h、48 h和168 h时均得到多条高质量碱基序列(碱基长度:6 017 997 220~6 782 061 623 bp),且Q20、Q30分别达到95%以上和90%以上,且G+C含量均达到44%以上(表2),表明本研究开展的转录组测序质量较高,符合进一步研究的要求。

表2 碱基信息统计表
2.1.2 Unigene基本注释 转录组测序结果显示,共拼接获得105 702个Unigene,在NR、KEGG、KOG和SwissProt数据库中获得基因注释的Unigene分别有53 385个、46 062个、31 587个和36 087个,同时在这4个数据库均有注释的Unigene共27 670个(图1)。

图1 NaCl胁迫下多枝柽柳叶片表达基因注释到4大数据库的韦恩图
2.2 差异表达基因数量分析
将多枝柽柳在NaCl胁迫处理后0 h、48 h和168 h的转录数据与对照进行比较,以FDR<0.05且|log2FC|>1筛选差异表达基因。在CK-0 h与200 mmol/L NaCl-48h比较组中共检测到11 754个基因的表达水平发生改变,其中6 374个基因的表达水平上调,5 380个基因的表达水平下调;在200 mmol/L NaCl-48 h与200 mmol/L NaCl-168h比较组中共11 645个基因表达发生了改变,有3 837个基因的表达水平受NaCl胁迫诱导上调,7 808个基因的表达水平受抑制下调;在CK-0 h与200 mmol/L NaCl-168 h比较组中共检测到7 768个基因的表达发生改变,其中2 542个基因受NaCl胁迫诱导上调,5 226个基因的表达水平受抑制下调(图2)。
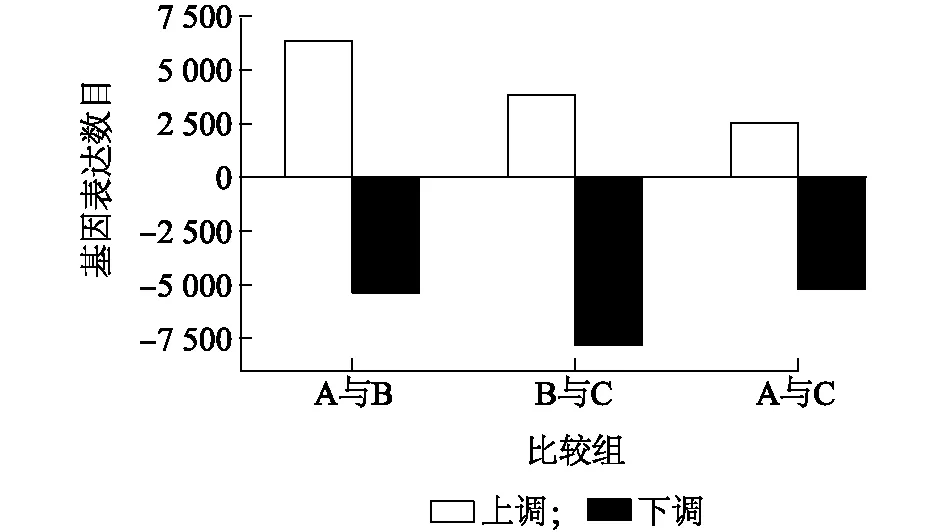
A表示CK-0 h;B表示200 mmol/L NaCl-48 h;C表示200 mmol/L NaCl-168 h。CK-0 h、200 mmol/L NaCl-48 h、200 mmol/L NaCl-168 h见表2注。
2.3 差异表达基因的GO分析
通过GO注释分析,上述差异表达基因(DEGs)可分为生物过程、细胞组分和分子功能3大类别,共51个不同分类组(图3)。在生物过程大类中,DEGs主要富集在细胞过程、代谢过程、单有机体过程和刺激响应中;在分子功能大类中,DEGs主要富集在催化活性、结合、转导活性和结构分子活性;在细胞成分大类中,DEGs主要富集在细胞、细胞部分、细胞器和膜。此外,随着NaCl胁迫时间的延长,上调的DEGs数量显著减少,且DEGs整体数量下降。由此推测,随着高盐胁迫时间的延长,多枝柽柳叶片在转录水平有大量DEGs表达水平出现下调。

A表示CK -0 h;B表示200 mmol/L NaCl-48 h;C表示200 mmol/L NaCl-168 h。CK-0 h、200 mmol/L NaCl-48 h、200 mmol/L NaCl-168 h见表2注。
2.4 差异表达基因的KEGG富集分析
对上述DEGs进行KEGG富集分析,根据其不同的代谢和信号通路可分为5个KEGG通路分支,包括代谢、遗传信息处理、环境信息处理、有机系统和细胞过程,这5个通路分支又进一步分成19个小类(图4),更加直观地显示了多枝柽柳在盐胁迫下发生调节和改变的代谢过程和信号通路。特别地,CK-0 h与200 mmol/L NaCl-48 h比较组中参与代谢、遗传信息处理、环境信息处理、有机系统和细胞过程通路分支的差异基因分别为1 882个、716个、132个、121个和99个。在200 mmol/L NaCl-48 h与200 mmol/L NaCl-168 h比较组中参与代谢、遗传信息处理、环境信息处理、有机系统和细胞过程等通路分支的差异基因分别为1 700个、446个、146个、103个和87个。在CK-0 h与200 mmol/L NaCl-168 h比较组中参与代谢、遗传信息处理、环境信息处理、有机系统和细胞过程等通路分支的差异基因分别为1 514个、545个、121个、80个和69个。在3个比较组中,参与代谢通路分支的差异表达基因最多,参与细胞过程通路分支的差异表达基因最少。此外,随着高盐胁迫时间的延长,5个KEGG通路分支的DEGs数量均逐渐下降,其中,遗传信息处理通路中的下降最为明显。

A表示CK-0 h;B表示200 mmol/L NaCl-48 h;C表示200 mmol/L NaCl-168 h。CK-0 h、200 mmol/L NaCl-48 h、200 mmol/L NaCl-168 h见表2注。a:代谢;b:遗传信息处理;c:环境信息处理;d:有机系统;e:细胞过程。
2.5 差异表达基因的KEGG通路分析
由KEGG通路分析结果可知,在CK-0 h与200 mmol/L NaCl-48 h、200 mmol/L NaCl-48 h与200 mmol/L NaCl-168 h和CK-0 h与200 mmol/L NaCl-168 h比较组中分别注释到的1 762个、1 426个和1 366个DEGs,并分别富集到129个、133个和127个KEGG通路中(图5),更加直观地反映出植物盐胁迫下是哪些代谢通路的表达发生了变化。其中,在CK-0 h与200 mmol/L NaCl-48 h比较组中,在前20个KEGG通路中,核糖体(ko03010)注释到435个DEGs,占24.69%,其后依次是次生代谢物的生物合成(ko01110)、植物病原体相互作用(ko04626)、苯丙烷生物合成(ko00940)、植物激素信号转导(ko04075)和植物MAPK信号通路(ko04016),分别注释到416个(23.61%)、88个(4.99%)、69个(3.92%)、69个(3.92%)和59个(3.35%)DEGs。200 mmol/L NaCl-48 h与200 mmol/L NaCl-168 h比较组在前20个通路中,代谢途径(ko1100)通路注释到684个DEGs,占47.97%;其后依次是次生代谢物的生物合成(ko01110)、植物激素信号转导(ko04075)、植物病原体相互作用(ko04626)、植物MAPK信号通路(ko04016)和苯丙烷生物合成(ko00940)等,分别注释到382个(26.79%)、82个(5.75%)、72个(5.05%)、64个(4.49%)和59个(4.14%)DEGs。CK-0 h与200 mmol/L NaCl-168 h比较组在前20个通路中,代谢途径(ko1100)通路注释到614个DEGs,占44.95%;其后依次是次生代谢物的生物合成(ko01110)、核糖体(ko03010)、植物激素信号转导(ko04075)、植物病原体相互作用(ko04626)和植物MAPK信号通路(ko04016)等,分别注释到351个(25.70%)、296个(21.67%)、72个(5.27%)、63个(4.61%)和49个(3.59%)DEGs。由此可知,多枝柽柳受到高盐胁迫后,DEGs在代谢途径、次生代谢物的生物合成、植物激素信号转导、植物病原体相互作用、植物MAPK信号通路和苯丙烷生物合成等KEGG通路上显著富集。

A表示CK-0 h;B表示200 mmol/L NaCl-48 h;C表示200 mmol/L NaCl-168 h。CK-0 h、200 mmol/L NaCl-48 h、200 mmol/L NaCl-168 h见表2注。
2.6 注释到KEGG通路的关键差异表达基因分析
转录因子在调控植物生长发育、适应环境中起到主要作用,尤其是在响应盐胁迫中具有重要作用。本研究有8个差异表达转录因子基因注释到KEGG通路中,主要为WRKY和bZIP 2种类型。
注释到KEGG通路(ko04626和ko04016)中响应盐胁迫的WRKY转录因子基因共5个,其中Unigene0010090、Unigene0077293和Unigene0079542在处理0 h、48 h和168 h时的表达水平呈先下降后上升趋势,而Unigene0014406和Unigene0024962在处理0 h、48 h和168 h时的表达水平一直呈上升趋势(表3)。有3个bZIP转录因子基因注释到KEGG通路(ko04016、ko01100、ko01110、ko01200、ko01212、ko04146、ko00071、ko00640、ko00410、ko01040、ko00592和ko04075)来参与盐胁迫的调控,其中Unigene0026888和Unigene0008868在处理0 h、48 h和168 h时的表达水平呈先上升后下降趋势,而Unigene0010561在0 h、48 h和168 h时的表达水平呈先下降后上升趋势(表3)。

表3 注释到KEGG通路的转录因子基因
2.7 KEGG通路中MAPK信号转导途径分析
MAPK级联是重要的信号转导途径,参与植物生长发育及对盐胁迫的应答反应等生理过程。由图6可知,CK-0 h与200 mmol/L NaCl-48 h和200 mmol/L NaCl-48 h与200 mmol/L NaCl-168 h比较组在KEGG 通路中,DEGs表达水平发生显著变化。
由图6可知,本研究中共有16个DEGs参与NaCl胁迫条件下MAPK信号转导途径。在病原体攻击——细胞死亡和H2O2产生(图6A)信号传递过程中MKK4/MKK5、MPK3/MPK6和WRKY22/WRKY29含有的基因(Unigene0054151、Unigene0055797和Unigene0070215)、病原体攻击—— 植物防御中活性氧的积累(图6A)信号传递过程中MPK4含有的基因(Unigene0016609)以及盐——耐盐性(图6B)信号传递过程中MKK4/6含有的基因(Unigene0016609)表达均在0 h、48 h和168 h呈先下降后上升趋势。
图6A表明,H2O2可以激活ANP1-MKK4/MKK5-MAPK3/MAPK6信号途径来调节相关基因的表达。本研究中,多枝柽柳在受到盐胁迫后,信号从MKK4/MKK5传递到MPK3/MPK6过程中,在NaCl处理168 h时可能启动了WRKY22/WRKY29防御基因,导致表达上调(图6A、表4);同时,盐胁迫下MEKK1被激活后,又激活了MKK2,再直接靶向MPK4/MPK6,组成MEKK1-MKK2-MPK4/MPK6模块介导抵御盐胁迫的应答反应(图6B、表4)。此外,在病原体攻击—— 植物防御中活性氧积累的信号传递过程中,MEKK1在盐胁迫下被激活,传递给未知机制,再到达MPK4,最终形成一个防御活性氧积累信号。其中,图6A中的MPK4和图6B中的MPK4/MPK6中都包含相同基因(Unigene0016609),且激活过程相近。由此推断,盐胁迫下在病原体攻击—— 植物防御中活性氧积累的信号传递过程中,可能是MKK2激活了MPK4。
在盐胁迫——胁迫适应信号传递过程中,由脱落酸(ABA)信号传递给PYR/PYL信号,在PYR/PYL信号传递中有2个基因(Unigene0071368和Unigene0030832)表达在盐胁迫0 h、48 h和168 h后呈先下降后上升趋势;有3个基因(Unigene0011883、Unigene0017324和Unigene0005290)表达在盐胁迫0 h、48 h和168 h后呈先上升后下降趋势。当信号传递到PP2C时,有3个基因(Unigene0002530、Unigene0087395和Unigene0051628)在0 h、48 h和168 h时表达先上调后下调,与信号传递到SnRK2时Unigene0056876基因的表达一致。信号传递到MAPKKK17/MAPKKK18时,有1个基因(Unigene0025820)在0 h、48 h和168 h时表达一直下调。经MAPKKK17/MAPKKK18信号传递到MPK1/MPK2时,Unigene0064719基因表达在0 h、48 h和168 h中呈先下降后上升趋势(图6C,表4)。由此可以推论,在ABA信号中SnRK2起主要的调控作用。多枝柽柳受到高盐胁迫后,SnRK2与ABA结合的PYR/PYL蛋白和PP2C相互作用并抑制其活性,使SnRK2始终保持磷酸化活性状态,来激活胁迫响应途径。
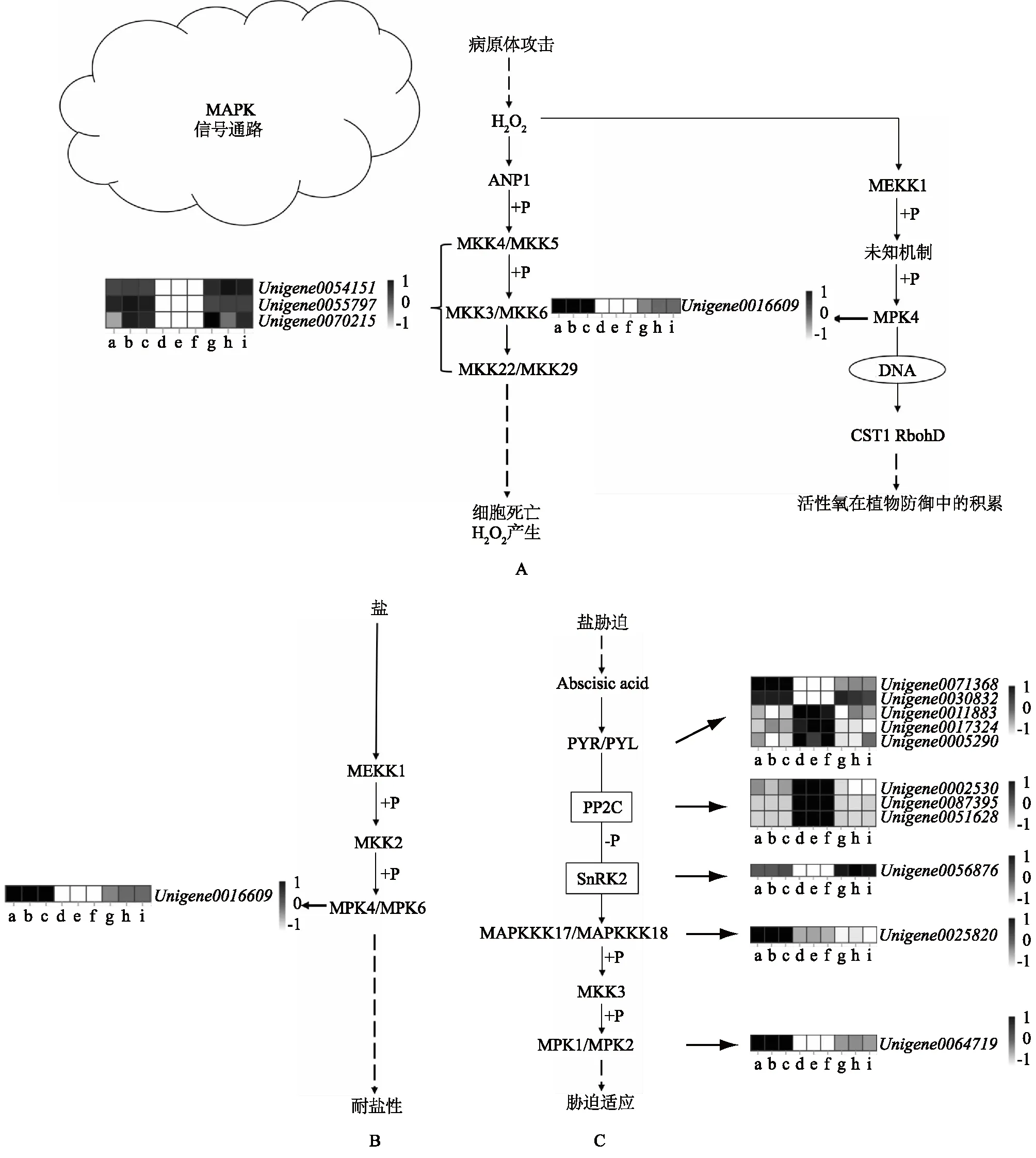
A:病原体攻击——细胞死亡和H2O2产生;B:盐——耐盐性;C:盐胁迫——胁迫适应。a:CK1-0 h;b:CK2-0 h;c:CK3-0 h;d:NaCl1-48 h;e:NaCl2-48 h;f:NaCl3-48 h;g:NaCl1-168 h;h:NaCl2-168 h;i:NaCl3-168 h;CK1-0 h、CK2-0 h、CK3-0 h、NaCl1-48 h、NaCl2-48 h、NaCl3-48 h、NaCl1-168 h、NaCl2-168 h、NaCl3-168 h见表2注。

表4 MAPK信号途径相关的KEGG基因注释
2.8 qRT-PCR验证
本研究随机选取8个与耐盐相关的DEGs进行qRT-PCR验证,结果(表5)显示,Unigene0104732、Unigene0083695和Unigene0069097基因表达水平受NaCl胁迫诱导呈先上升后下降趋势;Unigene0024962响应NaCl胁迫,表达水平显著上升,Unigene0090596、Unigene0007135和Unigene0088781基因表达水平受NaCl胁迫影响先下降后上升,而Unigene0028215基因表达水平受NaCl抑制显著下降。qRT-PCR验证结果与转录组测序分析结果完全一致(图7),证明本研究所得的转录组数据是准确可靠的,可为研究多枝柽柳耐盐机制提供基因资源和转录水平依据。
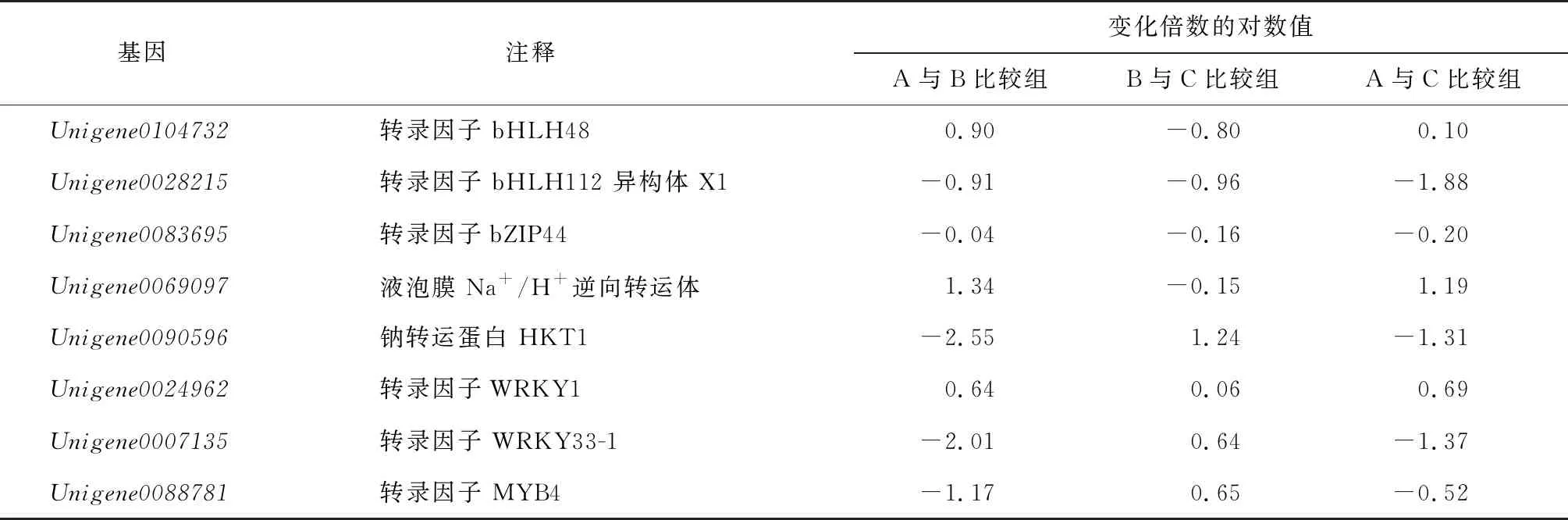
表5 qRT-PCR验证差异表达基因的表达变化
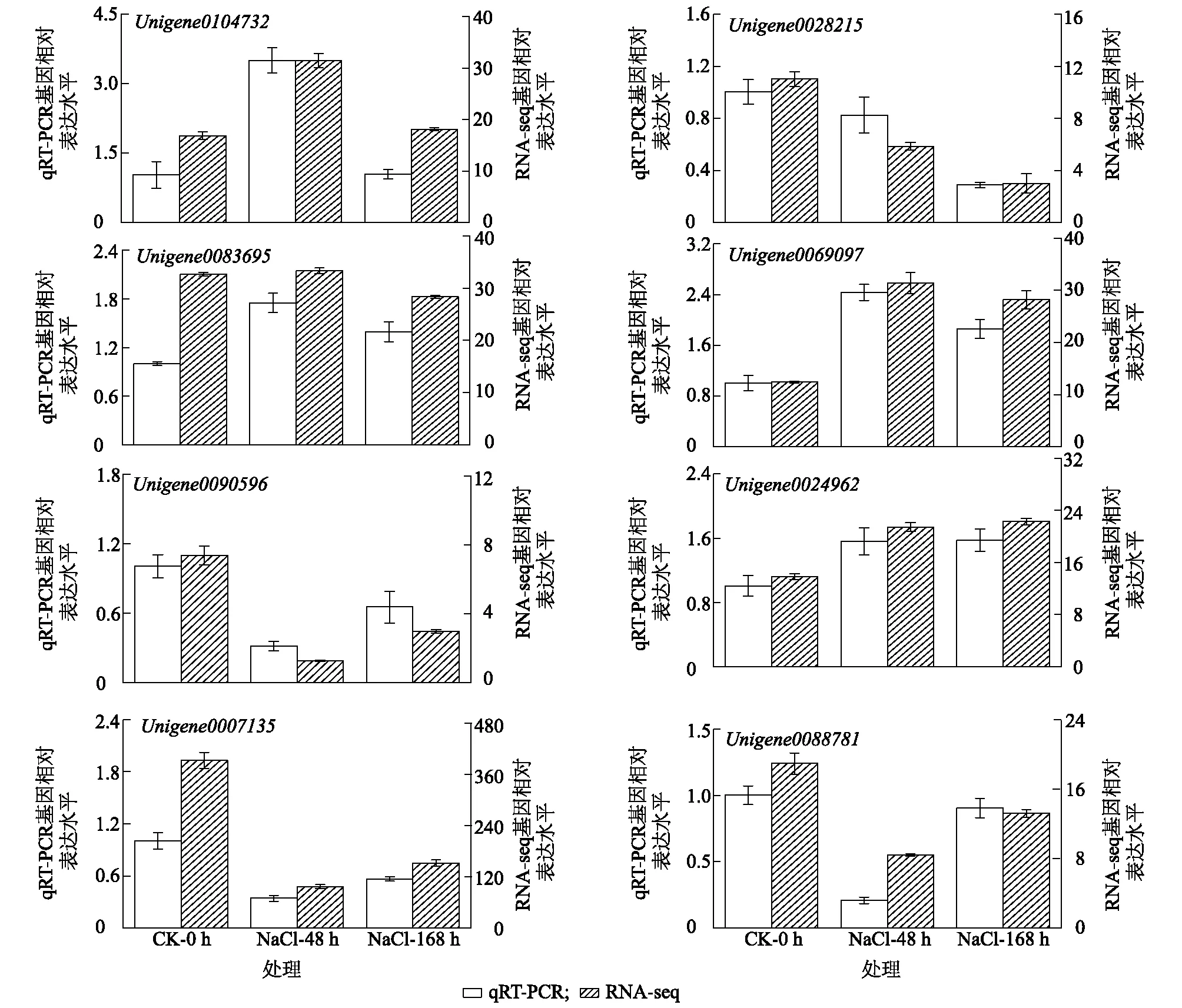
CK-0 h、200 mmol/L NaCl-48 h、200 mmol/L NaCl-168 h见表2注。
3 讨论
柽柳属(TamarixLinn.)植物在适应环境的长期过程中演变出一系列复杂的机制抵抗盐胁迫。从分子层面来讲,植物响应盐胁迫是一个多基因参与及调控的复杂过程,涉及代谢、信号传导、能量产生和运输、离子渗透和转运等诸多通路的相关基因[40-41]。因此,对多枝柽柳植物进行全面的转录组分析,有助于揭示柽柳属植物应答盐胁迫环境的响应机制。
柽柳属植物长期以来进化出复杂的调节网络以适应非生物胁迫的不利逆境[42],转录因子是所有非生物胁迫反应中最重要的调节因子[43]。WRKY是转录因子的大家族之一,已被证明参与多种代谢过程,并在与植物生物胁迫和非生物胁迫反应相关的转录重编程调节中发挥重要作用[44-46]。本研究中,编码WRKY转录因子的Unigene0024962在200 mmol/L NaCl处理48 h和168 h后表达水平呈上升趋势,WRKY转录因子编码基因Unigene0079542的表达水平在200 mmol/L NaCl处理48 h时出现下降,而在168 h时呈上升,表明随着盐胁迫时间的变化,Unigene0079542响应盐胁迫的方式发生了改变,与大豆[47]和长叶红砂[48]中WRKY转录因子编码基因受NaCl处理而上调的报道相类似。然而,与本研究结果相反的是,Lin等[49]发现辣椒CaWRKY27基因在转录水平的表达量受NaCl胁迫而下调。本研究发现WRKY转录因子Unigene0014406持续受NaCl胁迫处理的诱导,暗示该基因可能持续参与盐生植物多枝柽柳响应盐胁迫的应答反应。此外,bZIP转录因子在植物生长和环境胁迫应答中发挥重要的调控作用[50-51]。多枝柽柳叶片中bZIP转录因子编码基因Unigene0008868表达受NaCl诱导而显著上调,这与Huang等[52]在苎麻中发现的bZIP2表达规律相似,并暗示bZIP转录因子在植物对高盐胁迫的响应中起重要的调控作用。同时,MYB是植物体内数量和功能最多样化的转录因子家族之一,在非生物胁迫中也起到非常重要的作用[53-55]。本研究中MYB编码基因Unigene0088781在多枝柽柳叶片中的表达水平受NaCl胁迫先下降后上升,暗示该基因在受NaCl胁迫一定时间后才开始响应盐胁迫,类似现象已在紫花苜蓿幼苗[56]和玫瑰花瓣[57]中报道。综上可知,WRKY、MYB和bZIP等转录因子参与多枝柽柳应答盐胁迫的调控过程。
植物MAPK级联的功能包括参与生长发育、抗病反应、非生物胁迫应答和激素信号转导等过程[58-64]。已有研究结果表明,MEKK1-MPK4能够介导水稻的盐胁迫信号,水稻在盐胁迫下,OsMEKK1基因的表达受盐胁迫诱导上调,且OsMEKK1会磷酸化OsMPK4,而NaCl胁迫激活水稻中OsMEKK1和OsMPK4的酶活性进而调控水稻对NaCl的耐受性,并且MEKK1-MPK4级联通过调控相关转录因子的表达介导盐信号[31,65]。Mehlmer等[66]研究发现在拟南芥中,盐胁迫下的MKK2-MPK4/MPK6途径负责适应盐胁迫。与前人研究结果[66]相同的是,本研究中多枝柽柳可能也是通过MEKK1-MPK4和MKK2-MPK4/MPK6途径响应盐胁迫信号。此外,MAPK级联还参与植物多种激素信号,包括水杨酸(SA)[67]、生长激素(AUX)[68]、脱落酸(ABA )[69]和茉莉酸(JA)[70]等,其中,脱落酸参与高等植物生长发育、抗逆等生理过程,在非生物胁迫中起着关键作用,高盐、高温等非生物胁迫可刺激植物体内脱落酸的合成,并启动相关信号途径来激活植物抗逆机制[71]。ABA-PYR-PP2C-SnRK2负责脱落酸信号感应和传递的中央信号转导复合体,PYR/PYL/RCAR家族成员几乎都参与了脱落酸信号转导途径[72-73]。本研究中多枝柽柳在NaCl胁迫下也可能形成PYR-PP2C-SnRK2信号转导复合体,进而参与脱落酸激活,启动抗盐机制。
4 结论
在高盐胁迫下,WRKY、MYB和bZIP等转录因子参与多枝柽柳的耐盐调节过程;高盐胁迫下多枝柽柳的MAPK信号转导途径被激活,通过多种途径调节相关转录因子基因表达响应盐胁迫。本研究为进一步研究多枝柽柳耐盐分子机制提供了基础。

