功能性高分子栓塞微球的制备与研究进展
李鹏飞,王建南,许建梅
(苏州大学,a.纺织与服装工程学院;b.纺织行业医疗健康用蚕丝制品重点实验室,江苏苏州 215027)
经动脉化疗栓塞术(Transcatheter arterial che-moembolization,TACE)是一种癌症肿瘤的姑息治疗方法,其通过在目标动脉中设置导管,经过导管引入栓塞材料,以阻塞癌症肿瘤的血液流通和营养供给,来抑制肿瘤的生长。栓塞材料中可负载化疗药物,如阿霉素、顺铂、丝裂霉素[1-3]等,在病灶区域缓慢释放,同时达到局部化疗的效果。该方法自1976年首次提出以来,由于其微创性和显著的治疗效果已经发展成为非手术治疗的首选介入治疗方法[1]。栓塞材料的选择与使用很大程度上决定了TACE的成功与否[4]。理想的栓塞材料需要具备以下性质:a)可以顺利通过导管,不会粘滞或堵塞;b)无免疫原性,有良好的生物相容性;c)尺寸可以适应目标血管,阻断血氧供应并阻碍血管再生。目前,这些栓塞材料包括液体栓塞材料,例如2-氰基丙烯酸正丁酯(NBCA)、玛瑙;固体栓塞材料,例如明胶海绵、栓塞微球;机械装置栓塞材料,例如线圈、可拆卸气球[5]。而在以上这些栓塞材料中,高分子栓塞微球因为其形状与尺寸可控,具有压缩性、弹性和一定硬度[3],较大的比表面积利于负载药物等优点成为最常用的栓塞材料之一。
但常规的高分子栓塞微球在临床应用中存在一些不足,如以三丙烯明胶微球(Embosphere)、聚乙烯醇微球(DC Bead、HapaSphere)为代表的永久性栓塞微球可降解性差,导致炎症与异物反应[6]、复发后无法再次栓塞[7]等副作用;通过浸泡,仅在表面结合负载化疗药物的栓塞微球,药物释放速度快、释放过程不受控制,使得化疗的效果受到限制;淀粉、明胶等不透射线材质的栓塞微球自身无法实时成像,不能准确追踪其位置与大小。因而,按照临床上对栓塞微球的某一方面的特别需求,开发相应的具有某类功能性的高分子栓塞微球的发成为未来的研究方向。这些功能性栓塞微球包括生物降解型、环境响应型、可视化型、放射性型,或者同时具有以上多种功能等。
可生物降解型栓塞微球的基本目的是微球降解后:a)体积缩小便于栓塞远端更细小的血管;b)其中负载的药物得到缓释;c)血管再通,便于再次进行栓塞治疗。虽然通过使用可降解性的材料作为基材的方法就可以实现此种功能性,但是单一材料成球均有一定缺陷,因此目前的研究集中在多种材料复合的可降解型栓塞微球上,且均停留在临床试验阶段。环境响应型栓塞微球大多以上述可生物降解型栓塞微球作为基础,将环境敏感物质作为修饰材料,实现更为复杂的温度、pH、光、磁、微波等环境因素的动态响应,以达到术前预溶胀、缓释化疗药物、协同热疗等功能,但肿瘤的内外环境变化并不单一,因此这些研究也只在试验阶段显示出预期的效果。可视化型栓塞微球则是通过包埋不同类型的显影剂,来实现微球在肿瘤血管中自身显影,以确定其具体位置,达到靶向栓塞和疗效直观评价的功能性。由于此类微球实验效果与临床应用不一致,且成像预测的准确性和合理性仍受到质疑,因此,只有个别X射线可视化微球投入商业化使用。放射性型栓塞微球主要通过添加放射性元素,来实现栓塞协同放疗的功能特点,此类微球的研究有较为成熟的、商业化面市的先例,也已经有临床疗效的评价与对比,但其成像性能的改善和放射性剂量的安全性把控,仍然是研究新型放射性型栓塞微球需要解决的问题与方向。
对此,本文主要对上述四类功能性栓塞微球的研究进展进行综述,分析了栓塞微球各类功能性特点、作用机理,并指出了功能性栓塞微球研究中存在的问题与挑战,对功能性栓塞微球未来的发展趋势进行了展望。
1 功能性栓塞微球的种类及其特点
本文中所讨论的四类功能性栓塞微球,根据载体材料或应用方式还可以具体地分为更多类型。比如可降解栓塞微球可分为蛋白质类、多糖类、合成聚合物类等可降解栓塞微球;具有环境响应功能的栓塞微球还可分为pH响应、温度响应、光热响应、磁热响应、微波热响应类栓塞微球;可视化栓塞微球可分为CT成像可视化、MRI成像可视化等类别;放射型栓塞微球根据负载的放射性元素也可进行细分。表1从制备材料、负载药物、制备方法等多个方面列举了各类功能性栓塞微球的代表性研究,从 表1 中可以看到目前栓塞微球常用的载体材料主要有海藻酸钙(CA)、壳聚糖(CS)、胶原(CO)、聚乳酸(PLA)、聚乳酸-羟基乙酸(PLGA)、聚乙二醇(PEG)、聚苯乙烯(PS)以及一些衍生物如羧甲基壳聚糖(CCN)、羧甲基纤维素(CMC)、聚乙二醇二丙烯酸酯(PEGDA)等;各类微球的制备方法以传统的乳化法为主,还包括超声雾化、喷雾干燥、微流控等方法,而赋予其功能性的方法则是混合特异性的功能材料,如温敏的聚(N-异丙基丙烯酰胺)(PNIPAAm)、微波敏感的离子液体(ILS)、X射线可视的三碘苯甲酸(TIBA)等;微球形态大多为规则球形,尺寸分布从几微米到几百微米各自不同,但大部分集中在20~200 μm左右;这些栓塞微球在满足栓塞肿瘤血管的基础功能上,具备了一定时间内可生物降解、温度或pH响应控释药物、光热协同治疗、可追踪成像显影、放射性标记放疗等另外的功能。

表1 功能性高分子栓塞微球的代表性研究Tab.1 Representative research of functional polymer embolic microspheres
2 可生物降解型栓塞微球
相较于常规的栓塞微球,可生物降解的栓塞微球在进入血管后可以在几天到几个月内发生降解,以往的研究显示,这种降解性可以使得血管栓塞成为临时性的,几乎不会损伤肿瘤周围的正常组织,为正常组织功能下降的患者提供了治疗方法。同时,这类微球可以实现多次栓塞,避免了因为血管再生或支流血管堵塞不完全导致的肿瘤复发的问题。再者,配合可生物降解的栓塞微球,某些需要多次用药的化疗药物可以通过再通血管输入,进一步实现其可控释放[17-19]。而栓塞微球是否具有生物降解性质,主要取决于微球所使用的材料。不能生物降解或者降解性较差的材料主要有聚乙烯醇、聚丙烯酸等,这类材料不会因为水解、氧化、酶活性反应而产生键断裂,可以永久性地存在目标生物体中;可以生物降解的材料主要包括明胶、丝素蛋白等蛋白质类;壳聚糖、海藻酸钠、淀粉等多糖类;聚乳酸、聚乳酸-羟基乙酸等合成聚合物类。
2.1 蛋白质类
明胶是一种天然线性聚合物[19],作为胶原蛋白的变性产物,化学成分和生物功能与胶原蛋白相似[20],在蛋白酶的作用下,肽键断裂,可以水解为小分子的多肽和多种氨基酸,具有良好的生物相容性和生物降解性。但是,传统的明胶海绵颗粒栓塞剂形状不规则,且无法负载抗癌药物。为了解决该问题,Zhang等[20]通过反向悬浮交联和表面修饰羧基的方法,制备了可有效负载阿霉素的改性明胶栓塞微球。在PBS溶液中的降解实验表明,该明胶栓塞微球在20天后可几乎完全降解。可见,明胶降解速度过快,可通过与其他降解较慢的材料复合制备微球,以获得降解可控的栓塞微球。
丝素蛋白是一种通过蚕丝脱胶后得到的天然高分子聚合物,由18种不同的氨基酸组成[21],其基本结构为一条重链和一条轻链通过二硫键连接而成的二聚体,具有α-螺旋、β-折叠、β-转角和无规卷曲等不同的二级结构[22]。由于其可以在蛋白酶的作用下水解为无毒副作用的氨基酸和肽链段,故被视为具有优异的生物降解性。且不同的二级结构组成的结晶构象和无定形区间的比例影响了丝素蛋白的降解性和降解速率[22-23]。同时,丝素蛋白的多种氨基酸具有不同的官能团,可以进行不同程度的修饰,以便其负载各种性质的药物或者复合其他材料。但是,丝素蛋白制成尺寸较大的微球成球性较差,常与其他材料复合改善其成球性。对此,Chen等[24]用海藻酸钠修饰丝素蛋白,通过乳化交联法制得栓塞微球,具体过程如图1所示。在胰蛋白酶的降解实验中,该微球在第21天失重20.8%,表明其具有一定的降解性,可以再通血管后进行二次TACE。

图1 海藻酸钠修饰丝素蛋白栓塞微球的制备过程Fig.1 Schematic illustration of the preparation process of SA-modified SF embolic microspheres
2.2 多糖类
壳聚糖是一种天然多糖,来源于甲壳类动物的外骨骼,其基本结构为氨基葡萄糖和N-乙酰氨基葡萄糖通过1,4-糖苷键连接,本质是甲壳素的脱乙酰化衍生物。壳聚糖在体内会被溶菌酶降解为氨基葡萄糖。由于溶菌酶会破坏葡萄糖胺-葡萄糖胺、葡萄糖胺-N-乙酰-葡萄糖胺和N-乙酰-葡萄糖胺-N-乙酰-葡萄糖胺3种糖苷键,因此壳聚糖的乙酰化程度越高,酶的作用位点越多,壳聚糖降解速度越快[25]。但是,由于壳聚糖仅溶于酸性试剂,一般可通过对其进行化学修饰来达到水溶性,如羧甲基化,同时其含有游离的氨基,带有正电荷,可以与阴离子型的氧化羧甲基纤维素进行复合,Weng等[8]即采用反相乳液法制备了羧甲基壳聚糖-氧化羧甲基纤维素水凝胶栓塞微球。该微球的两批次样品,在4 mg/L溶菌酶磷酸盐缓冲液中分别在14天和30天后降解。
海藻酸钠是一种天然阴离子聚合物,通常从棕色海藻中提取,其分子结构是由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古洛糖醛酸(α-L-guluronic,G)按(1→4)键连接而成。其生物降解性与G、M嵌段比例有关。一般情况下,降解G段和M段需要不同的藻酸盐裂解酶,但也存在一些海藻酸盐裂解酶对G段和M段都存在裂解活性,并且对G段、M段的活性不同,因此G、M嵌段比例会影响海藻酸钠的降解速率[26]。Forster等[27]采用液滴发生器制备了高M含量(59%)和高G含量(68%)的高分子量海藻酸钠微球,监测其在绵羊子宫模型中的大小和重量变化,发现4周回复到原始尺寸,12周尺寸降至原始尺寸以下,发生降解迹象,但是3个月后依然可以观察到完整的微球。这表明高纯度、高分子量的海藻酸钠微球虽然可以生物降解,但降解时间很长,可以近似看作半永久性的栓塞微球。
淀粉作为价格低廉、来源广泛的一种多糖,其易在淀粉酶催化作用下降解为葡萄糖,具有较好的生物降解性。Sommer等[6]以水解马铃薯淀粉为材料,采用化学交联和甘油醚基取代的方法制备了可生物降解的淀粉栓塞微球L1(540 μm)和L2(510 μm)。在血清a-淀粉酶体外酶的作用下,两种微球都可以在54~72 h内降解。
2.3 合成聚合物类
聚乳酸(PLA)、聚乙醇酸(PGA)、聚乳酸-羟基乙酸(PLGA)均为人工合成的高聚物。其中,PLA和PGA可以分别水解为乳酸(LA)和羟基乙酸(GA)小分子,之后在相关酶的作用下降解为H2O和CO2,而GA由于结构简单,降解速度较LA更快;PLGA则是通过酯键断裂水解为LA和 GA,再进一步降解为H2O和CO2。因此,一般可以通过调整化学结构和组成来控制其降解速率[28]。例如,聚乳酸-羟基乙酸微球的合成中,调整LA与GA的比例对其降解速率有一定影响[29]。Lu等[30]以 1∶1.06 的LA/GA比值,采用溶剂蒸发和液相诱导相分离的方法制备了负载5-氟尿嘧啶的PLGA栓塞微球。其在室温PBS溶液中,27天可基本降解,60天可完全降解。
3 环境响应型栓塞微球
环境响应型栓塞微球是指可以根据外界环境变化,改变自身的组成、结构,实现功能的调整与变化的栓塞微球载体。这种环境变化可以是肿瘤内部环境特点造成的变化,如pH值、血氧含量等;也可以是人为外加的环境变化,如温度、光照、磁场等。通过对一般的高分子栓塞微球进行修饰改性,使其对这些环境变化刺激有一定响应性,以达到栓塞微球的靶向输送、负载药物的控制释放以及协同疗法的实现与增强等目的。根据其对不同环境变化的响应性,可以分为pH响应类,温度响应类,光、磁、微波响应热疗类。
3.1 pH响应类
由于肿瘤繁殖能力强,代谢速率快,导致积累大量乳酸,因此其内环境往往偏酸性,pH可以低至6.15[31-32]。利用肿瘤组织的pH梯度差异,可以通过在微球表面修饰pH响应材料来制备栓塞微球,当栓塞微球到达肿瘤的低pH环境中时,表面修饰材料的基团(如羧基、氨基)结构发生变化,聚合物大分子链发生构象转变,并可能伴随相变。Lu等[33-34]先后采用超支化聚氨基酸(HPTTG)和三嵌段多肽(PGTTCs)两种pH响应材料制备了栓塞复合微球,该两种材料均通过受pH控制的相变性质,在肿瘤部位形成凝胶,增强了栓塞效果。其中,超支化聚氨基酸的pH响应和凝胶化机理如图2所示。

图2 HPTTG栓塞微球凝胶化的机理Fig.2 Gelation mechanism of HPTTG embolization microspheres
3.2 温度响应类
将温敏材料作为基材或者修饰材料,可以制备得到温度响应类的栓塞微球,当环境温度发生变化时,微球中的温敏部分会发生溶胀率的剧烈变化,收缩并释放负载的药物,以此达到药物缓释的目的。Seo等[9]利用聚N-异丙基丙烯酰胺(PNIPAAm)在低临界溶液温度(32 ℃)下的热响应性质,通过微流控技术制备了聚N-异丙基丙烯酰胺(PNIPAAm)-聚乙二醇二丙烯酸酯(PEGDA)栓塞微球。根据低分子荧光染料的负载实验显示,室温(24 ℃)下微球溶胀吸收染料,生理温度(36 ℃)下收缩释放染料,证明了其可以实现小分子药物的控释的可行性。Van Elk等[35]将温度敏感的脂质体(含有阿霉素和Gd(HPDO3A)(H2O))包裹在钡离子交联的海藻酸钠微球中,制备了可以控制阿霉素释放的栓塞微球,将其与钬离子交联的海藻酸钠微球同时注射,可以使得微球在温度响应释放阿霉素的同时,得到热疗前后经过Gd(HPDO3A)(H2O)和钬离子加权的MR图像,以此反映其在体内沉积和温度触发释放的效果,具体如图3所示。
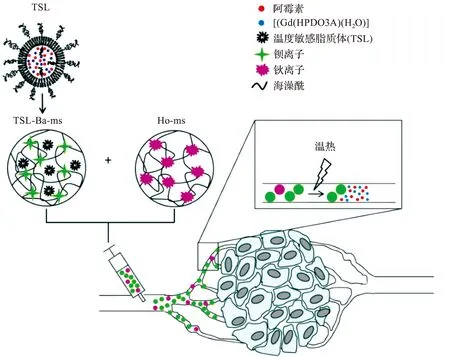
图3 钡离子交联海藻酸钠微球包裹温度敏感脂质体(TSL)的作用原理Fig.3 Mechanism of barium ion crosslinked sodium alginate microspheres encapsulated temperature sensitive liposomes (TSL)
3.3 光、磁、微波响应热疗类
热疗一般指热消融疗法,通过外加的电场、微波场、磁场或者光照[10,36-37]产生热效应,直接导致肿瘤产生热损伤而凝固性坏死,与TACE中的栓塞和化疗均具有一定的协同作用。但单一的热疗只对2、3 cm 以内的肿瘤有显著作用,对于大于5 cm的肿瘤的控制效果会大大下降[36-37]。将可以响应热疗的材料与TACE的栓塞微球结合,可以实现栓塞、化疗和热疗相互协同治疗的目的,目前研究的响应型热疗栓塞微球主要有光热疗、磁热疗、微波热疗等几类。
3.3.1 光热疗
利用一些纳米颗粒对于近红外光的吸收能力,可以赋予栓塞微球一定的光热响应性。Hou等[10]通过微流控技术将金纳米星原位包裹在海藻酸钙微球中,制备了可以吸收近红外光的光热疗栓塞微球,在808 nm的红外光的照射下,包覆金纳米星的海藻酸钙微球的温度增量最高可达67 ℃。体外细胞实验也验证了这些光热转化的热量可以杀死更多肿瘤细胞,使HepG2细胞的存活率从52%降至11%。然而,光热疗只能应用于几毫米深的浅表性癌症肿瘤,无法深入渗透人体病灶部位[32]。因此,对于较大的肿瘤或者特殊部位的肿瘤,光响应的热疗栓塞微球可能会存在消除不彻底的问题。
3.3.2 磁热疗
相较于光热疗,磁热疗借助磁性纳米颗粒和外加磁场产生热效应,具有较高的渗透性。其中,使用最为广泛的磁性纳米颗粒是顺磁性的Fe3O4纳米颗粒,而Aono等[11]发现MgFe2O4纳米颗粒的热效应要高于Fe3O4以及其他铁氧化物的纳米颗粒的热效应,并通过喷雾干燥法制备了含有MgFe2O4纳米颗粒的栓塞微球,实验证明了在交流磁场中,该微球样品的温度增量可达34 ℃,发热能力的提升可以提高栓塞微球的协同热疗效果。然而,其中并未涉及含有磁性纳米颗粒的栓塞微球的生物安全性实验,且临床需要高浓度的磁性纳米颗粒才能达到热疗所需温度。因此,生物安全性和热效应的效率仍是限制这类栓塞微球应用的主要问题。
3.3.3 微波热疗
将微波敏感的离子液体加载到栓塞微球中,可以实现微球的微波响应。微波刺激可以深入组织内部,且可以快速产生热量。Mao等[12]采用双乳液法制备了负载氧化锆的mPEG-PLGA栓塞微球,在微波作用下,兔VX2肝肿瘤内的平均温度在6 s内上升到60 ℃,在2 min上升到130 ℃。高热量导致肿瘤坏死,达到热疗效果。但是,由于微波的组织穿透性好,升温速度快,导致其极易损伤周围正常组织,造成较大的副作用。这一方面要求栓塞微球同时具备实时成像功能,以便及时监控肿瘤消融情况;另一方面,则是依赖微波增敏性更高的微球材料,能够低微波功率下产生足够热量,同时保护周围正常组织。
4 可视化型栓塞微球
X射线计算机断层扫描成像(CT)和磁共振成像(MRI)技术在TACE治疗中经常被用于实时追踪栓塞剂位置和评估治疗效果。但是,传统的栓塞微球不能在以上两种成像技术下自身显影,仅能借助简单混合的碘化造影剂来达到辅助可视化的目的[39]。这些造影剂在血液中具有分散性和流动性,导致定位不准确和毒性的全身扩散[15,40]。因此,栓塞微球自身可视化的功能性开发,对于栓塞剂的实时精确定位、治疗效果的准确评估均有实际意义。目前,该方面的研究集中在CT成像可视化、MRI成像可视化和CT/MRI双模成像可视化3个方面。
4.1 CT成像可视化
使具有辐射透过性的微球材料,通过物理包埋或者化学结合的方式,获得X射线的不透明性,是制备CT成像可视化栓塞微球的基本方法。其中,物理包埋法主要是将不透射线填料,如钡盐、二氧化锆等,与栓塞微球的基体材料物理混合。该方法的缺陷是,这些填料往往和基体材料结合得不够牢固,会从基材中分离或浸出,导致成像模糊,甚至还会引起系统毒性[11]。而化学结合法主要通过不透辐射的单体与基体共聚、含有不透辐射功能的基团接枝修饰等方法,赋予微球成像特性,目前,以含碘化合物的运用为主。例如,Sang等[40]采用含碘化合物4,4′-异丙基二-(2,6-二碘苯酚)(IBPA)作为扩链剂,合成了碘化聚L-乳酸基聚氨酯(I-PLAU),再采用双乳化(W/O/W)溶剂蒸发法制备了负载阿霉素的I-PLAU微球,如图4所示。在X射线下,两种不同基材与碘化物比例的栓塞微球的辐射不透性经过定量测试,大致与2.13 mm和2.84 mm厚度的铝相等。Wang等[13]通过三碘苯甲酸(TIBA)作为封端剂制备了X射线不透明聚乳酸(PLA),再采用W/O乳化法制备了CT成像栓塞微球。其中,与线形2臂端TIBA聚乳酸微球相比,星形4臂端TIBA聚乳酸微球的CT成像效果较优,实验表明,其在降解期间的碘含量没有急剧下降,显示出优于2 mm厚的铝的成像度。可见,栓塞微球的CT成像效果不仅与合成基材中碘化合物的用量有关,还与结合材料的分子结构有关,可以与含碘封端剂结合的点位越多,成像效果越好。

图4 I-PLAU/DOX微球的制备与表征Fig.4 Preparation and characterization of I-PLAU/DOX beads
4.2 MRI成像可视化
制备MRI成像可视化栓塞微球主要是通过在微球的基材中加入顺磁性、超顺磁性物质,赋予微球一定MR对比性。顺磁性物质主要指一些镧系元素,而超顺磁性物质多为铁氧化物。Oerlemans等[41]采用射流切割法制备了交联镧系元素的海藻酸钠栓塞微球,通过比较单位浓度下交联各种元素的海藻酸钠微球在MR信号下的弛豫速率,发现与钬(Ho3+)元素交联的微球造影效果最好,其次是镝(Dy3+)、钆(Gd3+)、铽(Tb3+)。Liu等[42]以卡拉胶、异烟肼和超顺磁性氧化铁纳米颗粒(SPIO)为原料,采用W/O乳化交联法制备了多孔栓塞微球,在MR信号下,SPIO聚集的区域与周围组织相比会显得更暗,该微球可以清楚地显示栓塞区域。而Liu等[14]则是通过乳液聚合和化学沉积的方法制得PS/Fe3O4纳米颗粒内核,再通过溶胶凝胶法在其上包覆介孔有机硅,得到了磁性介孔栓塞微球,在MR信号下可以清晰地成像。所以,本质上MRI成像与磁热疗都是将栓塞微球与磁性物质结合,通过其自身磁性实现热消融治疗和实时成像。因此,磁热疗和MRI成像往往可以结合在一起,赋予栓塞微球多功能性。
4.3 CT/MRI双模成像可视化
CT/MRI双模成像可视化栓塞微球则是综合了以上两种栓塞微球的性能,即在两种成像技术下均可自身显影。Wang等[15]基于超声分散法制得的含铁纳米颗粒的液态金属纳米滴,采用锐孔-凝固浴法制备了负载磁性液态金属纳米颗粒的海藻酸钙栓塞微球,由于液态金属纳米滴本身具有X射线不透性,其中含有的铁纳米颗粒又具有顺磁性,使得该栓塞微球具有CT/MRI双模成像可视化的双重性质。
5 放射性型栓塞微球
放射性型栓塞微球是指负载放射性物质的栓塞微球,一般是通过动脉导管注入到目标肿瘤处,释放高能量辐射来达到治疗目的。癌症肿瘤细胞对辐射敏感,但是体外放射性照射的治疗方式会对正常组织有损伤,例如,大部分正常肝脏只能接受低于40 Gy剂量的辐照[43],因此,通过向癌症肿瘤部位输入放射性型的栓塞微球可以实现内部的放射性治疗,同时对正常组织不会产生很大影响[44]。目前,已经投入商业化使用的栓塞微球主要是钇-90(90Y)微球,包含有玻璃微球、树脂微球两种类型,其临床应用的治疗效果并无显著差异[43- 44]。但是,由于钇-90的特性和玻璃、树脂基材的限制性,导致这类微球生物降解性差、成像结果不可靠,影响了多次给药和治疗效果的精确评价。
出于改善以上钇-90(90Y)微球缺陷的目的,近年来对于放射性物质的选择不再局限于钇-90。Pang等[16]通过氯胺-T法对胶原蛋白-壳聚糖微球(CCMs)进行了碘-131(131I)的放射性标记,制备了131I栓塞微球。对大鼠的肝脏栓塞治疗实验表明,相较于未经放射性标记的微球,经过131I标记的栓塞微球对大鼠的肝癌有明显的抑制作用,且可以通过CT实时监测。De La Vega等[45]采用微流控技术制备了聚L-乳酸栓塞微球,并使用铼-188(188Re)对其进行标记。在对大鼠的肝脏栓塞治疗实验中,使用单光子发射计算机断层扫描(SPECT)可以定量估算该放射性型栓塞微球对肿瘤和健康肝脏的辐射剂量,可以用于评估治疗结果。
6 总结与展望
功能性栓塞微球在对肿瘤进行化疗栓塞治疗的基础上,可以针对肿瘤特性、载药类型、辅助治疗手段实现一定程度的可控降解、环境响应、可视化与放射性。但是这些功能性的实现目前仍停留在实验层面,且还需要克服一些缺陷与问题。
a)丝素、壳聚糖、海藻酸钠、PLGA等均是制备可降解性栓塞微球的高分子材料,但仅使用以上单一物质制得的栓塞微球都存在其优势与问题。例如,纯丝素制得的微球球形好,但粒径小,溶胀率低,若制成适合栓塞的大尺寸又存在成球性差的问题;纯壳聚糖微球溶胀率大,但降解速率较快,且对药物的装载率较低;纯海藻酸钠微球具有良好的粒径和溶胀率,但球形较差。因此,将不同材料复合可以得到粒径尺寸、成球性、溶胀率、载药率均更加满足栓塞要求的复合微球,而对于多组分复合微球,材料间的比例与分布状态又会对降解的稳定性和可控性带来许多不确定性。
b)环境响应功能是栓塞微球实现靶向输送、药物控释的一种途径。但肿瘤的内环境复杂,影响微球状态的因素并不单一,导致微球的包封率、形貌尺寸、缓释效果会受到影响。因此,多重响应的栓塞微球开发成为必要。同时,环境响应的热消融治疗效果也会受到肿瘤深度、外刺激施加方式的限制,这需要通过进一步开发热效应、增敏性更高的栓塞微球响应材料来解决。
c)显影材料若通过物理包埋的方式,容易从微球中泄露,导致毒副作用和成像模糊,而采用化学结合的方式,则涉及到化学交联与特异性基团的修饰过程,制备过程复杂、成本高、适用范围狭窄。
d)新型的放射性栓塞微球目前可以通过成像分布估算其辐射剂量,但对于正常组织长期作用的安全性和其自身的有效性还需要更多的实验与临床研究。
对于多种功能性均具备的栓塞微球,为了实现尽量多的功能特性相结合的同时保证化疗栓塞效果,需要针对导管输入、血管栓塞、药物缓释、可控降解、协同治疗、实时成像等环节,从材料选择、制备方式中进行平衡与选择,实现真正意义上的多功能。