G蛋白偶联雌激素受体1的理化性质及其分子结构的分析
王 道, 陈建林
(中南大学湘雅二医院妇产科, 长沙 410011)
雌激素(estrogen)属于类固醇激素, 在细胞生理及病理过程中具有广泛而重要的调节作用。G蛋白偶联雌激素受体1(G protein-coupled estrogen receptor1, GPER1), 又名GPR30, 是一种功能性雌激素受体, 主要参与调节雌激素活化的快速非基因信号通路[1-2]。2002年, Filardo等[3]报道了该受体对雌激素有高度的亲和力, 定位于质膜或内质网中, 其在不同类型的组织中表达, 包括脑、肺、肝、脂肪组织、血管及免疫细胞等。然而, GPER1的发现使得研究雌激素受体蛋白在许多疾病中的作用变得更加复杂, 因为GPER1的表达可能取决于物种、组织、年龄和性别[4]。既往研究表明, 敲除GPER1可以抑制PI3K/AKT信号通路介导上皮细胞间充质转化(epithelial-mesenchymal transition, EMT), 从而阻碍胃癌细胞的增殖、迁移和侵袭[5]。另有研究证实, GPER1还能触发不同的级联反应, 特别是在乳腺癌细胞和肿瘤微环境中介导刺激作用[6], GPER1能够分别触发肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs)和乳腺肿瘤细胞中的重组人白细胞介素-1β(interleukin-1β, IL-1β)以及白介素受体1(interleukin-1 receptor 1, IL1R1)的表达[7]。大量研究数据也都表明, GPER1在大多数恶性肿瘤疾病中表达, 如黑色素瘤[8]、胰腺癌[9]、前列腺癌[10]、结直肠癌[11]和肝细胞癌[12]等, 因此, GPER1可能成为治疗癌症的靶点。此外, GPER1在小鼠模型中被证实可调节体重和葡萄糖/脂质的稳态, 发挥抗肥胖和抗糖尿病作用, 使其还可能成为治疗肥胖和糖尿病的有效药物[13]。最新研究报道, GPER1与多发性硬化症、帕金森氏病、动脉粥样硬化相关炎症有关[14], 但确切的分子调节机制尚不明确。
本研究借助多种生物信息学在线工具对GPER1蛋白的理化性质、分子结构、肿瘤相关性等方面进行综合分析, 以期阐明GPER1结构特性及其在肿瘤中的内在机制, 为探究其介导的信号传导机制提供理论依据, 为癌症等疾病的治疗提供候选靶点。
1 材料与方法
1.1 材料
通过美国国立生物技术信息中心数据库(national center for biotechnology information, NCBI)[15], 搜寻基因数据库并且下载得到人类GPER1的氨基酸序列信息, GenBank登录号为NP_001091671。
1.2 方法
获得人类GPER1蛋白的FASTA格式的氨基酸序列, 通过多种软件和网站预测和分析GPER1理化性质、信号肽结构、跨膜结构、亚细胞定位、二级结构、翻译后修饰位点、相互作用的蛋白网络以及与肿瘤的相关分析(表1)。

表 1 预测分析人GPER1的生物信息数据库及网站Tab. 1 Bioinformatic databases and websites for predictive analysis of human GPER1
2 结果与分析
2.1 GPER1的理化性质分析
进入ExPasy网站[16], 利用Protparam在线对人类GPER1的理化性质分析, 结果表明:该蛋白的相对分子质量为42 247.59 Da;理论等电点为8.63, 分子式为C1938H3018N510O509S20, 分别含有30个带正电荷的氨基酸残基(Arg + Lys)和25个带负电荷的氨基酸残基(Asp + Glu);总原子数为5 995;消光系数为39 015, 半衰期为30 h, 不稳定系数为48.12, 属于不稳定蛋白, 脂肪系数为110.51, 亲水性平均值为0.449, 表明该蛋白是疏水性蛋白。组成GPER1的氨基酸共有20种, 其中含量最高的是异亮氨酸, 占13.60%;含量最少的是色氨酸, 只有1.07%(表2)。
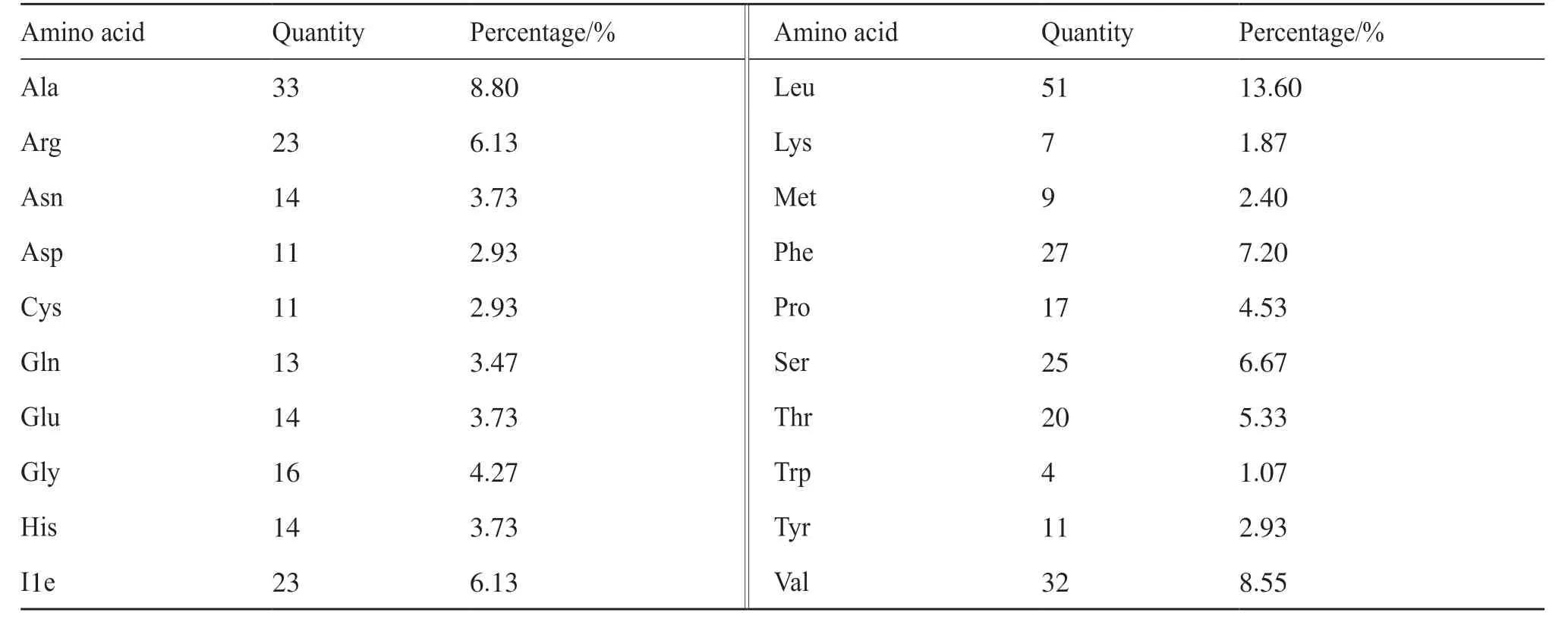
表2 GPER1的氨基酸组成Tab. 2 Amino acid composition of GPER1
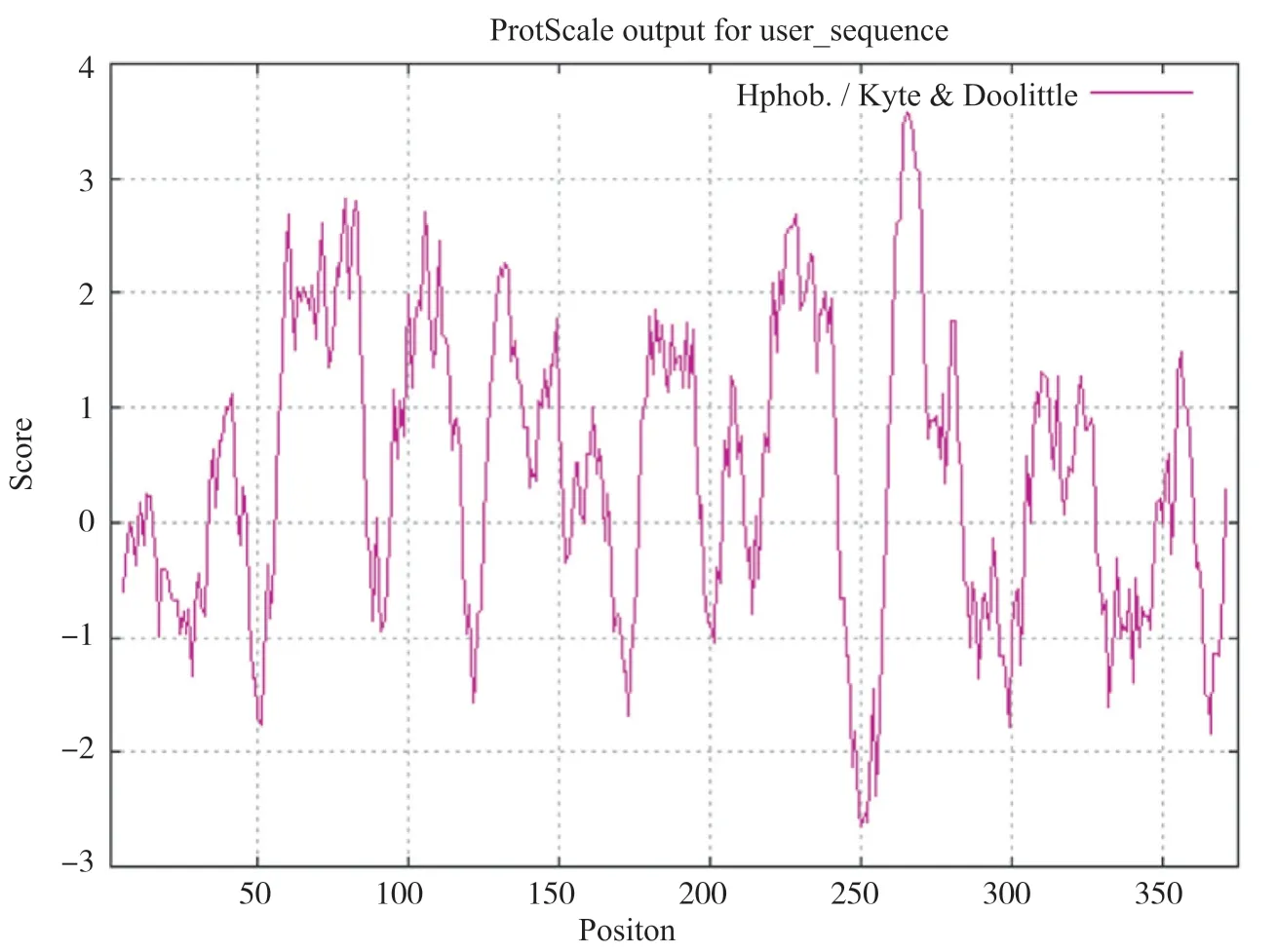
ProtScale在线分析GPER1的亲疏水性, 结果表明:最强的亲水位点在第250位的亮氨酸, 亲水值为 2.656;最强的疏水氨基酸是265位的缬氨酸, 亲水性分值为3.567。ProtScale分析的367个氨基酸(第5~371位)中有39.23%分布在低分值区域, 总得分为 121.137;60.49%分布在score大于0区域, 总得分为285.134。这表明亲水氨基酸少于疏水氨基酸, GPER1存在大量疏水域, 人类GPER1属于疏水性蛋白(图1)。
2.2 GPER1信号肽结构和跨膜结构分析
登录SignalP 5.0 Server网站[17], 分析人类GPER1信号肽序列, 结果显示, 存在信号肽的概率为0.003%, 而且没有发现切割位点, 推测不存在信号肽序列(图2)。
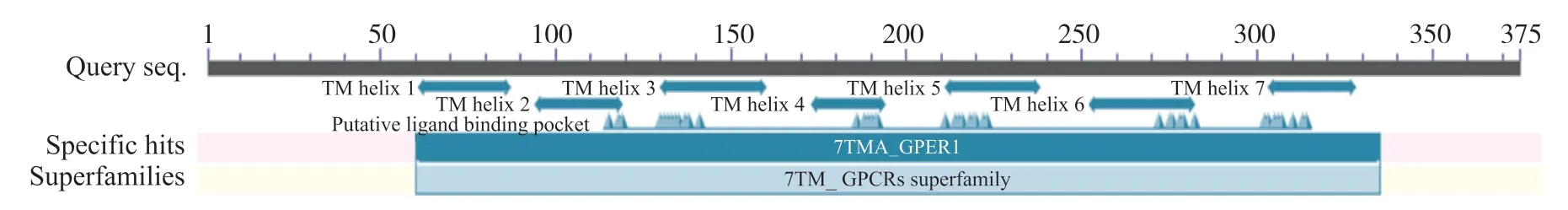
进入TMHMM 2.0网站[18], 分析人GPER1跨膜结构, 结果发现了7个跨膜结构区域, 分别位于第63~85位、第97~119位、第134~153位、第174~196位、第219~241位、第262~284位、第304~326位氨基酸残基之间(图3)。
2.3 GPER1亚细胞定位分析
PSORTII在线网站[18]对人类GPER1进行亚细胞定位分析, 结果显示, 人类GPER1定位于不同细胞器的可能性分别是:细胞质膜(60.90%)、内质网(13.00%)、液泡(17.40%)、线粒体(4.30%)和高尔基体(4.30%)(表 3)。
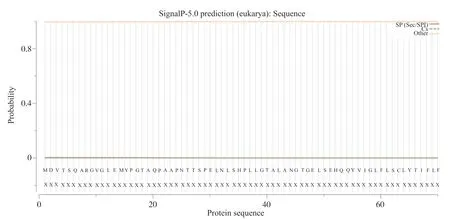
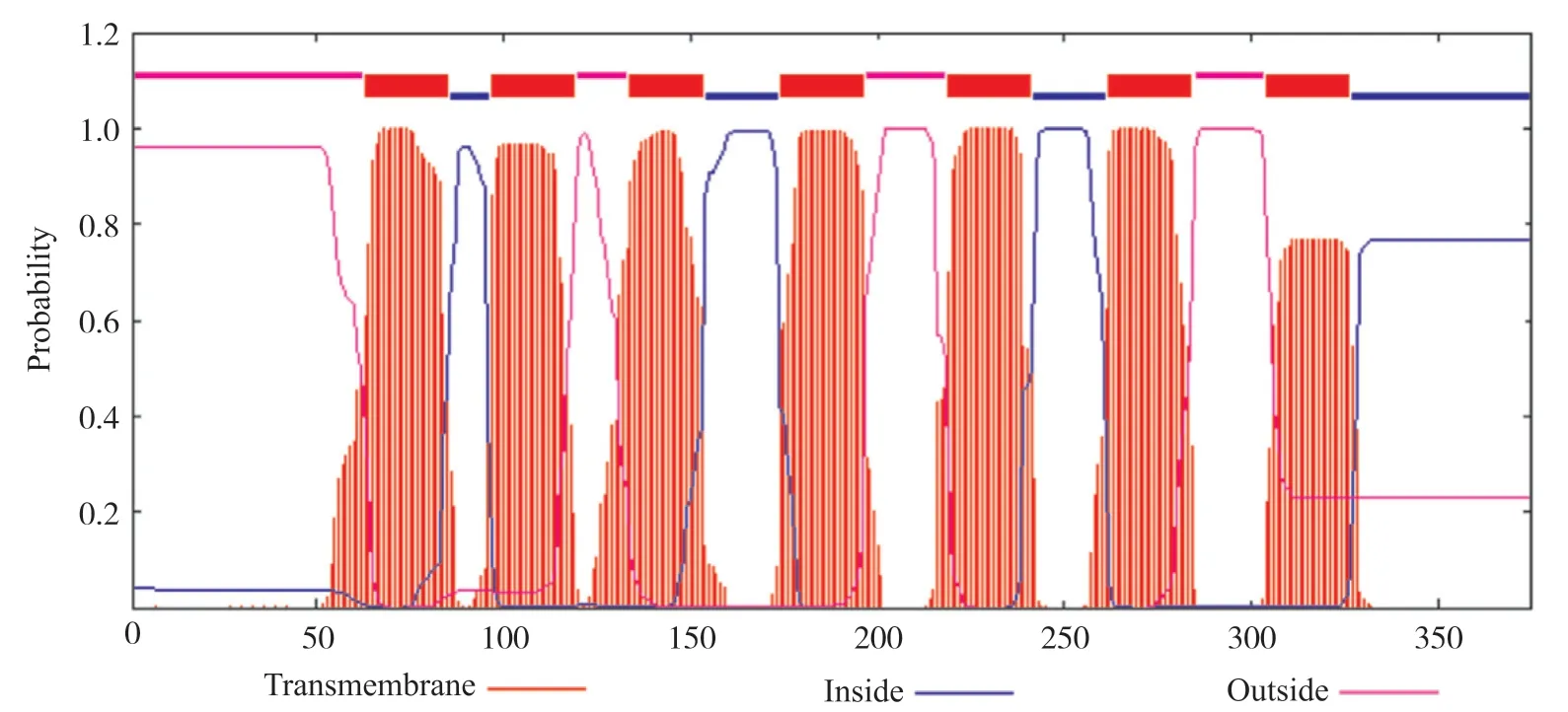

表3 人GPER1蛋白的亚细胞定位可能性Tab. 3 Subcellular localization probability of human GPER1 unit: %
2.4 GPER1的二级结构和结构域分析
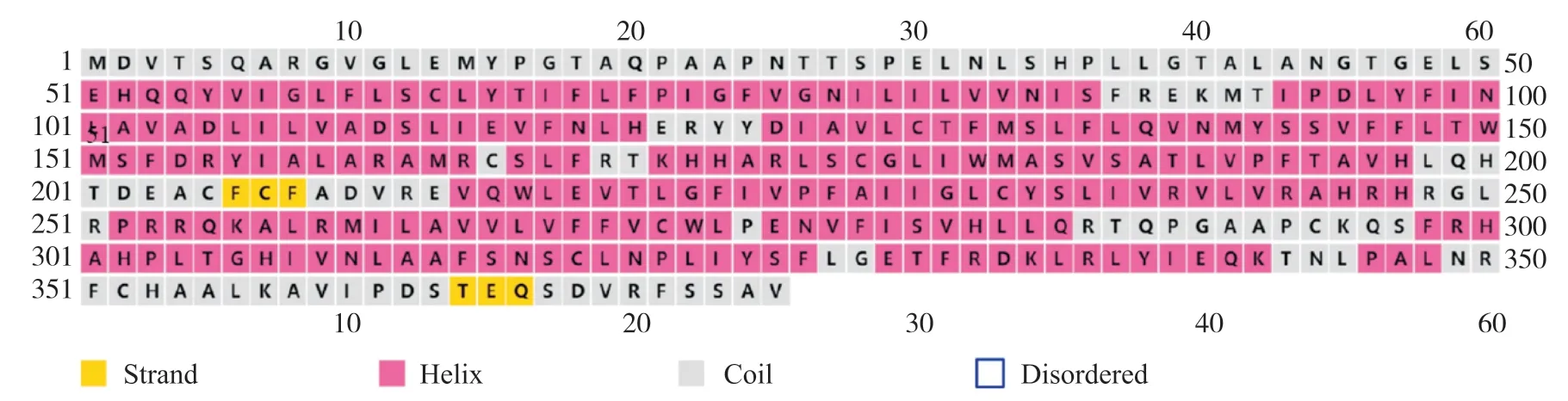
PSIPRED在线网站[19]预测人类GPER1蛋白质的二级结构, 结果显示, 多肽链中α-螺旋占68.53%, 无规则卷曲占29.87%, β-折叠链占1.60%(图4)。保守结构域分析结果显示, GPER1属于7TM_GPCRs 超家族, 该结构域由276个氨基酸残基组成(图5)。
2.5 GPER1翻译后修饰位点分析
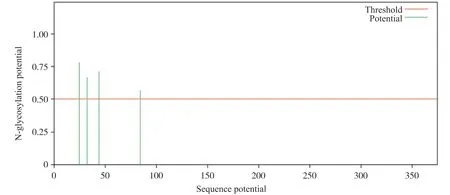
进入ExPasy网站[16], 利用NetNglyc-1.0、NetOGlyc-4.0、NetPhos3.1在线分别对人GPER1N-糖基化位点、O-糖基化位点和磷酸化位点进行分析。结果表明:人类GPER1存在4个潜在的N-糖基化位点, 分别位于第25、32、44和84位的氨基酸(图6);10个潜在的O-糖基化位点, 分别位于第4、5、18、26、27、28、34、40、46和287位的氨基酸;27个潜在的磷酸化位点, 其中丝氨酸磷酸化位点17个, 苏氨酸磷酸化位点7个, 酪氨酸磷酸化位点3个(图7)。
2.6 GPER1蛋白互作的网络分析
进入STRING12.0数据库网站[20], 预测与GPER1发生相互作用的蛋白, 构建了与GPER1蛋白相互作用的网络图(图8)。与GPER1发生相互作用的蛋白质评分前10名的有雌激素受体1(estrogen receptor 1, ESR1)、Discs大同源物4(discs large homolog 4, DLG4)、鸟嘌呤核苷酸结合蛋白Q(guanosine nucleotide-binding protein Q, GNAQ)、G蛋白α亚基(G protein alpha-subunit, GNAS)、雌激素受体2(estrogen receptor 2, ESR2)、原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase, SRC)、G蛋白偶联受体62(G protein-coupled receptor 62, GPR62)、G蛋白偶联受体61(G protein-coupled receptor 61, GPR61)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、酪氨酸蛋白激酶2(protein tyrosine kinase 2, PTK2), 相关评分分别是0.985、0.957、0.935、0.925、0.921、0.915、0.909、0.908、0.839、0.814。
2.7 GPER1与肿瘤的相关性分析
GPEIA数据库[21]显示出人GPER1在不同类型肿瘤组织中的表达水平, 结果表明, 人GPER1在肾上腺皮质癌(adrenocortical carcinoma, ACC)、膀胱尿路上皮癌(bladder urothelial carcinoma, BLCA)、乳腺浸润癌(breast invasive carcinoma, BRCA)、宫颈鳞癌和腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma, CESC)、结肠癌(colon adenocarcinoma, COAD)、肾嫌色细胞癌(kidney chromophobe renal cell carcinoma, KICH)、肺腺癌(lung adenocarcinoma, LUAD)、肺鳞癌(lung squamous cell carcinoma, LUSC)、 直肠腺癌(rectum adenocarcinoma, READ)、胃癌(stomach adenocarcinoma, STAD)、子宫内膜癌(uterine corpus endometrial carcinoma, UCEC)组织中低表达(P<0.05)(图 9)。
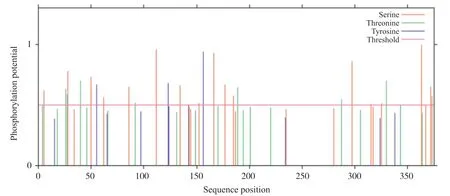
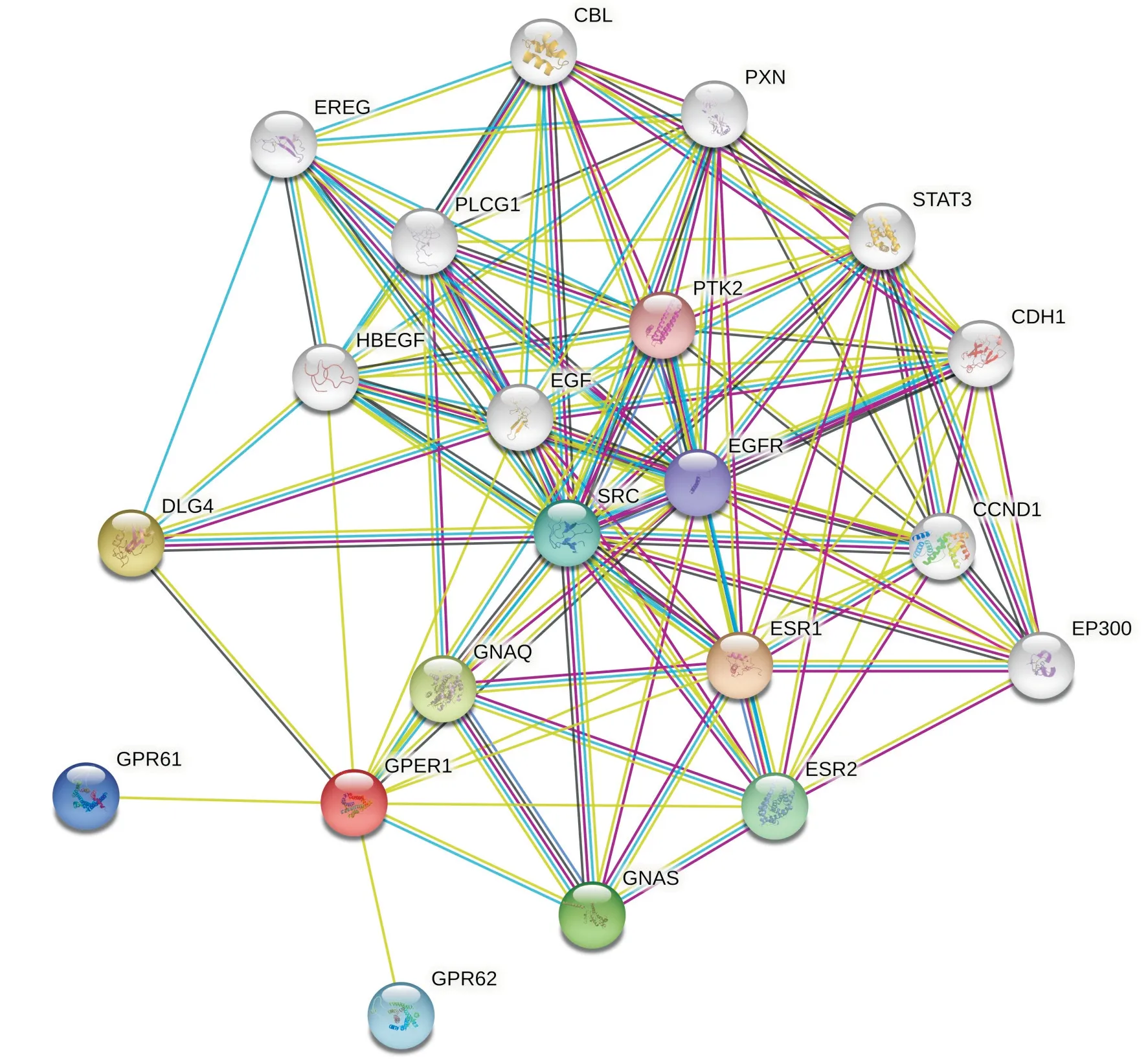
图 8 与人GPER1相互作用的蛋白网络Fig. 8 Protein network interacted with human GPER1
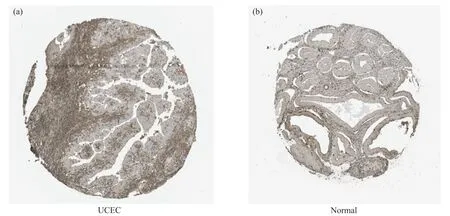
采用人类蛋白质图谱(the human protein atlas, HPA)数据库中GPER1在UCEC肿瘤组织和正常子宫内膜组织中的免疫组化的结果进行验证。结果显示, GPER1在子宫内膜肿瘤细胞中染色强度为弱, 数量小于25%(图10a), 在正常组织中染色强度中等, 数量为75%(图10b)。由此可知, GPER1在UCEC中的表达量低于其在正常子宫内膜组织中的表达, 而且在UCEC中的阳性表达全部集中在细胞质和膜质上。
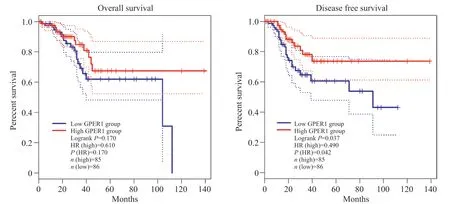
分析人GPER1的表达水平与UCEC患者的生存期的关系, 从“TCGA”来源的GPEIA数据库获取GPER1高表达患者和低表达患者的总体生存期(overall survival, OS)曲线和无病生存期(disease free survival, DFS)曲线。结果表明:在UCEC中GPER1低表达患者的总生存率分析中, 其LogrankP=0.170, 差异不显著;在UCEC中GPER1低表达患者的无病生存期低于其高表达患者, 其LogrankP=0.042, 差异显著(图 11)。
利用cBioPortal数据库分析GPER1突变信息和其对UCEC预后的影响, 结果表明, TCGA数据库1 450例子宫内膜癌患者样本中, 其中17例发生GPER1扩增, 4例深度删除, 2例截短突变, 14例错义突变, 共37例患者的GPER1发生突变, 基因突变率为2.6%(图12a)。同时,GPER1基因突变对UCEC患者的OS有明显的影响, 能显著降低患者总生存率, 差异有统计学意义(P<0.05), 但对UCEC患者的DFS没有显著影响(P>0.05)(图12b)。
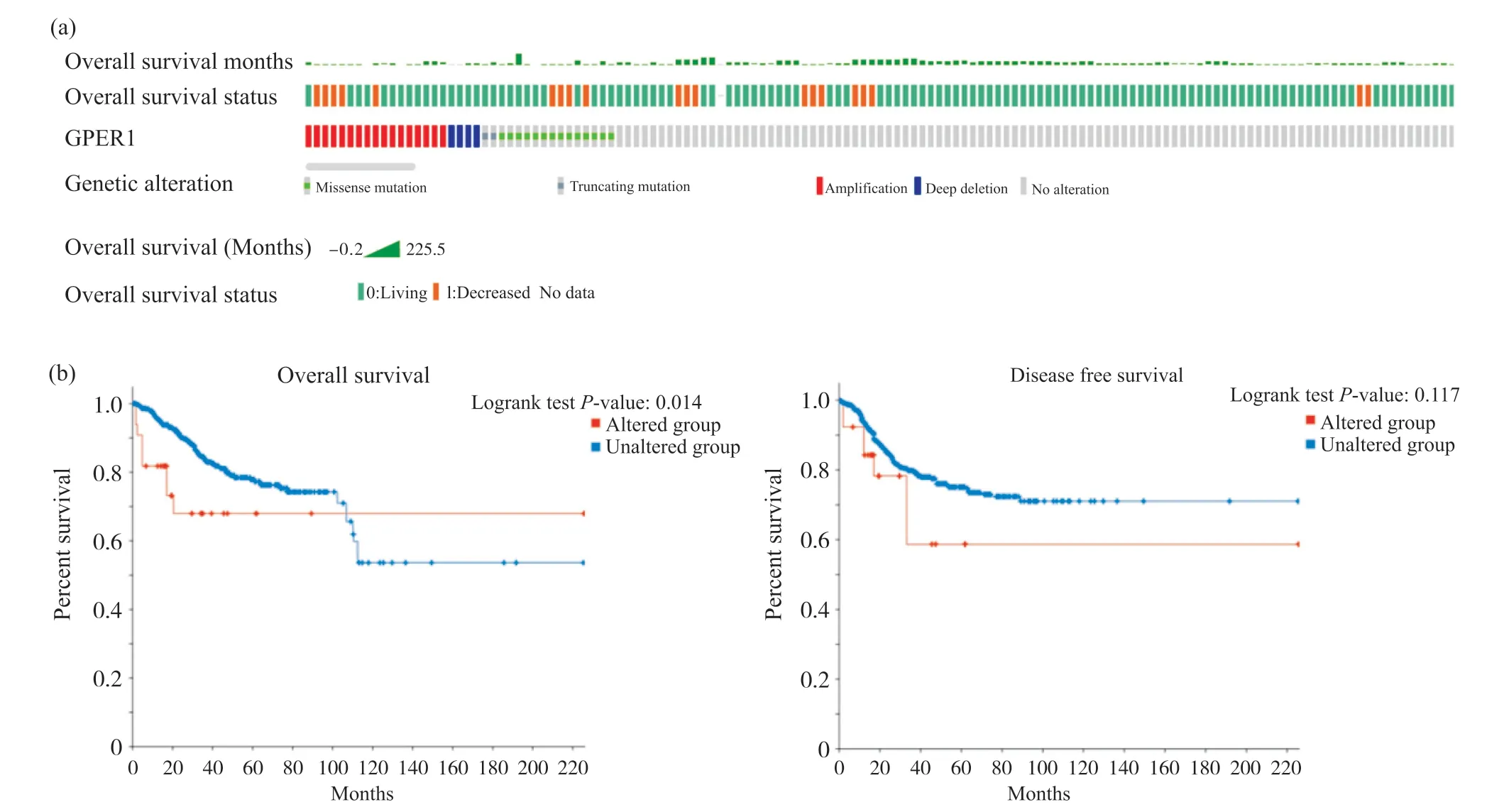
3 讨论
GPER1基因位于人类染色体7p22.3上, 与其他GPCRs相似, GPER1的N端区位于细胞外, 而C末端区在细胞内[22]。本研究结果显示, GPER1属于不稳定的疏水性蛋白质, 由20种氨基酸组成, 无信号肽, 含有7次跨膜结构域, 亚细胞主要位于细胞质膜上, 提示该蛋白主要在细胞质膜上发挥重要功能, 有利于胞外信号分子传递到胞内产生信号反应, 这个结果与跨膜结构预测分析是一致的, 正电荷氨基酸残基数目多于负电荷氨基酸残基, 表明该蛋白倾向结合某些带负电荷基团。GPER1的二级结构以α-螺旋为主, 无规则卷曲散布在结构内, 使其空间结构复杂多样, 这与Khan等[23]研究报道相一致。GPER1的结构多样性并具有多种生理功能, 结构域分析它属于GPCRs超家族, 7TM保守结构域位于60~335位氨基酸。GPCRs是人体内最大的膜受体蛋白家族, 在生殖、神经、心血管、免疫和内分泌等系统发挥着重要的调控作用[24], 使其可能成为治疗药物的主要靶点。
磷酸化和糖基化位点预测表明, 除结构域以外的其他氨基酸可能对GPER1起修饰激活的作用。哺乳动物正常细胞的生长和存活, 以及肿瘤细胞的遗传、代谢、炎性和微环境机制改变都与糖基化修饰改变密切相关[25]。有文献报道, GPER1 N-端的结构域中的Asn44是受体结构和活性所必需, 但是Asn25和Asn32不会发挥任何主要作用[26]。本文糖基化修饰结果表明:GPER1存在4个N-糖基化位点, 分别位于第25、32、44和84位的氨基酸;10个O-糖基化位点, 分别位于第4、5、18、26、27、28、34、40、46和287位的氨基酸。Pupo等[27]研究表明, 缺失糖化的GPER可能会诱发乳腺癌细胞迁移, 因此, 特异性干扰GPER糖蛋白可作为一种新的治疗策略。异常磷酸化途径也会与许多疾病发展有关[28]。本文结果显示, GPER1存在27个磷酸化位点, 其中丝氨酸磷酸化位点17个, 苏氨酸磷酸化位点7个, 酪氨酸磷酸化位点3个, 这些磷酸化位点的功能尚未知晓, 有待进一步研究。
通过STRING可知, 与GPER1发生相互作用的TOP10蛋白, 包括ESR1、DLG4、GNAQ、GNAS、ESR2、SRC、GPR62、GPR61、EGFR、PTK2。有文献报道, 在体外过表达ESR1能够抑制JAK/STAT3信号通路, 阻碍细胞增殖、迁移[29];前列腺癌中DLG4的表达水平与正常组织存在显著差异[30];GNAQ被抑制可诱导EMT过程, 促进肿瘤侵袭性[31];GNAS可以促进小鼠炎症性肝细胞癌的发展, 并与较差的存活率相关[32];ESR2和SRC表达模式与卵巢肿瘤发生相关联[33];GPR62和GPR61能激活雄性生殖细胞cAMP途径[34];EGFR发生二聚化和磷酸化, 其激活机制与肺腺癌、胶质母细胞瘤和结直肠癌的发生密切相关[35];在乳腺癌细胞的侵袭性研究中, FAK(又名PTK2)有助于GPER1介导STAT3激活, 促进三阴性乳腺癌细胞增殖[36]。GPER1与以上肿瘤相关的蛋白相互作用, 能够影响不同类型肿瘤细胞, 提示该蛋白与肿瘤发生有密切联系。
随后, 本研究进一步查询GPEIA数据库发现:人类GPER1在ACC、BLCA、BRCA、CESC、COAD、KICH、LUAD、LUSC、READ、STAD、UCEC组织中的表达水平均低于癌旁正常组织, 可见GPER1的表达在上述肿瘤组织中被抑制。Zhang等[37]研究发现, 低水平的GPER1与淋巴结转移密切相关。本研究还发现, 相比低表达的UCEC患者, GPER1高表达的患者无病生存率升高, 由此推测, 人类GPER1可作为UCEC病情评估的生物标志物。这与Deng等[38]认为GPER1在UCEC中起关键作用, 可作为预后观察指标的观点相一致。基因突变也与肿瘤形成和进展密切相关[39], 本研究中GPER1在UCEC患者中存在基因突变, 并且突变组UCEC患者总生存率明显下降。
综上所述, 本研究对人GPER1理化性质、分子结构和与肿瘤的关系进行探讨, 提示该蛋白是癌症临床病理和预后相关的重要因子。但是, 由于数据库的局限性可能会对数据产生一定的选择偏倚, 人类GPER1自身还存在复杂的分子机制, 后续还需深入的临床和试验来验证其在肿瘤疾病中的重要价值。

