基于光声和LIBS双模态成像技术在生物医学中的发展现状及趋势
胡 洋, 张兴超, 胡修玉, 苏宁宁, 陈加刚, 吴 慧, 修俊山*, 赵 岳*
(1. 山东理工大学物理与光电工程学院, 淄博 255000;2. 滕州市羊庄中心卫生院, 枣庄 277526)
激光在20世纪被人类发现, 是人类重大科技发明之一, 它具有很多优点, 如方向性好、亮度强和单色性好。所以, 自从被发明以后, 激光就被应用于很多领域, 对人类的社会生活产生了深远而广泛的影响, 与其相关的各种应用也层出不穷。目前, 激光成像技术在生物医学中的应用是激光领域的一个研究热点。生物组织具有极度不均匀性, 对光波有着强烈的散射和吸收, 所以光波不能深入生物组织, 也无法得到清晰的图像。但是, 随着成像技术的发展, 科学家们研发出了一系列可以对生物组织进行高质量成像的方法, 如光声成像(photoacoustic imaging, PAI)、激光诱导击穿光谱技术(laser induced breakdown spectroscopy, LIBS)、荧光显微成像、光学相干断层扫描技术、激光扫描共聚焦显微成像等, 在肿瘤诊断、血液动态变化以及细胞研究等领域已成为有力的新手段。
光声成像和LIBS是其中应用前景比较好的两种技术。在1880年, 美国科学家贝尔首次发现了光声效应, 即周期性的光照射物体时, 会导致物体发生温度变化, 引起体积和结构变化, 从而产生超声波, 而光声成像基于光声效应[1-2]; Brech等[3]发现激光激发会产生等离子体后, LIBS也被开发出来, 并随着先进激光器的发明广泛应用起来[4-5]。LIBS和光声成像都是成像技术, 这两种成像的方法简单来说都是利用激光照射样品, 激光会与样品表面发生反应, 再把这种反应想办法收集表征出来, 就可以呈现出我们所需要的样品的有关性质和结构方面的图样。但是这两种成像方法在本质上是不同的, 光声成像是在脉冲激光的照射下, 组织的光吸收域会产生超声信号, 这就是光声信号。这种光声信号携带了组织的光吸收特征信息, 再通过探测光声信号就能把它重建成光吸收分布图像。光声成像有着光学成像高选择性和超声成像深穿透性的优点, 对组织的成像分辨率和对比度都很高, 可对深层活体组织成像[6-8]。LIBS的原理是, 当激光照射在组织上, 激光会烧蚀样品, 在熔坑附近会电离形成等离子体, 把这些等离子体收集起来, 利用光谱仪就可以形成特征谱线[9-10]。由于原子和离子光谱的波长对应特定的元素, 它们具有一定的量化关系, 通过检测发射谱线的波长及强度就可以对样品中的元素进行检测分析。LIBS对元素有着很好的示踪作用, 能够定量分析和获得大多数元素的元素图, 灵敏度和分辨率也很高, 而且样品制备简单, 不需要接触样品, 是元素映射的有力工具。
综上所述, 激光照射组织是可以同时产生光声和LIBS效应的。通过检测光声信号和等离子体特征谱线, 我们可以得到光吸收分布和元素组成分布。在原理方面, 由于两种技术有着相似的激光激发过程, 通过单一激光脉冲激发可以得到声学以及光谱学等双参数信息;在系统方面, 两种成像技术又有着相似的系统组成, 可以实现部分仪器的协同使用。基于光声成像和LIBS成像在原理和系统上的互补性, 将两种成像技术有机结合, 可以开发出一种具有双参数检测的光声和LIBS双模态成像系统。此成像系统结合了两种技术的高灵敏、高分辨率以及可对样品进行多参数分析等优势, 同时提供组织的病理结构和元素表征信息, 在医学影像学领域有巨大的应用潜力。
1 光声效应及LIBS原理
光声成像是基于光声效应来进行成像的。用一束激光照射样品时, 样品内部就会吸收光能产生热量, 导致局部升温, 由于热胀冷缩原理, 从而引起样品热膨胀产生压力波。当激光脉冲持续足够短时, 其产生的信号幅值与光能量的沉积成正比, 波形由光吸收的分布决定。超声波会从组织内部传到组织外部, 接收探测这种超声信号就可以重建出样品的光吸收分布[11]。由于热膨胀产生超声波, 首先看热传导方程:

在公式(1)中,ρ是密度,T(r,t)是由于吸收光能产生的温升,Cp为比热,H(r,t)为单位面积、单位时间吸收的光能量。当激发光源的脉宽小于热扩散时间时, 热扩散就可以忽略, 在满足热限制和压力限制的条件下, 各项同性吸收体内光声压P(r,t)满足波动方程, 即:

Cs、β、Cp分别为超声波在吸收体内的传播速度、等体积膨胀系数、比热容。由于光能量沉积H(r,t)是介质内光吸收分布函数A(r)与激光脉冲时域函数I'(t)的乘积函数, 则光声压可表示为:

式中r、r′和t分别代表位置和时间。在声学特性均匀的介质和理想的激光脉冲作用的条件下, 产生的光声信号的幅值与脉冲激光的幅值成正比, 信号的形状由光能量的吸收决定。
LIBS利用高能量激光束聚焦在样品上, 产生激光等离子体, 利用光谱仪采集样品表面等离子体产生的发射谱线信号, 以此来实现对样品的定性和定量分析[12-14]。在LIBS进行定性定量分析的过程中, 谱线的强度是特定元素对应特定波长的。在计算元素的谱线强度时, 一般需要假设激光激发产生的等离子体处于局部热平衡状态。在局部热平衡状态下, 等离子体发生的过程大多都是碰撞, 此时每个粒子在各能级的分布遵循玻尔兹曼分布, 元素对应的谱线强度可由以下公式表示:
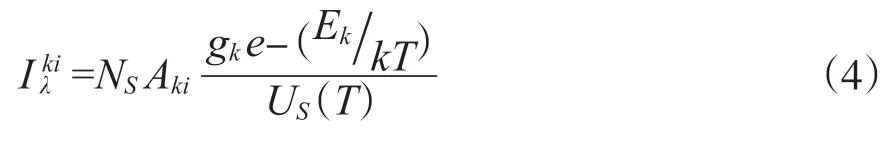
式中λ为k、i能级之间跃迁形成的特征谱线波长,NS为粒子数密度,Aki为k、i两能级间的跃迁几率, 表示在单位时间内原子在两个能级之间跃迁的次数。gk为统计权重, 表示电子在某一能级轨道上能够存在的状态数。Ek、k、T、US(T)分别为激发态能量、玻尔兹曼常数、等离子体温度和分布函数。在这个公式中,NS和原子发射谱线强度密切相关, 当确定好谱线, 可以得到除NS以外的其他所有参数[15]。
光声成像和L I B S成像原理的示意图如图1所示。
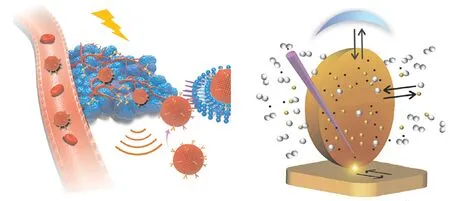
图1 光声成像和LIBS成像原理[13] Fig. 1 Principles of photoacoustic imaging and LIBS imaging[13]
2 光声成像系统和LIBS成像系统
2.1 光声成像系统
光声成像是通过使用单个机械平移或旋转聚焦传感器映射光声信号来实现的。它的优势主要包括在超声分辨率下检测内源性光学吸收对比度[16]。图2显示了一种光声成像的系统示意图。在图中, 高数值孔径光学透镜用于将激光束聚焦到组织表面, 光学透明声反射器将光声波引导至超声换能器。传感器和激光束一起在平面上进行机械扫描, 吸收的激光辐射导致介质热膨胀, 脉冲激光束弱聚焦到生物组织中, 产生超声波发射[17-18]。然后, 用聚焦超声换能器检测超声波, 对检测到的信号进行校正, 形成高分辨率的图像[19]。
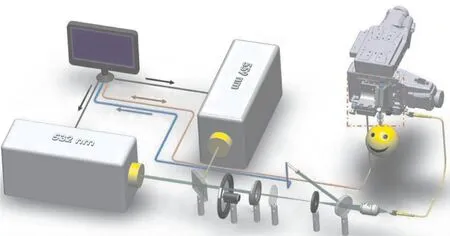
图2 光声成像系统示意图[17] Fig. 2 Schematic diagram of photoacoustic imaging system[17]
2.2 LIBS成像系统
LIBS的优点包括易于使用和操作速度快, 其材料采样、雾化和激发步骤通过单个激光脉冲同时发生。此处, 其可以通过在感兴趣区域上扫描样本表面, 以逐像素的方式获得元素图样。对于逐像素扫描模式, 如图3的LIBS系统示意图所示[20], 激光器在同一位置提供多次激光发射;之后, 样本按照步长在x(或y)方向移动, 并按照编程顺序重复操作。重复频率为10 Hz的纳秒紫外线(266 nm)激光脉冲通过物镜聚焦, 以诱发材料击穿。等离子体中发射的光辐射由导出的光学系统收集, 并使用配备增强型电荷耦合器件(ICCD)摄像机的光谱仪进行分析[21-22]。
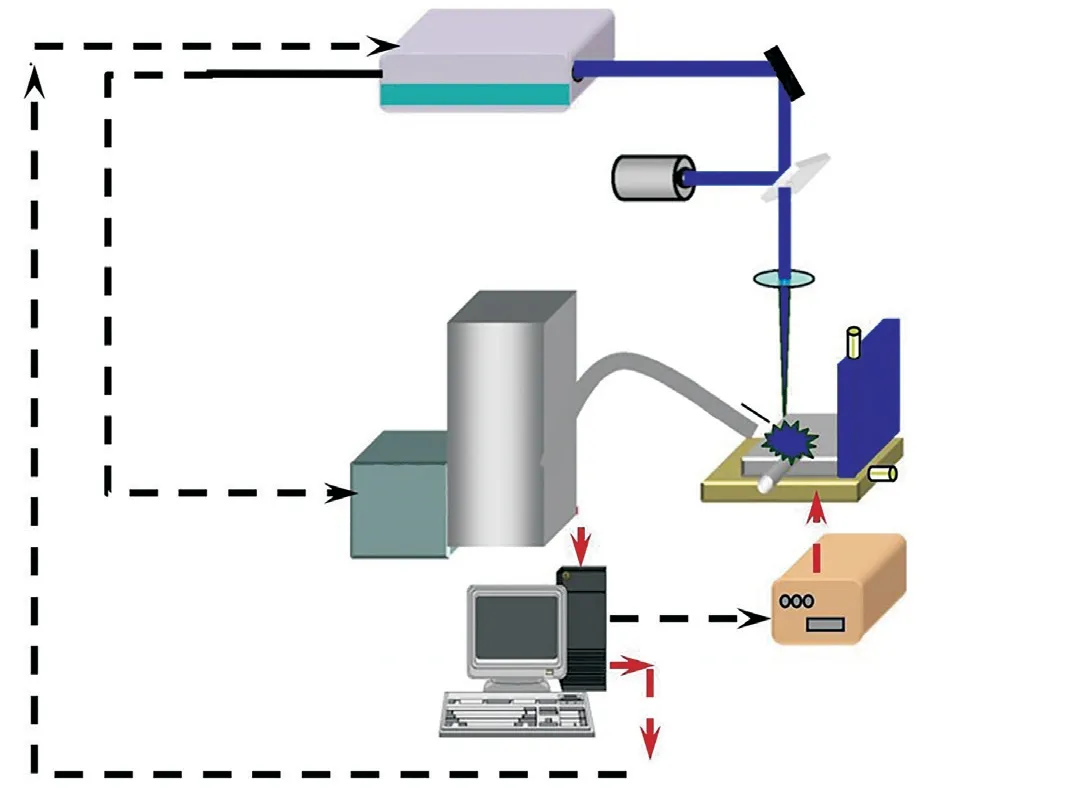
图3 LIBS系统示意图[20] Fig. 3 Schematic diagram of LIBS system[20]
综上所述, 光声成像系统和LIBS成像系统具有很大的相似性。在设备方面, 两种技术同时需要利用到激光以及扫描平台等设备;在扫描方式方面, 两者都是基于点对点扫描进行成像分析, 这都为两种技术的结合提供了良好的基础。因此, 通过调整激光功率, 共用同一光源以及扫描平台, 可以实现同时的光声和LIBS双模态成像。
3 在医学领域中的应用
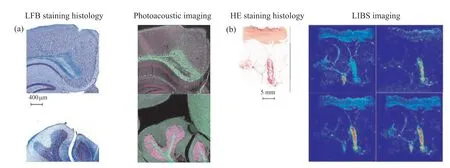
光声成像和LIBS在对组织切片的观察和成像上都有了广泛的应用。光声成像可以用来观察小鼠的脑结构, LIBS可用来观察皮肤组织的成像。图4a展示了小鼠大脑和小脑切片髓鞘的非标记光声成像图, 对切片用髓鞘特异性染料劳克坚牢蓝(Luxol fast blue, LFB)进行染色, 使用光学显微镜进行观察, 把得到的图像再和显示髓鞘(绿色)和核酸(紫色)分布的光声组织学光声显微镜图像进行对比, 这两种图像显示了相同的细节[23]。LIBS在对皮肤组织成像时, 得到的结果如图4b所示, 使用苏木精-伊红(hematoxylin-eosin staining, HE)染色后的组织可以很容易地识别皮肤的三层(即表皮、真皮和皮下组织)。相关LIBS元素图像以从冷到暖的色阶显示。通过观察发现, 皮肤中的元素具有很强的异质性, 结合对元素分布的综合分析, 可以正确识别和区分三种不同的生理皮肤层[24]。以上成像结果表明, 光声成像和LIBS成像可以实现对组织切片的吸收特性及元素分布的高分辨成像, 两种技术在组织成像领域有着广阔的应用前景。
光声成像和LIBS成像不仅可以对组织切片成像, 还可以实现组织中金属元素的示踪。光声成像常用于监控活体动物体内金属纳米粒子的示踪。图5a展示了金纳米笼在小鼠皮下黑色素瘤的分布情况。通过向小鼠尾静脉注射浓度为10 nmol/L的金纳米笼, 对比注射0、3、6 h的光声图像, 揭示小鼠黑色素瘤内金纳米笼的聚集情况[25-26]。而LIBS也可以对小鼠肾脏中金属元素进行示踪。图5b展示了在对小鼠静脉注射钆(Gd)基纳米颗粒24 h后其肾脏冠状截面的双元素成像。由于Na是生物组织的组成成分, 除了大型集合管和血管这种缺乏组织的区域外, Na信号均匀分布, 而Gd主要在肾皮质区域检测到, 并且在集合管的外部区域。放大的截面图也清楚地表明肾脏周围存在高水平的Gd[27]。以上结果表明, 这两种技术在探测生物体组织中金属元素的示踪方面都有非常成熟的应用, 未来还有很大的发展空间。

4 总结与展望
在过去的几十年里, 医学成像领域取得了重大进展。光声成像作为近些年来发展的一种新的无损医学成像方法, 在医学领域中有诸多的应用, 而LIBS技术也在观察组织结构和元素分布等医学研究方面有着很高的应用价值。当超短脉冲激光经聚焦后激发生物组织时, 组织将产生光声信号, 生物组织的光声信号携带了组织对光的吸收特性, 通过测量光声信号能重建出组织的光吸收分布图像。与此同时, LIBS通过激光聚焦组织表面形成等离子体。利用光谱仪对等离子体发射光谱进行分析, 以此来识别组织中的元素组成成分, 进而可以进行组织中元素的识别、分类、定性以及定量分析。这两种成像方式在系统上是非常相似的, 都需要用到激光照射物体以及利用扫描平台等, 所以两者可以共用同一台光源以及扫描平台实现同时的双模态成像。基于它们从原理到系统的相似性, 可以很容易地构建光声和LIBS的双模态成像系统, 如图6所示。光声成像的优势在于能够实现活体动物的组织深度成像和功能分子示踪, 因此, 光声成像技术在癌症、心血管疾病和神经疾病方面有着广泛的应用。而传统的病理样品制备也可以直接用于LIBS分析, 并可以显示元素的生物分布, 且与样品的形态保持一致。同时, 组织的元素图像可以表征病变, 正常组织和病变组织元素分布会有所不同。任何具有医学意义的样本的元素图像和组织病理学图像之间的直接比较也可能有某些元素的关系, 特别是可能与某些病理学相关的生理区域, 带来视觉组织病理学以外的信息。

此外, 在光声成像和LIBS技术结合的应用上仍然存在着一些局限性。光声成像与超声一样, 分辨率在物理上会受到成像深度和超声频率的反比关系限制。分辨率会随着频率的增加而增加, 但是在更高的频率下信号衰减会更大, 这就会导致成像深度受到限制, 灵敏度也会受到组织内光散射的影响。在分析复杂样品时, LIBS在量化和数据处理方面具有很大的挑战性, 由于LIBS成像的机制是收集等离子体, 故等离子体形态的波动也会导致成像的不确定性。当激光功率比较小的时候, 发生的是光声成像, 但当激光功率逐渐变大, 逐渐超过检测物表面的损伤阈值时, 激光射在上面会形成熔坑, 这时主要发生的是等离子的电离, 但是是否还存在着光声效应仍然存疑。但总体来看, 光声成像与LIBS成像技术在临床医学应用方面有着极强的互补优势。结合两者优点的光声和LIBS双模态成像系统, 与其他单系统成像方式对比, 在多尺度、多参数协同表征病理方面都有着不小的优势, 二者结合可以得到光吸收信息、光谱学信息等不同参数的表征结果。纳米科技在生物学和医学领域的应用愈加广泛。对生物组织中金属和有机离子分布及其他纳米粒子示踪的日益关注表明, 光声和LIBS双模态成像技术有望成为无标记、多方位成像的一种极有价值的研究工具, 在纳米粒子介导的诊断到治疗中有着广阔的应用空间, 将成为医学诊断和图像引导治疗的关键工具应用于医学成像领域。

