尼达尼布治疗放射性肺炎合并免疫检查点抑制剂相关性肺炎1例*
高源,刘青,李燕
611130 成都,成都市温江区人民医院 肿瘤科(高源);610041 成都,四川大学华西医院 肿瘤中心放疗科(刘青、李燕);611130 成都,四川大学华西医院 肺癌中心(李燕)
放射性肺炎(radiation pneumonitis,RP)是胸部肿瘤在放疗中出现的一类并发症,疾病早期以肺部急性炎症为主,随疾病进展晚期可出现肺组织纤维化表现[1-2]。免疫检查点抑制剂相关性肺炎(checkpoint inhibitor pneumonitis,CIP)是由免疫检查点抑制剂引起的免疫相关肺损伤,早期同样以肺部炎症为主,而随着T淋巴细胞的过度活化以及纤维化因子的增生,最终导致肺纤维化的形成[3-5]。根据多项研究结果显示,免疫检查点抑制剂联合放疗能改善晚期非小细胞肺癌患者的预后,但有部分患者治疗过程中肺炎的发生率增加[6-9]。目前RP与CIP的治疗原则相似,在炎症期以糖皮质激素和吸氧治疗为主,必要时给予抗感染治疗,而肺纤维化期尚无有效的治疗方案。尼达尼布是一类靶点明确的酪氨酸激酶抑制剂,通过抑制炎症因子的释放、纤维细胞的迁移、细胞外基质的沉积等方式发挥抗肺纤维化作用,目前常用于特发性肺纤维化等肺间质性疾病的治疗。现将四川大学华西医院收治的1例尼达尼布治疗RP合并CIP的病例情况报告如下。
1 病例资料
1.1 一般资料
患者男性,69岁,因“咳嗽、咳痰,痰中带血5月余,确诊肺癌20余天”于2020年10月18日入院。病理报告:“右肺下叶鳞癌”。基因报告:“EGFR(-)、ALK(-)、ROS1(-)、BRAF(-)”。PD-L1(22C3)检测: “TPS 30%,CPS 30”。2020年9月30日外院PET-CT报告(图1A):“右肺下叶背段肺门区软组织肿块4.9 cm×2.3 cm×5.6 cm,符合中央型肺癌,双侧肺门及纵膈多发淋巴结显示,最大直径1.5 cm,不排除转移”。患者既往吸烟50余年,平均20支/天。功能状态评分(performance status,PS)1分。诊断:“右肺下叶鳞癌伴纵隔淋巴结转移T3N2M0 ⅢB期,EGFR(-)、ALK(-)、ROS1(-)、BRAF(-),PD-L1(22C3)TPS 30% CPS 30”。
1.2 抗肿瘤治疗过程
考虑患者高龄,同期放化疗无法耐受,自2020年10月22日至12月25日接受TC方案化疗联合免疫治疗(白蛋白紫杉醇400 mg静脉滴注d1+卡铂450 mg静脉滴注d1+卡瑞利珠单抗200 mg静脉滴注d1)4周期,治疗后2021年1月10日复查胸部CT(图1B):“右肺下叶背段肺门区软组织肿块2.7 cm×2.3 cm×1.8 cm,符合中央型肺癌,双侧肺门及纵膈多发淋巴结显示”。效果评价为部分缓解(partial response,PR)。2021年2月4日至4月12日行肺部残留病灶放疗(PTV,60 Gy/30f,图2),2021年5月21日复查胸部CT(图1C):“右肺下叶背段肺门区软组织肿块2.7 cm×2.4 cm×1.8 cm,符合中央型肺癌,双侧肺门及纵膈多发淋巴结显示。对比2021年1月10日旧片未见明显变化”。
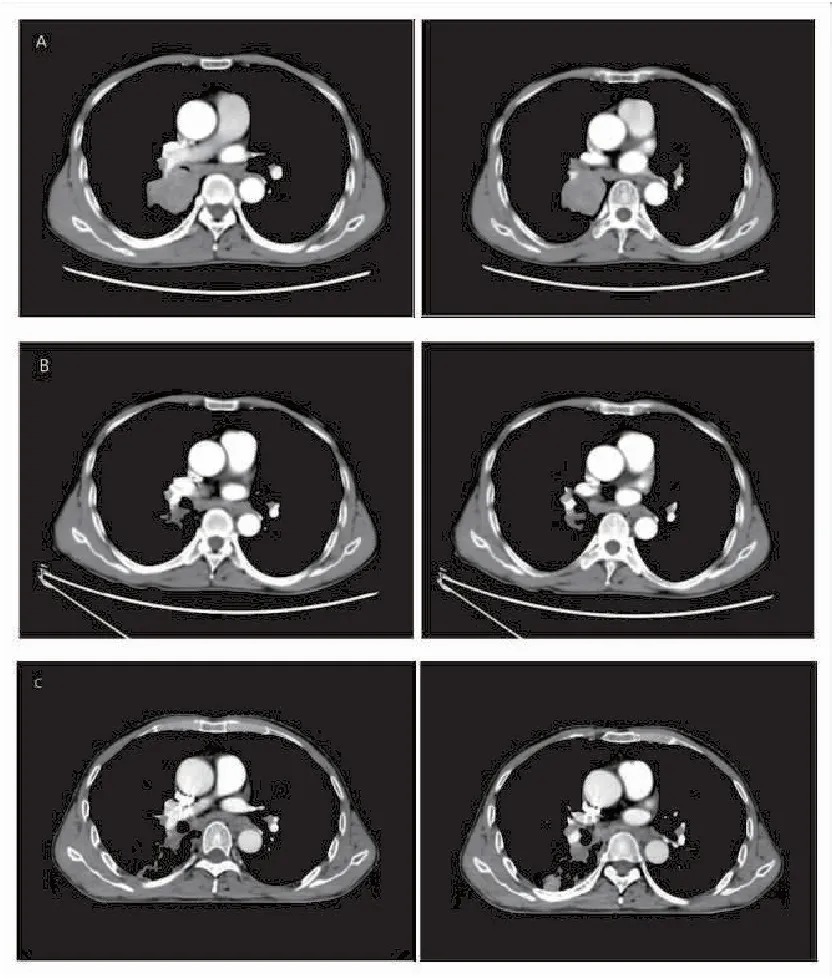
图1 抗肿瘤治疗前后胸部CT
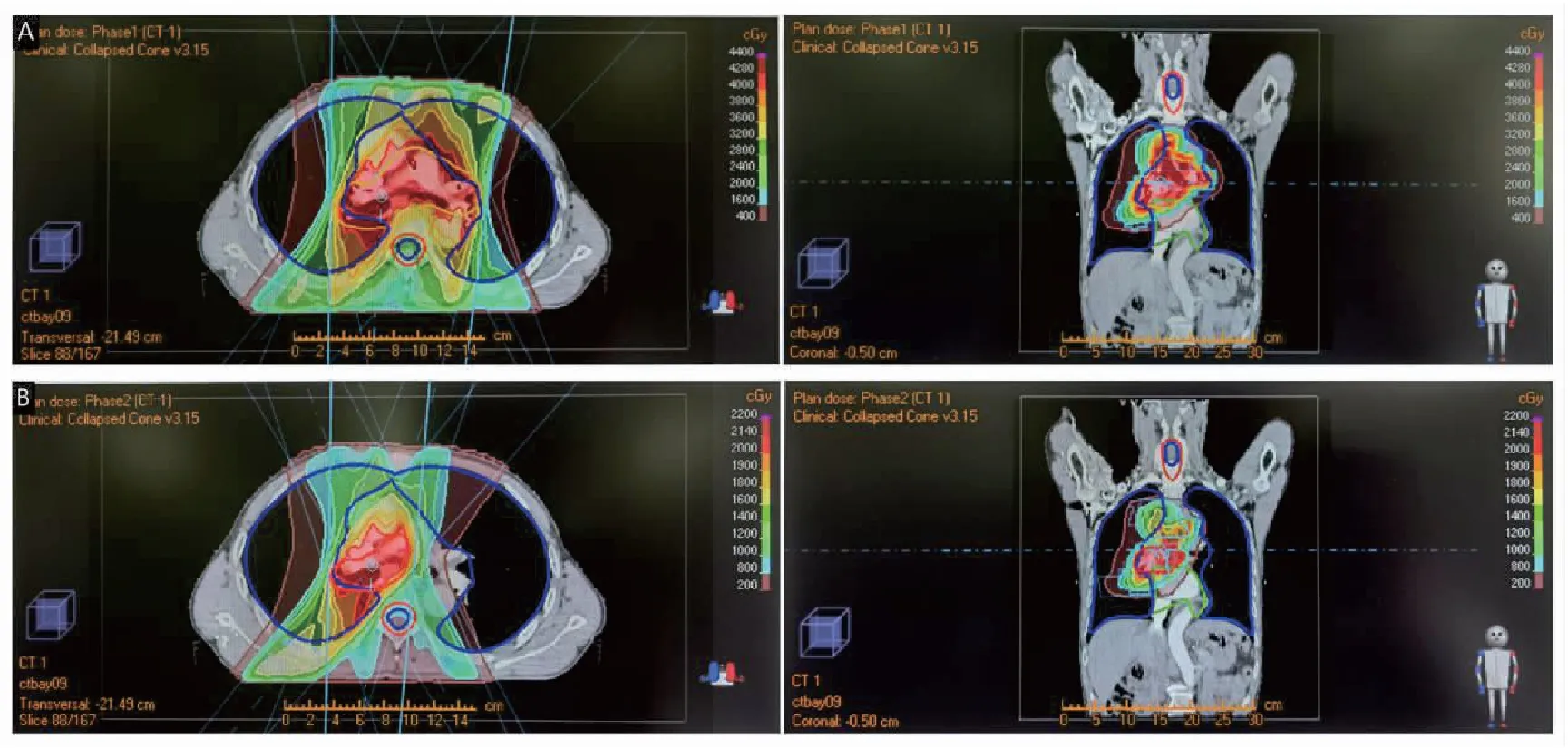
图2 放疗靶区
1.3 RP合并CIP治疗过程
2021年6月15日患者门诊复诊时诉咳嗽、咳痰加重,伴呼吸困难。2021年6月16日胸部CT(图3A):“双侧肺部内侧带炎性渗出及纤维化改变”。肺功能检查:第1秒用力呼气容积(comparison of forced expiratory volume in the first second,FEV1)2.04 L,用力肺活量(forced vital capacity,FVC)2.65 L,一氧化碳弥散量占预计值的百分比(DLCO)57%。因患者既往行化疗联合免疫治疗及胸部放疗,诊断为RPⅡ级、CIPⅡ级。明确诊断后予以标准化激素治疗(第1~2周:强的松30 mg 1天1次,治疗2周后开始减量,直至6周后停药),同时予以尼达尼布抗纤维化治疗(尼达尼布150 mg口服1天2次)。2021年9月6日复查胸部CT(图3B):“对比2021年6月16日旧片,双侧肺部炎性渗出及双侧肺门区纤维化改变减少”,复查肺功能检查: FEV1 2.21 L,FVC 2.67 L,DLCO 62%。患者咳嗽、气紧症状缓解,PS评分1分。患者RP合并CIP发生的肺纤维化较前好转,尼达尼布治疗有效。
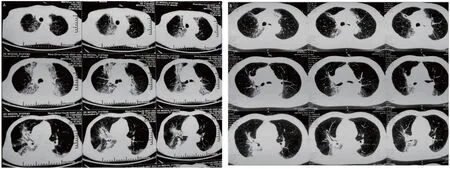
图3 RP合并CIP治疗前后肺部CT
患者后续未行抗肿瘤维持治疗,激素停药后未再口服激素治疗,继续口服尼达尼布维持治疗。末次随访至2022年2月15日,胸部CT(图4)提示双侧肺门区纤维化较前未见明显增加,患者不良反应可耐受,肿瘤疗效评估为稳定。
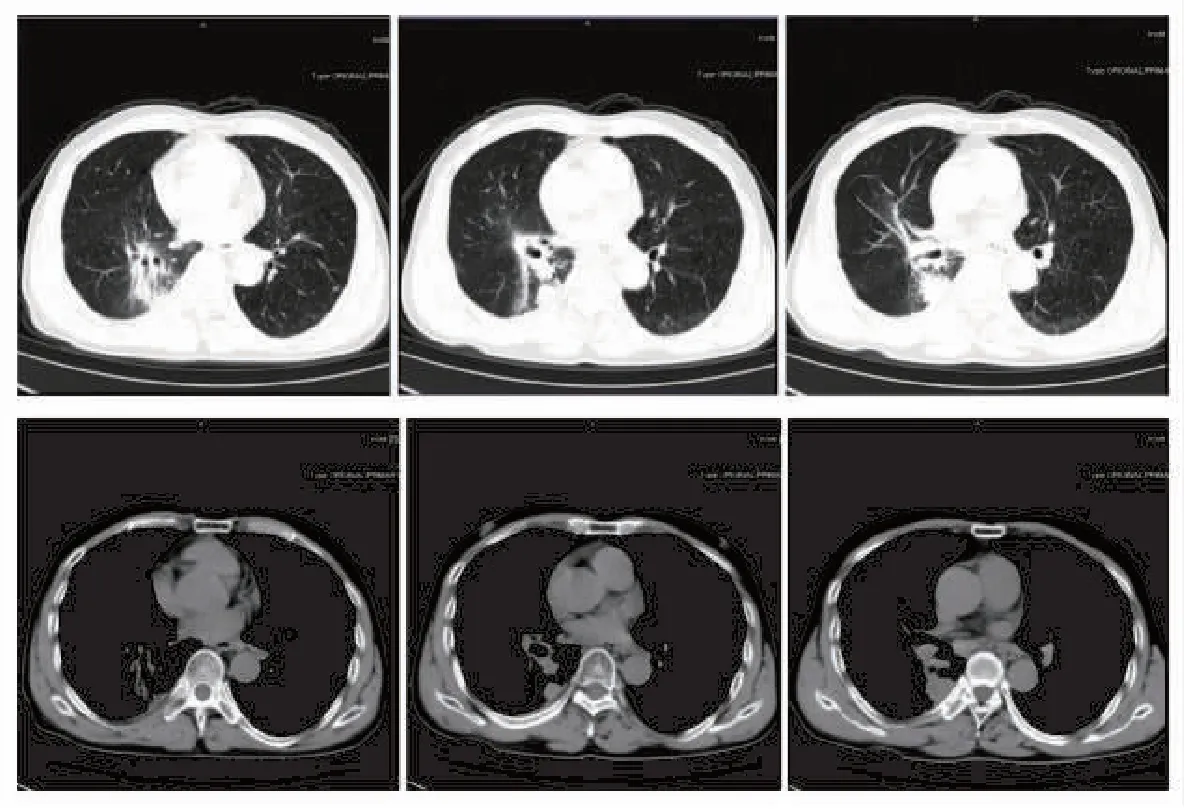
图4 尼达尼布维持治疗后肺部CT表现
2 讨 论
本例患者为ⅢB期局部晚期非小细胞肺癌患者,予以化疗联合免疫治疗后疗效评价PR,并针对肺部残留病灶行局部放疗,在抗肿瘤治疗后出现呼吸系统症状,肺功能检查提示肺功能下降,影像学表现为肺部渗出性病灶及纤维化改变。根据美国临床肿瘤协会CIP诊疗指南[10]的诊断标准,有免疫点抑制剂治疗史,且伴有新出现的呼吸系统症状和胸部CT新发病灶的患者可诊断为Ⅱ级CIP。同时患者在2个月前完成局部放射治疗,根据《放射性肺损伤的诊断及治疗》[11]的诊断依据,在6个月内有肺照射病史,且伴有影像学改变及呼吸系统症状的患者可诊断为Ⅱ级RP。因此在患者因呼吸困难就诊时诊断为Ⅱ级CIP合并Ⅱ级RP,在给予激素抗炎治疗及尼达尼布抗纤维化治疗后患者影像学表现及呼吸系统症状明显缓解。
RP及CIP的发生机制与肺泡上皮细胞的损伤、成纤维细胞增殖有关的转化生长因子-β(transforming growth factor β,TGF-β)/血小板衍生生长因子(platelet-derived growth factor,PDGF)信号通路的激活有关[1-5,12-13]。在肺组织不断损伤-修复的过程中,各类炎症细胞聚集在肺组织中,促使上皮应激反应和纤维化增生,最终导致肺组织的纤维化。进展性纤维化性间质性肺疾病(progressive fibrosing interstitial lung disease,PF-ILD)是一类以FVC下降伴呼吸症状进行性恶化以及肺组织纤维化进行性增加为表现的肺部疾病[14],其发生机制与RP及CIP高度相似。3种疾病发展过程中均会导致肺纤维化的发生,而RP及CIP导致的肺纤维化目前尚无明确的治疗方案推荐。
在关于PF-ILD的研究中,相关结果显示通过阻断TGF-β/PDGF信号通路可抑制成纤维细胞灶的形成,有助于减缓肺组织纤维化的进展[15]。尼达尼布是一种多靶点的抗纤维化药物,TGF-β/PDGF信号通路是其主要作用的信号通路[16]。一项关于PF-ILD的研究结果显示,经尼达尼布治疗的患者FVC年下降率明显改善(P<0.001)[17]。目前尼达尼布已获批用于PF-ILD的治疗,而在RP及CIP所致肺纤维化尚无明确治疗推荐的情况下,考虑RP及CIP与PF-ILD有相似的机制,故采用尼达尼布治疗RP合并CIP所致的肺纤维化。在本病例中,患者经过激素联合尼达尼布的方案治疗后,呼吸困难等症状缓解,影像学提示肺纤维化减轻,肺功能有所改善,不良反应可耐受。
随着肿瘤免疫治疗的不断发展,越来越多的肿瘤患者采用免疫治疗联合传统治疗的联合治疗方案,随之而来的便是不良反应的合并发生。RP及CIP 所致的肺纤维化是影响肿瘤患者日常生活质量的重要因素,但目前仍未有指南推荐相关治疗药物。
本病例报道的意义在于,RP合并CIP所致的肺纤维化患者在口服尼达尼布治疗后取得了较好的疗效,且耐受性和安全性好,为RP及CIP所致的肺纤维化提出了新的治疗思路。但本病例仅为个案,且目前有关抗纤维药物治疗RP及CIP的文献也都为个案报道[18-19],研究样本不足,还需更多的临床研究证实。此外,在RP及CIP的初始阶段,成纤维细胞尚未形成病灶,在此阶段提前予以尼达尼布治疗能否预防纤维化的形成,目前尚未有文献报道。而当患者因Ⅱ级以上CIP停止免疫治疗时,同步给予抗纤维化药物能否增加肿瘤患者免疫治疗再挑战的机会,也还需进一步的临床研究探索。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

