免疫检查点抑制剂相关性肝毒性的研究进展*
白怡雪,袁瑞,张师容,郭卉,刘梦洁
710061西安, 西安交通大学第一附属医院 肿瘤内科(白怡雪、袁瑞、张师容、郭卉、刘梦洁);710049西安, 西安交通大学 仿生工程与生物力学研究所(郭卉)
免疫检查点抑制剂的问世打破了肿瘤治疗的格局,为肿瘤患者带来了新的希望。自2013年首个免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)获美国食品药品监督管理局批准上市以来,越来越多的患者获益于ICIs[1- 2]。免疫检查点是免疫细胞表面参与免疫调节的分子,主要包括细胞毒T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)、程序性死亡受体1(programmed death receptor 1,PD-1)及其配体(programmed death receptor ligand 1,PD-L1)等。ICIs可以阻断免疫检查点分子的活化,进而使T细胞重新激活并诱导其抗肿瘤活性[3-4]。随着ICIs获批的癌种越来越多[1,5-6],适应症从开始的后线治疗逐渐向一线治疗过渡[5,7],免疫相关不良反应(immune-related adverse events,irAEs)的发生逐渐成为临床关注的热点问题。免疫检查点在维持免疫自我耐受和预防自身免疫性疾病方面起着关键作用,干扰这一机制会导致irAEs的发生,并在全身各个器官都可有表现[8],大多数的irAEs在停药或加用糖皮质激素后可以得到控制,但也有部分患者因发生irAEs而导致永久停药,甚至死亡,其中ICIs相关性肝毒性(ICI-induced immune-mediated hepatitis,IMH)已成为一个重要的临床问题。
1 免疫相关性肝损的发生率
近5年II/III期临床研究报道的IMH的发生率在0.3%~42%之间,并且有0~24%的患者会出现严重的IMH(≥3级)(表1),由此可见在发生IMH的患者中有近一半的患者会发生较为严重的IMH。在接受单药治疗的患者中,CTLA-4抑制剂的IMH发生率最高,最高可达30%,其中1%~10%为≥3级[9-11]。在应用PD-L1抑制剂的大型临床研究中,患者IMH的发生率与CTLA-4抑制剂的相似(任何级别为1%~30%,≥3级为2%~10%)[12]。相比之下,PD-1抑制剂单药治疗的IMH的发生率最低,在0~3%之间,≥3级反应较少,目前报道的发生率<1%[9,13-15](表1)。CTLA-4抑制剂和PD-1抑制剂的联合用药会导致IMH的发生率升高,任何级别的IMH发生率为18%~22%,其中8%~11%为≥3级[13-16]。
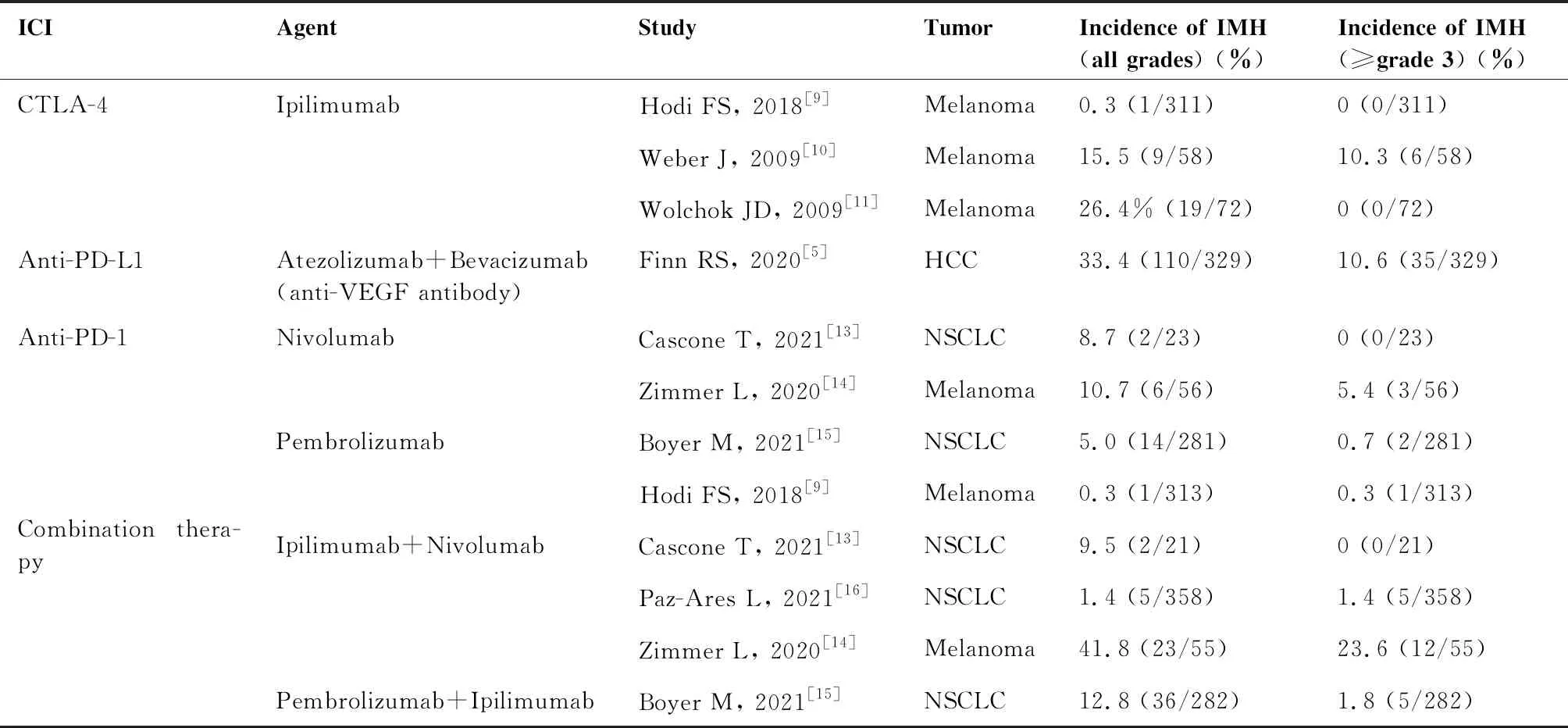
表1 II期和III期临床试验报告的免疫治疗药物严重肝毒性的发生率
对于不同类型ICIs在IMH的发生率和严重程度上的差异,确切的机制尚不清楚。正常情况下,CTLA-4表达在Treg细胞表面,通过抑制效应T细胞的增殖和释放细胞因子来抑制免疫反应,以维持自身免疫耐受。CTLA-4抑制剂通过细胞介导的细胞毒作用损伤Treg细胞,从而使肿瘤微环境中效应T细胞与Treg细胞的比例升高,增强抗肿瘤效应[17]。Wing等[18]构建了CTLA-4敲除小鼠,发现小鼠会出现严重且迅速致死的T细胞增殖、高丙种球蛋白血症以及T细胞介导的自身免疫性疾病。这表明,Treg细胞和效应T细胞的失衡可能导致CTLA-4抑制剂相关的IMH。PD-1表达在T细胞表面,而其配体PD-L1和PD-L2存在于抗原提呈细胞、肿瘤细胞和各种正常组织细胞表面,Treg细胞同时表达PD-1和PD-L1[17]。阻断PD-1也能增强效应T细胞的活化,但与阻断CTLA-4相比,会激活较少数量的效应T细胞增殖[17]。这可能是PD-1抑制剂IMH的发生率和严重程度较CTLA-4抑制剂低的原因。
在接受ICIs治疗的肝细胞癌(hepatocellular carcinoma,HCC)患者中,IMH的发生率看似高于其他类型的肿瘤,但实际上,其中真正由于免疫治疗引起的肝损伤的比例与非HCC患者的试验结果相似[5,7]。由于纳入HCC患者的ICIs临床研究主要为Child-Pugh A级(代偿期)的患者,因此限制了对病情较重患者的普适性。不过,在CheckMate-040研究中纳入了少数Child-Pugh B级(失代偿期)患者(n=49),研究结果显示Nivolumab治疗后的总体IMH发生率为8%[19],目前仍不清楚不同Child-Pugh分级的患者IMH的发生率是否有差异。
非HCC患者应用ICIs也有发生IMH的风险。例如,在接受PD-1抑制剂单药治疗的晚期黑色素瘤患者中,有4%~7%的患者出现了不同程度的IMH,其中1%的患者发生≥3级的IMH[20-21]。在接受PD-1抑制剂联合酪氨酸激酶抑制剂治疗的晚期肾细胞癌患者中,27%的患者出现了不同程度的IMH,其中13%的患者发生了≥3级的IMH[22]。
总体而言,接受ICIs联合治疗的患者的IMH发生率高于接受ICIs单药治疗的患者。其中有14%~52%的患者会出现严重的IMH(≥3级)。此外,既往有慢性肝炎或肝硬化的HCC患者中,IMH发生的频率更高,这可能与慢性肝炎或肝硬化患者的肝功能储备较差有关。
2 IMH的危险因素与预测指标
2.1 危险因素
IMH在不同人群中的发生率、发生级别和距ICIs治疗的间隔都有很大的异质性,这受到多方面的影响[23]。首先,原发肿瘤的类型会影响IMH的发生,一项纳入了晚期肿瘤患者的ICIs II期和III期临床研究的Meta分析发现,与非小细胞肺癌和前列腺癌相比,黑色素瘤患者发生IMH的可能性更高(OR分别为2.71和5.66)[24]。此外,在应用pembrolizumab的患者中,体重指数(body mass index,BMI)是IMH的危险因素之一,BMI每增加1 kg/m2,发生irAEs的风险增加9%(OR: 1.09,95%CI: 1.02~1.17,P=0.012),这可能与脂肪组织中炎症相关的促炎细胞因子增多有关[25]。
目前尚缺乏自身免疫性肝炎的肿瘤患者中接受ICIs治疗后IMH发生率的报道。HCC免疫治疗的临床研究纳入的患者大部分为乙肝感染者,这些研究中并未观察到病毒性肝炎的HCC患者的IMH风险与非病毒性肝炎感染者之间的差异,并且在治疗过程中未观察到乙肝的再激活[19,26]。关于非HCC的ICIs的临床研究大都排除了乙肝和丙肝感染的患者,因此仍需要进一步研究来明确病毒载量较高的慢性活动性病毒性肝炎应用ICIs发生IMH的风险性。
2.2 预测指标
目前尚缺乏针对IMH的特异性预测生物标志物。高中性粒细胞与淋巴细胞的比率(neutrophil-to-lymphocyte ratio,NLR)与多种肿瘤的irAEs相关[27]。在对接受ICIs治疗的非小细胞肺癌的研究中,治疗前衍生中性粒细胞与淋巴细胞比率(derive neutrophil-to-lymphocyte ratio,dNLR)>3与较差的预后相关[28]。这表明肿瘤诱导的中性粒细胞极化和激活与较差的ICIs疗效有关。此外,在开始ICIs治疗前的一些生物标志物与发生irAEs的高风险相关。例如,在ICIs治疗开始3周后检测到了总体B细胞数量的减少,CD21loB细胞和浆母细胞百分比的增加,以及CD21loB细胞克隆的增加,这些患者在应用ICIs后 6个月经历了严重的irAEs,因此ICIs后B细胞的早期变化也有助于识别irAEs高风险的患者[29]。血清细胞因子水平也可为患者对irAEs的易感性提供预测价值。例如,在接受ipilimumab治疗的黑色素瘤患者中,治疗前血清中高水平的IL-17的患者更有可能发生≥3级的irAE,因此IL-17可以作为一个预警分子[30]。所有这些针对irAEs的预测因子仍需要在更大的研究中进行证实,才能推荐应用于临床实践中。
3 临床表现和病理特征
IMH主要分为肝细胞型、胆汁淤积型和混合型。IMH主要表现为谷丙转氨酶(alanine aminotransferase,ALT)和(或)谷草转氨酶(aspartate aminotransferase,AST)的升高,伴或不伴胆红素的升高,胆汁淤积型可有碱性磷酸酶(alkaline phosphatase,ALP)和谷氨酰转肽酶(gamma-glutamyl transferase,GGT)的升高。患者通常没有特异性症状,常表现为乏力(17.9%)、发热(7.1%)、腹痛(7.1%)等,有时也可出现黄疸(3.6%),伴或不伴其他组织器官的irAEs,如结肠炎、肺炎等[31]。病情较重的患者可表现为黄疸、右腹痛、尿色深、易瘀伤,急性肝功能衰竭较为罕见[32]。患者开始治疗至发生IMH的时间差异较大。与接受PD-1抑制剂或PD-L1抑制剂治疗的患者相比,接受CTLA-4抑制剂治疗的患者自开始治疗至发生IMH的时间间隔更短,二者的中位时间分别为48天(27~118天)和34天(25~46.5天)(P=0.04)[33]。
肝活检可以明确IMH的诊断,并评估组织损伤的严重程度。IMH最常见的镜下表现是以小叶中心区为主的点状或融合性坏死的急性肝炎和肉芽肿性肝炎[34]。在接受CTLA-4抑制剂治疗的患者中,可能会表现为肉芽肿性肝炎,这与严重的小叶坏死和炎症活动相关。肉芽肿由上皮样细胞组成,无多核巨细胞,边界不清。坏死呈点状或融合状,主要见于小叶中心区。所有患者均有中心静脉内皮炎[34]。而接受PD-1/PD-L1抑制剂治疗的患者则表现为小叶性、非肉芽肿性的肝炎,22%的患者组织活检显示微小肉芽肿团块,无纤维蛋白沉积,56%的患者出现门脉纤维化,仅22%的患者出现中心静脉内皮炎[34-35]。免疫组织化学表征显示在接受CTLA-4抑制剂治疗的患者中,以CD8+T淋巴细胞浸润为主,而接受PD-1/PD-L1抑制剂的患者表现为CD8+T淋巴细胞和CD4+T淋巴细胞混合浸润[35]。
总的来说,IMH的临床表现不特异,病理检测可以进行鉴别。在诊断免疫相关性肝损伤时,一方面需结合患者的病史、临床表现、生化指标,必要时进行肝活检,以排除引起肝损伤的其他潜在病因如病毒性肝炎、酒精性肝病、自身免疫性肝炎等;另一方面,应仔细了解、询问患者其他的合并用药,排除其他药物引起肝损伤的可能。
4 治疗现状
4.1 治疗
根据癌症免疫治疗学会(Society for Immunotherapy of Cancer,SITC)、欧洲医学肿瘤学会(European Society for Medical Oncology,ESMO)和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)的指南推荐(表2),IMH可通过暂停免疫治疗或加用糖皮质激素来治疗。指南建议2级IMH患者口服泼尼松,剂量为0.5~1 mg/kg体重,3/4级患者静脉注射甲基泼尼松,剂量为1~2 mg/kg体重。尽管指南之间存在细微差异,但它们都采取逐渐抑制免疫的方法,包括暂停或永久停止ICIs,然后进行皮质类固醇治疗和进一步的免疫抑制等,是否重新应用ICIs取决于最初的严重程度和对后续治疗的反应。

表2 主要专家协会对抑制剂相关肝毒性管理建议的比较
在应用糖皮质激素的患者中,非肝脏肿瘤患者的IMH的缓解时间通常约为2周[2],而HCC患者的缓解时间差异较大(3~104天)[36-37]。
根据对激素治疗的反应性,IMH分为激素敏感型、激素依赖型和激素难治型。激素敏感型的患者表现为应用糖皮质激素后2~3天内肝功能指标恢复到基线水平[35];激素依赖型的患者表现为应用激素后2~3天内肝功能指标恢复到基线水平,但在缓慢减药后再次出现反跳性肝炎[38]。即使糖皮质激素治疗有效,仍应持续监测患者临床症状、体征和肝功能指标。监测频率根据IMH的严重程度和开始使用糖皮质激素后的缓解速度来调整。持续监测肝功能指标也有助于指导激素减量。有文献报道多达1/3的患者会出现反跳性肝炎,因此在IMH缓解后应继续进行肝功能监测[31]。一些经停药和糖皮质激素治疗后肝功能检查仍恶化的患者称为激素难治性IMH。在这些情况下,可以添加第二种免疫抑制剂,最常使用的是霉酚酸酯[34,37]。硫唑嘌呤是自身免疫性肝炎的一线药物[36],虽然它在IMH中的应用已有报道,但应用仍然受限,因为它的免疫抑制作用需要数月才能达到峰值,而且其代谢产物有肝脏毒性[36]。其他药物,例如抗胸腺细胞球蛋白[39]、托珠单抗[40]、英夫利昔单抗[37],甚至血浆置换[41]也都应用于难治性IMH。
4.2 irAEs的严重程度对免疫治疗疗效的影响
MD Anderson Cancer Center(得克萨斯大学安德森癌症中心)的一项横断面研究揭示,尽管使用了糖皮质激素,但与没有发生≥3级irAEs的患者相比,经历过严重irAEs(≥3级)的患者的中位无进展时间(progression-free survival,PFS)更长[33]。对此的机制尚不完全清楚,可能与ICIs诱导的免疫激活不仅导致肿瘤特异性T细胞反应,同时还导致其对患者自身细胞的耐受性丧失、免疫细胞过度激活、细胞因子过度分泌有关[4]。而对ICIs客观反映越好的患者,其免疫反应被激活得越强烈。失去对自身耐受后,被强烈激活的肿瘤特异性T细胞攻击正常细胞,从而导致更严重的irAEs[4],所以在带来更严重的不良反应的同时也能带来更长的PFS。
4.3 免疫治疗再挑战
根据SITC、ESMO和CSCO的指南推荐,2级IMH应暂时停止ICIs,3~4级则永久停止。但是否发生了3~4级IMH就不能再挑战免疫治疗,而发生2级IMH在症状控制后再启动ICIs治疗是否真的安全?重启免疫治疗时选择哪一种ICIs药物呢?
Riveiro-Barciela等[41]报道了1例应用PD-1抑制剂后发生2级IMH暂停治疗的患者,重新启动免疫治疗时更换为CTLA-4抑制剂,随后发生了4级IMH。IMH后再次挑战PD-1抑制剂和CTLA-4抑制剂的联合治疗方案具有IMH再发的高风险[42]。在CTLA-4抑制剂和PD-1抑制剂联合治疗的21名IMH患者中,有4名患者再次接受PD-1抑制剂治疗并没有导致IMH复发[37]。与先接受CTLA-4抑制剂然后接受PD-1抑制剂的患者相比,先接受PD-1抑制剂然后接受CTLA-4抑制剂的患者更容易出现≥3级的IMH[43]。Brahmer等[44]猜想这是由于在引入CTLA-4抑制剂期间PD-1抑制剂的半衰期延长所致。nivolumab的半衰期为17~25天,但在T细胞上作用至少持续59天,所以即使血清中的nivolumab浓度检测不到,PD-1阻断依旧存在。由于PD-1抑制剂活性延长,即使患者随后接受的为CTLA-4抑制剂单药治疗,体内仍然有持续作用的PD-1抑制剂,这也就如同PD-1抑制剂和CTLA-4抑制剂联合治疗方案,无形中增加了IMH再发风险。也有文献报道了在应用PD-1抑制剂发生3~4级IMH后,成功重新引入PD-1抑制剂而没有复发的案例[45]。可能有效的方法包括同时使用布地奈德(皮质类固醇),或在ICIs联合治疗(PD-1抑制剂联合CTLA-4抑制剂)后出现严重不良反应的患者再挑战时,应用PD-1抑制剂单药治疗[46]。然而,这些方法在被广泛采用之前需要进行严格的临床研究的证实。
综上所述,IMH的治疗遵循循序渐进的方法,首先是停止ICIs,然后是糖皮质激素的应用,最后是其他免疫抑制剂的应用,并在每一步后密切监测肝功能指标。而IMH缓解后ICIs的再挑战尚无定论,需要根据患者的基础状况、对治疗的响应性、相关实验室检查的动态变化进行评估,并且仍需更多的临床研究进行验证。
5 展 望
随着ICIs的适应证越来越广、使用频率越来越高,irAEs的识别和治疗已成为重要的临床课题。IMH是肿瘤免疫治疗的一种并非罕见的并发症,其表现和严重程度异质性高。尽管对这种并发症的认识正在提高,但仍有很多问题没有得到解答。目前指南推荐的主要依据为回顾性病例系列研究结果,为了加强这一领域的证据基础,需要进行大型前瞻性研究和随机对照试验。IMH患者的遗传和免疫情况同样非常重要,随着我们认识的深入,ICIs的选择将走向个体化、精准化,不仅要考虑到每个患者的应答情况,还要考虑到他们潜在的遗传背景可能带来的风险。我们需要寻找并探索IMH特异的预测因子和可能的潜在危险因素,识别出IMH的高危人群,对于这类人群进行早期预警,尽量规避由IMH的发生带来的风险,进而使更多的患者从ICIs治疗中获益。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

