EGFR敏感突变晚期肺腺癌患者靶向耐药后的免疫治疗:疗效和毒性分析*
朱敏,谢肖肖,田雨可,曾梓洵,胡瀚,贾蓉,周进
610054成都,电子科技大学 医学院(朱敏);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 肿瘤内科(谢肖肖、田雨可、周进);646000 四川 泸州,西南医科大学 临床医学院(曾梓洵、胡瀚);610500成都,成都医学院 临床医学院(贾蓉)
晚期肺癌的治疗已进入靶向时代,以表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors,EGFR-TKIs)为代表的分子靶向药物改变了驱动基因阳性晚期非小细胞肺癌的治疗格局[1]。随着药物研发不断进步,目前EGFR-TKI已呈现“三代同堂”的局面[2],药物的可及性大大提高。同时,不同代药物也实现了接力使用,这显著延长了患者的总生存期。但靶向治疗无法回避药物的耐药性问题[3],而耐药后的治疗选择以化疗为主,疗效有限。近年来,利用机体自身免疫系统抗癌的免疫治疗问世,为晚期肺癌患者带来了新的希望。特别是含程序性死亡受体1(programmed cell death protein 1,PD-1)/程序性死亡配体(programmed death-ligand,PD-L1)抗体的免疫联合方案,已成为驱动基因阴性的晚期非小细胞肺癌一线治疗的标准[4-6]。但免疫治疗在EGFR突变患者中应用探索较少,部分研究显示分子靶向治疗和免疫治疗同步使用安全性较差[7-9]。现有III期研究如ORIENT-31、CT25等,在靶向耐药后的EGFR突变人群中观察了应用PD-1抑制剂联合化疗或抗血管治疗的疗效,目前数据结果支持在耐药后可有限制地应用免疫治疗,但最佳的联合治疗模式还需进一步的探索[10-11]。本次我们回顾分析了32例EGFR敏感突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,观察在靶向耐药后给予免疫治疗的疗效及安全性。
1 对象与方法
1.1 研究对象
回顾性分析2019年1月至2020年6月四川省肿瘤医院收治的晚期肺腺癌患者,收集其年龄、性别、吸烟史、EGFR突变、是否转移等临床资料。纳入标准:1)病理诊断为肺腺癌;2)初始基因检测为EGFR 19DEL或L858R敏感突变;3)曾接受EGFR-TKI药物口服治疗,并耐药进展;4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;5)有完整的临床病理信息,包括吸烟、性别、年龄和临床分期等;6)EGFR-TKI进展后接受了免疫治疗(PD-1抑制剂)为主的联合治疗。排除标准:1)年龄<18岁;2)怀孕或哺乳期女性;3)有EGFR其他罕见位点突变;4)合并其他恶性肿瘤病史;5)有间质性肺炎、严重的自身免疫性疾病等免疫治疗禁忌证;6)无定期随访复查资料者。
1.2 基因检测方法
所有患者在初始诊断时均使用组织活检进行基因检测,采取突变扩增系统(amplification refractory mutation system,ARMS)技术检测。由我院病理科提供石蜡切片标本,QIAamp DNA试剂盒定量提取石蜡切片肿瘤组织的DNA。试剂盒设有内部和外部质控样本,阳性对照和阴性对照。
1.3 评价指标
靶向治疗耐药后的免疫治疗疗效评估依据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1标准。每6~8周进行相应的血液学和影像学检查,以评价疗效及监测病情变化。主要观察指标为客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、无进展生存时间(progression-free survival,PFS)及总生存期(overall survival,OS)。免疫相关不良事件(immune-related adverse event,irAE)的诊断参考CSCO免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)毒性管理指南2021,并按照发生程度分为G1~G4,同时记录免疫不良反应的治疗情况及转归。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。Log-rank检验进行两组生存比较,ORR和DCR通过Fisher’s检验比较,P<0.05为差异有统计学意义。
2 结 果
2.1 临床基线特征
根据纳入排除标准,本研究共纳入患者32例,所有患者均为EGFR敏感突变,且在靶向治疗耐药后接受以PD-1抑制剂为主的联合治疗。ICIs药物为帕博利珠单抗、纳武利尤单抗、卡瑞利珠单抗和信迪利单抗,化疗方案均为培美曲塞联合顺铂,抗血管药物为贝伐珠单抗。入组患者中,男性21例(65.6%,21/32),女性11例(34.4%,11/ 32);平均年龄(67±10.2)岁,男性平均(69±9.1)岁,女性平均(62±7.8)岁;不吸烟 (总吸烟量<100支)或轻度吸烟者(至少戒烟15年且吸烟量<10包/年)占40.6%(13/32);EGFR基因突变中20例为19DEL(62.5%)突变,12例为L858R(37.5%)突变;靶向治疗情况为一代EGFR-TKI 8例,二代EGFR-TKI 5例,3代EGFR-TKI 11例,1+3序贯治疗5例,2+3序贯治疗3例;免疫治疗方案中帕博利珠单抗联合化疗9例,纳武利尤单抗联合化疗3例,卡瑞利珠单抗联合化疗8例,信迪利单抗联合化疗6例,帕博利珠单抗联合化疗及抗血管4例,卡瑞利珠单抗联合化疗及抗血管2例;治疗期间共有14例患者进行了局部放疗,靶向治疗期间有9例,免疫治疗期间有5例。入组患者基线情况见表1。

表1 患者临床特征
2.2 疗效分析
随访截止2022年3月,32例患者均完成随访。总体ORR为43%,DCR为67%,PFS为7.1个月,OS为11.7个月。对于不同EGFR突变类型患者,19DEL和L858R突变PFS分别为7.4个月和6.8个月,组间差异无统计学意义(P=0.364)。靶向治疗期间未出现T790M突变患者的PFS较出现T790M突变者有延长趋势(8.7个月vs5.1个月,P=0.017)。总体来讲,不同免疫药物的联合治疗,PFS从6.2到8.4个月,差异无统计学意义。治疗过程中无放疗参与者PFS 7.2个月,加入放疗者为7.0个月。总体的疗效及亚组分析见表2。
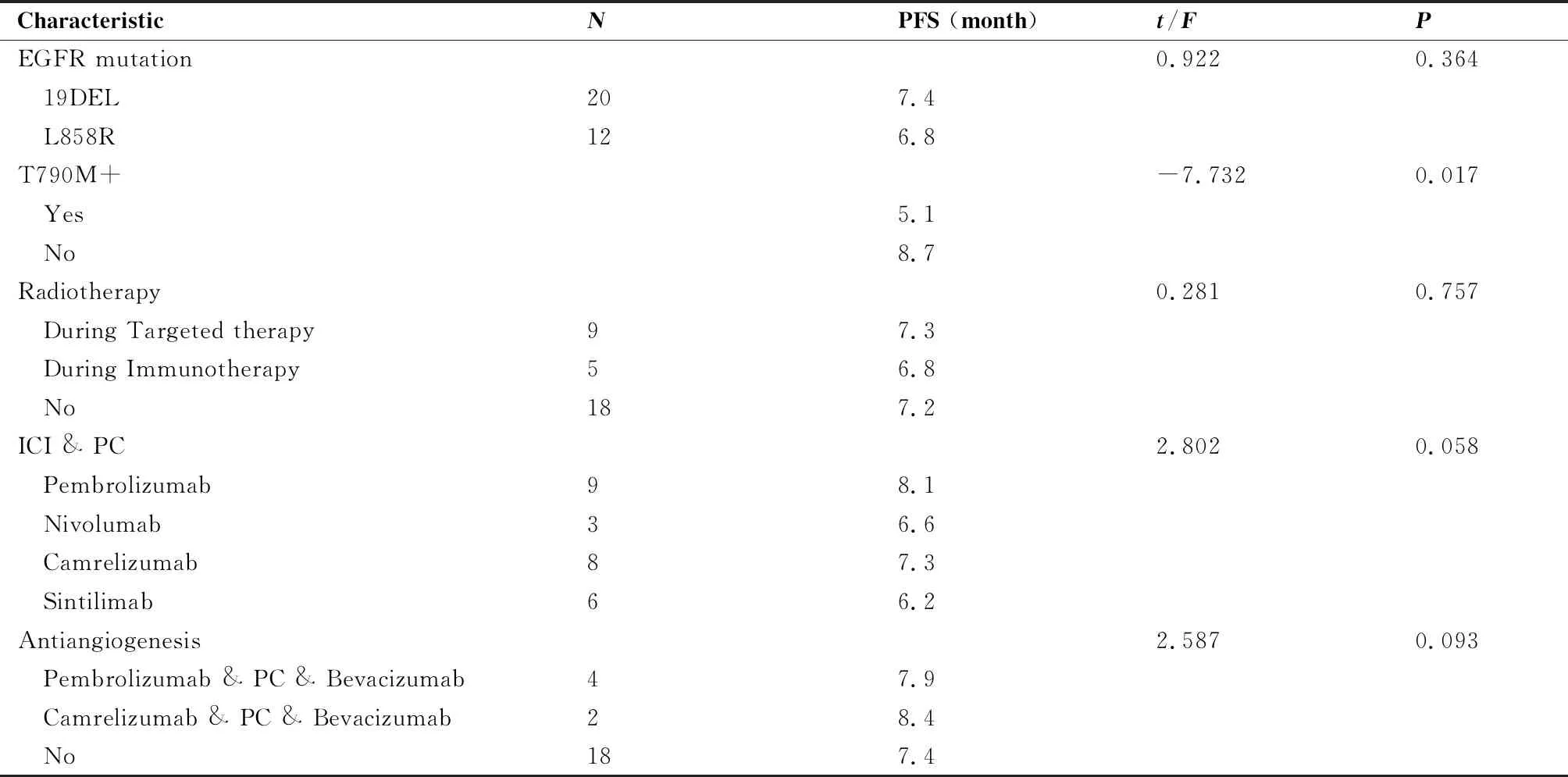
表2 分类人群疗效
2.3 毒性分析
32例患者中治疗相关不良反应的发生率为93.8%(30/32),包括恶心17例、食欲缺乏14例、乏力11例、呕吐9例、皮疹7例、肝功能不全6例、毛细血管增生6例、水肿4例、肺炎2例、其他3例,未发现新的不良反应。其中,≥3级的不良反应为皮疹2例、乏力2例,占总体人群的6.2%,停药1个月后均自行缓解。不良反应汇总见表3。

表3 治疗相关不良反应
3 讨 论
目前肺癌是全球发病率第二、死亡率最高的恶性肿瘤[12],在我国,肺癌的发病率和死亡率均位居首位[13]。肺癌的早诊早筛现状并不乐观,约一半患者在首次诊断时就发现有远处转移[14]。按照目前诊疗规范,这类患者归入不可治愈类型,治疗效果差,生存期短,是我国实现癌症防治目标的重大阻碍。近年来随着非小细胞肺癌尤其是腺癌驱动基因的发现和药物研发进展,晚期非小细胞肺癌患者生存得到显著改善,治疗进入靶向时代。目前NCCN、ESMO、CSCO等主流指南均一致推荐对于非小细胞肺癌,尤其是晚期非鳞癌患者,常规在组织学明确后进行EGFR、ALK、ROS1、MET、RET、BRAF、KRAS等基因的检测[15]。在众多驱动基因中,对EGFR基因的研究最深入、临床应用最广泛。我国肺癌患者EGFR基因突变频率较高,占30%~50%[13]。Ⅲ期临床研究IPASS证实吉非替尼一线治疗晚期EGFR基因突变的NSCLC患者,相较于传统化疗可显著延长PFS,同时其ORR和OS均优于化疗,明显改善了患者的预后[16]。后续的LUX-LUNG、ARCHER1050、FLAURA等研究,进一步奠定了靶向治疗在EGFR敏感突变患者治疗中不可撼动的地位[2,17-18]。
靶向治疗为晚期EGFR突变非小细胞肺癌患者带来了显著的临床生存获益,并且其更少的副作用及更高的肿瘤缓解率明显改善了患者的生存质量。但靶向治疗也有其局限性,大部分患者会不可避免地发生耐药。现有指南推荐靶向人群在耐药后再次基因检测探索耐药原因。若无继续分子靶向治疗机会时,后线治疗以化疗为主,可联合抗血管治疗、局部放疗等。但受限于病情进展后患者分期晚、体能状态相对差、化疗药物选择局限性等因素,临床缓解率有限,部分病人进入病情快速恶化模式,亟需新的治疗方式以适应临床需求。
近年来,ICIs在恶性肿瘤治疗中取得重大突破。ICIs较传统化疗明显延长了总生存期,已成为晚期NSCLC患者的标准一线治疗方案[4-6,19-20]。目前,国家药品监督管理局批准用于肺癌的有纳武利尤单抗、帕博利珠单抗、阿替利珠单抗、度伐利尤单抗、卡瑞利珠单抗、替雷利珠单抗、信迪利单抗等。以帕博利珠单抗为例,KEYNOTE-407研究比较了帕博利珠单抗或安慰剂联合白蛋白紫杉醇/紫杉醇+卡铂方案一线治疗转移性鳞状NSCLC的有效性和安全性,结果显示PFS(8.0个月vs5.1个月,HR=0.57)和OS(17.1个月vs11.6个月,HR=0.71)显著延长[4]。另有多项研究如KEYNOTE189、CAMEL、RATIONAL、ORIENT等进一步证实在晚期NSCLC中,ICIs的临床应用价值。但令人遗憾的是,并非所有患者都能从免疫治疗中获益。特别是EGFR基因突变的患者,KEYNOTE-001、KEYNOTE-010、BIRCH、OAK等多个研究的亚组数据提示该类患者免疫治疗的效果并不理想[19,21-23]。另有研究也证实,EGFR敏感突变患者一线采用免疫治疗或者免疫和靶向的联合治疗,不仅没有带来疗效提升,反而会导致严重的不良反应[9,24]。因此目前,对于EGFR突变患者,免疫治疗的应用前景仍有较大争议。而Impower 150则给出另一种模式,在该研究的EGFR突变亚组中,PD-L1抑制剂联合化疗和抗血管生成治疗的OS较化疗联合抗血管生成治疗的患者显著延长(29.4个月vs18.1个月,HR=0.6,95%CI:0.31~1.41),提示部分EGFR基因突变患者仍可能从免疫联合治疗中获益[25]。如何识别出免疫治疗获益的基因突变阳性NSCLC患者,以及治疗的时机和组合方式,是未来研究的方向之一。故本研究在真实世界中分析EGFR突变患者靶向耐药后接受免疫联合治疗的疗效,探索免疫治疗在此类人群中的治疗价值,为靶向耐药患者后线治疗提供临床经验。
本研究共纳入32例接受EGFR-TKI靶向治疗后耐药的晚期肺腺癌患者。这些患者后线均接受了PD-1单抗联合治疗,联合化疗采取的是培美曲塞加顺铂方案,部分人群在联合化疗基础上加入了贝伐珠单抗抗血管治疗。结果显示总体ORR为43%,DCR为67%,PFS为7.1个月,OS为11.7个月。对于不同EGFR突变类型,EGFR 19DEL和L858R突变患者接受含PD-1单抗治疗的无进展生存期差异无统计学意义。基于目前靶向治疗的多个研究发现,这2个主流的突变位点疗效有较大的分离和差异[26-28],因此倾向于把EGFR 19DEL和L858R突变的肺腺癌划分为两种不同机制的疾病。本研究样本量较少,未发现二者免疫治疗效果的不同,故仍需要更多的临床数据进一步验证。
T790M作为一二代EGFR-TKI治疗的一个主要耐药原因,本研究对其在免疫治疗中的作用进行了观察。结果发现,靶向治疗期间未出现T790M突变患者的PFS较出现T790M突变者有延长趋势。另有一项PD-1抑制剂的回顾性疗效分析发现,相对于携带常见EGFR突变或T790M突变,携带罕见EGFR突变和无T790M突变的NSCLC患者有更长的PFS[29]。但受限于总体样本,还需进一步地探索T790M的免疫治疗预测作用。另一方面,本研究还观察到免疫联合化疗较在此基础上再加入抗血管生成药物相比,其PFS无差异;治疗期间是否联合放疗对患者生存无明显影响。这些结果同样受限于样本量,结果无统计学意义,但更可能与免疫治疗以及靶向耐药后微环境的复杂性相关。
本研究仍存在一些局限性:1)本研究未进行肿瘤细胞PD-L1以及肿瘤突变负荷(tumor mutation burden,TMB)水平的统计。部分研究显示在靶向治疗耐药后微环境的重塑打破了突变患者原有的免疫豁免机制,这可能是EGFR突变阳性患者一线应用免疫治疗和耐药后应用免疫治疗临床获益不同的原因之一。对这一点的深入研究或可为识别能从免疫治疗中获益的EGFR突变阳性患者提供新的思路;2)本研究主要观察了免疫联合治疗在EGFR-TKI耐药后能有临床获益,但因样本量较少,临床的参考价值有限,未来还需要扩大样本量并继续探索不同免疫组合方案的疗效及耐受性;3)临床对免疫同步联合EGFR-TKIs治疗的高毒性有较深刻的认识,但对耐药后的免疫治疗毒性认识较少。尽管多数回顾性研究并未观察到新的不良反应,但限于资料有限和证据级别较低,对分子靶向治疗耐药后应用免疫治疗仍应该提高警示,加强观察。
总之,靶向治疗已显著改善了驱动基因阳性晚期NSCLC患者的生存,但由于其不可避免会出现耐药,且缺乏耐药后的有效治疗策略,探索免疫治疗在驱动基因阳性的NSCLC患者靶向耐药后的治疗价值至关重要。通过检测PD-L1或TMB的表达水平以及深入探索靶向治疗的耐药机制,或可为识别能从免疫治疗中获益的EGFR突变阳性患者提供新的思路。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

