老年晚期非小细胞肺癌患者免疫治疗的疗效和安全性*
陈靖宇,张欢,夏杨晨,刘芳芳,蒋继宗,朱正飞,胡洁,褚倩
430030 武汉,华中科技大学同济医学院附属同济医院 肿瘤科(陈靖宇、张欢、刘芳芳、蒋继宗、褚倩);430030 武汉,华中科技大学同济医学院 第二临床学院(夏杨晨);200032上海,复旦大学附属肿瘤医院 放射治疗中心(朱正飞);200032上海,复旦大学附属中山医院 呼吸科(胡洁)
肺癌是死亡率最高的恶性肿瘤,严重威胁着人民的生命健康[1]。多项临床试验结果表明,以程序性细胞死亡蛋白1(programmed death 1,PD-1)抑制剂和程序性细胞死亡蛋白配体1(programmed death-ligand 1,PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)能有效改善晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的治疗结局,延长生存期。NSCLC多见于老年患者,中位诊断年龄为70岁,中位死亡年龄为72岁[2]。由于标准化临床试验的特殊性,大多数临床试验未纳入70岁以上的老年患者,试验结果在老年人群中缺乏代表性[3-7]。
研究表明,患者的免疫功能可能会随着年龄的增加而产生特殊的变化。在老年小鼠和人类中,幼稚CD4+T 细胞和 CD8+T 细胞的数量更少[8],且细胞毒性CD4+T细胞和活化的Treg细胞亚群会产生显著变化,可能与慢性炎症和免疫力下降有显著相关性[9]。同时,随着年龄的增长,老年患者肺内中性粒细胞将过度浸润,导致老年患者流感相关死亡率增加,这可能与老年患者中性粒细胞中异常 PI3K 信号传导有关[10-11]。这些变化导致老年患者可能对免疫治疗疗效不佳,或增加免疫相关不良反应的发生风险。
目前尚缺乏针对老年患者免疫治疗的大型前瞻性临床研究。近期发表的几项回顾性研究结果表明,75岁以内的老年患者使用ICIs治疗具有与年轻患者相似的疗效和安全性,而75岁以上的老年患者使用ICIs治疗并未取得优于化疗的临床疗效[12-14]。哪些老年患者能真正从ICIs治疗中获益?目前尚缺乏相关的疗效和预后标志物研究。因此,本研究旨在评估真实世界临床队列中老年NSCLC患者使用ICIs治疗的有效性和安全性,进一步探索潜在的疗效和预后相关标志物。
1 对象和方法
1.1 研究对象
本研究是一项基于AME肿瘤免疫真实世界研究协作组(AME real-World Immune-Oncology Group,ARION)(NCT 04766515)的多中心回顾性研究,收集2018年3月至2021年10月就诊于中国3家医疗中心(华中科技大学同济医学院附属同济医院、复旦大学附属中山医院、复旦大学附属肿瘤医院)接受ICIs治疗的老年晚期NSCLC患者的资料。纳入标准:1)经组织病理学和影像学检查确诊的IV期NSCLC患者;2)接受过至少一次ICIs治疗;3)首次ICIs治疗时年龄≥70岁。排除标准:1)病历资料严重缺失;2)合并其他恶性肿瘤并正在接受相应抗肿瘤治疗。本研究经我院伦理委员会审核及批准(批号:TJ-IRB20200731),患者知情同意书豁免。
1.2 研究方法
收集患者接受ICIs治疗前的基线临床资料,包括:年龄、性别、吸烟史、内科合并症(高血压、心脏病、糖尿病)、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分、诊断(组织学类型、转移部位、基因状态、PD-L1表达水平)、免疫治疗情况(治疗线数、治疗方案)和基线期实验室检查结果[血红蛋白、白蛋白、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、白细胞计数、中性粒细胞计数、淋巴细胞计数、中性淋巴比值]等。记录患者治疗期间的影像学检查报告,包括头颈部CT/MR、胸部CT、腹部CT/MR、骨ECT、PET/CT等,采用实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)1.1版对患者进行疗效评估。
1.3 主要结局指标
主要疗效评估指标包括客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、缓解持续时间(duration of response,DoR)、无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS)。ORR为完全缓解(complete response,CR)和部分缓解(partial response,PR)的病例数在可评价疗效患者中所占的百分比,DCR为CR、PR和疾病稳定(stable disease,SD)的病例数在可评价疗效患者中所占的百分比。PFS为从ICIs治疗开始至确认的疾病进展(progressive disease,PD)、死亡或失访的时间间隔。OS为ICIs治疗开始至任何原因导致的死亡或失访的时间间隔,截止随访时间仍存活的患者,以最后随访时间记录为删失值。
1.4 统计学方法
应用SPSS 19.0统计学软件分析数据。PFS和OS通过Kaplan-Meier法统计分析,采用Log-rank进行生存检验。各临床因素与PFS和OS的相关性分析采用单因素及多因素Cox风险比例回归模型(进入法)。血液标志物相关性分析采用t-test检验。Kaplan-Meier生存曲线采用GraphPad 8.0软件绘制。以P<0.05定义为差异具有统计学意义。
2 结 果
2.1 基线特征
研究共纳入102例老年晚期NSCLC患者,其中男性84例(82.35%)、女性18例(17.65%);所有患者首次ICIs治疗开始时的年龄均≥70岁,中位年龄为73岁;55例(53.92%)患者既往有吸烟史;腺癌患者43例(42.16%),鳞癌患者41例(40.20%);57例(55.88%)患者的基因检测结果可追溯,其中表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变阳性患者7例(6.86%),野生型患者50例(49.02%);30例(29.41%)患者PD-L1表达水平可获取,其中12例(11.76%)患者PD-L1 TPS<1%,8例(7.84%)患者PD-L1 TPS为1%~49%,10例(9.8%)患者PD-L1 TPS≥50%。患者基线特征的具体情况见表1。

表1 患者基线特征

ECOG: Eastern Cooperative Oncology Group; PD-L1: Programmed death ligand 1; TPS: Tumor proportion score; EGFR: Epidermal growth factor receptor.
2.2 疗效
本研究中位随访时间为17.1个月(IQR:11.0~21.2个月),共有78例患者能获取临床和影像学资料进行疗效评估,其中32例患者(41.02%)获得疾病缓解(1例CR、31例PR),37例患者(47.43%)的最佳疗效为SD(表2)。在最佳疗效为SD的37例患者中,13例患者(16.67%)疾病稳定时间≥6个月。ORR为41.02%,DCR为88.46%。

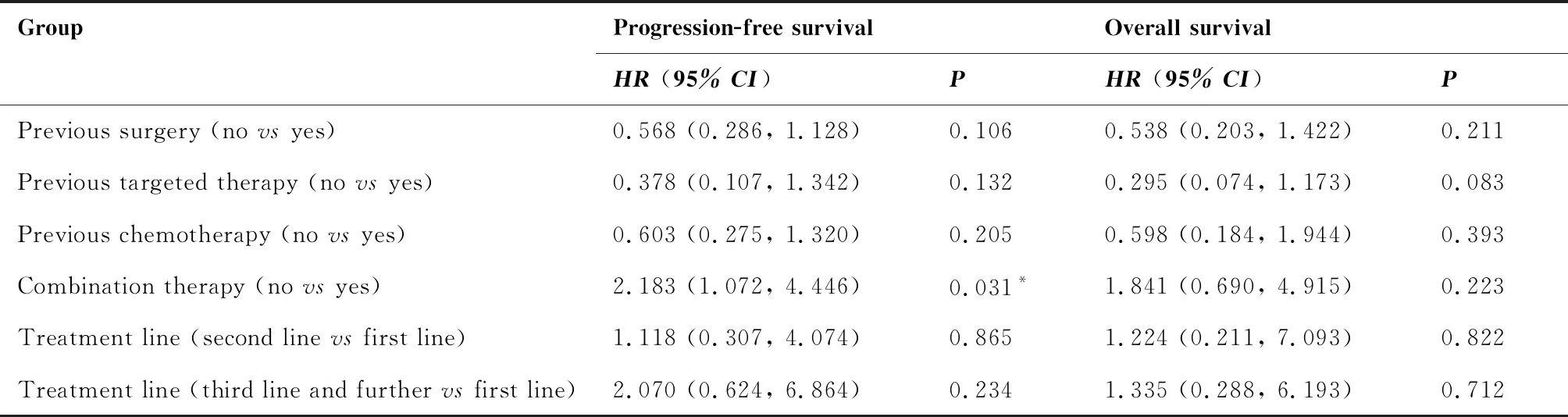
表2 患者客观疗效
本研究中患者的中位PFS为7.5个月(95%CI: 4.4~10.6),截至2022年4月15日,共61例患者出现疾病进展或死亡。对患者的PFS进行单因素分析,结果表明,ECOG PS评分0~1分(P=0.041)、无肝转移(P=0.048)及接受一线治疗(P=0.047)的患者中位PFS明显长于相应的对照组,差异具有统计学意义;无糖尿病病史、有吸烟史、无脑转移、无靶向治疗史的患者中位PFS有延长趋势。其中ECOG PS≥2分的患者只有8例,研究结果可能存在一定的偏倚。不同年龄组、不同病理类型患者之间PFS差异无统计学意义(表3)。总人群PFS与阳性亚组的PFS如图1所示,因ECOG PS≥2分的患者只有8例,没有针对ECOG亚组展示PFS。
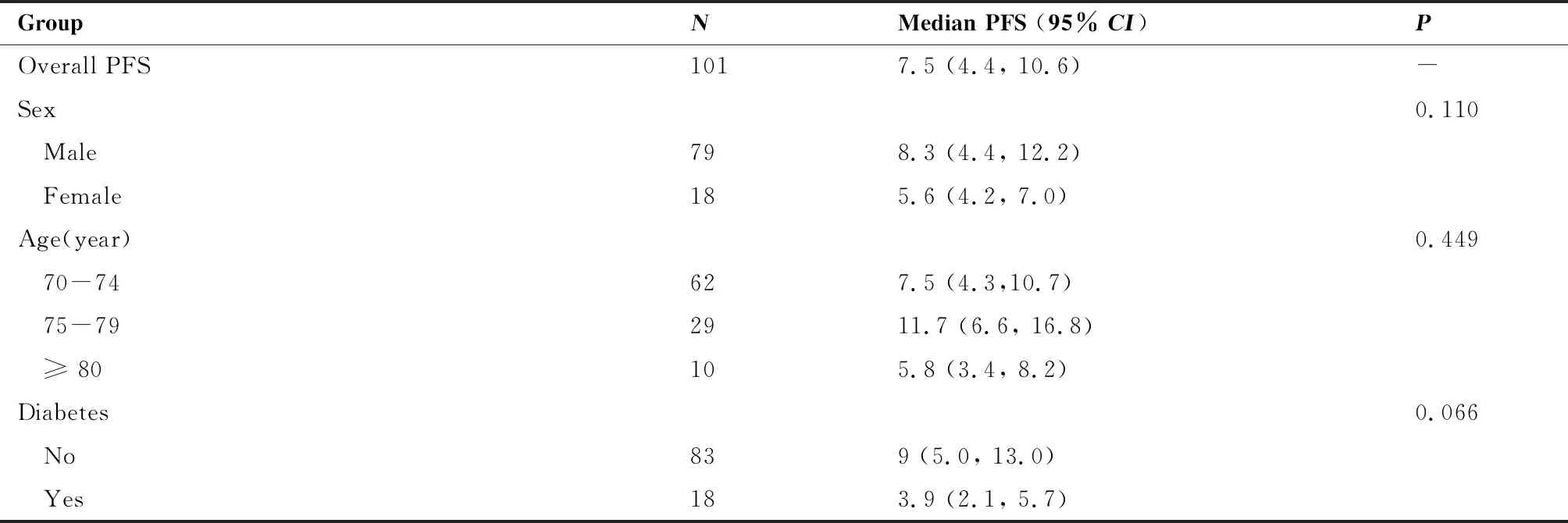
表3 总人群PFS及亚组分析
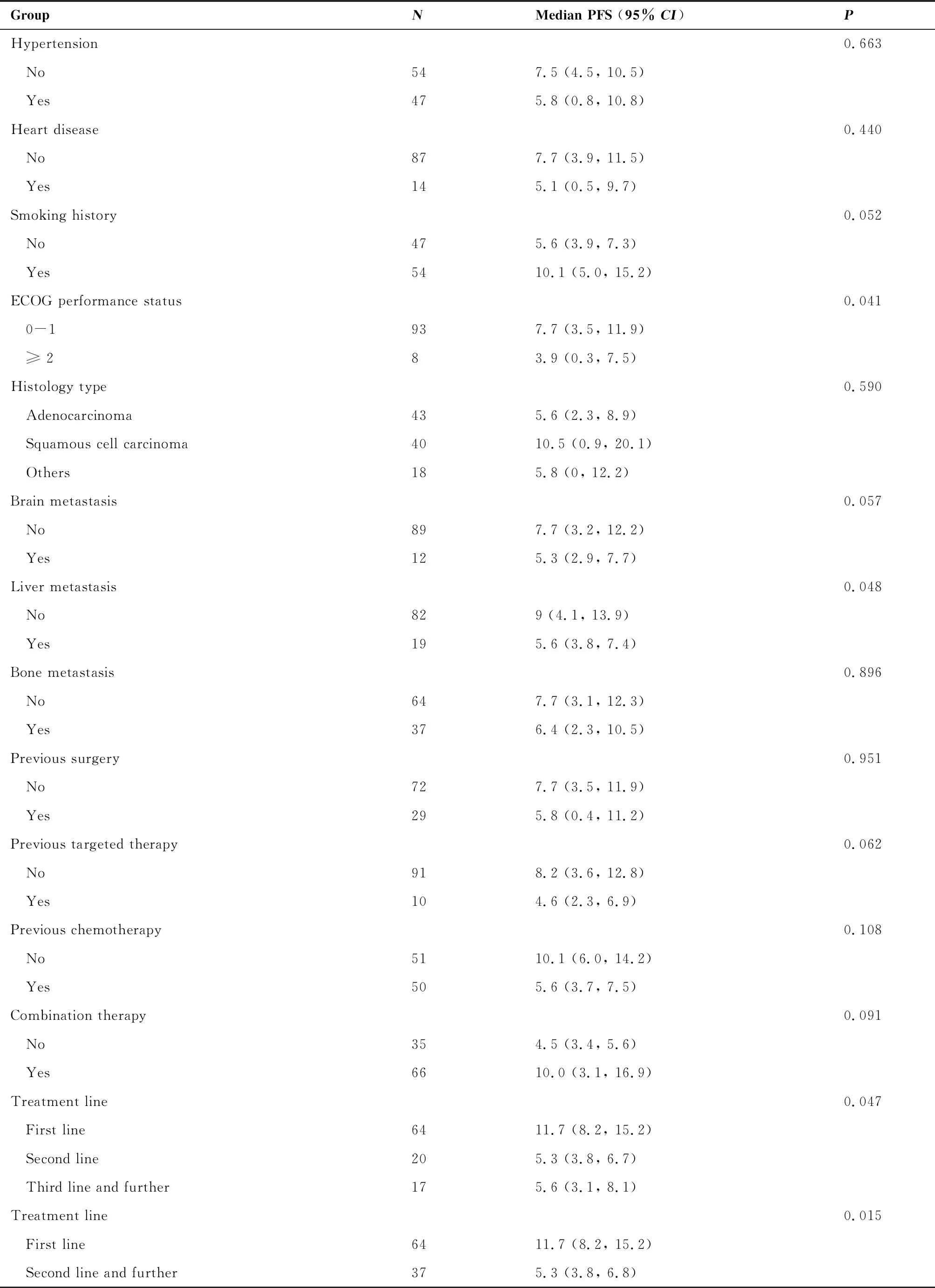
PFS: Progression-free survival;ECOG: Eastern Cooperative Oncology Group.
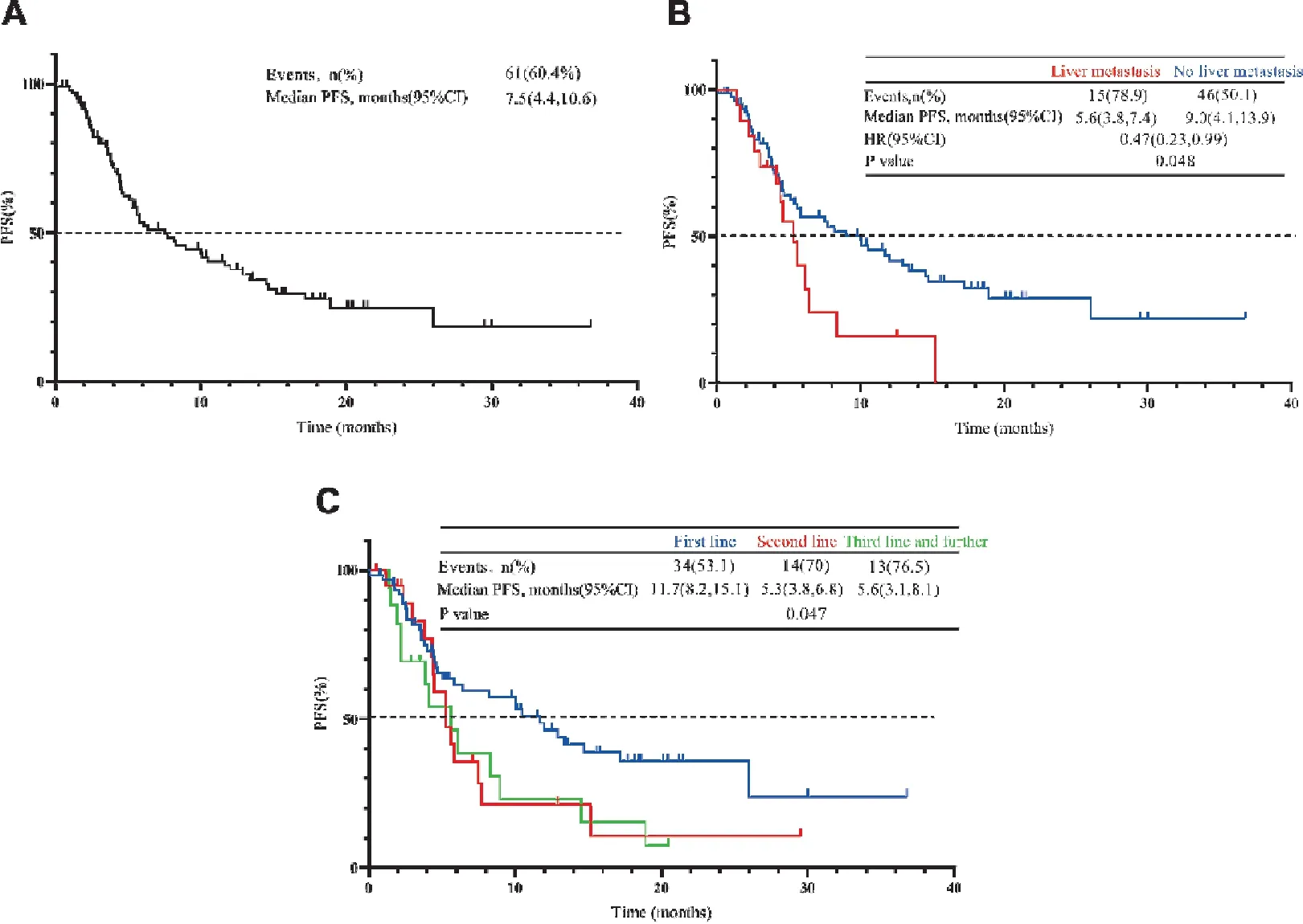
图1 总人群PFS及各阳性亚组PFS
本研究中患者的中位OS为22.0个月(95%CI: 4.4~10.6),截至2022年4月15日,共34例患者死亡。对患者的OS进行单因素分析,结果表明,有吸烟史的患者的OS显著长于无吸烟史的患者(22.8个月vs18.2个月,P=0.010),无脑转移患者的OS显著长于有脑转移患者(22.0个月vs9.0个月,P<0.001);无靶向治疗史及接受一线治疗的患者OS有延长的趋势。不同年龄组、不同病理类型患者间OS差异无统计学意义(表4)。总人群OS与阳性亚组的OS如图2所示。
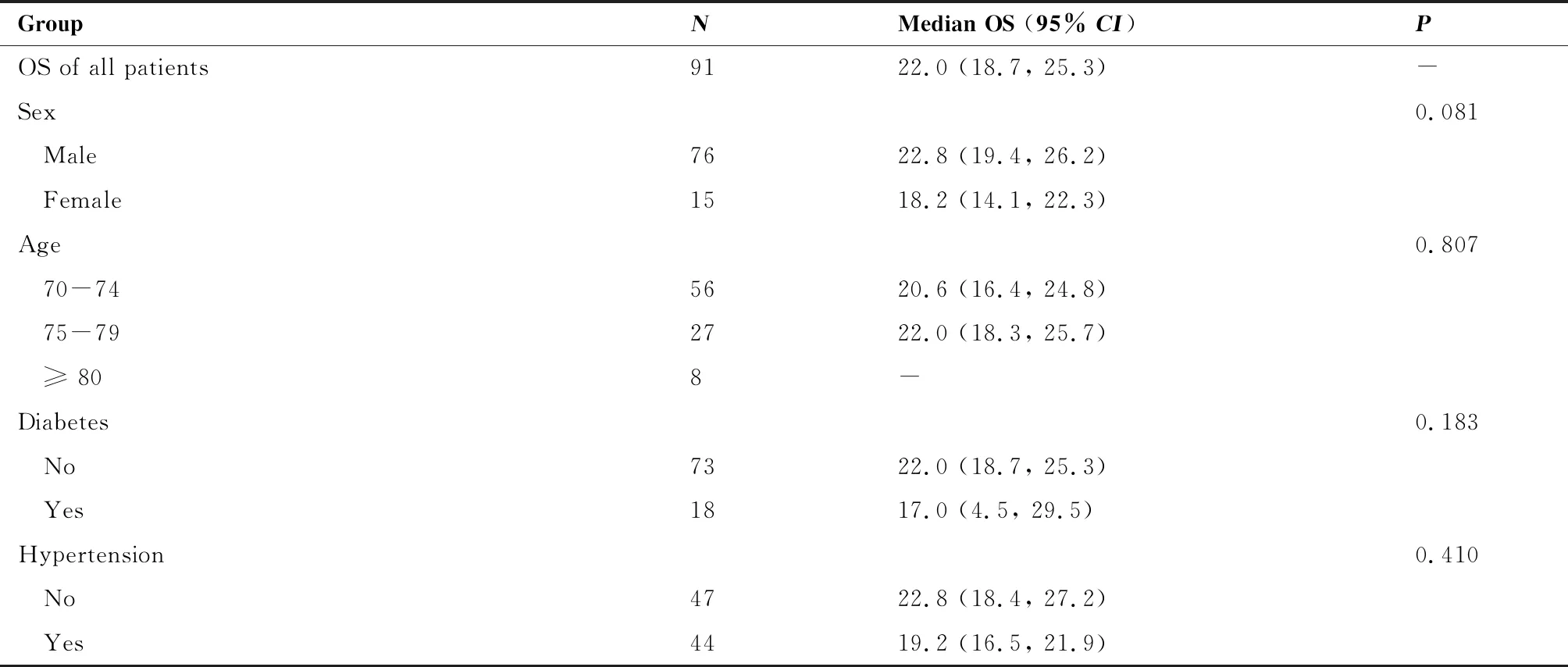
表4 总人群OS及亚组分析

OS: Overall survival;ECOG: Eastern Cooperative Oncology Group.

图2 总人群OS及各阳性亚组OS
对患者的PFS和OS分别进行多因素Cox风险比例回归模型分析,结果表明,ECOG PS评分≥2分的患者的PFS(P=0.001)和OS(P<0.001)均显著短于ECOG PS评分0~1分的患者;联合用药组患者的PFS显著长于单药治疗组(P=0.031);脑转移患者的OS显著短于无脑转移的患者(P=0.017)(表5)。

表5 PFS及OS的多因素Cox风险比例回归模型
LUSC: Lung squamous cell carcinoma; LUAD: Lung adenocarcinoma; other abbreviations as indicated in Table 1.
2.3 安全性
48例(47.06%)患者在接受ICIs治疗期间出现不良事件(adverse events,AEs),其中21例(20.59%)患者出现≥3级AEs。肝功能异常是最常见的AE,见于12例患者(11.76%),也是最常见的≥3级AE(7例患者,6.86%)。所有不良事件发生情况见表6。
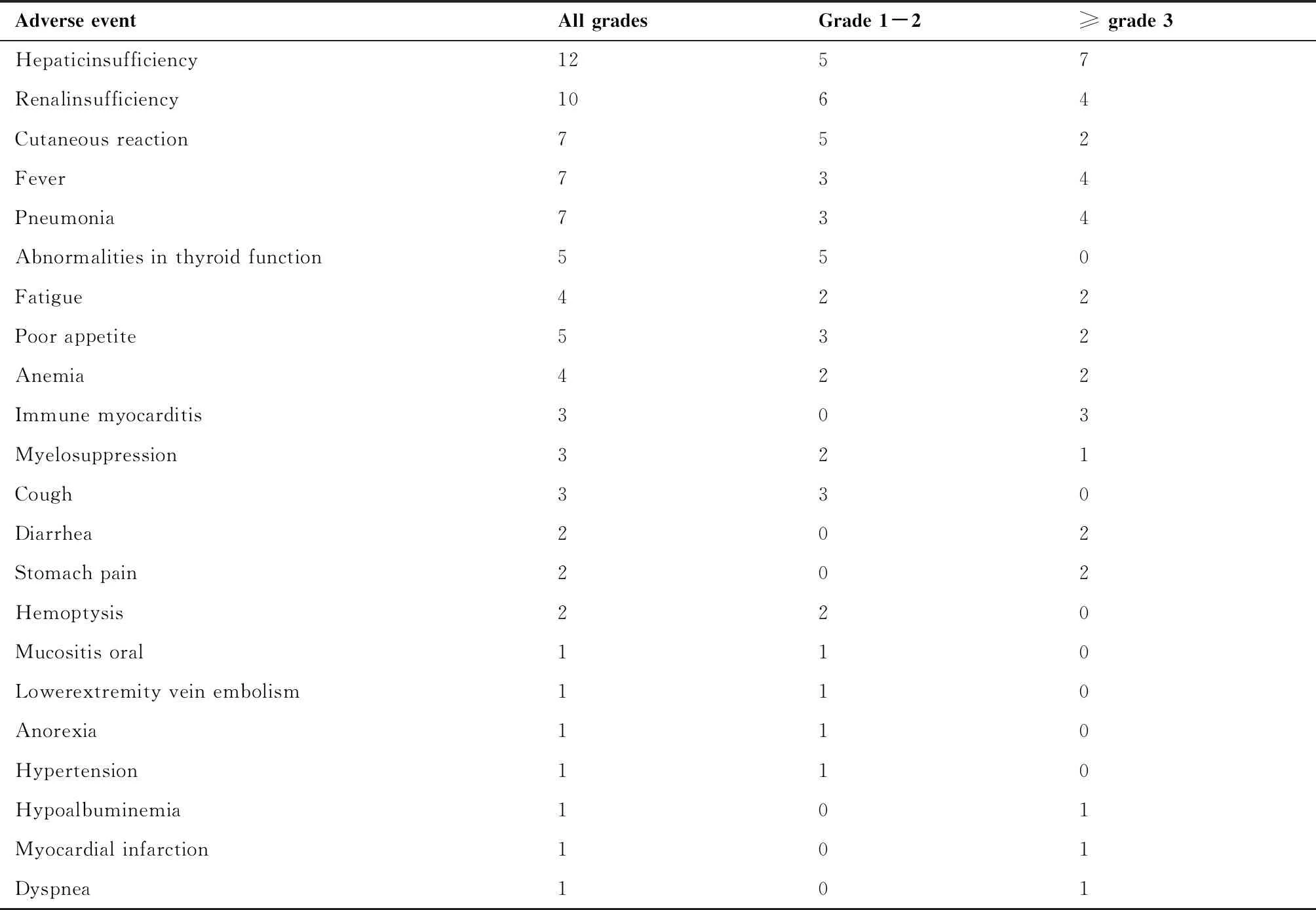
表6 不良事件的类型和发生频次
2.4 疗效和预后相关标志物探索
以中位PFS为Cut-off值,将PFS长于中位PFS定义为预后良好,PFS短于中位PFS定义为预后不佳,据此将患者分为两组。比较两组患者间血红蛋白、白蛋白、肌酐、ALT、AST、白细胞计数、中性粒细胞计数、淋巴细胞计数及中性淋巴比值的水平有无差异。共收集到86份基线期血常规及生化检查结果,其中用于血红蛋白、白蛋白、肌酐、ALT、AST、白细胞计数、中性粒细胞计数、淋巴细胞计数、中性淋巴比值分析的样本数分别为84、84、86、84、83、83、83、83例(图3)。结果表明,预后不佳组患者的血红蛋白(P=0.026)和白蛋白(P=0.025)水平显著低于预后良好组,预后不佳组的中性淋巴比值较预后良好组有升高趋势(P=0.087)。

图3 实验室检查与预后的相关性
3 讨 论
老年人是肺癌的高发人群,近年来,部分回顾性研究及前瞻性研究的亚组开始关注这一特殊人群使用ICIs治疗的疗效和安全性。老年患者接受ICIs治疗同样能够获益,PFS和OS较未接受免疫治疗组均有延长[12-14],对老年患者按不同年龄段进行更细的分层研究,未发现不同年龄段患者接受ICIs治疗的疗效存在明显差异[15-16]。在本研究中,我们回顾性分析了三家中心102例≥70岁晚期NSCLC患者接受ICIs治疗的疗效,结果同样表明,ICIs在这一特殊人群中展现出了良好的临床疗效,ORR为41.02%,DCR为88.46%,中位PFS为7.5个月,中位OS为22.0个月;同样,不同年龄段亚组间亦未观察到显著的疗效差异。
ECOG PS评分反映了患者的体力状态和日常活动能力,ECOG PS评分≥2分被认为与NSCLC患者的不良预后相关。Spigel等的[17]研究纳入了556例70岁以上的IIIB/IV期NSCLC患者,其中ECOG PS评分为2分的患者中位OS显著短于总体人群(4.0个月vs9.1个月)。Mezquita等[18]的研究显示ECOG PS评分为 0~1分的晚期NSCLC患者生存期更长。Grosjean等[19]研究的多变量分析显示,在老年患者中的ECOG PS评分高、体重指数低及肺免疫预后指数(lung immune prognostic index,LIPI)差与患者更差的预后相关,其中LIPI评分的计算方法为根据患者治疗前的衍生中性淋巴比值(derived neutrophil-to-lymphocyte ratio,dNLR)是否大于3和乳酸脱氢酶(lactate dehydrogenase,LDH)是否大于正常值上限将患者分为3组(0分:dNLR<3且LDH<正常值上限;1分:dNLR≥3或LDH≥正常值上限;2分:dNLR≥3且LDH≥正常值上限)[20]。在本研究中,我们同样观察到ECOG PS评分≥2分与更差的PFS和OS具有显著相关性,同时预后不佳组的中性淋巴比值较预后良好组有升高的趋势(P=0.087)。
ICIs在晚期NSCLC治疗中的探索始于单药后线治疗,随着临床研究的开展而逐步向联合治疗和一线治疗推进。在中国,自2018年纳武利尤单抗获批NSCLC二线单药治疗的适应症后,ICIs同样经历了从单药、后线逐步跨越到联合、一线治疗的布局。本研究中,接受ICIs单药治疗的患者更多来自于2018~2019年免疫联合治疗获批前。既往研究表明,化疗能有效促进肿瘤新生抗原释放、募集和活化CD8+T细胞,增强ICIs的疗效[21]。无论鳞癌还是非鳞癌,一线免疫联合化疗均明显优于单纯化疗,一线治疗(无论单药或联合化疗)的有效率和生存期均明显优于后线治疗[22-23]。在本研究中,一线治疗组的PFS显著优于后线治疗组,OS亦有延长的趋势;ICIs联合治疗对比ICIs单药治疗同样能够显著延长患者的PFS,表明一线治疗及联合治疗模式的临床获益在老年人中同样能够得到体现。研究表明,既往有吸烟史的人群较没有吸烟史的人群更能从ICIs治疗中获益,分析可能与更高的肿瘤突变负荷(tumor mutation burden,TMB)相关[24]。在本研究中,有吸烟史的老年患者OS显著长于无吸烟史者,PFS亦有延长趋势,提示吸烟史可能同样是老年NSCLC患者接受ICIs治疗的预后因素。
老年人接受ICIs治疗的安全性备受关注,尤其要警惕严重irAEs的发生。研究显示,与18~64岁的患者相比,65岁以上患者发生irAEs的比例更高[25]。而一项针对黑色素瘤、透明细胞癌和NSCLC的回顾研究则得到了不同的结果,老年患者和年轻患者在发生irAEs的等级上无明显差异[26]。在本研究中,47.06%的患者在接受 ICIs治疗时出现任意级别的AE,20.59%的患者出现≥3级AE,与既往研究相比并未发现明显差异。
免疫治疗的疗效和预后标志物是近年来的热点问题,能协助区分免疫治疗的真正获益人群。PD-L1和TMB被认为可能是ICIs的疗效和预后标志物,但其预测价值尚难完全满足实际临床需求。本研究发现,患者接受ICIs治疗的PFS与基线期的血红蛋白和白蛋白水平相关,血红蛋白和白蛋白水平降低的患者PFS更短。造成这一现象的原因可能为低的血红蛋白和白蛋白水平通常意味着更差的营养状况和ECOG PS评分,进而导致更差的临床疗效。目前尚缺乏血红蛋白和白蛋白水平与免疫治疗疗效相关的机制研究,期待未来相关研究的开展以进一步揭示这一现象背后的本质。
本研究结果表明ICIs在≥70岁的老年NSCLC患者中同样具有良好的临床疗效和安全性,ECOG PS评分0~1分、有吸烟史、一线及联合治疗的患者可能是这类患者中接受ICIs治疗的潜在优势人群,基线期白蛋白、血红蛋白水平降低可能预示着ICIs治疗效果不佳,对老年患者的临床治疗提供了一定的参考。
然而,本研究也存在一定的局限性。首先,作为回顾性研究,在研究过程中存在不可避免的数据缺失,可能导致部分结果存在偏倚。其次,本研究为单臂研究,未纳入接受非免疫治疗的患者作为对照组。此外,本研究的样本量有限,在进行亚组分析的过程中可能由于部分亚组样本量不足而导致结果存在一定的偏倚。未来仍需要大样本的前瞻性临床研究进一步验证老年NSCLC患者接受ICIs治疗的疗效和安全性。
致谢
所有作者感谢AME肿瘤免疫真实世界研究协作组(ARION)的学术支持,感谢RayPlus数据库系统(华中科技大学数字PET实验室、中国科学技术大学数字PET实验室、武汉瑞赛迦科技有限公司联合研发)对本项目的支持!
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

